Oleh: Jessica A. Belser dan Terrence M. Tumpey
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Pengenalan
Kemunculan spesies virus influenza A pada avian dan mamalia selain manusia yang memiliki kemampuan untuk menyebar ke hospes manusia mewakili kekhawatiran kesehatan manusia yang terus menerus ada. Terdapat keperluan mendesak untuk mempelajari virus-virus influenza yang bersirkulasi dalam hospes selain manusia dalam rangka memahami lebih baik potensi pandemi yang dimilikinya jika suatu ketika virus-virus ini mendapatkan kemampuan untuk menyebabkan infeksi manusia yang berkelanjutan. Bersamaan dengan itu, pemahaman variasi bawaan yang dimiliki virus influenza manusia sangat kritikal dalam rangka mitigasi keparahan penyakit pada saat epidemi tahunan. Penggunaan model mamalia memungkinkan kemampuan virus influenza untuk menyebabkan penyakit berat dan/atau menular kepada kontak naif untuk dapat dipelajari dalam lingkungan yang aman dan terkendali. Informasi ini memberikan kontribusi vital terhadap perkembangan upaya pencegahan dan pengendalian. Akan tetapi, hasil yang didapat dari studi macam ini dapat dipengaruhi oleh pilihan model mamalia yang digunakan di laboratorium, seleksi virus yang akan dipelajari pada spesies tertentu, metode inokulasi yang digunakan, dan dosis virus yang diberikan. Keputusan yang diambil berdasarkan informasi tentang hal ini dan variabel eksperimen lainnya sangat penting dalam rangka memastikan bahwa data yang didapat sedapat mungkin relevan dan dapat diandalkan secara saintifik.
Terdapat kesadaran publik yang terus berkembang terhadap ancaman kesehatan masyarakat yang ditimbulkan oleh virus influenza [41]. Virus influenza musiman pada umumnya menyebabkan penyakit ringan pada manusia, tetapi memiliki potensi menyebabkan penyakit berat, terutama pada lansia atau populasi dengan kelemahan imunitas. Unggas air liar, yang berlaku sebagai reservoir alami untuk kebanyakan virus influenza, pada umumnya menunjukkan infeksi asimptomatik ketika terinfeksi virus LPAI. Infeksi sporadis virus LPAI pada manusia biasanya terjadi setelah terpapar kontak dengan unggas terinfeksi, dan dalam jumlah lebih sedikit, berkontak dengan unggas air liar terinfeksi, dan kecuali virus H7N9, biasanya infeksinya tidak fatal. Sebaliknya, HPAI dapat menimbulkan fenotip letal baik pada hospes unggas maupun manusia. Meskipun virus pandemi H1N1 2009 adalah virus yang paling banyak dipelajari asal dari babi, infeksi sporadis pada manusia oleh virus asal babi lainnya masih terus terjadi. Kesemua virus ini memerlukan pemeriksaan menyeluruh untuk menentukan potensi pandemi dan ancaman yang dimilikinya terhadap kesehatan manusia. Heterogenitas level tinggi di antara virus-virus ini memunculkan perlunya model mamalia yang sama heterogennya untuk mempelajari virus-virus tersebut.
Pada Bab ini, kita mendiskusikan tentang pertimbangan utama yang harus ditangani saat mendesain, melakukan, dan menginterpretasikan penelitian yang dilakukan pada model mamalia. Beberapa contoh peranan yang penelitian-penelitian ini miliki terhadap kesehatan masyarakat akan didiskusikan di sini. Dilakukan bersama pendekatan in-vitro, ex-vivo, dan modeling eksperimental lainnya (Gambar 24.1), studi mamalia in-vivo menawarkan kesempatan tiada duanya untuk mengukur interaksi kompleks antara virus-hospes, yang sangat penting dalam memahami pathogenesis, patobiologi, dan kemampuan penularan virus influenza avian dan manusia.
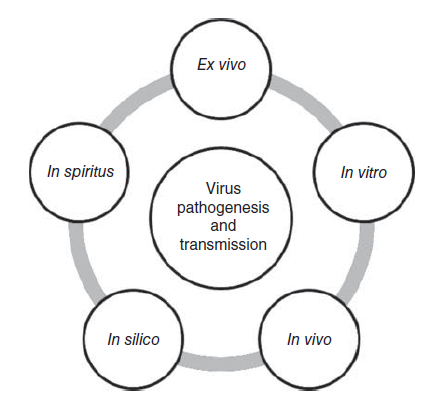
Gambar 24.1 Modelling laboratorium infeksi virus influenza pada mamalia. Contoh-contoh platform penelitian berbeda yang dapat berkontribusi terhadap pemahaman yang lebih besar tentang patogenitas, penularan dan tropisme virus influenza. In spiritus = dalam nafas.
Faktor yang berhubungan dengan pilihan model yang tepat
Model eksperimental mamalia dapat mengkontribusikan informasi berharga terhadap penelitian dan pemahaman virus influenza. Akan tetapi, pilihan spesies yang akan digunakan dapat menimbulkan dampak besar terhadap arti data yang didapat. Tidak ada satupun model yang secara ideal cocok untuk semua aplikasi penelitian. Lebih tepatnya, setiap spesies mamalia memiliki keuntungan dan kerugian spesifik, dengan spesies yang berbeda cocok untuk tujuan penelitian yang berbeda, sehingga penting untuk memutuskan spesies mana yang paling cocok untuk karakteristik model yang diinginkan (Gambar 24.2). Beberapa area yang perlu dipertimbangkan saat memilih model dideskripsikan di bawah ini.
Fasilitas
Faktor utama yang menentukan hewan model mana yang paling sesuai untuk investigasi adalah ukuran, biaya, dan kemudahan handling spesies model tersebut. Rodensia kecil seperti mencit menawarkan beberapa keuntungan, meliputi biaya yang relatif murah dan mudah untuk dipelihara. Musang memerlukan kandang yang lebih besar dan filtrasi udara yang lebih ketat untuk mempertahankan keadaan seronegatif terhadap virus influenza yang bersirkulasi di udara sekitar sebelum digunakan sebagai hewan model. Babi guinea telah muncul sebagai alternatif selain musang dalam konteks ini, karena ukurannya yang relatif lebih kecil [82]. Spesies mamalia berukuran lebih besar dari ordo yang lebih tinggi seperti primata non-manusia biasanya berbiaya mahal, dan hanya sedikit laboratorium memiliki fasilitas yang sesuai untuk mengakomodasi spesies-spesies ini. Seleksi virus yang akan dipelajari juga dapat mempengaruhi keputusan ini, karena penelitian terhadap banyak virus, termasuk virus HPAI harus dilakukan di fasilitas yang memenuhi persyaratan biosafety yang sesuai [28].
Pembacaan eksperimen
Tipe data yang akan diambil dari eksperimen akan sangat mempengaruhi pilihan spesies yang akan digunakan untuk investasi. Sebagai contoh, tidak semua spesies mendukung replikasi virus influenza manusia tanpa adaptasi terlebih dahulu, tidak semua menunjukkan gejala klinis yang sama dengan infeksi pada manusia, tidak semua menimbulkan patologi serupa dalam saluran pernafasan seperti yang diamati pada manusia, atau menularkan virus dengan efisien kepada hewan yang naif [69]. Selain itu, ketersediaan reagen spesifik spesies tertentu sangat bervariasi antar model, sehingga membatasi kemampuan untuk meneliti ciri atau karakteristik tertentu pada spesies yang dipilih. Sebagai contoh, musang biasanya dianggap sebagai model terbaik untuk mempelajari patogenesis dan penularan virus influenza yang terjadi secara kebetulan [9], tetapi kurangnya reagan yang tersedia untuk penelitian ciri-ciri imunologi saat ini membatasi dapat dipergunakannya spesies ini untuk uji-uji tertentu. Pertimbangan lebih dulu terhadap parameter-parameter kritis dalam eksperimen yang akan dijalankan dapat membantu memilih model mana yang akan digunakan untuk setiap kasus.
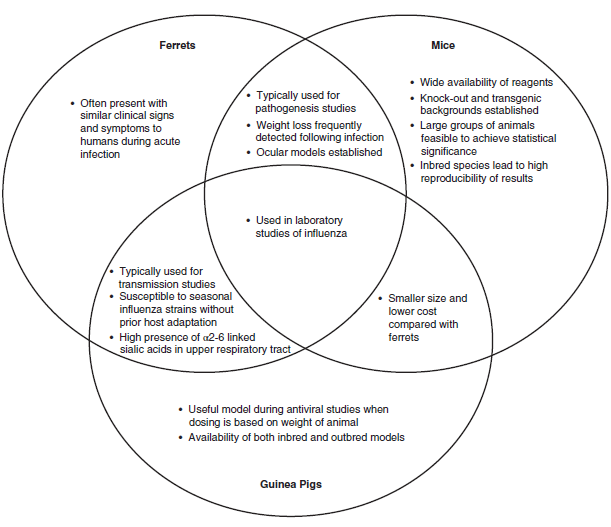
Gambar 24.2 Keuntungan dan kerugian penggunaan tikus, musang dan babi guinea sebagai hewan model untuk digunakan dalam penelitian virus influenza.
Spesifisitas pengikatan reseptor dan perlekatan virus
Virus-virus influenza berikatan kepada glikokonjugat yang mengandung ujung asam sialik baik pada Neu5Ac⍺(2,3)-Gal atau Neu5Ac⍺(2,6)-Gal [123]. Epitel dalam saluran pernapasan atas manusia memiliki tautan asam sialik ⍺2,6 dalam jumlah berlebih; epitel saluran pernafasan bawah memiliki sialosid dengan konformasi baik ⍺2,6 maupun ⍺2,3 (Gambar 24.3) [70]. Pada umumnya, virus influenza manusia akan lebih memilih berikatan dengan tautan asam sialik ⍺2,6, yang memfasilitasi replikasi virus dalam saluran pernapasan manusia bagian atas, sementara virus influenza avian lebih memilih berikatan dengan tautan asam sialik ⍺2,3 sehingga replikasi virus lebih efisien dalam paru-paru. Karena itulah preferensi pengikatan reseptor seringkali dihubungkan dengan tropisme virus influenza pada manusia. Demikian juga distribusi sebagian asam sialik ppada model hewan mamalia berbeda dapat mempengaruhi virulensi yang teramati setelah uji tantang eksperimen inokulasi. Sebagai contoh, pola pengikatan virus influenza manusia dan avian kepada jaringan saluran respirasi musang sangat mendekati serupa manusia, sementara pola pengingatan pada saluran respirasi tikus Murinae tidak serupa [119, 151]. Karena itulah, spesifisitas pengikatan reseptor pada virus-virus yang akan dipelajari, demikian juga distribusi ikatan asam sialik ⍺2,3 dan ⍺2,6 dalam epitelium saluran respirasi hewan model mamalia yang dipilih dapat mempengaruhi cakupan hospes, virulensi, dan kemampuan penularannya [34].
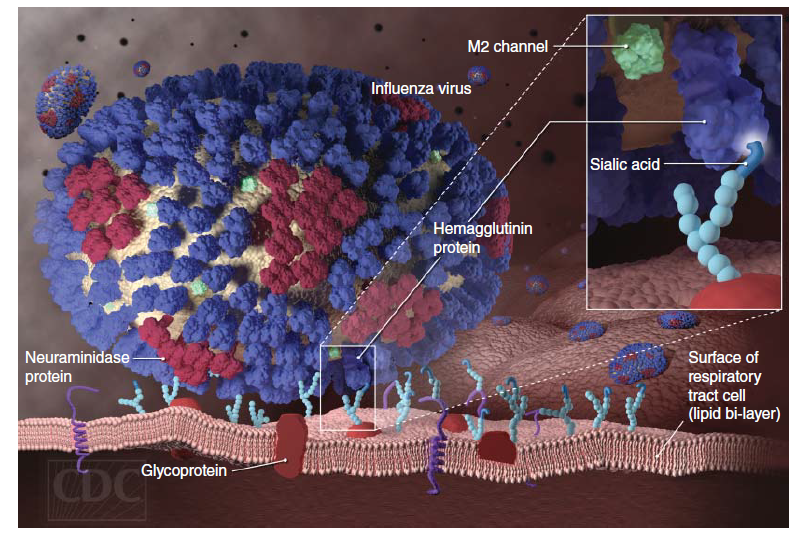
Gambar 24.3 Berikatannya virus influenza dengan sel epitel hospes. Hemagglutinin (HA) virus berikatan dengan asam sialik yang ada dalam epitel sel hospes dalam saluran pernafasan. Sumber: Dan Higgins/PHIL CDC.
Ukuran sampel dan kekuatan statistik
Peneliti yang melakukan penelitian pada hewan memiliki kewajiban etis untuk menggunakan jumlah hewan seminimal mungkin untuk mencapai hasil yang valid dan dapat direproduksi. Karena mencit sebagai hewan coba adalah hasil inbreeding, tersedia sangat luas, dan relatif tidak mahal, hewan coba ini biasanya dipergunakan saat statistical rigor (pengujian dengan ambang batas kepercayaan 95%) diperlukan. Akan tetapi, data yang berarti bisa didapat dari seluruh spesies mamalia, meskipun perlu menyeimbangkan segala batasan jumlah sampel (meliputi jumlah, biaya, ruang, dan pertimbangan etika, seperti didiskusikan dalam bagian ini). Saat kekuatan statistik tidak memungkinkan, atau ukuran sampel sangat terbatas, peneliti harus berhati-hati saat interpretasi hasil penelitiannya [11, 10]. Meta-analisis yang mendapatkan kekuatan statistik dari analisa data yang diambil dari banyak penelitian terpisah dengan skala lebih kecil, memberikan pilihan tambahan agar dapat lebih ketat dalam interpretasi hasil yang yang didapat dari eksperimen yang memang perlu untuk membatasi sampelnya dalam ukuran sampel yang lebih kecil [127, 164].
Pertimbangan etik
Penelitian hewan coba memiliki peranan sangat penting dalam banyak aspek penelitian virus influenza, dan peneliti harus waspada terkait masalah kesejahteraan hewan dan penelitian yang bertanggungjawab. Karena itulah ketaatan terhadap prinsip “3 R” dalam penelitian terhadap hewan, yaitu reduction (reduksi), replacement (pergantian), dan refinement (perbaikan) harus diperhatikan dan diambil sebagai pertimbangan saat mendesain eksperimen in-vivo [114]. Penggunaan uji in-vitro dan ex-vivo secara bersamaan sangat baik dalam meningkatkan dan memperkaya eksperimen in-vivo [11, 78].
Model mamalia inokulasi tradisional secara intranasal dan intratrakeal
Terdapat banyak spesies mamalia yang, meskipun bukan merupakan hospes alami virus influenza, dapat menyokong infeksi virus influenza dan replikasi. Inokulasi melalui rute intranasal atau intratrakeal menggunakan cairan inokulum berisi virus yang diencerkan biasanya menyebabkan infeksi pada setiap spesies. Tetapi seperti yang akan didiskusikan di bawah, virulensi dan penampakan gejala klinis dapat bervariasi antar spesies (Tabel 24.1). Meskipun perlu menyeimbangkan rasio jenis kelamin hewan model mamalia yang digunakan dalam penelitian, karena perbedaan gender dapat mempengaruhi berbagai parameter biologis [30], studi patogenesis dan transmisi virus influenza biasanya dibatasi menjadi satu jenis kelamin saja dalam satu eksperimen dalam rangka meminimalisir potensi variasi.
Mencit
Mencit (Mus musculus) dipergunakan dimana-mana dalam penelitian laboratorium karena, selain banyak keuntungan lainnya, biaya yang murah, mudahnya dihandling dan pemeliharaannya, genome yang sudah terkarakterisasi dengan baik, banyaknya reagen yang tersedia untuk spesies ini, dan ketersediaan latar belakang transgenik. Akan tetapi, mencit bukanlah hospes alami virus influenza, dan virus influenza A manusia (subtipe H1 dan H3) seringkali memerlukan adaptasi hospes untuk mencapai level replikasi virus yang tinggi. Selain itu, mencit tidak menunjukkan banyak gejala klinis dan simptom yang teramati selama infeksi pada manusia, dan studi tentang penularan biasanya tidak dilakukan pada spesies ini, meskipun beberapa studi terpilih telah melaporkan penularan dari mencit terinfeksi kepada mencit naif [81,141]. Meskipun terdapat limitasi-limitasi tersebut, mencit mewakili model yang berguna untuk studi patogenesis influenza, karena onset gejala, patologi paru-paru, dan induksi respon hospes secara sementara berhubungan dengan replikasi virus. Selain itu, latar belakang inbreeding dari kebanyakan strain hewan laboratorium tikus murine memungkinkan studi perubahan tidak kentara pada virus, yaitu fenotipe yang mungkin lebih sulit untuk diamati pada spesies outbred.
Patogenesis virus influenza
Gejala klinis yang paling jelas pada mencit yang diinokulasi dengan virus manusia yang belum diadaptasikan atau virus LPAI adalah penurunan berat badan ringan sampai moderat, yang pada umumnya sembuh dalam 14 hari pasca inokulasi (DPI). limfopenia, letargi dan penurunan suhu badan sementara juga dapat terjadi selama fase akut infeksi, secara temporal dihubungkan dengan puncak titer virus. Replikasi virus biasanya terbatas pada saluran pernafasan saja, terutama paru-paru dan hidung. Sejumlah besar sitokin dan kemokin proinflamasi dapat dideteksi dalam paru-paru mencit terinfeksi atau cairan basuhan bronkoalveolar.
Penyakit berat berakibat kematian pada mencit terjadi setelah inokulasi virus manusia yang telah beradaptasi dengan mencit, virus pandemi 1918 yang telah direkonstruksi kembali, atau virus avian tipe liar, pada umumnya HPAI meskipun tidak terbatas hanya HPAI saja [54, 91, 93, 146]. Mencit yang terinfeksi virus-virus ini biasanya kehilangan lebih dari 20% berat badannya sebelum menyerah pada infeksi saat diinokulasi dengan dosis tinggi. Virus bereplikasi dalam paru-paru dalam titer yang tinggi, kemudian penyebaran secara sistemik ke otak dan organ lainnya dapat terjadi, terutama selama infeksi dengan virus HPAI H5N1 [91]. Seperti pada kasus berat pada manusia, pada umumnya didapati respon imun yang tidak teratur dengan limfopenia dan leukopenia yang jelas terlihat dalam darah perifer dan hipersitokinemia dalam paru-paru [143, 147]. Patologi pneumonia virus dalam paru-paru mencit yang terinfeksi virus yang virulen pada umumnya serupa dengan yang diamati pada manusia, lesi histologi terdeteksi di sepanjang saluran respirasi [69]. Histopatologinya konsisten dengan pola tempelan virus HPAI H5N1 dalam paru tikus murine [151].
Infeksi mencit transgenik
Tidak seperti model mamalia, model mencit menawarkan kesempatan unik untuk menginvestigasi peranan mediator imun spesifik dalam patogenesis virus influenza melalui penggunaan hewan transgenik. Mencit yang tidak memiliki reseptor sitokin individual dan/atau jalur sinyal telah memungkinkan studi yang lebih teliti dan seksama terhadap kontribusi respon hospes individual terhadap viral patogenesis [14, 136]. Selain itu, pentingnya faktor-faktor yang berkontribusi terhadap terbentuknya keadaan antiviral yang kuat, seperti misalnya protein Mx, telah diteliti dengan mempelajari mencit inbred yang direkayasa untuk membawa gel alel Mx1 fungsional [115, 149]. Selain manipulasi genetik, mencit telah digunakan untuk mempelajari efek kehamilan, malnutrisi, obesitas, diabetes dan komorbiditas lainnya terhadap patogenesis virus influenza [25, 37, 138, 156].
Musang
Meskipun tidak dipergunakan seluas mencit, musang (Mustela putorius furo) mewakili hewan coba yang telah diakui dan digunakan secara luas sebagai hewan coba untuk meneliti patogenesis dan transmisibilitas virus influenza. Tidak seperti mencit, virus influenza A dapat menginfeksi musang naif tanpa melalui adaptasi hospes sebelumnya. Akan tetapi, ukuran tubuhnya yang besar, biaya pemeliharaan yang lebih mahal, dan genome yang masih belum lengkap karakterisasinya membatasi penggunaan musang sebagai hewan coba untuk beberapa laboratorium atau khususnya dalam penggunaannya untuk penelitian tertentu, terutama yang memerlukan ukuran sampel besar. Selain itu, kerentanan musang yang tinggi terhadap infeksi virus influenza mewajibkan investigator untuk selalu memakai perlindungan respirasi saat berada dalam ruangan yang sama dengan hewan, untuk memastikan bahwa musang tidak terekspos patogen respirasi yang berasal dari manusia. Meskipun musang berasal dari outbreding, yang menghasilkan potensi variasi antar hewan dalam sebuah eksperimen jika dibandingkan dengan strain mencit inbreeding, manfaat patotipe virus dalam spesies dimana gejala klinis dan simptom penyakitnya mendekati atau serupa dengan yang ditemukan pada manusia seringkali lebih penting dari variabilitas ini. Karana itulah, musang mewakili model mamalia yang sangat cocok untuk mempelajari secara bersamaan patogenesis dan transmisi [9]. Penggunaan model hewan musang untuk mengevaluasi efektivitas vaksin juga memvalidasi penggunaan vaksin ini dalam karakterisasi awal virus influenza.
Patogenesis virus influenza
Musang yang terinfeksi virus influenza manusia biasanya menunjukkan gejala sakit ringan dan sementara, menunjukkan berbagai gejala klinis dan simptom infeksi yang juga terjadi selama infeksi pada manusia, meliputi berair, rinorea (hidung meler), dan demam. Berkurangnya berat badan dari ringan sampai moderat umum ditemukan. Replikasi virus-virus influenza musiman dan strain bervirulensi rendah lainnya biasanya terbatas pada saluran pernafasan atas musang. Akan tetapi, replikasi virus dalam paru-paru telah terdeteksi untuk beberapa virus manusia, terutama virus strain pandemi [90, 148].
Virus-virus avian dan swine dengan virulensi rendah pada umumnya menyerupai virus influenza manusia dalam patogenitasnya pada musang, dengan terdeteksinya kehilangan berat badan moderat dan demam selama fase akut infeksi, meskipun perbedaan strain spesifik yang mengakibatkan patogenitas yang meningkat memang terjadi [10, 90, 91, 107, 153]. Replikasi virus sepanjang saluran respirasi umum ditemukan, bersama inflamasi ringan terlokalisir yang secara umum ditemui pada paru-paru. Sebaliknya, beberapa virus HPAI dari subtipe H5 dan H7 mampu menyebabkan penyakit sistemik dan fatal pada musang, ditandai dengan penurunan berat badan, demam berkelanjutan, letargi yang jelas terlihat, dyspnea, diare, dan potensi keterlibatan neurologis, meskipun hal ini bisa jadi spesifik strain (Gambar 24.4) [14]. Musang diinokulasi dengan virus-virus bervirulensi tinggi, biasanya mati selama infeksi fase akut, seringkali karena tercapainya ambang titik akhir manusiawi dari morbiditas, letargi, dan/atau simptom neurologi. Penyebaran virus secara sistemik ke otak dan organ ekstrapulmoner lainnya seringkali ditemukan [9]. Gangguan berat pada parameter-parameter limfohematopoetika umum ditemukan. Inflamasi jaringan pulmoner bisa saja berat, dengan bronkopneumonia dan bronkiolitis akut yang terdeteksi pada awal infeksi, terutama setelah infeksi virus-virus HPAI H5N1 atau virus 1918 yang telah direkonstruksi [69, 163].
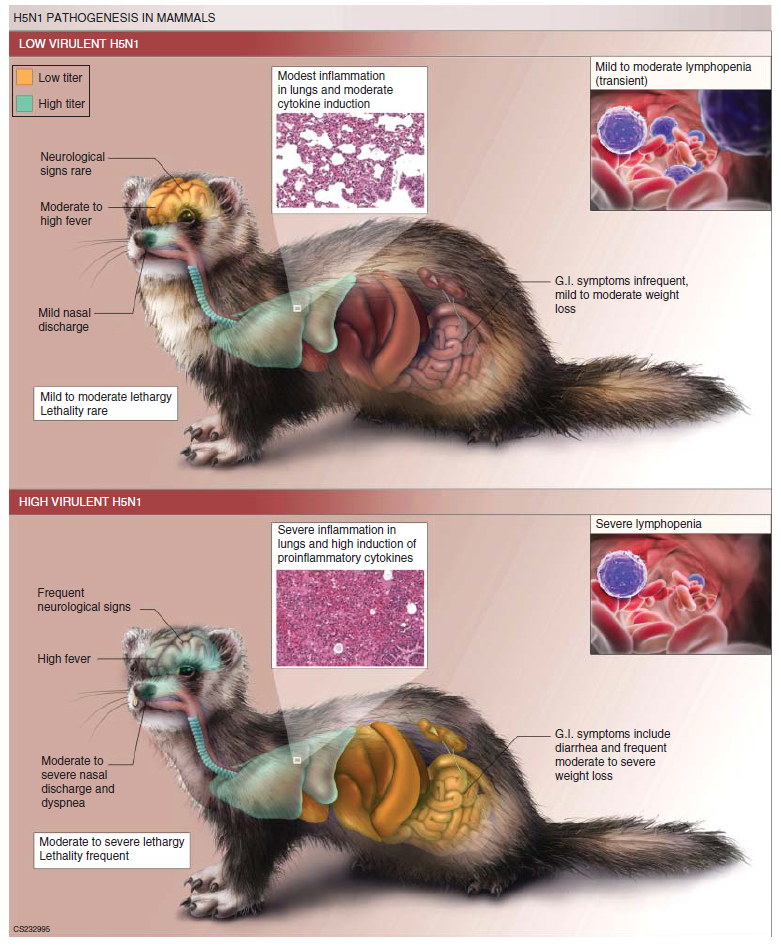
Gambar 24.4 Penggunaan model musang untuk mempelajari patogenesis virus H5N1. Banyak virus dan ciri hospes yang dipelajari dalam laboratorium menggunakan musang setelah infeksi virus AI seperti H5N1 ditunjukkan pada gambar. Banyak virus LPAI menunjukkan ciri serupa dengan virus H5N1 bervirulensi rendah digambarkan dalam panel atas. Ilustrasi oleh Allisa Eckert. Dari Belser, J.A. dan T.M. Tumpey. 2013. H1N1 pathogenesis studies in mammalian models. Virus Research 178:168-185, dengan izin Elsevier.
Penularan virus influenza
Penularan virus influenza antar musang telah didokumentasikan sejak 1941 [2]. Karena tingginya kerentanan musang terhadap infeksi virus influenza, munculnya gejala klinis dan simptom penyakit yang sesuai dengan yang teramati pada manusia, dan persetujuan umum terhadap data yang didapat dari model eksperimen penularan dan data yang didapat dari populasi manusia, musang telah menjadi model yang sangat penting untuk mempelajari penularan. Hewan ini dapat digunakan sebagai hewan model baik penularan yang terjadi karena kontak langsung (misalnya antara musang terinfeksi dan musang naif yang dipelihara dalam tempat yang sama), dan penalaran yang terjadi melalui droplet atau rute aerosol (memisahkan musang terinfeksi dan musang naif dengan pembatas yang dapat ditembus udara, tidak termasuk kontak langsung atau tidak langsung melalui makanan, air atau alas kandang terinfeksi, tetapi hanya memungkinkan pertukaran udara antar hewan) [12]. Meskipun model mamalia tidak dapat merekreasi seluruh perilaku sosial dan fisik yang teramati antar manusia yang mungkin berkontribusi terhadap insidensi penularan virus, dan penggunaan musang naif serologis pada kebanyakan studi ini tidak sepenuhnya mewakili populasi manusia yang memiliki berbagai derajat imunitas yang telah ada sebelumnya terhadap strain yang bersirkulasi, tidak dapat dipungkiri bahwa model musang memungkinkan studi yang mendekati dalam mempelajari determinan virus dan hospes yang berkontribusi terhadap transmisibilitas virus influenza [12, 64].
Virus influenza A musiman ditularkan dengan efisien antara musang ke musang baik melalui droplet respirasi dan melalui kontak langsung [52, 89]. Virus pandemi influenza, termasuk virus H1N1 dari wabah tahun 1918 dan 2009 dan virus H2N2 dari wabah tahun 1957, juga memperlihatkan kemampuan penularan pada musang melalui rute-rute tersebut, demikian juga virus-virus tertentu yang berasal dari babi [56, 90, 97, 106, 107, 148]. Sebaliknya, virus-virus HPAI seperti H5N1 dan H7N7 tidak langsung ditularkan antar musang, atau hanya ditularkan melalui kontak langsung, konsisten dengan kurangnya penularan berkelanjutan dari manusia ke manusia [5, 89, 158]. Banyak virus LPAI dihubungkan dengan infeksi manusia, termasuk virus dalam subtipe H7N2 dan H9N2, telah menunjukkan kapasitas penularan antar musang melalui kontak langsung [5, 153]. Virus-virus H7N9 telah menunjukkan beberapa kapasitas untuk penularan melalui droplet pernafasan [8, 111, 154, 162]. Meskipun tidak ada satupun spesies hewan model bukan manusia yang dapat menjadi model paling tepat dalam lingkungan laboratorium yang mempelajari penularan virus influenza pada manusia, studi-studi ini secara kolektif memperlihatkan bahwa musang secara umumnya mengikhtisarkan transmisibilitas fenotipe baik virus influenza avian maupun manusia, memberikan informasi penting untuk kesehatan masyarakat.
Babi guinea
Klaim kerentanan babi guinea (Cavia porcellus) terhadap infeksi virus influenza dimulai dari pandemi 1918, tetapi hanya pada tahun-tahun terakhir spesies ini telah digunakan untuk mempelajari patogenesis dan penularan secara penuh dalam lingkungan penelitian [81]. Pemeliharaannya yang berbiaya cukup murah dan ukurannya yang kecil membuat babi guinea sebagai spesies yang menarik untuk studi laboratorium. Selain itu, spesies ini merupakan hospes permisif terhadap banyak virus influenza A, dan distribusi reseptor asam sialik pada saluran pernapasan babi guinea serupa dengan manusia [113]. Meskipun babi guinea tidak menunjukkan banyak gejala klinis yang nampak, yang membatasi penggunaannya dalam eksperimen patogenesis tradisional, hewan ini sering digunakan untuk menilai transmisibilitas virus influenza.
Patogenesis virus influenza dan respon hospes
Tidak seperti mencit dan musang, babi guinea yang terinfeksi tidak menunjukkan gejala klinis jelas setelah terinfeksi virus influenza, dan tidak menunjukkan demam, berat badan yang terus turun, atau letargi selama fase akut infeksi. Karena itulah, virus-virus yang bersifat letal pada mencit dan musang (termasuk virus 1918 yang telah direkonstruksi dan beberapa virus HPAI H5N1) tidak mempertahankan fenotipe virulen pada spesies ini [150]. Meskipun begitu, baik virus influenza manusia maupun avian mampu menginfeksi babi guinea tanpa adaptasi hospes terlebih dahulu, dengan puncak titer virus dalam sampel saluran pernafasan atas terdeteksi sebesar 1 – 4 DPI [81, 150]. Replikasi virus-virus influenza, termasuk subtipe H5N1, pada babi guinea terbatas hanya pada saluran pernafasan [43, 150]; penyebaran sistemik ke otak masih belum dideteksi. Lesi pulmoner dan pneumonia bronchointerstitial telah dilaporkan pada babi guinea yang terinfeksi virus H5N1, tetapi keparahan histopatologi secara keseluruhan berkurang dibandingkan dengan hewan model mencit atau musang [72, 150]. Keberadaan protein Mx fungsional pada babi guine mungkin berkontribusi terhadap resistensi spesies ini setelah infeksi virus influenza. Fisiologi paru-paru babi guinea serupa dengan manusia. Tetapi, seperti juga pada musang, kekurangan reagen yang tersedia untuk spesies ini membatasi penggunaannya untuk beberapa aplikasi [141]. Induksi respon imun bawaan telah dipelajari pada hewan ini [80], demikian juga pemberian interferon tipe I secara eksogenik [130, 150].
Penularan virus influenza
Seperti musang, virus-virus musiman dan pandemi yang tidak diadaptasi bereplikasi dalam titer yang tinggi dalam saluran pernapasan babi guinea dan mampu menular kepada hewan naif baik melalui kontak langsung maupun melalui rute airborne/udara [81, 96]. Kemampuan penularan virus influenza B juga telah diperlihatkan pada babi guinea [109]. Virus influenza swine/babi dan virus LPAI H9N2 tidak secara mudah menular pada hewan ini, meskipun virus H7N9 menunjukkan kemampuan menular antar babi guinea dalam model kontak langsung, serupa dengan hasil pada musang [42, 133]. Menariknya, meskipun virus-virus H5N1 pada umumnya tidak menunjukkan penularan antar musang, beberapa virus HPAI H5N1 telah menunjukkan penularan kepada babi guinea naif melalui kontak langsung [43, 160].
Tikus kapas (Cotton rat)
Cotton rat (Sigmodon hispidus) rentan terhadap infeksi banyak patogen manusia, dan telah dipergunakan sebagai model untuk banyak virus respirasi [21, 45]. Meskipun tidak digunakan seluas mencit, karena terbatasnya reagen yang tersedia untuk spesies ini, cotton rat menawarkan beberapa manfaat berbeda dibanding mencit, dan karena itu menjadi model pilihan untuk beberapa laboratorium. Hewan ini bersifat permisif terhadap banyak virus influenza A yang tidak dapat bereplikasi pada mencit tanpa adaptasi dulu sebelumnya, memfasilitasi studi virus-virus tipe liar (wt) paa hewan ini. Hal ini sebagian mungkin disebabkan distribusi asam sialik di sepanjang saluran respirasi pada cotton rat yang lebih menyerupai distribusi asam sialik pada manusia, dengan ekspresi lebih besar asam sialik tautan ⍺2,6 dalam trakea dan paru-paru, daripada mencit [16]. Selain itu, tidak seperti banyak strain mencit, spesies ini membawa serangkaian gen Mx fungsional [21]. Akan tetapi, kurangnya refleks bersin membatasi penggunaan cotton rat dalam studi transmisibilitas [38].
Patogenesis virus influenza
Cotton rat telah diinokulasi dengan virus-virus LPAI atau manusia menunjukkan penurunan berat badan ringan sementara, penurunan temperatur tubuh sementara dan letargi ringan, dengan bukti histopatologi pada jaringan paru-paru [16, 71, 104]. Virus biasanya bereplikasi dalam titer yang tinggi baik pada hidung maupun paru-paru, dengan puncak virus load teramati sebesar 1 – 3 DPI. Histopatologi paru-paru dapat moderat atau berat, dengan terdeteksinya bronkiolitis dan pneumonia interstitial dengan titer 7 DPI [16, 71]. Virus HPAI mempertahankan fenotipe letalnya ada cotton rat saat diinokulasikan dalam dosis tinggi, dengan penurunan berat badan yang lebih besar dan hipotermia yang teramati jika dibandingkan dengan infeksi virus LPAI [16].
Imunitas terhadap virus influenza
Ekspresi antivirus Mx yang aktif secara biologi pada cotton rat inbred memungkinkan evaluasi respon awal bawaan, karena infeksi virus pasca inokulasi biasanya dikendalikan sebelum onset respon imun adaptif [38]. Model cotton rat telah dipergunakan untuk mempelajari respon antibodi dan imunitas heterosubtipik yang dipicu oleh vaksin influenza inaktif, vaksin hidup teratenuasi, atau sebelum infeksi, menghasilkan hasil yang serupa dengan yang teramati pada studi pada manusia [117, 131, 159]. Meskipun tidak lebih sering dipelajari pada cotton rat, penilaian efektivitas antiviral untuk virus influenza juga mungkin dilakukan menggunakan hewan ini [124].
Babi
Babi (Sus scrofa) telah lama dianggap sebagai ‘wadah pencampuran’ untuk virus influenza, karena mereka mampu menyokong replikasi baik virus avian maupun manusia [87]. Kapasitas ini mungkin diberikan oleh ekspresi kedua asam sialik, baik ⍺2,3 maupun ⍺2,6 yang keduanya terdapat dalam saluran pernapasan babi, dengan distribusi serupa dengan yang teramati pada manusia [145]. Hal ini makin menggarisbawahi peranan babi dalam mempelajari virus influenza, terdapat banyak model in-vitro sel epitel babi dan eksplan jaringan respirasi babi, yang melengkapi hasil in-vivo [33, 59]. Tetapi, persyaratan kandang dan pemeliharaan yang terspesialisasi untuk dapat melakukan penelitian pada hewan model ini membatasi penggunaan spesies ini hanya pada laboratorium tertentu saja.
Patogenesis virus influenza
Infeksi virus influenza pada babi biasanya muncul sebagai penyakit respirasi, dan dapat berkontribusi terhadap pneumonia karena infeksi bakterial sekunder pada spesies ini, meskipun infeksi subklinis sering terjadi [33, 152]. Virus H1N1 2009 mampu menyebabkan penyakit moderat pada babi, muncul banyak gejala klinis infeksi, diantaranya bersin, batuk, leleran hidung, dyspnea, dan letargi [73, 86]. Replikasi virus tanpa kemunculan simptom klinis telah didokumentasikan pada babi mini [56]. Berlawanan dengan hewan model mamalia lainnya, seperti mencit dan musang, infeksi virus HPAI H5N1 pada babi pada umumnya mengakibatkan infeksi ringan atau asimptomatik, replikasi virus pada umumnya terbatas pada saluran pernafasan [77]. Gejala serupa telah teramati pada babi, tapi tidak pada babi mini yang terinfeksi virus H7N9 [154, 162]. Karakterisasi respons imun yang timbul setelah infeksi virus influenza asal avian, babi atau manusia telah meningkatkan lebih jauh penggunaan hewan model ini untuk studi patogenesis [33].
Penularan virus influenza
Temuan-temuan dalam studi transmisibilitas virus influenza antar babi, dan dari babi ke spesies mamalia rentan lainnya, memiliki implikasi jelas tentang penyebaran virus yang mungkin mengancam kesehatan manusia, terutama pandangan bahwa empat virus pandemi terakhir pada manusia sebagian berasal atau seluruhnya berasal dari reservoir hewan non-manusia [35]. Untuk mendukung hal ini banyak studi telah mendokumentasikan penularan virus influenza antar spesies dari babi ke manusia, seringkali karena pekerjaan yang berhubungan dengan babi [44, 161]. Studi yang mekrekreasi kejadian penularan dari babi ke babi telah menemukan bahwa isolat H3N2 babi dan strain varian H3N2 manusia yang diisolasi dari manusia keduanya dapat menular antar babi saat hewan tersebut ditempatkan dalam kontak dekat [65]. Selain itu, penularan virus H7N9 dari babi terinfeksi ke babi naif yang berkontak (terbukti baik melalui isolasi virus ataupun serokonversi) telah ditemukan [79, 162]. Studi ini dan lainnya memberikan bukti eksperimental tentang kemampuan babi mendukung penyebaran virus pada populasi babi, menyebabkan potensi paparan terhadap manusia yang lebih besar.
Primata non-manusia
Primata bukan manusia, meliputi cynomolgus macaques (Macaca fascicularis) dan monyet tupai/squirrel (Saimiri sciureus) telah digunakan untuk mengevaluasi virulensi baik virus avian maupun manusia [99, 112]. Transmisi virus dari yang primata bukan manusia yang terinfeksi kepada yang naif saat berkontak langsung juga dilaporkan [94]. Akan tetapi, karena biaya, ukuran tubuh, dan kendala etika, hewan ini jarang digunakan untuk studi patogenesis tradisional atau studi penularan.
Patogenesis virus influenza dan respon hospes
Meskipun jarang dipakai dalam studi untuk mengevaluasi virulensi virus influenza dengan potensi pandemi, studi patotipe yang dilakukan pada primata bukan manusia
Respon hospes terhadap virus influenza
Kedekatan fisiologi dan kesamaan antara manusia dan primata bukan manusia membuat hewan ini diinginkan untuk mempelajari sistem biologi dan respons hospes setelah infeksi virus influenza. Studi-studi telah terbukti bernilai untuk memahami perbedaan dalam respons hospes yang dipicu oleh virus yang menyebabkan penyakit ringan sampai berat pada mamalia [98]. Hewan model ini juga telah digunakan untuk mengidentifikasi peranan determinan molekuler dalam hubungannya dengan dampak merugikan pada respon hospes dan berubahnya parameter limfohematopetik di antara virus-virus yang dihubungkan dengan penyakit berat pada manusia, terutama virus 1918 yang telah direkonstruksi dan virus-virus HPAI H5N1 [4, 29]. Penggunaan model yang mengeluarkan gejala sangat mendekati dengan gejala yang timbul pada suatu penyakit pada manusia telah memungkinkan pemahaman lebih besar terhadap pneumonia yang diinduksi virus, memberikan informasi berharga yang dapat berkontribusi terhadap perbaikan pengobatan dan perawatan infeksi virus pada mamalia.
Model mamalia lainnya
Meskipun spesies mamalia non-manusia lainnya jarang dipakai sebagai hewan model laboratorium, masih sangat penting untuk mempelajari kerentanan spesies-spesies ini terhadap infeksi virus influenza dalam rangka mendapatkan pemahaman potensi risiko menghandling hewan terinfeksi, terutama pada individu yang mungkin beresiko terpapar karena tugas pekerjaan. Batasan spesies biasanya membatasi permitivitas kebanyakan spesies ini terhadap infeksi virus influenza, meskipun pembentukan jalur keturunan virus influenza yang stabil pada beberapa kejadian (misalnya canine influenza H3N8 atau equine influenza H7N7) telah menunjukkan potensi keterlibatan antar spesies [32, 142]. Penting untuk disebutkan, virus H5N1 telah secara produktif menginfeksi secara luas banyak spesies mamalia, meliputi anjing, kucing, hamster syria, dan kelinci, mempertahankan kapasitas untuk menyebabkan penyakit letal tergantung pada strain virus dan spesies yang dievaluasi [14, 69]. Meskipun infeksi virus influenza pada spesies-spesies ini dalam lingkungan laboratorium telah dipelajari meskipun jarang, tidak diragukan lagi telah memberikan kontribusi penting dalam pemahaman kita tentang hubungan antarmuka antara hewan dan manusia.
Variasi rute inokulasi dan dosis
Studi yang disebutkan diatas sangat mewakili hewan yang diinokulasi melalui rute intranasal, yang merupakan metode dapat diandalkan dan konsisten untuk menginfeksi hewan dengan virus dosis tinggi. Akan tetapi, banyak model mamalia dapat diadaptasikan untuk mempelajari rute paparan alternatif yang mengancam kesehatan masyarakat. Selain itu, modulasi kondisi inokulasi dapat memberikan wawasan yang lebih luas terhadap virulensi virus influenza dan memungkinkan infeksi tertarget di tempat-tempat anatomis.
Modulasi instillasi cairan
Pengenceran virus dalam cairan inokulum yang kemudian diberikan ke dalam saluran pernapasan adalah rute inokulasi tradisional pada mamalia kecil untuk influenza. Meskipun begitu, variasi dalam dosis, volume dan likasi inokulasi ini dapat berdampak besar terhadap keparahan infeksi pasca inokulasi. Banyak virus yang menunjukkan fenotipe letal saat diberikan dalam dosis tinggi tidak menyebabkan penyakit letal ketika diberikan dalam dosis rendah [91]. Instilasi intranasal adalah rute inokulasi paling umum pada mencit, tetapi volume yang diberikan bervariasi tergantung laboratorium, berkisar kurang dari 25µL sampai 100 µL didepositokan dalam hidung hewan tersebut. Studi komparatif telah memperlihatkan bahwa perbedaan sekecil-kecilnya 10 µL dalam volume yang diberikan sudah cukup untuk memodulasi morbiditas dan mortalitas virus setelah infeksi [92]. Selain itu, mengurangi volume inokulum dari 1 ml menjadi 500µL atau 100µL saat inokulasi intranasal musang membatasi jaringan saluran pernafasan yang pada awalnya terpapar virus [7, 17, 47]. Melewati hidung hewan dan langsung menginokulasi langsung dengan rute intratrakea juga dapat mencapai patologi situs spesifik di tubuh musang [17, 18]. Inokulasi pada beberapa lokasi anatomis (biasanya meliputi saluran pernafasan dan konjungtiva) biasanya digunakan pada model primata non-manusia untuk mencapai infeksi virus influenza yang konsisten [112]. Karena pilihan metode inokulasi yang cocok dan volume yang dibutuhkan dapat sangat mempengaruhi presentasi penyakit dan patologi yang teramati setelah infeksi virus influenza, harus diperhatikan dengan baik parameter-parameter ini, terutama saat membandingkan studi antar laboratorium yang menggunakan protokol inokulasi yang berbeda.
Inhalasi aerosol
Meskipun instilasi cairan inokulum merupakan praktek yang biasa di lapangan, terdapat keperluan untuk mempelajari model manusia untuk merekapitulasi rute inokulasi yang terjadi di alam. Karena inhalasi virus dalam aerosol mewakili salah satu dari beberapa mode penularan virus influenza pada manusia [139, 140], metode inokulasi inhalasi telah ditetapkan pada banyak spesies mamalia. Model inhalasi aerosol, selain lebih mendekati paparan alami dibandingkan dengan metode inokulasi cairan instilasi, juga dapat memitigasi kemungkinan hewan menumpahkan inokulum dari saluran pernafasannya sebagai akibat dari reflek menelan [46]. Banyak studi telah dilakukan untuk membandingkan pemasukan virus dengan aerosol dengan rute intranasal untuk memahami dengan lebih baik perbedaan dalam infektivitas, onset dan perkembangan penyakit, kinetika dan durasi pendedahan virus, dan pemicu respon imun.
Eksperimen inokulasi virus influenza pada mencit melalui rute inhalasi aerosol telah ditetapkan lebih dari 50 tahun yang lalu [116]. Sejak itulah, banyak instrumentasi yang lebih rumit untuk membuat, mengambil sampel, dan menganalisis aerosol telah meningkatkan kemampuan kita untuk menginvestigasi peranan dosis infeksius dan ukuran partikel dalam mengatur deposisi virus dalam saluran respirasi mamalia [46, 67, 88]. Inokulasi mencit, musang, babi guinea, dan monyet tupai melalui rute inhalasi aerosol sudah didokumentasikan [23, 46, 96, 126]. Akan tetapi, kebanyakan penelitian ini dilaksanakan menggunakan strain virus influenza historis dalam laboratorium,atau virus yang telah mengalami adaptasi pada mamalia. Terdapat perlunya memperluas studi-studi ini untuk mencakup virus influenza kontemporer dan strain yang memiliki potensi pandemi. Dalam konteks ini, studi terbaru telah menemukan bahwa musang yang diinokulasi dengan virus H5N1 melalui rute inhalasi aerosol mempertahankan infektivitas dan letalitas tinggi seperti musang yang diinokulasi melalui intranasal, tetapi musang yang diinokulasi aerosol memunculkan penyakit yang lebih parah saat dipaparkan virus dalam dosis yang lebih rendah [47, 74].
Inokulasi okular
Meskipun tidak dipelajari secara rutin dalam konteks infeksi virus influenza, mata mewakili tempat yang memiliki potensi replikasi virus dan jalur masuknya virus untuk menimbulkan infeksi produktif pada saluran pernafasan [13]. Hal ini karena distribusi asam sialik permisif baik pada kornea mata manusia dan sel epitel konjungtiva, demikian juga kelenjar nasolakrimal, yang menjembatani jaringan okular dan hidung [70. Dominannya asam sialik dalam jaringan okuler mungkin sebagian mengatur tropisme okular yang terlihat pada beberapa virus avian influenza pada manusia, tetapi kemampuan baik virus manusia maupun avian influenza untuk berikatan dengan jaringan okuler manusia mengindikasikan bahwa ada faktor lain yang berkontribusi terhadap tropisme beberapa virus untuk jaringan ini [7, 103].
Sampai saat ini, model inokulasi okuler untuk virus influenza telah ditetapkan pada mencit dan masing, kebanyakannya menggunakan cairan suspensi yang ditanamkan ke permukaan mata dengan atau tanpa perlukaan pada kornea sebelumnya [13]. Mencit pada umumnya mengikhtisarkan tropisme okuler yang teramati pada beberapa subtipe virus pada manusia [15, 132, 137], sementara baik virus manusia maupun avian influenza dapat menimbulkan infeksi respirasi produktif dan menular pada musang setelah inokulasi dengan cairan atau aerosol inokulum [1, 6, 7]. Mencit dan musang yang telah diinokulasi melalui rute okuler biasanya tidak mengalami gejala okuler makroskopik yang teramati pada manusia, misalnya konjungtivitis, tetapi memperlihatkan penyakit respirasi yang pada umumnya teramati setelah inokulasi intranasal tradisional.
Alternatif rute inokulasi
Paparan respirasi dan paparan okuler mewakili dua dari rute infeksi virus influenza yang paling sering pada manusia, tetapi beberapa rute inokulasi dilakukan di laboratorium untuk menyelidiki infektivitas dan tropisme virus. Inokulasi intragastrik pada mencit, musang, babi guinea, dan hamster telah dilakukan untuk menjadi model kemampuan virus H5N1 dalam menyebabkan penyakit setelah terpapar melalui jalur digesti [72, 76, 121]. Menggaris bawahi kemampuan virus HPAI untuk menyebabkan penyakit berat dan kematian setelah diinokulasikan melalui beberapa rute pada model hewan mamalia, virus influenza H5N1 menunjukkan mampu mempertahankan fenotipe letalnya setelah diinokulasi melalui intravena atau intrakranial [14, 24]. Pemahaman terhadap risiko relatif terhadap rute-rute potensial paparan virus pada manusia memungkinkan penilaian yang lebih dalam terhadap virulensi virus-virus influenza yang mengancam kesehatan manusia, dan menjadi pedoman mitigasi risiko-resiko tersebut.
Pentingnya penetapan model untuk kesehatan masyarakat
Model mamalia yang terkarakterisasi dengan baik memainkan banyak peranan tak ternilai dalam hubungannya dengan pencegahan, pengobatan, dan studi virus influenza pada human (Kotak 24.1). Selain sistem penuh (whole-system) data in-vivo memberikan jembatan penting antara eksperimentasi in-vitro dan ex-vivo, dan memungkinkan studi tersebut menjadi interaksi kompleks antara virus dengan hospes yang tidak mungkin dilakukan dengan cara lain. Beberapa contoh peranan model untuk kesehatan masyarakat disampaikan di bawah ini.
Evaluasi vaksin dan kandidat vaksin
Pengujian virus-virus kandidat vaksin yang dipertimbangkan untuk produksi vaksin bergantung pada banyak pengujian untuk mendemonstrasikan atenuasi dibandingkan dengan virus asal/induknya [155]. Diantara pengujian ini salah satunya adalah perlunya mendemonstrasikan atenuasi virus pada musang atau model mamalia yang cocok, seperti misalnya mencit. Jika dibandingkan dengan strain induk, virus kandidat vaksin harus memiliki titer virus yang direduksi secara substansial dalam jaringan saluran respirasi, dan tidak menunjukkan gejala klinis penyakit. Patotiping virus-virus tipe liar secara komprehensif yang merupakan asal virus kandidat vaksin kemudian menjadi penting dalam rangka memastikan penilaian menyeluruh profil keselamatan kandidat vaksin ini sebelum diserahkan kepada produsen vaksin [19]. Penggunaan paradigma ini telah berakibat dalam evaluasi banyak virus kandidat vaksin yang dihasilkan bak dari reasortansi klasik maupun reverse genetik pada model mamalia setelah terjadinya pandemi dan wabah baru-baru ini [27, 113].
Model mamalia juga sangat penting untuk pengujian pendekatan vaksin baru praklinis. Pendekatan vaksin alternatif yang tidak memerlukan propagasi dalam telur berembrio, tidak memerlukan penggunaan virus hidup, dan/atau perlu memasukkan antigen virus tersimpan untuk meningkatkan proteksi silang mewakili sebuah area penelitian intensif yang selalu memasukkan evaluasi preklinis in-vivo [128]. Efektivitas adjuvan baru untuk meningkatkan imunogenitas dan/atau reaktivitas silang vaksin-vaksin yang sudah ada maupun yang sedang dalam percobaan juga telah dievaluasi menggunakan model-model ini [3, 36]. Metode pemberian virus alternatif juga telah dibandingkan yaitu melalui injeksi intramuskular atau spray hidung seperti yang biasa dilakukan pada spesies mamalia untuk efektivitas dan imunogenitas yang lebih meningkat [68, 125]. Meskipun musang biasanya digunakan untuk studi evaluasi ini, pengembangan reagen spesifik untuk musang agar dapat mengkuantifikasi respon imun hospes dengan lebih baik masih diperlukan agar memberikan hasil penilaian yang lebih mendetail tentang korelasi imun dan proteksi dalam studi tersebut [110].
Model mamalia terus memainkan peranan setelah vaksin telah diberi izin penggunaan pada manusia. Studi serologi manusia mengevaluasi proteksi silang dari vaksinasi musiman sebelumnya melawan strain heterolog baru yang telah dibantu oleh penelitian paralel pada model mamalia [26, 53]. Beberapa studi yang menggunakan model musang dan babi guinea telah mengukur kemampuan vaksinasi dalam memblok transmisi virus influenza homolog atau heterolog kepada kontak naid, memberikan pelengkap eksperimental terhadap studi langsung pada manusia yang telah mengevaluasi efektivitas vaksinasi pada pekerja medis dalam rangka mengurangi penularan virus kepada pasien [84, 100, 108]. Meskipun tidak sering dilakukan dikarenakan ukuran, baiya, dan pertimbangan etik, vaksinasi pada primata non-manusia dengan menggunakan virus kandidat vaksin telah memberikan informasi berharga tentang respon imun humoral dan seluler setelah vaksinasi [39]. Perbandingan respons protektif antara mencit muda dan mencit tua telah memberikan model in-vivo untuk mempelajari efektivitas vaksinasi pada populasi berbeda dan untuk menyelidiki cara-cara baru dalam meningkatkan vaksin untuk mendapatkan imunogenitas yang lebih besar dalam populasi dengan gangguan imun.
Efektivitas pengobatan antiviral
Model mamalia kecil pada umumnya digunakan untuk penilaian praklinis terhadap inhibitor virus influenza dan pendekatan antiviral lainnya ketika efektivitas telah didemonstrasikan in vitro [122]. Karena itu, menetapkan terlebih dahulu model in-vio yang telah dicirikan dengan baik melawan virus influenza kontemporer, terutama yang telah memiliki potensi pandemi, memaksimalkan kemampuan untuk menentukan efektivitas agen antivirus yang sedang diinvestigasi. Pilihan spesies mana yang akan digunakan dan virus tantan dapat sangat mempengaruhi parameter uji yang tersedia untuk mengkuantifikasi efek antivirus dan harus diperhatikan desain studinya untuk menyeimbangkan uji virus tantang yang kuat pada hewan tanpa melebihi kemampuan agen antivirus dalam berfungsi sebagaimana mestinya.
Mencit seringkali digunakan untuk mempelajari efektivitas perawatan antivirus baru melawan virus influenza, karen mencit memungkinkan pengukuran banyak parameter terkait aktivitas antiviral. Hal ini meliputi reduksi dan/atau proteksi terhadap morbiditas, mortalitas, replikasi virus dalam jaringan saluran respirasi, penyebaran virus secara sistemik, patologi paru, dan induksi respon hospes yang berbahaya, diantara parameter yang lainnya [124]. Banyak dari observasi ini juga dapat dievaluasi pada musang, meskipun ukuran spesies ini yang lebih besar mungkin menyebabkan dosis yang digunakan lebih besar karena tergantung pada berat badan, dengan demikian meningkatkan biaya yang diperlukan. Babi guinea dan cotton rat juga telah digunakan untuk uji antivirus, akan tetapi tidak adanya patogenesis virus yang biasanya teramati pada spesies-spesies ini pada umumnya membatasi parameter yang diamati hanya pada titer virus saja. Akan tetapi, studi-studi ini tidak diragukan lagi telah meneliti kemampuan pengobatan antivirus dalam mengurangi tingkat keparahan infeksi virus influenza, demikian juga dalam menilai keseluruhan kebugaran virus-virus yang resisten terhadap antivirus [20, 22, 118].
Studi baru-baru ini telah mempelajari kemampuan pengobatan antiviral tidak hanya untuk membatasi virulensi pada hospes terinfeksi, tetapi juga untuk menghambat penularan virus [82]. Musang telah digunakan sebagai model transmisi rumah tangga virus H1N1 2009 dengan mengobati baik musang terinfeksi maupun yang naif kontak dengan oseltamivir, dan mengukur efisiensi transmisi antar hewan [102]. Studi serupa juga telah digunakan untuk menyelidiki pendekatan antivirus alternatif, karena perlakuan interferon mengganggu kemampuan penularan virus pandemi H1N1 2009 antar babi guinea saat tidak satupun donor maupun hewan kontak diobati [230]. Studi-studi ini memberikan pelengkap yang diperlukan untuk studi epidemiologi retrospektif mengevaluasi efektivitas antiviral pada populasi manusia, dengan begitu meningkatkan pemahaman terhadap penularan virus tanpa dan dengan intervensi farmasi.
Surveilans dan penilaian resiko
Surveilans aktif virus influenza di seluruh dunia memberikan gambaran virus yang mana yang saat ini bersirkulasi pada burung liar, unggas galinaseus, dan spesies lainnya. Determinan elusidasi molekuler yang memberikan patogenitas dan transmisibilitas virus telah meningkatkan kemampuan kita untuk meneliti data sekuens dari isolat hasil surveilans dalam rangka mengidentifikasi penanda virulensi atau adaptasi virus pada mamalia yang mungkin dapat meningkatkan ancaman infeksi pada manusia. Selain itu, transmisibilitas virus pada hewan laboratorium adalah sebuah komponen Influenza Risk Assessment Tool (IRAT), sebuah alat evaluasi yang didesain untuk menilai potensi risiko pandemi virus-virus influenza A [31]. Penentuan kerentanan terhadap antivirus, kedekatan hubungan antigenik dengan kandidat vaksin, dan keparahan penyakit juga dapat dibantu dengan inokulasi eksperimental virus-virus ini pada mamalia. Penilaian resiko telah dilakukan untuk virus-virus pandemi sebelumnya yang masih memiliki potensi ancaman terhadap kesehatan manusia, seperti misalnya H2N2, virus-virus avian influenza tipe liar yang telah menyebabkan infeksi sporadis pada manusia sampai saat ini, dan virus influenza hasil reasortansi virus manusia dan avian [57, 58, 61].
Karena agen-agen antiviral yang tersedia sekarang ini mewakili garis pertahanan pertama melawan virus-virus influenza baru, evaluasi virus-virus yang telah dilakukan melalui uji in vitro menunjukkan resistensi terhadap produk-produk antiviral ini memiliki peranan penting dalam upaya persiapan menghadapi pandemi. Banyak model mamalia yang telah digunakan untuk menentukan apakah virus yang resisten terhadap oseltamivir menunjukkan virulensi yang semakin berkurang jika dibandingkan dengan strain sensitif [49, 157]. Transmisibilitas virus yang resisten terhadap oseltamivir juga telah dievaluasi pada model musang dan babi guinea, dan telah ditemukan bahwa strain resisten mampu mempertahankan fenotipe menular [118, 157]. Pemahaman resiko yang dimiliki virus yang resisten terhadap produk antivirus yang telah ada, dan penilaian mutasi-mutasi yang dapat merubah kebugaran virus in vivo, memberikan informasi vital untuk petugas kesehatan masyarakat.
Peranan kondisi lingkungan
Meskipun musim virus influenza bervariasi di seluruh dunia, mungkin bahwa kondisi lingkungan dan perilaku manusia mempengaruhi periode epidemi tahunan [95]. Temperatur dan kelembaban telah diidentifikasi sebagai dua parameter yang berkontribusi terhadap musim virus influenza secara umum, dan khususnya dalam penularannya [83]. Beberapa studi menggunakan babi guinea dan musang telah dilakukan untuk memodelkan efek kondisi lingkungan terhadap transmisi virus kepada kontak naif. Studi-studi ini telah memberikan data eksperimental yang mengindikasikan bahwa kondisi dingin dan kering memungkinkan frekuensi transmisi virus H1N1 dan H3N2 melalui droplet respiratori dibandingkan dengan kondisi kelembaban relatif tinggi dan temperatur yang tinggi [80, 129]. Selain mempelajari insidensi dan efisiensi transmisi virus antar hewan, memelihara hewan dalam ruang lingkungan terkontrol memungkinkan dapat dipelajarinya profil aerosol dan pendedahan virus dari mamalia terinfeksi dalam kisaran kelembaban dan kondisi temperatur tertentu [48]. Studi-studi in-vivo ini memungkina dilakukannya pemeriksaan lebih dekat terhadap parameter-parameter lingkungan yang memerlukan pengaturan kontrol secara ketat, dan tidak dapat dengan mudah dilakukan dalam konteks yang berbeda.
Penentu potensi pandemi
Virus avian influenza dari banyak subtipe, terutama virus H5 dan H7, telah menyebabkan penyakit manusia secara sporadis dan kematian yang telah tercatat selama berdekade lalu. Akan tetapi, virus-virus subtipe ini sampai saat ini belum menyebabkan pandemi, kemungkinan karena transmisibilitas yang buruk antar manusia. Memahami bagaimana virus mendapatkan fenotipe menular dan apakah fenotipe ini dapat didapatkan tanpa mengakibatkan hilangnya virulensi pada manusia, mewakili kebutuhan kesehatan masyarakat yang mendesak. Dengan menggunakan model musang, dua studi independen menemukan bahwa virus-virus H5N1 mampu memperoleh fenotipe menular, hal ini menggarisbawahi ancaman kesehatan masyarakat yang dimiliki virus subtipe ini jika perubahan tersebut terjadi di alam [51, 55]. Hasil yang serupa juga telah didapat dari virus subtipe H7 [134], mengungkapkan potensi pandemi banyak subtipe virus influenza. Studi-studi in-vivo ‘gain-of-function’ ini memberikan informasi esensial yang tidak hanya mengidentifikasi perubahan genetik pada virus yang memberikan fenotipe menular, tetapi juga mempedomani upaya surveilans, seleksi strain vaksin, dan keputusan mencadangkan vaksin, dan pengujian efektivitas antivirus [62, 75].
Meskipun terdapat banyak informasi yang dapat diambil dari studi-studi ini, terdapat banyak permasalahan biosfatey, biosekuriti, dan etik yang mesti diperhatikan dalam rangka mempedomani pembuatan dan manipulasi virus yang berpotensi meninggikan resiko infeksi pada manusia secara bertanggungjawab [78]. Eksperimentasi in-vivo memberikan penilaian yang lebih komprehensif fan lebih dapat diandalkan tentang penularan virus, akan tetapi melakukan pekerjaan pendukung berikutnya yang berkelanjutan di banyak platform penelitian mewakili sebuah langkah penting dalam proses ini (Gambar 24.1). Terdapat langkah dalam rangka meningkatkan transparansi diantara peneliti, ahli kesehatan masyarakat, badan regulasi, pemberi dana, dan masyarakat awam saat melakukan perencanaan, pelaksanaan, dan diseminasi hasil-hasil penelitian tersebut [40, 50]. Karena infeksi virus influenza pada manusia terus ada, dan kemunculan virus baru yang membawa ancaman terhadap kesehatan manusia, pengawasan ketat terus menerus dan penilaian manfaat dan resiko potensi kesehatan masyarakat yang didapat dari jenis penelitian ini akan menjadi penting.
Kesimpulan
Virus influenza merupakan ancaman berkelanjutan terhadap kesehatan masyarakat, sehingga menjadi penting untuk terus menerus mengawasi dan melakukan investigasi dalam rangka mencapai persiapan optimal terhadap wabah dan pandemi yang tak terhindarkan lagi. Bab ini telah menggambarkan bagaimana penggunaan model mamalia merupakan elemen vital terhadap upaya-upaya ini. Karena data in-vivo memiliki peranan penting dalam pencegahan dan pengendalian infeksi virus influenza, diperlukan perbaikan terus menerus pada model yang dalam rangka secara optimal mempelajari dan meniru paparan manusia terhadap penyakit. Perkembangan dalam aerobiologi yang telah membawa meningkatnya penggunaan inokulasi via inhalasi pada manusia dibandingkan instilasi cairan adalah salah satu contoh inovasi tersebut [46]. Bioluminescence imaging dengan virus influenza reporter yang kompeten replikasinya, memungkinkan analisa dinamika infeksi real-time in-vivo, mewakili pendekatan baru yang akan memberikan pemahaman bsesar tentang interaksi virus-hospes di masa depan [105, 144]. Selama mengejar perkembangan-perkembangan penting terdapat beberapa area yang berhubungan dengan penggunaan model hewan dalam penelitian virus influenza yang tidak boleh diabaikan. Pelaporan lebih mendetail tentang metode eksperimen dan statistik dalam publikasi studi menggunakan model mamalia diperlukan untuk meningkatkan pemahaman, interpretasi dan reproduksibilitas data yang terdapat di dalamnya [63]. Selain itu, penting untuk setiap penelitian untuk menggunakan jumlah sampel hewan yang sesuai, analisa virus-virus berbeda untuk menghindari hasil strain spesifik saja yang tidak disengaja, dan pembacaan hasil eksperimen yang bervariasi [11, 78]. Perhatian yang hati-hati terhadap hal-hal ini dan pertimbangan-pertimbangan lainnya akan sangat membantu kita dalam mempelajari dan menginterpretasikan potensi zoonosis virus animal influenza di tahun-tahun mendatang.
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

