Oleh :Edwin J. B. Veldhuis Kroeze dan Thijs Kuiken
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Perkenalan
Dari reservoir burung liar asalnya, virus influenza A (IAV) telah melewati barrier spesies pada beberapa waktu lalu atau lainnya di masa lalu dan menyebabkan infeksi IAV endemik pada manusia, babi domestik (lihat Bab 16-19), kuda (lihat Bab 20 dan 21), dan baru-baru ini pada anjing domestik (lihat Bab 22). Akan tetapi, tampaknya terdapat beberapa batasan berhubungan dengan kisaran spesies mamalia yang dapat diinfeksi virus IAV. Hal ini sebagian mungkin disebabkan penggunaan sialosakarida sebagai reseptor untuk virus dapat berikatan, dan kemampuannya untuk dengan efisien menekan respon imun bawaan dari hospes. Bab ini memberikan pembahasan tentang banyak mamalia dimana terdapat bukti infeksi sporadis berbagai virus AIV, yaitu hewan karnivora, cetacea, primata non-manusia, kelelawar, ungulata berkaki genap dan berkaki tunggal, rodensia, lagomorpha, dan pemakan semut.
Sebuah “game changer” dalam beberapa tahun terakhir adalah penemuan infeksi IAV pada kelelawar dunia baru. Virus ini tidak saja endemik pada populasi kelelawar, tetapi juga merupakan subtipe baru yang tidak ditemukan pada reservoir burung liar. Karena itulah, mereka tampaknya mewakili reservoir asli tambahan dari virus AIV, dan hanya sekarang saja dimasukkan ke dalam Bab ini karena memang baru saja ditemukan.
Karakteristik yang dimiliki oleh spesies mamalia dimana virus IAV telah menjadi endemik adalah jumlah populasi yang besar dan agregasi dalam ruangan tertutup (bangunan publik untuk manusia, kandang tertutup/barn untuk babi, kandang/stables untuk kuda, dan kandang/kennel untuk anjing domestik). Pada spesies-spesies ini, infeksi IAV terdapat dalam populasi secara terus menerus, dan virusnya telah beradaptasi pada spesies hospesnya. Pada akhir skala ini adalah spesies-spesies mamalia dimana infeksi virus AIVnya hanya berkisar pada kasus-kasus sporadis pada individu hewan karena adanya transfer antar spesies, yang diperparah dengan menyebarnya pandemi virus AIV H1N1 dari manusia kepada kucing dan musang peliharaan. Penghubung antara kedua titik ekstrim dalam skala ini adalah spesies mamalia dimana penularan virus AIV yang efisien tampaknya mungkin terjadi, akan tetapi untuk beberapa alasan tidak berakibat persistensi virus dalam populasi. Banyaknya laporan epidemi virus AI Avian pada anjing laut pelabuhan (Phoca vitulina) adalah sebuah contoh yang jelas.
Meskipun begitu, situasi dapat berubah dengan cepat. Siapa yang mengira dua puluh tahun yang lalu bahwa virus avian-like H5N1 akan menimbulkan kekacauan di antara banyak spesies mamalia, atau bahwa anjing domestik akan memiliki virus AI sendiri yang beradaptasi pada spesies canine. Skala perubahan global populasi hewan dan ekosistem yang didiaminya, bersama dengan sifat virus AI telah berimbas pada situasi yang dinamis. Karena itulah informasi yang disajikan dalam Bab ini harus dipandang sebagai sebuah ‘tangkapan terkini’ terhadap situasi yang ada saat Bab ini ditulis. Infeksi sporadis pada hari ini bisa saja menjadi situasi endemis di masa depan.
Infeksi HPAI H5N1 pada beraneka ragam spesies mamalia
Virus avian influenza berpatogenitas tinggi (HPAIV) yang muncul di Asia tahun 1996 pada unggas telah menunjukkan kapasitasnya untuk menginfeksi banyak spesies mamalia, termasuk manusia. Pada spesies-spesies ini, virus dapat menyebar ke banyak organ diluar saluran pernafasan, mengakibatkan penyakit berat dan kematian. Infeksi alami telah dilaporkan pada banyak spesies karnivora baik liar maupun domestik [48, 100, 103, 106, 107, 117, 147, 166, 180, 188, 210, 211, 222, 245, 256] (Tabel 23.1 dan 23.2), babi domestik [119], black-lipped pikas (Ochotona curzinae) [252], dan keledai [1] (Tabel 23.3). Bukti serologis infeksi alami atau paparan virus HPAI H5N1 telah dilaporkan pada tikus cokelat (Rattus norvegicus) [55, 197], racoon (Procyon lotor) [84], dan kuda [55]. Selain itu, infeksi virus HPAI H5N1 eksperimental (tidak didiskusikan mendalam di sini) telah dilakukan pada hewan laboratorium (mencit, tikus, hamster) [73, 128, 133, 195, 198], musang (Mustela putorius furo) [69, 133, 255], cynommolgus macaques (Macaca fascicularis) [112, 184, 185], red fox [Vulves vulpes) [183], sapi (Bas taurus) [98], dan kelinci laboratorium [252].
Dua kekhawatiran yang muncul tentang banyak kasus sporadis yang disebabkan infeksi HPAI H5N1 pada mamalia adalah bahwa mereka bisa menjadi sumber infeksi kepada manusia, dan mereka memberikan kesempatan bagi virus untuk beradaptasi memungkinkan penularan yang efisien antara mamalia ke mamalia lainnya. Sampai saat ini tidak terdapat bukti konkrit persebaran virus HPAI H5N1 dari amalia liar ataupun domestik ke manusia. Tentang penularan mamalia ke mamalia yang efisien, satu-satunya bukti yang kuat adalah kemungkinan penyebaran dari harimau ke harimau pada kebun binatang di Sri Racha, Thailand, di tahun 2004 [222]. Karena itulah, sumber utama infeksi HPAI H5N1 pada manusia tetap saja unggas, dimana virus tetap terus bersirkulasi di Asia Timur dan Afrika Utara [240].
Indikasi pertama bahwa virus HPAI H5N1 dapat menyebar dari unggas ke mamalia selain manusia adalah pada bulan Desember 2003, saat infeksi HPAI H5N1 fatal dilaporkan pada dua ekor harimau (Panthera tigris) dan dua ekor Leopard (Panthera pardus) di Kebun Binatang di Suphanburi, Thailand [100]. Diikuti oleh wabah kedua di bulan Oktober 2004 di Sri Racha, Thailand yang melaporkan kematian atau euthanasia sejumlah 147 ekor harimau [222]. Felidae yang terinfeksi menunjukkan gejala demam tinggi, gangguan pernafasan, dan (pada beberapa kasus) gejala syaraf, dan mati disertai gejala leleran hidung serosanguinus tiga hari setelah onset gejala klinis (Gambar 23.1). Autopsi mengungkapkan temuan paru-paru yang mengalami kongesti berat dan hemoragi, yang selaras dengan temuan patologi mikroskopis yaitu pneumonia bronko interstitial dan kolakalisasi ekspresi antigen virus influenza dalam pneumosit. Persebaran virus ekstrarespiratori didemonstrasikan dengan adanya meningoencephalitis dan hepatitis, ko-lokalisasi dengan ekspresi antigen virus influenza dalam neuron dan hepatosit [100, 222]. Felid yang terinfeksi pada awalnya terinfeksi sebagai akibat memakan karkas unggas segar – isolat virus HPAI H5N1 yang diambil dari felid pada kedua kebun binatang sangat serupa dengan strain HPAI H5N1 yang bersirkulasi pada unggas pada saat itu [6]. Sangat mungkin bahwa penularan HPAI H5N1 dari harimau ke harimau lainnya juga terjadi di Sri Racha, karena wabah terus berlanjut meskipun pemberian karkas unggas segar sudah dihentikan. Terdapat bukti terbatas adanya penularan HPAI H5N1 ke manusia. Lima penjaga kebun binatang ditempatkan dibawah pengawasan setelah menunjukkan gejala klinis [224]. Akan tetapi, hanya dua dari 58 penjaga kebun binatang dan dokter hewan, yang keduanya tidak menunjukkan gejala klinis, memiliki antibodi anti-HPAI H5N1 dalam serum enam minggu setelah wabah [222].
Infeksi virus HPAI H5N1 dilaporkan tidak hanya di Thailand, tetapi juga di Kamboja dan China. Di Bulan Desember 2003 terdapat wabah virus HPAI H5N1 pada 26 spesies unggas, termasuk burung pemangsa, di Phnom Tamao Wildlife Rescue Centre, Kamboja. Selama berlangsungnya wabah ini, dua ekor singa (Panthera leo), dua ekor harimau, dua ekor Asiatic golden cats (Catopuma temminckii), tiga ekor leopard, dan satu ekor clouded leopard (Neofelis nebulosa) menunjukan gejala anoreksia dan letargi selama 5 – 7 hari, tetapi tidak ada sakit pernafasan atau kematian. Sampel serum diambil dari satu ekor harimau, satu ekor leopard, satu ekor Asiatic golden cat, dan satu ekor clouded leopard, dan semuanya memiliki titer antibodi penetralisir melawan virus HPAI H5N1 sebesar 10 – 40. Isolat virus HPAI H5N1 dari unggas di kebun binatang secara filogenetik sangat serupa dengan yang berasal dari unggas di Kamboja, dan diasumsikan bahwa karkas unggas terinfeksi yang digunakan sebagai sumber pakan baik untuk burung pemangsa maupun kucing besar merupakan sumber infeksi [48]. Di tahun 2005, seekor harimau di sebuah kebun binatang di Shanghai, China, mati dengan temuan klinis dan patologi yang serupa dengan yang ditemukan pada harimau di Thailand. Isolat virus HPAI H5N1 dari paru-paru harimau berasal dari clade 2.2, dan secara filogenetik hampir identik dengan yang diisolasi di tahun yang sama dengan itik migrasi di Danau Poyang, China. Akan tetapi, tidak dilaporkan adalah apakah harimau telah mengkonsumsi ayam atau burung liar [147].
Dimulai pada tahun 2004, terdapat beberapa laporan dari seluruh dunia bahwa kucing domestik dengan infeksi HPAI H5N1 alami – dari Thailand di tahun 2004 [169, 10], Jerman dan Austria di tahun 2006 [106, 117, 237], Irak di tahun 2006 [245], Indonesia di tahun 2006 [168], dan Israel di tahun 2012 [155]. Sebagian besar laporan ini mengindikasikan bahwa kontak dengan atau memakan unggas terinfeksi adalah rute infeksinya, dan telah mendeskripsikan penyakit klinis berat sampai kematian pada kucing. Lima hari setelah memakan burung dara, seekor kucing di Thailand mengalami demam tinggi, gangguan pernafasan, dan depresi, dan mati setelah dua hari kemudian [210]. Beberapa kucing di Pulau Rugen di Jerman terinfeksi virus HPAI H5N1 yang berasal dari clade 2.2 [214] dan secara genetik sangat mirip dengan isolat dari burung angsa whooper (Cygnus cygnus) dari wilayah yang sama [106, 237]. Beberapa ekor kucing di Israel menunjukkan gangguan pernafasan, kelemahan, dan setelahnya mati setelah memakan karkas kalkun. Virus HPAI H5N1 yang ditemukan pada kucing serupa dengan yang didapat dari kalkun [155]. Sebaliknya, tidak ada gejala klinis yang teramati pada beberapa kucing yang mendapat hasil swab positif virus HPAI H5N1 dengan uji PCR setelah berkontak dengan unggas terinfeksi pada shelter hewan di Austria [117].
Infeksi eksperimental HPAI H5N1, baik melalui inokulasi intratrakea atau melalui memakan anak ayam terinfeksi, menunjukkan bahwa kucing rentan memunculkan penyakit respirasi berat dan komplikasi ekstra respiratori. Kucing mengalami bukan hanya pneumonia bronko interstitial berat tetapi juga nekrosis dan inflamasi berat pada otak, jantung, hati, ginjal, limfa, kelenjar adrenal, dan usus, berko-lokalisasi dengan ekspresi antigen virus influenza dalam sel epitel dan mesenkim dalam jaringan-jaringan ini (Gambar 23.2) [111, 186, 231]. Selain itu, pankreatitis hemoragik juga diamati pada kucing yang terinfeksi secara alami [245].
Bukti serologis bahwa kucing terekspos atau terinfeksi dengan virus HPAI H5N1 tergantung situasi pada unggasnya. Di wilayah geografis dimana virus HPAI H5N1 endemik pada unggas, ditemukan proporsi seropositif sebagai berikut: 8 dari 111 ekor (7%) di Thailand Tengah [28], 100 dari 500 ekor (20%) di Jawa dan Sumatera [167], dan 9 dari 25 ekor (36%) di wilayah-wilayah endemik di Mesir [55]. Sebaliknya tidak ada kucing yang ditemukan seropositif di wilayah-wilayah di Eropa dimana kasus HPAI H5N1 telah terjadi pada unggas sebagai epidemik [138, 160].
Pedoman pencegahan dan manajemen infeksi virus HPAI H5N1 pada kucing peliharaan dipublikasikan oleh Kuiken dan koleganya dan oleh European Advisory Board of Cat Diseases [223]. Di wilayah-wilayah dimana virus HPAI H5N1 telah terdeteksi pada unggas atau burung liar, pemilik kucing harus menghindari memberi makan kucingnya daging unggas yang belum dimasak, dan memelihara kucing di dalam rumah untuk mencegahnya berkontak dengan unggas terinfeksi atau kotorannya. Pada kasus suspek infeksi HPAI H5N1 pada kucing, dokter hewan dan pemilik kucing harus mempertahankan upaya higiene ketat dalam penanganan hewan, karantina dan pengujian kucing-kucing yang terdampak. Vaksin virus avian influenza H5N6 heterolog beradjuvan telah diperlihatkan mampu melindungi kucing terhadap penyakit fatal yang disebabkan infeksi HPAI H5N1 [231].
Infeksi virus HPAI H5N1 juga telah dilaporkan pada anjing domestik, tetapi penyakit yang berhubungan dengannya tampaknya lebih ringan dibandingkan kucing. Hanya terdapat satu laporan kasus infeksi alami virus HPAI H5N1 pada anjing [211]. Seperti kucing, anjing juga sepertinya terinfeksi karena memakan unggas terinfeksi. Anjing itu mengalami demam tinggi, dyspnea, dan letargi 5 hari kemudian, dan mati besok harinya. Autopsi mengungkap kongesti dan edema pulmoner berat yang berkorelasi secara histologis dengan pneumonia interstitial dan ekspresi antigen virus influenza dalam sel alveoli paru. Penyebaran virus diluar sistem respirasi (ekstra-respiratori) didemonstrasikan secara histologis dengan nekrosis hepatik multifokal dan tubulonefritis, yang berko-lokalisasi dengan ekspresi antigen virus influenza dalam hepatosit dan sel epitel glomerulus dan tubulus renalis. Virus HPAI H5N1 yang diisolasi dari paru-paru, hati, ginjal, dan urin secara genetik serupa dengan virus yang diisolasi sebelumya dari harimau di Thailand [211]. Dalam infeksi virus HPAI H5N1 eksperimental pada anjing, gejala klinis yang muncul berkisar antara demam naik turun dan konjungtivitis [130] sampai anoreksia, demam, konjungtivitis, nafas memburu, batuk, dan kematian pada satu dari enam ekor anjing [37]. Sebaliknya dari kasus faal yang dilaporkan oleh Songserm dan koleganya [211], replikasi virus dan lesi yang berhubungan dengannya pada anjing yang diinfeksi secara eksperimental terbatas hanya pada saluran pernafasan. Tingginya persentase jumlah anjing yang memiliki antibodi spesifik terhadap virus influenza H5N1 menunjukkan bahwa anjing pada umumnya terinfeksi atau terekspos kepada virus HPAI H5N1 di wilayah-wilayah dimana virus bersifat endemik pada unggas (160 dari 629 ekor anjing (25%) di Thailand Tengah [28], dan 4 dari 25 ekor anjing (16%) di wilayah endemik di Mesir [55].
Terdapat satu laporan infeksi virus HPAI H5N1 yang berhubungan dengan kematian anjing rakun (Nyctereutes procyonoides), yang termasuk ke dalam famili Canidae [180]. Sekitar 100 dari total 1000 ekor anjing rakun dari sebuah peternakan bulu di China mati dengan menunjukkan gejala respirasi, diare atau keduanya di tahun 2005. Karakterisasi genetik dan molekuler mengidentifikasi virus, yang duusikasi dari paru-paru dua ekor anjing rakun yang mati, yaitu virus HPAI H5N1. diasumsikan bahwa karkas ayam yang diberikan untuk dimakan anjing rakun adalah sumber infeksi [180]. Tidak ada satupun dari 102 anjing rakun liar yang disampel di Korea Selatan tahun 2011 memiliki antibodi terhadap virus AI [34].

Gambar 23.1 Infeksi alami virus HPAI H5N1 pada harimau di Sri Racha, Thailand pada tahun 2004. Hewan yang terdampak mengalami demam tinggi, gangguan pernafasan, dan (pada beberapa kasus) gejala syaraf, dan mati dengan leleran hidung serosanguinus. Hak milik fotografi milik Dr. Roongroje Thanawongnuwech, Chulalongkorn University, Thailand.
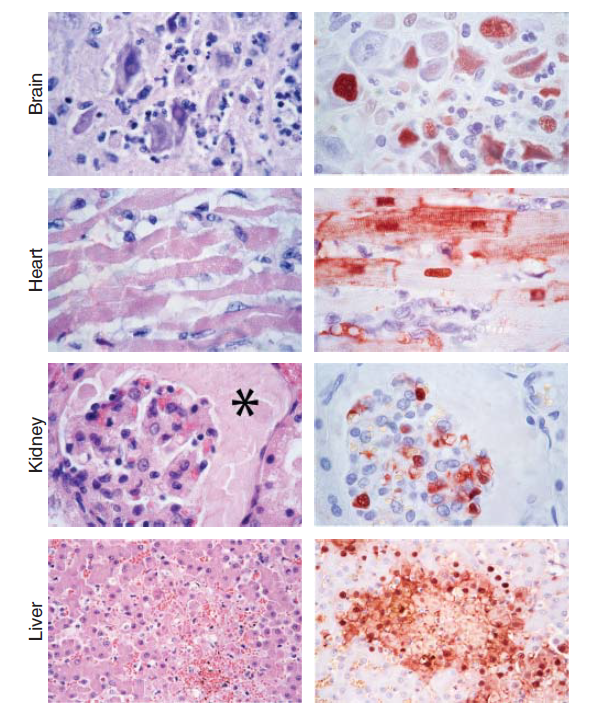
Gambar 23.2 Lesi histologi sistemik pada kucing domestik setelah infeksi eksperimental virus HPAI H5N1. Kolom sebelah kiri menunjukkan foci radang nekrotik yang terdapat pada banyak jaringan yang diwarnai dengan hematoksilin dan eosin. Kolom sebelah kanan menunjukkan antigen virus influenza (pewarnaan merah-coklat) yang ditemukan pada beberapa sayatan bagian dari jaringan yang sama, diwarnai untuk nukleoprotein menggunakan immunohistokimia. Dicetak ulang dari The American Journal of Pathology, January 2006, Vol. 168, No. 1, pp. 176–183, Rimmelzwaan G. F., van Riel D., Baars M., Bestebroer T. M., van Amerongen G., Fouchier R.A., Osterhaus, A. D., Kuiken, T. Influenza A virus (H5N1) infection in cats causes systemic disease with potential novel routes of virus spread within and between hosts. Dengan izin dari Elsevier.
Rubah merah (Vulpes vulpes), yang termasuk ke dalam famili Canidae, adalah predator dan pemakan bangkai penting bagi unggas baik liar maupun domestik, dan berpotensi terekspos virus HPAI H5N1 melalui rute ini. Virus HPAI H5N1 (A/fox/Azerbaijan/1413/2006) diisolasi dari seekor rubah di Azerbaijan di tahun 2006 [58]. Infeksi eksperimental menunjukkan bahwa rubah merah mengekskresikan virus dari tenggorokan sampai sekitar 7 hari setelah inokulasi. Ingesti anak itik yang terinfeksi menyebabkan infeksi subklinis atau pneumonia ringan, sementara inokulasi intratrakea menyebabkan pneumonia berat, myocarditis, dan ensefalitis. Semua hasil ini menunjukkan bahwa rubah merah mungkin memainkan peran dalam penyebaran virus [183].
Terdapat satu laporan infeksi virus HPAI H5N1 yang fatal pada Owston palm civet (Chrotogale owstoni), spesies yang terancam punah di seluruh dunia yang termasuk ke dalam famili Viverridae. Kasus itu melibatkan tiga ekor Owston palm civet yang dipelihara bersama dalam penangkaran di taman nasional di Vietnam tahun 2005. Musang-musang ini menunjukkan gejala anoreksia dan gejala neurologis, yaitu paralisa kaki belakang, selama 1 sampai 2 hari sebelum mati. Pemeriksaan patologis mengungkapkan pneumonia interstitial, meningitis, edema serebral, dan nekrosis hepatik multifokal. Virus HPAI H5N1 terdeteksi melalui isolasi virus, RT-PCR, dan immunohistokimia dalam semua jaringan ini, demikian juga pada ginjal dan usus, yang menunjukkan adanya infeksi virus sistemik. Meskipun virus HPAI H5N1 dari Owston palm civet serupa dengan yang ada pada unggas, dan kematian unggas tak terdiagnosa dilaporkan di sekitar taman, musang tersebut tidak memakan karkas unggas mati, karena itu sumber infeksi masih belum diketahui [165, 188].
Terdapat laporan kasus tunggal infeksi virus HPAI H5N1 pada musang batu/stone marten (Martes foina) [107] dan American mink (Mustela vison) [166], keduanya termasuk kedalam famili Mustelidae. Stone marten berasal dari Pulau Rugen, Jerman Utara, dan American Mink berasal dari Swedia Selatan. Kedua hewan tersebut hidup bebas, menunjukkan gejala klinis dan diidentifikasi pada tahun 2006. Mereka mungkin terinfeksi sebagai akibat memakan burung liar terinfeksi. Pemeriksaan histopatologi pada stone marten mengungkapkan adanya ensefalitis dan nekrosis pankreatik, ko-lokalisasi dengan ekspresi antigen virus influenza dalam neuron dan sel asinar pankreatik [107]. Lebih mengejutkan lagi, baik pneumonia maupun antigen virus influenza tidak ada yang terdeteksi di dalam paru-paru, yang berkebalikan dengan pneumotropisme virus HPAI H5N1 pada kebanyakan mamalia lainnya. Karakterisasi molekuler isolat dari Swedish mink (A/Sweden/mink/V907/2006) mengungkapkan tidak adanya adaptasi spesifik kepada mamalia [103, 256].
Hanya terdapat bukti serologis infeksi virus HPAI H5N1 pada rakun (Procyon lotor), yang termasuk ke dalam famili Procyonidae. Sejumlah 10 (0,9%) dari total 1088 rakun sehat yang hidup bebas yang disampel di Jepang antara tahun 2005 dan 2009 memiliki antibodi penetralisir virus untuk virus AI H5N1 tetapi tidak memiliki antibodi terhadap virus dari subtipe hemaglutinin (HA) yang berbeda, meliputi H1, H3, H7, dan H9. Selama periode tersebut, Japan mengalami dua wabah virus HPAI H5N1 pada peternakan unggas dan satu angsa yang hidup liar. Karena itulah, rakun bisa saja terinfeksi atau terekspos karena memakan karkas burung yang terinfeksi [84].
Hanya terdapat bukti serologis adanya infeksi HPAI H5N1 pada tikus coklat (Rattus norvegicus), termasuk dalam famili Muridae. Antibodi inhibisi hemaglutinasi terhadap virus AI H5N1 ditemukan pada beberapa ekor tikus cokelat yang di sampling pada pasar unggas hidup di Hong Kong [197], dan 1 ekor (1,4%) dari 72 ekor tikus coklat yang disampling di Kairo, Mesir dan wilayah sekitarnya setelah virus HPAI H5N1 menjadi endemik pada unggas di sana tahun 2006 [55]. Secara eksperimental, tidak hanya tikus laboratorium, tetapi juga mencit laboratorium (Mus musculus) dari famili Muridae dan hamster (Mesocricetus auratus) dari famili Cricetidae mengembangkan infeksi produktif dan lesi yang berhubungan dengannya setelah inokulasi HPAI H5N1 [133, 195, 198].
Terdapat satu laporan infeksi HPAI H5N1 pada black-lipped pika (Ochotona curzoniae), dari famili Ochotonidae, yang bersama dengan kelinci dan terwelu termasuk ke dalam ordo Lagomorpha. Bukti infeksi virus HPAI H5N1 ditemukan pada black-lipped pikas yang disampling antara bulan Agustus 2006 dan Desember 2007 dalam habitat alaminya di sekitar Danau Qinghai, China [252], dimana terdapat wabah infeksi virus HPAI H5N1 berskala besar pada burung migrasi [36, 124, 253]. Pada awalnya, antibodi inhibisi hemaglutinasi terhadap virus AI H5N1 terdeteksi pada 11 ekor (13%) dari 82 ekor pika. Kemudian, virus HPAI H5N1 diisolasi dari sampel otak, paru-paru, dan rektum pada 5 ekor (3%) dari 147 pika yang baru ditangkap. Secara filogenetik, isolat-isolat ini dapat dibagi menjadi keturunan campuran/Vietnam H5N1 dan keturunan H5N1 mirip Qinghai burung liar. Kemungkinan black-lipped pika mendapatkan virus ini dari burung-burung liar di tempat merumput bersama. Infeksi eksperimental pada kelinci (Oryctolagus cuniculus), dari famili Leporidae, berakibat infeksi produktif dan pneumonia interstitial, dengan ekspresi antigen virus influenza dalam sel epitel pada turbinata hidung, trakea dan paru-paru [252].
Baru-baru ini, kisaran hospes virus HPAI H5N1 telah meluas termasuk didalamnya keledai (Equus africanus asinus), yang bersama dengan kuda (Equus ferus caballus) termasuk ke dalam famili Equidae. Pada sebuah desa di Mesir tahun 2009, virus HPAI H5N1 diisolasi dari swab hidung (pool) dari tiga ekor keledai yang menunjukkan gejala respirasi ringan. Keledai-keledai tersebut menunjukkan gejala batuk, demam, dan leleran hidung serosa selama 72 jam. Onset gejala respirasi ini adalah 1 minggu setelah wabah infeksi HPAI H5N1 pada unggas di desa yang sama. Analisis filogenetik isolat dari keledai menunjukkan homologi yang dekat kekerabatannya dengan virus HPAI H5N1 Mesir yang bersirkulasi pada unggas dan unggas. Kemudian, antibodi melawan virus AI H5N1 ditemukan pada 27 ekor (26%) dari 105 ekor keledai dari dimana virus HPAI H5N1 endemik pada unggas. Rute infeksi yang mungkin meliputi paparan aerosol dari kotoran burung, makanan atau air minum yang tercemar kotoran burung, atau kontak langsung dengan burung terinfeksi. Terdapat kekhawatiran bahwa keledai yang pada umumnya dipelihara bersama unggas mungkin dapat menyebarkan virus HPAI H5N1 yang telah beradaptasi pada mamalia ke manusia [1]. Dalam survei serologi yang dilakukan kemudian, El Sayed dan koleganya [55] menemukan antibodi terhadap H5N1 tidak hanya pada keledai tetapi juga kuda di wilayah endemik H5N1 di dan sekitar Kairo.
Meskipun sapi (Bos taurus), dari famili Bovidae, dapat terinfeksi secara alami dengan virus AI [33, 127], tidak ada laporan infeksi alami virus HPAI H5N1 pada sapi. Secara eksperimental, empat anak sapi/pedet yang diinokulasi secara intranasal dengn virus HPAI H5N1 yang berasal dari kucing yang terinfeksi secara alami mengalami infeksi subklinis dengan ekskresi virus yang rendah dari hidung. Tidak ada bukti kuat adanya penularan dari pedet ke pedet, meskipun satu dari dua pedet sentinel dipelihara bersama dengan pedet yang diinokulasi mengalami serokonversi, swab hidung dari kedua pedet sentinel tetap negatif RNA HPAI H5N1 selama eksperimen berlangsung [98].
Infeksi virus influenza A lain pada beraneka ragam spesies mamalia
Virus-virus influenza A dalam Ordo Carnivora, subordo Caniformia
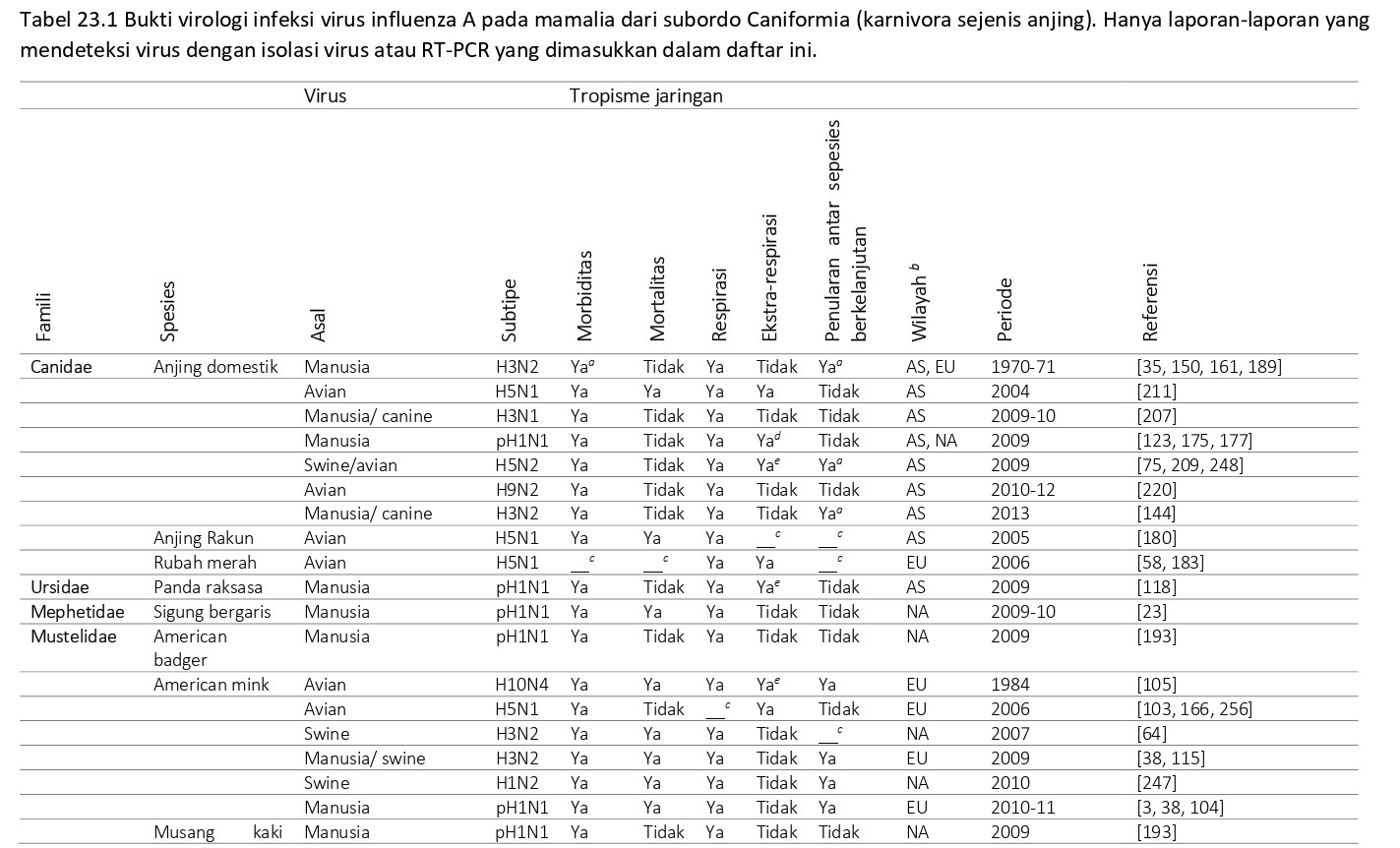
Berbagai spesies termasuk ke dalam Ordo Carnivora, subordo Caniformia, telah terinfeksi virus AI (Tabel 23.1), dan dideskripsikan dengan detail dalam bagian-bagian berikut.
Virus influenza A dalam famili Canidae
Sirkulasi berkelanjutan virus AI yang beradaptasi dengan canine adalah sebuah fenomena yang hanya baru-baru ini terjadi. Pada tahun 2022, virus AI H3N8 yang berasal dari kuda menyebabkan wabah penyakit pernafasan pada kawanan 92 ekor anjing English foxhound di Inggris. Meskipun rute penularan tidak diketahui, tempat anjing-anjing itu dipelihara berdekatan dengan stable kuda, dan baru saja diberi makan daging dari dua kuda yang euthanasia [43]. Dua tahun kemudian, virus AI H3N8 yang juga berasal dari kuda menyebabkan wabah penyakit pernafasan pada anjing greyhound di Florida, Amerika Serikat [39]. Dimulai dari 2007, virus AI berpatogenitas rendah (LPAI) H3N2 yang berasal dari unggas menyebabkan penyakit respirasi pada anjing di Korea Selatan [206], China [121], dan Thailand [27]. Virus-virus H3N8 dan H3N2 ini sekarang telah beradaptasi dengan hospes barunya, bisa dengan mudah menyebar secara efektif di dalam populasi anjing domestik, dan merupakan agen etiologi yang telah dikenali untuk penyakit baru ini – yang disebut canine influenza (untuk ulasan mendalam silahkan lihat Bab 22).
Sebaliknya dari keadaan virus AI yang telah beradaptasi dengan anjing, telah dikenali selama bertahun-tahun bahwa virus AI asal manusia dapat berpindah secara sporadis antar barrier spesies dan menginfeksi anjing domestik. Secara eksperimental, kerentanan anjing terhadap infeksi virus AI H1N1 manusia didemonstrasikan pada awalnya tahun 1959 [2], dan infeksi alami pertama kali didemonstrasikan tahun 1975, saat virus AI H3N2 diisolasi dari anjing terdampak [35, 189]. Studi memperlihatkan respons serologis pada anjing terhadap virus AI H3N2 manusia [63, 101, 189] juga menunjukkan bahwa terdapat penularan virus dari manusia kepada anjing. Baik infeksi alami maupun eksperimental dari virus AI H3N2 pada anjing biasanya subklinis [35, 85, 101, 150, 161, 225], meskipun mungkin dapat menyebabkan demam turun naik [150]. Virus AiaI H3N2 manusia ditularkan pada anjing sentinel yang dipelihara bersama dengan anjing yang diinfeksi experimental dengan inokulasi [150].
Saat berlangsungnya pandemi influenza baru-baru ini yang disebabkan oleh virus AI H1N1 (pH1N1) terjadi pada manusia, juga telah dilaporkan terjadi infeksi pada anjing domestik di China [175] dan Amerika Serikat [177]. Anjing yang positif pH1N1 memiliki bukti klinis pneumonia, dengan demam, batuk dan anoreksia. pH1N1 telah dikonfirmasi pada pemilik anjing 1 minggu sebelumnya. Inokulasi eksperimental isolat canine dari China kepada anjing mengakibatkan gejala klinis ringan dan penularan antar anjing yang tidak efektif [123]. Sebaliknya, inokulasi isolat manusia pH1N1 kepada anjing tidak menyebabkan infeksi [11].
Baru-baru ini, dua reassortant virus canine influenza (CIV) pH1N1 dan H3N2 telah diisolasi di Korea Selatan dari swab hidung anjing domestik yang menunjukkan gejala pernafasan. Reasortan pertama, H3N1, memiliki segmen gen HA dari CIV H3N2 dan sisa 7 segmen gen lainnya dari pH1N1. Inokulasi eksperimental pada anjing berakibat infeksi subklinis dengan pendedahan virus dari hidung. Pada saat otopsi, keparahan pneumonia bersifat intermediate antara lesi ringan karena infeksi pH1N1 dan lesi berat karena infeksi CIV H3N2 [207]. Reasortan kedua, H3N2, memiliki segmen gen M dari pH1N1 dan tujuh segmen gen sisanya dari CIV H3N2. Infeksi eksperimental pada anjing menghasilkan pendedahan virus, penularan anjing ke anjing, dan keparahan pneumonia serupa dengan infeksi CIV H3N2 klasik [144].
Di tahun 2009, virus LPAI H5N2 diisolasi di China dari swab hidung anjing domestik dengan gejala pernafasan [209, 248]. Anjing yang diinfeksi eksperimental mendedahkan virus, mengalami demam turun naik dan gejala pernafasan ringan [209]. Virus ditularkan dari anjing terinfeksi baik ke anjing sentinel [209] dan ke kucing dan ayam [75].
Virus LPAI H9N2 terdeteksi melalui kultur dan PCR pada 13 (2.2%) dari 588 ekor anak anjing sampai anjing muda yang menunjukkan gejala klinis (batuk, muntah, demam) di Guangzi, China, tahun 2010 dan 2011. Secara serologis, sampai 45% anjing teruji positif. Virus tersebut, yang dikenal sebagai A/canine/Guangxi/1/2011 (H92), menunjukkan lebih dari 98,5% homologi genetik dengan keturunan Eurasia LPAI H9N1 [22]. Anjing dapat terinfeksi melalui inokulasi intranasal [250, tetapi tidak dengan memakan ayam yang terinfeksi [5]. Meskipun virus didapat dari turbinata hidung, trakea, dan paru-paru dalam hubungannya dengan pneumonia ringan, infeksi bersifat subklinis dan tidak ada virus yang didedahkan dari saluran pernafasan atas. Sebaliknya pada eksperimen lainnya dimana anjing diinokulasi melalui intranasal [5] menunjukkan gejala pernafasan ringan, mendedahkan virus dari hidung, dan anjing sentinel terinfeksi. Terdapat kekhawatiran bahwa anjing dapat berkontribusi terhadap penyebaran lebih lanjut, dan adaptasi virus virus LPAI yang telah beredar luas ini pada mamalia.
Pengendalian influenza pada anjing domestik harus meliputi upaya higiene rutin, seperti misalnya isolasi anjing terinfeksi untuk mencegah penyebaran virus kepada hewan lain [230]. Karena anjing rentan terhadap infeksi virus AI, hidup berdekatan dengan manusia, dan mungkin memiliki akses terhadap unggas yang ada di pasar unggas hidup, terutama di Asia Tenggara, anjing berpotensi menjadi hospes intermediate untuk persebaran virus ke manusia. Selain itu, karena anjing bersifat rentan baik kepada virus AI manusia maupun avian, mereka memiliki potensi untuk menjadi sebagai ‘wadah pencampur’ dimana reasortansi baru mungkin muncul, seperti yang telah terlihat baru-baru ini untuk virus reasortan AI H3N1 dan H3N2 [144, 207].
Virus-virus influenza A dalam famili Ursidae
Beruang adalah hewan berumur panjang, memiliki habitat yang luas, dan oportunistik sehingga dikira sangat mudah terpapar agen-agen infeksius dari banyak hewan dan manusia. Akan tetapi, laporan paparan virus AI pada beruang sangat jarang ada. Terdapat satu laporan antibodi serum positif lemah virus AI (dan virus influenza B) pada anak beruang coklat Eurasia (Ursus arctos arctos) dalam penangkaran di Kroasia, menunjukkan paparan dari manusia yang terinfeksi [132]. Bukti yang lebih meyakinkan adanya infeksi virus AI ditemukan pada panda raksasa (Ailuropoda melanoleuca) oleh Li dan koleganya [122]. Pada tahun 209, selama pandemi H1N1 pada manusia, tiga panda raksasa yang ada di pusat konservasi di Provinsi Sichuan, China menunjukkan gejala klinis penyakit pernafasan. Swab hidung yang diambil dari satu ekor hewan teruji positif PCR untuk gen HA pH1N1, dan melalui kultur positif virus AI. analisis filogenetik isolat virus menunjukkan adanya penularan antara manusia ke panda tanpa adanya adaptasi signifikan. Ketiga panda menerima pengobatan oseltamivir 75 mg dua kali sehari untuk 5 – 6 hari, sembuh, dan mengalami serokonversi terhadap pH1N1 [118].
Virus-virus influenza A dalam famili Ailuridae
Terdapat laporan positif lemah titer antibodi nukleoprotein virus AI dengan agar gel immunodiffusion pada satu dari 73 ekor panda merah (red panda/Ailurus fulgens) di China [181]. Sumber tipe virus influenza tidak diberitahukan secara spesifik.
Virus-virus influenza A dalam famili Mustelidae
American mink (Mustela vison) adalah spesies mustela yang dipelihara dalam penangkaran dalam jumlah besar untuk memanen bulunya. Baru-baru ini spesies ini telah ditempatkan kedalam genus terpisah yaitu Neovison vison atau Vison vison dari musang domestik (Mustela putorius furo) dan European mik (Mustela lutreola) berdasarkan filogeni molekuler [78]. Kerentanan American mink terhadap infeksi virus AI telah dikenali selama beberapa dekade. Pada akhir tahun 1970-an dan awal tahun 1980-an, antibodi terhadap virus AI H3N2 dan H1N1 manusia terdeteksi pada mink di peternakan di Jepang [157, 159]. Inokulasi mink dengan virus AI H3N2 manusia mengakibatkan infeksi produktif dengan gejala klinis dan menularkan pada mink lain yang berkontak dengan mink terinfeksi. Infeksi produktif pada mink juga muncul setelah inokulasi H1N1 manusia, H1H1 swine, H1N1 equine dan H3N2 dan H4N1 avian [139]. Dalam sebuah eksperimen serupa [156, 243], inokulasi virus AI avian yang berbeda (H3N8, H5N3, H7N2, H8N4, dan H11N4) atau mamalia (H1N1 manusia dan swine, dan H2N2 equine) juga berakibat infeksi produksi, dengan penularan kepada mink yang berkontak.
Pada tahun 1984, virus AI H10N4, mungkin berasal dari avian, menyebabkan wabah penyakit pernafasan berat dengan 100% morbiditas dan 3% mortalitas pada 100.000 ekor mink pada peternakan yang berdekatan di Swedia [105]. Gejala klinis meliputi anoreksia, bersin, batuk, dan leleran hidung dan mata. Pemeriksaan patologi pada kasus yang fatal menunjukkan pneumonia interstisial akut.infeksi eksperimental pada mink menginduksi gejala klinis dan perubahan patologis serupa, penularan terjadi pada mink sentinel yang dipisahkan dengan kandang kawat. Diperkirakan asal virus adalah dari burung liar (corvid, burung camar, dan itik) yang tertarik mendekati atap kandang mink dimana berserakan bekas pakan yang diberikan dari atas kandang [105]. Menariknya infeksi komparatif pada mink baik dari virus AI H1N0N4 (A/mink/Sweden/3900/1984) atau virus AI H10N7 (A/chicken/Germany/N/1949) mengungkapkan bahwa hanya virus H10N4 yang ditularkan kepada sentinel, dan menyebabkan pneumonia yang lebih berat dibandingkan H10N7 [56, 57]. Analisis genome penul baru-baru ini mengungkapkan bahwa gen protein non-struktural dari virus H10N4 mungkin berkontribusi terhadap virulensinya terhadap mink dengan membantu virus menghindari respon imun bawaan [257].
Pada tahun 2006 dan 2007, virus AI H3N2 swine dihubungkan dengan meningkatnya penyakit respirasi dan kematian pada mink di peternakan di Nova Scotian, Kanada. Gejala klinis meliputi batuk kering, dan pemeriksaan patologi kasus fatal mengungkapkan pneumonia interstitial dan bronkiolitis. Virus yang diisolasi dari mink terinfeksi berhubungan dengan dengan virus AI triple reassortant yang telah muncul di tahun 2005. Rute infeksi diperkirakan dari memakan sisa daging yang tidak dimasak, seperti paru-paru babi dari sebagian wilayah Kanada dimana virus AI H3N2 telah diketahui berada di situ [64].
Pada tahun 1009 dan 2010, virus AI H3N2 reasortan manusia/swine menyebabkan wabah penyakit pernafasan pada mink di 18 peternakan di Denmark. Gejala klinis meliputi bersih, batuk dan hemoragi dari hidung, dan angka mortalitas rata-rata 1,2%. Gen HA dan neuraminidase (NA) virus yang diisolasi homolog dengan virus H3N2 manusia, dan enam gen yang tersisa homolog dengan virus AI H1N2 swine yang bersirkulasi. Temuan ini menunjukkan bahwa mink rentan terhadap infeksi baik virus asal babi maupun manusia, dan dapat berlaku sebagai ‘wabah percampuran’ [115]. Kemungkinan sumber infeksi berasal dari memakan jeroan mentah, seperti trakea dan paru-paru. Semua mink yang terinfeksi menerima jeroan ini dari satu rumah potong hewan yang sama. Wabah yang berlangsung selama 10 minggu terus berlanjut karena mink terus diberikan pakan jeroan yang terinfeksi, terjadinya penularan horizontal, atau keduanya [38].
Pada tahun 2010 dan 2011, virus AI pH1N1 manusia menyebabkan wabah penyakit pernafasan pada beberapa peternakan mink di Denmark, Norwegi dan Belanda [3, 38, 104]. Gejala klinis meliputi leleran hidung, batuk dan bersin pada rubah dan kesusahan bernafas/dyspnea pada kit/anak mink. Angka kematian pada anak mink berkisar antara 14% di Norwegia sampai 30% di Belanda. Pemeriksaan patologi pada anak mink yang mati menunjukkan pneumonia interstisial akut berat. Analisis filogenetik mengungkapkan bahwa virus yang diisolasi dari Norwegian mink sangat mendekati dengan virus AI pH1N1 manusia di tahun 2009 yang bersirkulasi di antara manusia di Norwegia selama musim dingin tahun 2010-2011. Akan tetapi tidak ada gejala pernafasan yang dilaporkan peternak mink di Norwegia pada saat wabah terjadi, dan pemberian jeroan babi sebagai makanan mink dianggap sebagai sumber infeksi yang paling mungkin pada saat itu. Peternak mink di Belanda menderita penyakit mirip influenza pada saat wabah terjadi. Tidak dilaporkan apakah mink pada peternakan di Belanda terekspos langsung dengan babi atau diberi makan jeroan babi [3, 104].
Pada tahun 2010, reassortant virus AI H1N2 menyebabkan penyakit pernafasan pada peternakan di pertengahan barat Amerika Serikat yang memiliki 15,000 ekor mink. Gejala klinis meliputi gangguan pernafasan berat persisten, dan hemoragi dari hidung dan lubang oral, dan angka kematian tampaknya berkisar 3%. Pemeriksaan patologi pada kasus yang fatal mengungkapkan pneumonia bronko interstitial hemoragi yang dihubungkan dengan virus AI H3N2 dan Escherichia coli hemolitik. Analisis filogenetik mengungkapkan bahwa virus memiliki gen matriks dan gen nukleoprotein yang menunjukkan kekerabatan genetik dengan keturunan virus AI swine. Sumber infeksi tampaknya dari memakan daging kalkun mentah, tidak ada jeroan babi yang diberikan, dan tidak ada kawanan babi yang berdekatan dengan wilayah terinfeksi [247].
Kesimpulan dari semua laporan di atas adalah bahwa American mink sangat rentan tidak hanya terhadap infeksi, tapi juga terhadap penyakit berat yang disebabkan oleh virus AI manusia, avian, dan swine, dan bahwa penularan dari mink ke mink secara efisien mungkin saja terjadi. Karena mink mungkin berlaku sebagai ‘wadah pencampuran’ yang memfasilitasi reasotanai virus AI dari spesies hospes yang berbeda [115]. Selain itu, sumber infeksi yang umum berulang adalah pemeliharaan terbuka, yang menungkinkan kontak dengan burung liar, dan memberi makan produk mentah dari hewan yang terinfeksi AI seperti misalnya babi dan unggas. Karena itulah, penggunaan tempat pemeliharaan yang mencegah kontak dengan burung liar, dan memasak produk hewan sebelum diberikan sebagai pakan [247] adalah upaya yang paling penting untuk mencegah influenza pada American mink.
Musang domestik (Mustela putorius furo) pada awalnya berasal dari European polecat (Mustela putorius) dan telah digunakan sejak tahun 1930 sebagai hewan model percobaan infeksi virus AI pada manusia. Hal ini sebagian dapat dijelaskan dengan adanya kesamaan pada pola berikatannya virus AI terhadap bagian-bagian yang berbeda di dalam saluran pernafasan dan manusia [235]. Musang terbukti sangat rentan terhadap infeksi baik dengan virus AI manusia [202] maupun swine [196]. Selain itu, infeksi virus AI manusia pada musang menginduksi gejala klinis yang serupa dengan yang diamati pada manusia, seperti demam, letargi, anoreksia dan leleran hidung selesma. Sebaliknya, virus AI swine menginduksi penyakit yang lebih berat dan juga kematian. Pada tahun 1934, Shope memberikan deskripsi mendetail, akurat dan mengilustrasikan dengan sangat baik lesi-lesi yang muncul pada musang terinfeksi, baik secara makroskopik maupun mikroskopik [196]. Penularan virus AI telah didemonstrasikan dari musang ke manusia [203] dan antar musang, baik melalui kontak langsung [216] maupun melalui udara [8]. Banyak studi terhadap efektivitas vaksin, produksi antivirus, patogenesis dan penularan, dan reasortansi virus, kesemuanya berhubungan dengan virus AI yang dilakukan pada musang [12, 14, 49, 83, 86, 89, 90, 102, 109, 201, 226]. Pada studi-studi tersebut, inokulasi banyak virus AI manusia dan avian menghasilkan infeksi dan penyakit produktif.
Berdasarkan informasi di atas, kita dapat mengira bahwa epidemi virus AI alami pada musang akan menjadi umum. Akan tetapi, bahkan kasus individual infeksi alami virus AI pada musang saja sangat jarang dilaporkan, apalagi epidemi. Fisher dan Scott melaporkan infeksi AI alami pada mik di tahun 1944 [61]. Setelahnya, Bell dan Dudgeon melaporkan wabah infeksi AI pada dua koloni musang di Sussex, Inggris, di bulan Februari 1947 [17]. Musang yang sakit menunjukkan leleran hidung dan mata, blepharosynechia, bersin, letargi dan demam selama sekitar 7 hari, dan delapan ekor musang mati. Akan tetapi ajaibnya tidak ada satupun dari hewan ini yang menunjukkan lesi paru makroskopik pada saat nekropsi meskipun nasofaringnya tersumbat. Pengurus hewan menunjukkan gejala mirip influenza sebelum dan selama wabah, dan diasumsikan sebagai sumber infeksi. Serokonversi yang luas terhadap virus AI pada kelompok musang rumahan ini menunjukkan bahwa terdapat penularan efisien antara musang ke musang lainnya [17].
Terdapat berbagai kasus virus AI pH1N1 pada musang peliharaan di Amerika tahun 2009. Musang yang terinfeksi menunjukkan gejala pernafasan dari ringan sampai berat, dan beberapa mati. Gejala klinis meliputi demam , letargi, bersin dan batuk. Pada semua kasus, keluarga manusia yang memelihara musang menderita influenza, dan mungkin merupakan sumber infeksi [172, 173, 178, 179]. Musang yang diinfeksi secara eksperimental dengan virus pH1N1 menunjukkan gejala klinis serupa dan pada saat autopsi menunjukkan pneumonia bronko interstitial multifokal nekrosis [201, 233].
Infeksi alami virus AI babi pada musang tidak dilaporkan sebelum tahun 2009, dimana terdapat wabah virus AI H1N1 swine reasortan kontemporer dalam koloni musang di Amerika Serikat [163]. Usang menunjukkan gejala pernafasan pada umumnya, dan pada saat diotopsi menunjukkan adanya pneumonia bronko interstitial dengan bronkiolitis nekrotik. Karakterisasi genetik virus yang diisolasi menunjukkan bahwa babi merupakan sumber infeksi.
Pada bulan Oktober dan November 2009, infeksi virus AI pH1N1 terjadi pada American badger (Taxidea taxus) dan musang kaki hitam (Mustela nigripes) yang dipelihara terpisah pada sebuah kebun binatang di California, Amerika Serikat. Gejala klinis meliputi letargi, tidak nafsu makan, dyspnea, leleran hidung, dan batuk. American badger yang terkena euthanasia karana parahnya penyakit, dan pada saat diotopsi menunjukkan adanya bronkopneumonia dengan ekspresi antigen virus AI. Virus AI pH1N1 teridentifikasi dalam sampel paru dari American badger dan swab dari musang kaki hitam melalui PCR dan sekuensing. Manusia diasumsikan sebagai sumber infeksi [193].
Bukti serologis infeksi AI pH1N1 ditemukan pada berang-berang laut laut utara yang hidup bebas (Enhydra lutris kenyoni), dengan perkiraan kisaran umur antara 2 – 19 tahun, yang ditangkap di pesisir Washington, Amerika Serikat pada bulan Agustus 2011. ELISA mengungkapkan bahwa 21 ekor (70%) dari 30 ekor berang-berang laut memiliki IgG terdeteksi (>200 mg/dL) untuk rHA pH1N1 (A/Texas/05/2009) ; 22 ekor (73%) dari 30 ekor hewan ini memiliki titer antibodi H1 sebesar > _ 40 terhadap virus pH1N1 [122]. Sumber infeksi tetap tidak diketahui, meskipun potensi kontak antara gajah laut utara (Mirounga angustirostris) [67] dan berang-berang laut dianggap sebagai salah satu kemungkinan, karena tempat makan dan breeding mereka beririsan di sepanjang pesisir Pasifik timur laut [122].
Virus-virus influenza A dalam famili Procyonidae
Terdapat bukti serologis infeksi alami virus AI pada rakun (Procyon lotor). Dari 730 ekor rakun yang hidup bebas yang disampling antara tahun 2004 dan 2006 di beberapa negara bagian Amerika Serikat (California, Texas, Louisiana, Mayland, Wyoming dan Colorado), 2,4% nya memiliki antibodi terhadap virus AI avian dari subtipe H10N7, H4N6, H4N2, H3 dan H1 [76]. Agaknya mereka terinfeksi melalui kontak langsung maupun tidak langsung dengan burung liar terinfeksi. Inokulasi intranasal virus AI H4N8 (/chicken/Alabama/1975) kepada rakun mengakibatkan infeksi subklinis dengan shedding via nasal sampai 14 hari pasca inokulasi (DPI) dan penularan kepada rakun sentinel [76]. Pada eksperimen lainnya, paparan rakun terhadap virus H4N6 melalui air minum dan air basuhan hanya menyebabkan infeksi produktif jika dosis virus tinggi, dan paparan melalui telur terinfeksi dan karkas burung air liar tidak menyebabkan infeksi [191]. Hasil ini, bersama dengan sifat alami rakun yang peridomestik, menunjukkan bahwa spesies ini mampu untuk menginfeksi unggas dan babi [76].
Virus-virus influenza A dalam famili Mephetidae
Antara bulan Desember 2009 dan Januari 2010, delapan ekor sigung bergaris (Mephitis mephitis) mati dalam sebuah peternakan mink dekat Vancouver, Kanada. Nekropsi dua dari hewan ini menunjukkan splenomegali dan pneumonia pada saat pemeriksaan makroskopis. Temuan histologi meliputi rhinitis, bronkopneumonia dengan bakteria di dalam lesi, pneumonia interstitial multifokal, dan plasmasitosis nodus limfatik dan limpa. Virus AI pH1N1 dan virus penyakit Aleusia teridentifikasi dalam sampel organ melalui PCR dan sekuensing. Penyebab kematian ditentukan utamanya sebagai pneumonia virus influenza dengan infeksi bakterial sekunder. Sumber kedua virus ini diperkirakan dari American mink yang dipelihara bersama, yang beberapa menunjukkan leleran hidung. Akan tetapi, kemungkinan penularan virus AI langsung dari manusia kepada sigung bergaris juga tidak dapat dikecualikan.
Virus-virus influenza A dalam famili Phociade, Odobenidae, dan Otariidae
Laporan infeksi AI alami lebih sering pada pinnipedia – clade mamalia dari ordo carnivora yang meliputi Odobenidae (walrus), Phocidae (anjing laut sejati), dan Otaridae (anjing laut berbulu dan singa laut).
Telah terjadi wabah berulang virus influenza A pada anjing laut pelabuhan (Phoca vitulina), dengan penularan antar anjing laut secara efisien dan kematian yang tinggi. Wabah yang pertama kali tercatat yang melibatkan virus AIV H7N7 terjadi di Semenajung Cape Cod, New England, Amerika Serikat pada musim dingin tahun 1979-1980 [65, 114, 239]. Gejala klinis meliputi dispnea, letargi, emfisema pada leher, leleran berbusa putih sampai merah dari hidung dan mulut. Lebih dari 400 ekor anjing laut pelabuhan, sebagian besarnya anjing laut muda, mati dengan mortalitas 20% [65]. Jumlah yang tinggi ini menunjukkan adanya penularan antar anjing laut yang efisien, akan tetapi tampaknya virus ini tidak mampu bertahan dalam populasi anjing laut. Autopsi menunjukkan adanya pneumonia yang dicirikan dengan bronkhitis nekrotik dan bronkiolitis, dan alveolitis hemoragik [65]. Virus AIV H7N7 diisolasi dengan titer yang tinggi dari paru-paru dan dengan titer yang rendah dari otak anjing laut yang sakit. Anjing laut yang diinfeksikan secara eksperimental juga mengalami pneumonia, tetapi dalam derajat keparahan yang lebih rendah dibandingkan yang ditemukan pada kasus infeksi alamiah [239]. Antibodi terhadap virus ini ditemukan dalam serum anjing laut abu-abu (Halichoerus grypus) dari Nova Scotia, Canada, yang berjarak lebih dari 500 mil dari Cape Cod, tetapi tidak ada kematian anjing laut yang dilaporkan [65]. Meskipun bersumber dari avian, virus ini bereplikasi dengan lebih efektif pada mamalia (musang, kucing dan babi) daripada pada unggas (ayam dan kalkun), yang menunjukkan kemungkinan adaptasi virus pada mamalia. Hal ini termasuk kejadian insidentil infeksi manusia selama otopsi anjing laut terinfeksi, yang menyebabkan konjungtivitis, tetapi tidak ada penularan antar manusia [238]. Inokulasi eksperimental melalui konjungtiva pada Monyet bajing juga menyebabkan konjungtivitis, bersama penyakit pernafasan dan penyebaran virus sistemik [145]. Sumber virus masih belum ditemukan, tetapi diperkirakan berasal dari burung air seperti terns (Sterna species), karena burung ini diketahui membawa virus IAV dan berhubungan dengan anjing laut pelabuhan di air dan daratan. Kemungkinan faktor lainnya yang berkontribusi terhadap wabah adalah kepadatan populasi yang tidak biasa sangat tinggi dan temperatur tinggi yang tidak sesuai musimnya, yang membuat anjing laut menuju daratan [65].
Pada musim dingin tahun 1982-1983, terjadi wabah infeksi AI H4N5 asal avian pada anjing laut pelabuhan di lepas pantai New England, Amerika Serikat. Diperkirakan 60 ekor anjing laut pelabuhan mati, dan angka mortalitasnya diestimasikan sebesar 2-4%. Pemeriksaan histopatologi mengungkapkan adanya bronkopneumonia nekrotik, dan virus AI H4N5 diisolasi dari paruaru, lipnodus hlar, dan otak dari anjing laut yang terkena. Menariknya, virus ini tidak bereplikasi dalam usus itik setelah diinokulasikan melalui intranasal, berkebalikan dengan isolat virus IAV asal-avian awal yang diisolasi dari mamalia [82].
Di bulan Januari 1991 dan Januari 1992 terjadi wabah infeksi virus AI asal avian masing-masing dari subtipe H46 dan H3N3, pada anjing laut pelabuhan di Cape Cod, Massachusetts, Amerika Serikat. Otopsi menunjukkan emfisema subkutan dan pneumonia interstisial akut, pneumonia hemoragik akut, atau keduanya [30].
Dari bulan September sampai Desember 2011, terjadi wabah virus AI H3N8 pada anjing laut pelabuhan di New England, Amerika Serikat. Sebanyak 162 ekor anjing laut mati dan otopsi menunjukkan pneumonia akut. Berdasarkan analisis genetik, virus yang diisolasi dari paru-paru berkerabat dekat dengan virus AI H3N8 yang bersirkulasi pada burung air [9]. Menariknya, virus AI H3N8 asal avian telah terdeteksi melalui PCR pada anjing laut harpa (Phoca groenlandica) yang ditangkap di perairan pesisir Lautan Atlantik barat laut beberapa tahun sebelumnya [22]. Tidak dilaporkan apakah anjing laut tersebut mengalami gejala pernafasan. Virus AI H3N8 dari anjing laut pelabuhan memiliki substitusi asam amino D7101N pada protein PB2-nya. Substitusi ini juga ditemukan pada virus HPAI H5N1 yang menginfeksi manusia [42, 192], dan mengindikasikan adanya adaptasi replikasi virus pada mamalia. Berdasarkan uji aglutinasi, virus ini memiliki afinitas tidak hanya terhadap asam sialik tipe avian 𝛂2,3 galaktosa (penghubung reseptor SA𝛂2,3) tetapi juga terhadap asam sialik tipe manusia 𝛂2,6 galaktosa (penghubung reseptor SA𝛂2,6). Adaptasi mamalia ini menimbulkan resiko meningkatnya infeksi pada manusia [9].
Baru-baru ini, antara bulan Maret dan Oktober 2014, wabah virus AI H10N7 asal avian pada anjing laut pelabuhan menyebar ke arah selatan di sepanjang pesisir Eropa barat laut negara Swedia, Denmark, Jerman, dan Belanda [21, 110, 258]. Sejumlah besar anjing laut yang mati terdampar yang tidak biasa ditemui (sekitar 2000 ekor totalnya) ditemukan. Dari otopsi ditemukan lesi pulmoner berupa pneumonia bronko interstitial dengan emfisema yang serupa dengan uang telah dilaporkan sebelumnya pada wabah di Amerika Utara. Virus terdeteksi dalam paru-paru [21, 110, 258] dan limpa [110]. Gen HA dan NA dari virus anjing laut ini secara genetik berkerabat dekat dengan virus AI H10N7 yang baru-baru ini ditemukan pada itik migrasi di Georgia, Mesir, dan Belanda [21].
Pada bulan April 2010, infeksi virus AI pH1N1 asal manusia terdeteksi pada gajah laut utama (Mirounga angustirostris) di California, Amerika Serikat. Virus diisolasi dari swab hidung dari 2 ekor dari 42 ekor gajah laut betina dewasa yang tampak sehat, yang baru saja naik ke darat setelah berbulan-bulan di laut. Sekuensing genetik isolat anjing laut mengungkapkan bahwa lebih dari 99% homolog dengan virus AI pH1N1 yang telah muncul pada manusia tahun 2009. Manusia adalah sumber infeksi yang paling mungkin, meskipun paparan manusia di laut terbatas pada kapal pengangkut. Kemungkinan adaptasi isolat ini pada gajah laut adalah sebuah asumsi, karena replikasi normal dalam kultur sel MDCK, tetapi tidak efisien dalam sel epitel trakeobronkial manusia dibandingkan dengan stran referensi virus AI pH1N1. Antibodi spesifik terhadap virus AI pH1N1 terdeteksi dalam serum yang dikoleksi dari gajah laut setelah bulan April, sementara serum yang dikoleksi sebelumnya semuanya negatif [67].
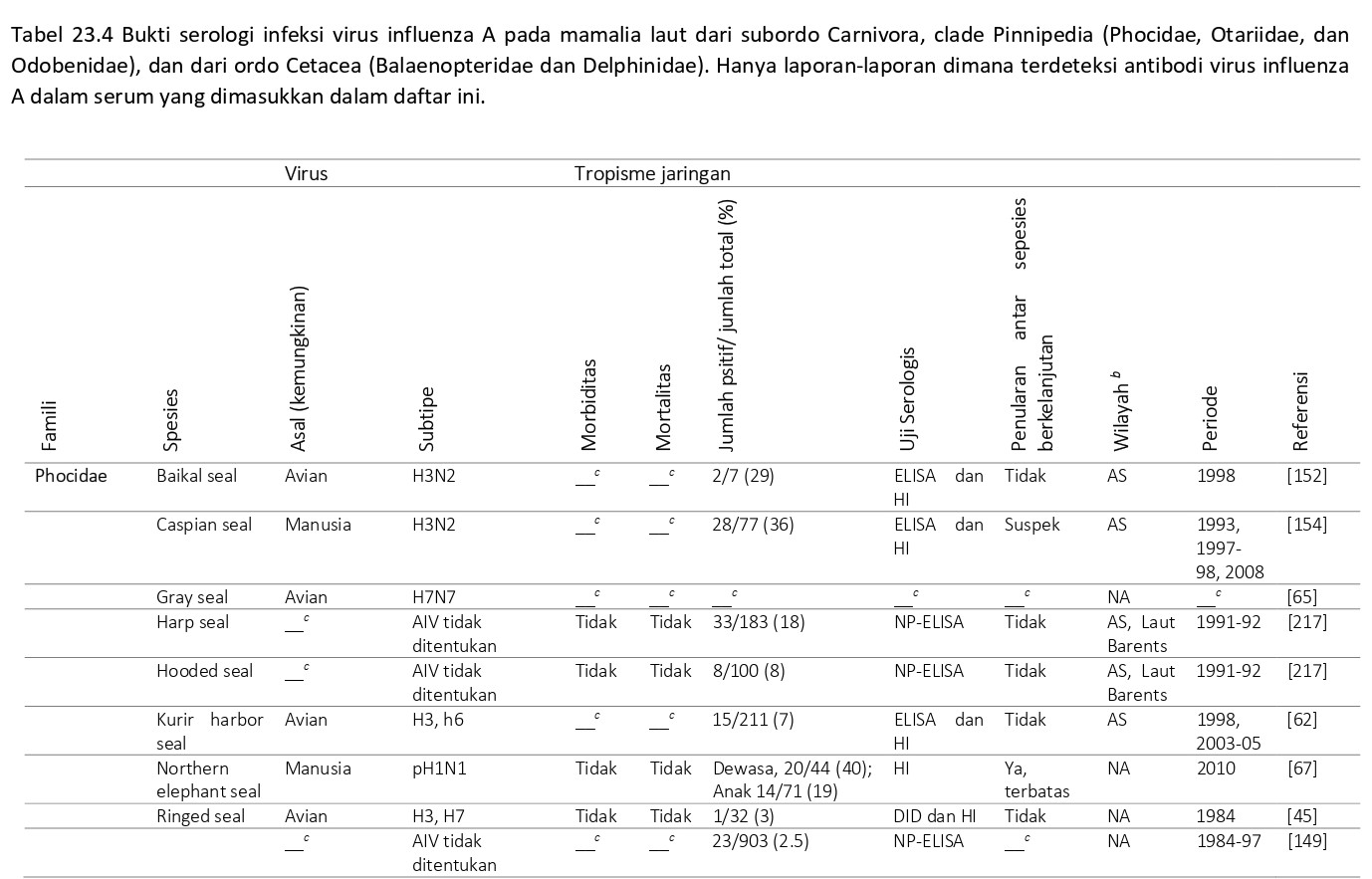
Dari seluruh spesies pinniped yang disebutkan diatas termasuk ke dalam famili Phocidae. Selain adanya bukti serologis infeksi virus AI, terdapat banyak artikel yang melaporkan keberadaan antibodi terhadap virus AI dalam serum pinniped (Tabel 23.4). Bukti serologis ini telah ditemukan tidak hanya pada spesies pinnipedia yang termasuk kedalam famili Phocidae, tetapi juga pada walrus Pasifik (Odobenus rosmarus divergens), yang termasuk ke dalam famili Odobenidae, dan anjing laut berbulu Amerika Selatan (Arctocephalus australis) yang termasuk ke dalam famili Otariidae. Data serologis ni mengindikasikan bahwa kerentanan pinnipedia terhadap infeksi virus AI yang berasal baik dari manusia maupun avian melibatkan lebih banyak spesies daripada yang telah sebelumnya terdeteksi.
Kemampuan virus AI avian untuk menular dengan efisien di antara anjing laut pelabuhan dan menyebabkan kematian yang tinggi bersifat tidak biasa. Untuk menginvestigasi hal ini, Rami dan koleganya menentukan pola berikatannya virus AI pada saluran pernafasan anjing laut pelabuhan (Gambar 23.3). Mereka menemukan ikatan virus AI avian yang berlebihan kepada sel bronkial an epitel, yang konsisten berkorelasi dengan efisiensi penularan antar anjing laut. Dalam studi yang sama, mereka juga menemukan berikatannya virus AI yang langka yaitu berikatan dengan sel epitel bronkiolar dan alveolar anjing laut pelabuhan [182]. Hal ini sejalan dengan ditemukannya ekspresi reseptor SA𝛂2,3 yang biasanya jarang ditemukan di dalam paru-paru anjing laut pelabuhan [9]. Temuan ini tidak sesuai dengan laporan tingginya mortalitas anjing laut pelabuhan [65, 114, 239], meskipun konsisten dengan patogenitas rendah yang terlihat dalam infeksi eksperimental virus AI H7N7 pada anjing laut pelabuhan [65]. Salah Satu penjelasan yang mungkin adalah bahwa epidemi alami virus AI avian pada anjing laut pelabuhan diperparah dengan angen lain yang berko-infeksi seperti misalnya spesies Mycoplasma [65].
Virus-virus influenza A dalam Ordo Carnivora, subordo Feliformia
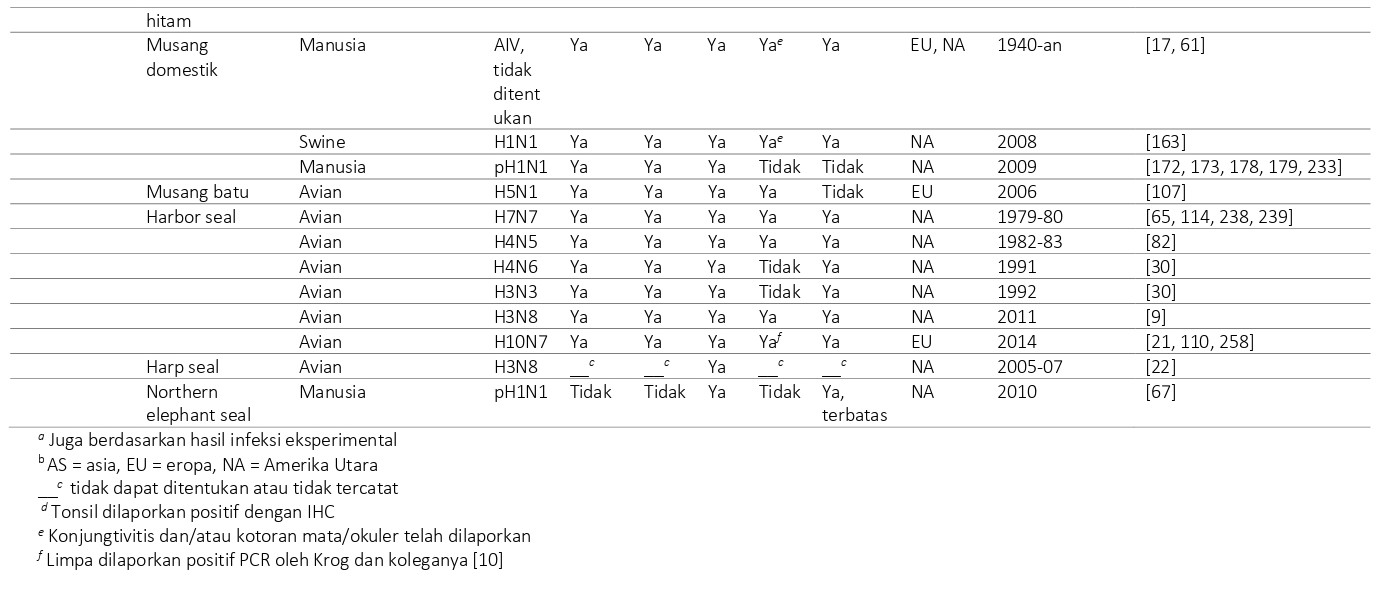
Berbagai spesies dari ordo Carnivora, subordo Feliformia telah terinfeksi influenza virus AIV (Tabel 23.2), dan dideskripsikan secara detail dalam bagian berikut.
Virus-virus influenza A dalam famili Felidae
Tidak seperti canine influenza pada anjing, tidak terdapat bukti penularan terus menerus virus AI yang telah beradaptasi pada kucing domestik. Dalam sejarahnya, kucing bahkan tidak dianggap rentan terhadap penyakit yang disebabkan oleh infeksi AI [77, 83]. Akan tetapi, seperti anjing, kucing peliharaan hidup dengan berkontak sangat dekat dengan manusia. Memang, seiring dengan pandemi virus H3N2 1968 pada manusia, kucing yang terekspos secara alami memiliki titer HI sebesar > 40 terhadap virus AI H3N2 manusia, menunjukkan kerentanan terhadap infeksi. Secara eksperimental, kucing mengembangkan infeksi subklinis setelah inokulasi tidak hanya virus AI H3N2 mansua, tetapi juga setelah inokulasi dengan H7N3 avian, H1N1 avian, dan H7N7 asal anjing laut, dan virus influenza B [83, 161, 162, 189].
Ide bahwa infeksi virus AI tidak menyebabkan penyakit pada kucing terbukti salah dengan kemunculan virus HPAI H5N1 pada kucing (lihat diatas). Selain patogenitas infeksi virus avian ini pada kucing, virus AI pH1N1 asal manusia juga dilaporkan menyebabkan penyakit pernafasan berat pada kucing, baik di Amerika [32, 125, 164, 170, 174, 176, 213] dan di Perancis [116]. Pada sebagian besar dari kasus-kasus ini, pemilik kucing atau anggota keluarganya telah terdiagnosa terinfeksi virus AI pH1N1 dan dianggap sumber infeksi pada kucing peliharaan mereka. Beberapa ekor kucing mati karena infeksi. Pada saat di otopsi, ditemukan pneumonia bronko interstitial nekrotik berat yang dihubungkan dengan virus AI pH1N1 [125, 213]. Kucing yang diinokulasi secara eksperimental menunjukkan lesi serupa, dan menularkan virus kepada kucing sentinel yang berkontak dengannya [234]. Meskipun kebanyakan kasus melibatkan satu hewan tunggal saja, terdapat satu wabah di Italia dimana 25 dari 90 ekor kucing dalam satu koloni mati. Paru-paru dari dua kucing yang mati karena penyakit pernafasan berat menunjukkan pneumonia bronko interstitial nekrotik yang berhubungan dengan virus AI pH1N1. Diantara kucing-kucing yang selamat, 21 ekor kucing memiliki antibodi serum terhadap virus AI pH1N1, dan dua ekor menunjukkan hasil positif PCT dari swab hidung. Jika diambil secara bersama-sama, temuan-temuan ini merupakan indikasi kuat adanya penularan virus AI pH1N1 antara satu kucing ke kucing lainnya [60].
Screening serologis antibodi virus AI pH1N1 untuk kucing memberikan hasil yang bervariasi. Dari serum yang diambil dari kucing peliharaan selama musim influenza tahun 2009-2010, 22,5% dari Ohio, Amerika Serikat (n=400 [4] dan 21,8% dari negara-negara bagian di Selatan dan Barat-Tengah Amerika Serikat (n=78] [140] memiliki antibodi hambatan hemaglutinasi (HI) terhadap virus AI pH1H1, menunjukkan bahwa kucing sangat rentan terhadap infeksi virus AI pH1N1. Sebaliknya, hanya 1,2% dari serum yang dikoleksi dari kucing (n=1800) selama periode yang sama di China Selatan memiliki antibodi terhadap virus AI pH1N1 dari hasil uji ELISA nukleoprotein (NP) spesifik [218], dan hanya 1,93% serum yang dikoleksi dari kucing(n=1150) di Jerman tahun 201-2011 yang memiliki antibodi terhadap virus AI pH1N1 dari hasil uji netralisasi virus [44]. Kucing liar tampaknya tidak begitu mungkin terinfeksi virus AI pH1N1 daripada kucing peliharaan. Hanya 0,43% dari serum yang diambil dari kucing liar (n=200) di Florida antara November 2008 dan Juli 2010 memiliki antibodi terhadap AI pH1N1 dari hasil uji ELISA [68], dan dalam sebuah survei kucing (n=1140) di China timur laut, hanya 11% serum yang diambil dari kucing liar yang memiliki antibodi terhadap virus AI pH1N1, dibandingkan dengan 30,6% serum dari kucing peliharaan [251].
Epidemi influenza jangka pendek pada kucing yang serupa, namun disebabkan oleh CIV H3N2, terjadi di Korea Selatan pada tahun 2010 pada dua animal shelter besar. Shelter ini memelihara anjing dan kucing, dan kedua epidemi yang terjadi bersamaan dengan atau didahului oleh infeksi CIV H3N2 pada anjing. Sangat mungkin bahwa terdapat penularan virus dari anjing ke kucing, diikuti dengan penularan cepat antar kucing. Pada salah satu shelter, yang memiliki 60 ekor kucing, terdapat angka morbiditas 47% dan mortalitas 22%; di shelter yang lain yang memiliki 50 ekor kucing, terdapat morbiditas 100% dan mortalitas 44%. Gejala klinis pada kucing meliputi demam tinggi, letargi, dyspnea, dan batuk. Pada saat diotopsi, paru-paru menunjukkan bronkopneumonia, dan virus yang diisolasi hampir identik dengan CIV H3N2 berdasarkan hasil sekuensing keseluruhan (delapan) segmen gen yang ada [92, 208]. Infeksi CIV H3N2 eksperimental pada kucing mengakibatkan gejala klinis yang serupa dan pneumonia bronkointerstitial nekrosuppuratif berat, berkolokalisasi dengan antigen virus influenza yag melimpah dalam sel epitel bronkhi [208]. Baik untuk virus AI pH1N1 maupun CIV H3N2, memelihara kucing dalam jumlah banyak tampaknya menjadi faktor resiko dalam penularan virus antar kucing.
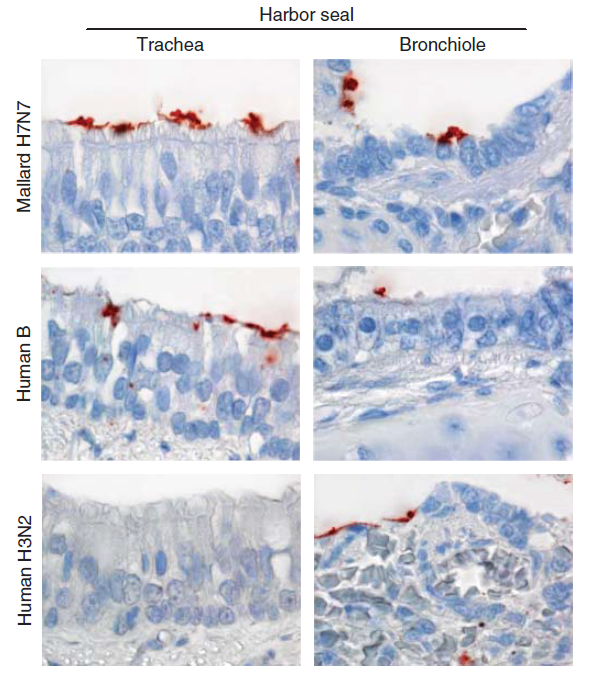
Gambar 23.3 Virus avian influenza A berpatogenitas rendah/ LPAI (H7N7), virus influenza A musiman pada manusia (H3N2), dan virus influenza B pada manusia menunjukkan derajat perlekatan yang berbeda-beda terhadap trakea dan bronkioli anjing laut pelabuhan (Phoca vitulina). Pewarnaan merah mengindikasikan perlekatan virus kepada permukaan sel epitel. Dicetak ulang dari Ramis A. J., van Riel D., van de Bildt M. W. G., Osterhaus A., Kuiken T. Influenza A and B virus attachment to respiratory tract in marine mammals. Emerging Infectious Diseases [serial on the Internet]. 2012 May [tanggal disitasikan]. Available from 10.3201/eid1805.111828. Dengan izin dari EID.
Terdapat kekhawatiran bahwa kucing, seperti juga anjing, dapat berlaku sebagai hospes intermediate untuk virus AI, selain dapat memfasilitasi adaptasi kepada mamalia namun juga menularkan virus kepada manusia [111, 140]. Melihat laporan baru-baru ini tentang penularan virus AI dari unggas, anjing, dan manusia kepada kucing, dan potensi penularan efisien antara kucing ke kucing lainnya, kucing perlu untuk dimasukkan ke dalam program monitoring influenza untuk melindungi kesehatan masyarakat [77].
Infeksi dengan virus AI pH1N1 terjadi pada empat ekor cheetah (Acinonyx jubatus) di sebuah taman hewan di California, Amerika Serikat pada bulan November 209. Gejala klinis meliputi ptyalisme, anoreksia, dan letargi. Virus AI diisolasi dari swab yang diambil dari satu hewan memiliki homologi 100% dengan analisis sekuens dengan isolat virus AI pH1N1 manusia. Petugas pengurus hewan mengalami gejala sakit mirip influenza dan diperkirakan mungkin merupakan sumber infeksi [41].
Bukti serologis infeksi virus AI yang tidak dispesifikasikan terdeteksi pada satu dari 16 kucing Pallas (Felis [Otocolobus] manul) di Daurian Steppe di Rusia di 2010-2011. Sumber pasti paparan virus terhadap virus AI untuk kucing-kucing ini tidak diketahui, meskipun mungkin mereka telah berkontak dengan kuda, anjing, kucing, dan tikus rumahan di pemukiman manusia yang terpencil. Selain itu, kucing Pallas juga menduduki lubang-lubang halian rubah dan memangsa Daurian pika (Ochotona daurica) dan voles (Microtus spesies) [148]. Menariknya, baik rubah merah (Vulpes vulpes) [183] maupun pika bibir hitam (Ochotona curzoniae) [252] ditemukan rentan terhadap infeksi virus AI H5N1.
Virus-virus influenza A dalam famili Viverridae
Di musim semi tahun 2009, penyakit pernafasan berat terjadi pada Binturong Borneo (Arctictis binturong penicillatus) pada kebun binatang di California, Amerika Serikat. Gejala klinis melipuri letargi, tidak nafsu makan, dyspnea, leleran hidung, dan batuk. Hewan kemudian dieutanasia karena penyakitnya berat dan otopsi menunjukkan pneumonia interstitial. Melalui sekuensing dan PCR teridentifikasi virus AI pH1N1 dalam sampel paru dari American Badger (Taxidea taxus) dan dalam swab dari musang kaki hitam (Mustela nigripes) yang dipelihara terpisah pada satu kebun binatang yang sama dan menderita penyakit respirasi selama periode waktu yang sama. Diasumsikan bahwa manusia adalah sumber infeksi [193].
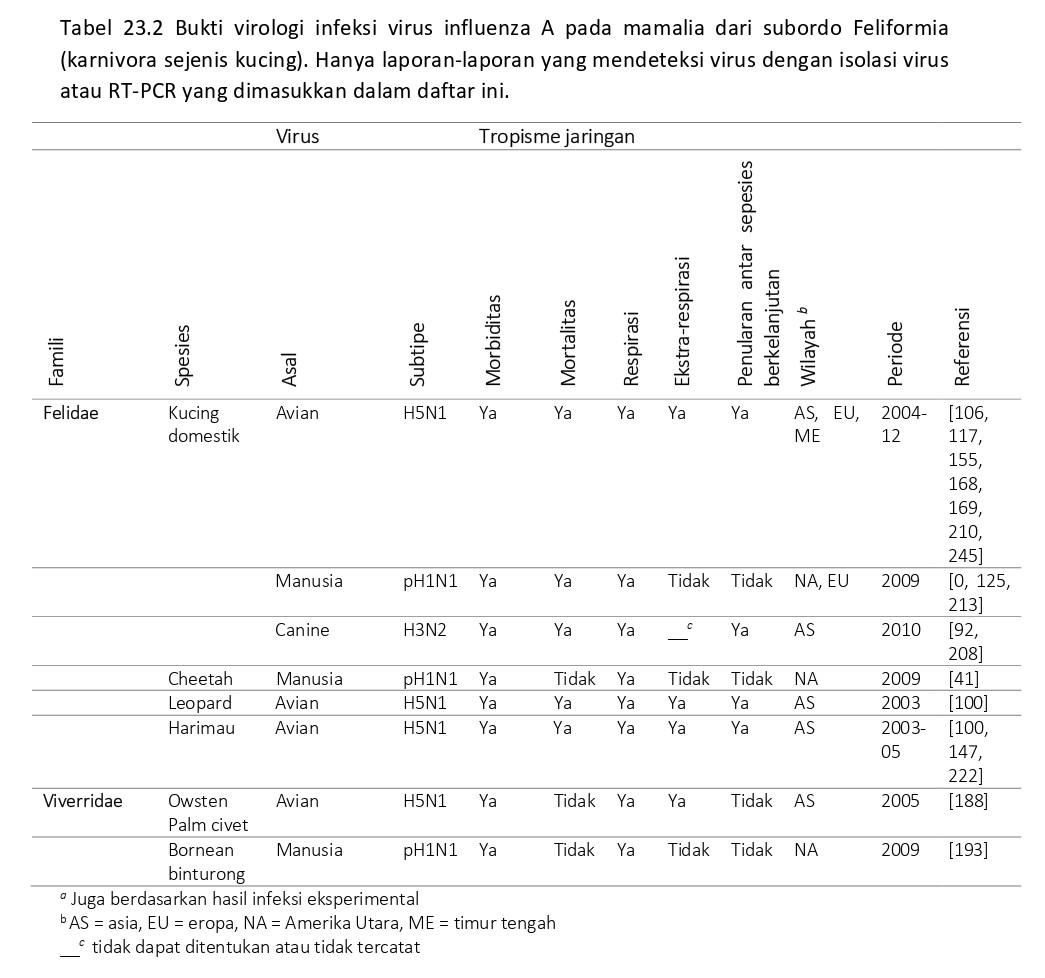
Virus-virus influenza A pada spesies non-babi dalam ordo Artiodactyla
Meskipun terdapat fakta bahwa ordo Artiodactyla (ungulata berkuku genap) memiliki 220 spesies kebanyakan adalah hewan domestik atau buruan yang penting, infeksi AIV telah dilaporkan hanya sporadis pada beberapa spesies saja selain babi domestik dan babi liar (Sus scrofa) yang termasuk kedalam famili Suidae. Bukti infeksi atau terpapar virus AI telah dilaporkan pada sapi (Bos taurus), domba (Ovies aries), kambing (Capra aegagrus hircus), yak (Bos grunnies), dan kerbau air (Bubalus bubalis), yang termasuk ke dalam famili Bovidae, pada alpaca (Lama pacos), yang termasuk ke dalam famili Giraffidae, dan pada rusa kutub (Rangifer tarandus), rusa fallow (Dama dama), dan rusa European roe (Capreolus capreolus) yang termasuk ke dalam famili Cervidae (Tabel 23.3) [53, 54, 63, 71, 127, 131, 187, 190]. Satu-satunya epidemi penyakit pernafasan berat yang disebabkan oleh infeksi AI pada Artiodactyla non-babi dilaporkan pada unta Bactria (Camelus bactrianus), yang termasuk ke dalam famili Camelidae [244]. Influenza pada babi domestik dan babi liar didiskusikan dengan mendetail pada bab 16-19.
Kemungkinan virus IAV pertama yang diisolasi dari ruminansia adalah dari Domba di Hungaria tahun 1960 [127, 190], diikuti oleh beberapa isolasi virus AI H3N3 dari sapi di Rusia dari awal tahun 1970 sampai 198-an [127]. Virus-virus ini juga diisolasi selama wabah penyakit pernafasan pada domba dan sapi yang bersamaan dengan pandemi dan sirkulasi virus AI H2N2 Asia/1957 dan H3N2 Hong Kong/1968 pada manusia.
Romvary dan kolega melaporkan isolasi virus AI H2N2 Asia (A/Borzsony/111/1960) dari domba dewasa dan fetusnya yang sudah terbentuk sempurna yang menderita penyakit pernafasan di Hungaria tahun 1960 [19]. Kejadian ini bersamaan dengan pandemi virus H2N2 Asia/1979 pada manusia. Penyakit pernafasan teramati pada beberapa kawanan domba. Untuk mengkonfirmasi kerentanan domba terhadap virus AI manusia, domba diinokulasi via intratrakea dengan strain H2N2 dan PR8 yang telah beradaptasi terhadap telur. Inokulasi virus menyebabkan demam, anoreksia, batuk, dyspnea, dan kelesuan. Otopsi dengan DPI 7 mengungkapkan pneumonia virus baik secara makroskopis dan histologis, demikian juga respon imun yang jelas terhadap strain inokulasi [190]. Akan tetapi, tidak dilaporkan apakah virus AI diisolasi kembali dari domba yang diisolasi (re-isolasi). Re-isolasi pernah dicoba oleh McQueen dan Davenport tahun 1963, saat mereka menginfeksikan beberapa domba berumur 3 – 10 minggu dengan isolat virus AI H2N2 domba Hungaria (A/Borzsony/111/1960 dan PR/8/1934. Domba menunjukkan respon demam tetapi tidak ada gejala pernafasan, dan tidak ada virus yang dapat di re-isolasi dari swab hidung diambil pada 2 dan 3 DPI, atau dari paru-paru dan trakea saat diotopsi pada 3 DPI. Titer antibodi homolog terdeteksi di dalam sera dari semua domba yang diinokulasi [141]. Selama epidemi besar H2N2 pada manusia di Irlandia pada bulan Januari 1961 [142], serum sapi diambil antara awal tahun 1960 dan musim panas tahun 1961 kemudian di screening untuk antibodi terhadap virus AI H2N2. Tidak ada bukti meyakinkan yang menunjukkan menyebarnya virus pada sapi karena semua hasil uji serum negatif [143].
Antibodi yang muncul secara alami melawan virus AI H3N2 terdeteksi pada 16 dari 28 ekor sapi, 5 dari 12 ekor kambing, dua ekor kerbau air, dan satu ekor persilangan yak-zebu di Nepal dan India, yang dilakukan pengambilan sampelnya antara tahun 1972 dan 1973 [71]. Hal ini bersamaan dengan bersirkulasinya virus AI H3N2 (A/England/42/1972, berhubungan dekat dengan A/Hong Kong/1/1968) diantara manusia di India dan Nepal [212]. Hewan-hewan tidak dilaporkan menunjukkan gejala klinis apapun. Inokulasi eksperimental virus AI H3N2 kepada yak menginduksi gejala klinis ringan penyakit pernafasan, termasuk batuk dan rasa tidak nyaman dan kelelahan, pada 6 DPI [71]. Penyakit pernafasan lebih berat yang mirip influenza teramati pada anak sapi umur 3 – 4 minggu yang diinokulasi secara eksperimental dengan virus AI strain H3N2 (A/cald/Duschanbe/55/1971) yang diisolasi dari pedet di Rusia. Untuk 4 DPI pedet menunjukkan leleran hidung dan batuk. Virus didedahkan melalui hidung pada 7 DPI. Infeksi serupa dengan isolat virus AI H3N2 tidak menginduksi gejala penyakit pernafasan [33].
Infeksi AI pada sapi dilaporkan berhubungan dengan kasus berkurangnya secara akut produksi susu, yang disebut ‘milk drop syndrome’ [24, 40, 70, 74]. Sebuah studi case control pada kawanan sapi perah di Devon, Inggris, menunjukkan bahwa meningkatnya titer antibodi terhadap virus AI H1N1 (A/England/333/1988) dan virus AI H3N2 (A/England/427/1988) dihubungkan dengan berkurangnya air susu secara tiba-tiba, gejala penyakit pernafasan, dan temperatur rektal yang tinggi dibandingkan dengan kontrol [40].
Sebaliknya dari laporan sporadis virus AI pada beberapa ruminansia, banyak wabah penyakit pernafasan berat dihubungkan dengan infeksi AIV H1N1 manusia tercatat pada unta Baktria pada peternakan di seluruh Mongolia antara tahun 1978 dan 1988. Selama epidemi berat musim dingin tahun 1979-1980, 4000 ekor unta menunjukkan gejala yang meliputi demam, batuk, bronkhitis, dan leleran hidung dan mata. Gejala klinis pada umumnya bertahan sampai 5 – 7 hari. Beberapa unta mengalami aborsi, dan angka mortalitas sebesar 9,1%. Isolat virus AI H5N1 dari swab nasofaring dari hewan yang terdampak menginduksi penyakit pernafasan pada unta naif yang secara eksperimental diinokulasi secara serologis. Analisis sekuensing genetik dari isolat tersebut mengungkapkan bahwa gen PB1, HA dan NA nya hampir identik dengan isolat AIV manusia H1N1 dari tahun 1977 yang sangat berhubungan dekat dengan strain vaksin H1N1 HI1N1 (USSR/77XPR/8/34) reasortan yang diinaktivasi dengan sinar UV yang digunakan pada orang-orang Mongolia di Leningrad, sementara gen sisanya berasal dari strain PR/8 H1N1 laboratorium. Telah dispekulasikan bahwa manusia merupakan sumber infeksi pada unta, karena epidemi pada unta bersamaan dengan epidemi influenza ringan H1N1 diantara anak-anak Mongolia yang divaksinasi [244]. Selama periode waktu yang sama dan di wilayah yang sama dengan wabah yang terjadi pada unta Mongolia tahun 1985, virus AI H1N1 telah diisolasi dari seorang anak yang mengalami penyakit pernafasan. Isolat ini secara genetik hampir identik dengan virus AI H1N1 pada unta [7], menunjukkan bahwa reassortant virus AI H1N1 mampu melewati barrier spesies.
Mengikuti lonjakan pandemi H1N1 2009, terdapat kekhawatiran bahwa jemaah haji yang berkumpul pada musim haji mungkin dapat menginfeksi unta dromedari (Camelus dromedarius, termasuk famili Camelidae) di Arab Saudi, dan juga jemaah haji yang pulang kembali ke kampung halaman dapat menulari unta dromedari di negara asal mereka [171]. Akan tetapi, tidak ada laporan selanjutnya yang dapat membuktikan kekhawatiran ini. Meskipun virus parainfluenza-3 dihubungkan dengan penyakit pernapasan pada unta dromedari [87], antibodi melawan virus AI belum pernah dilaporkan sampai saat ini pada unta dromedari.
Baru-baru ini, virus AI H3N8 diisolasi dari salah satu dari 46 swab hidung yang dikoleksi dari unta Bactrian sehat dari Mongolia antara bulan Januari 2012 dan Januari 2013. Analisis filogenetik dari isolat mengindikasikan bahwa terjadi penularan virus AI yang berhubungan dekat dengan equine H3N8 antara kuda ke unta relatif baru saja terjadi. Di Mongolia, epidemi AIV H3N8 yang terjadi berulang muncul di wilayah-wilayah dimana banyak kuda dan unta Bactria yang hidup bebas. Penularan antar unta belum pernah dilaporkan sampai saat ini [246].
Screening serologis telah dilakukan pada anggota lain famili Camelidae. Antibodi terhadap virus AI telah ditemukan pada lebih dari 100 ekor alpaca Peruvia (Lamas pacos), dengan prevalensi sebesar 4% [187]. Screening serologi yang lebih baru untuk antibodi terhadap virus AI, termasuk H1N1 manusia dan equine H3N8, pada vicuna (Vicugna vicugna) liar, dan Lama (Lama glama) dari Argentina menunjukkan hasil negatif [13, 136].
Virus-virus influenza pada ordo Cetacea
Laporan paparan alami virus IAV jarang ditemukan pada cetacea, ordo mamalia yang meliputi ikan paus, lumba-lumba, dan porpoise (Tabel 23.3). Virus AI H1N3 asal avian diisolasi dari beberapa buah paru-paru dan 2 hati yang diambil dari paus Minke (Balaenoptera acutorostrata) hidup yang ditangkap oleh kapal penangkap paus di Pasifik Selatan selama tahun 1975-1976. Virus diidentifikasi dengan mikroskop elektron dan dikultur di dalam telur. Protein NA virus ini secara antigenik sangat dekat dengan AIV. Tidak ada gejala penyakit yang dilaporkan [129, 232].
Virus AI H13N2 dan H13N9 diisolasi dari paus pilot bersirip panjang (Globicephala melaena, sekarang disebut G. melas) dihubungkan dengan dua kejadian terdampar massal di sepanjang garis pantai Semenanjung Cape Cod, Amerika Serikat, di tahun 1984 [81]. Salah satu dari pasu pilot yang sakit dan bingung tertangkap dalam keadaan hidup, dieutanasia, dan diperiksa. Paus itu sangat kurus/emasiasi dan kulitnya mengelupas. Otopsi makro mengungkapkan pembesaran nodus limfatik hilar, paru-paru hemoragik, dan hati yang kecil dan rapuh. Meskipun virus AI subtipe H13N2 dan H13N9 diisolasi dari nodus limfatik hilar dan paru-paru, tidak terdapat bukti bahwa infeksi virus AI lah yang menyebabkan lesi ini. Ciri genetik dan antigenik isolat virus AI dari paus pilot menunjukkan bahwa virus tersebut berasal dari burung camar (gull) [81]. Memang, 28 tahun setelah isolasi awalnya, virus isolate H13N2 dari paus pilot yang berhasil dikonfirmasi dengan analisis genetik [72]. Sebaliknya dari isolat H13 dari burung camar yang lain bersifat enterotropik pada itik, virus-virus ini tampaknya sensitif terhadap pH yang rendah, karena tidak bereplikasi ataupun menginduksi penyakit pada itik yang diinokulasi melalui oral. Virus memang bereplikasi di dalam usus bawah itik ketika diinokulasi via rektal, dengan begitu menghindari keadaan asam yang ada dalam proventrikulus. Kedua isolar juga bereplikasi dalam hidung musang yang diinokulasi via intranasal. Penularan fekal-oral dari burung camar yang mendedahkan virus kepada paus yang sedang makan diajukan sebagai rute penularan yang mungkin terjadi [81]. Penularan semacam itu mungkin difasilitasi oleh burung camar dan paus yang makan bersama satu spesies ikan yang sama disaat terjadi suatu peristiwa yang disebut “multi-spesies feeding frenzies”. Ingesti aksidental sebagai rute penularan juga mungkin terjadi karena tidak jarang burung masuk terhisap ke dalam perut paus baleen saat peristiwa ‘feeding frenzy” dan laporan tentang burung yang tertelan oleh paus baleen juga telah dipublikasikan [79, 200].
Bukti serologis infeksi virus AI pada cetacea telah dilaporkan untuk paus Minke, Dall’s porpoises (Phocoenoides dalii), dan beluga (Delphinapterus leucas) (Tabel 23.4). Menariknya, lima serum beluga positif berasal dari sampel relatif kecil 34 ekor beluga dari satu populasi dari wilayah yang sama (Pulau Baffin, Nunavut, Kanada), di sampel antara tahun 1991 dan 1992. Tidak ada antibodi melawan virus AI yang terdeteksi pada 76 narwhal (Monodon monoceros) atau empat paus bowhead (Balaena mysticetus) dari survei yang sama [149].
Virus-virus influenza pada primata selain manusia (non human primates/NHP)
Hanya ada tiga artikel yang dipublikasikan yang memberikan bukti virologi infeksi virus AI pada primata non manusia (NHP) (Tabel 23.5). Pertama, di tahun 1971 Johnsen dan koleganya [93] melaporkan epidemi virus AI H3N2 (A/Hong Kong/1968) pada koloni white-handed gibbon (Hylobates lar) di Thailand. Virus pertama kali masuk ke dalam koloni tersebut melalui inokulasi eksperimental pada beberapa individu terpilih, tetapi setelah 2 – 3 minggu keadaan berkembang menjadi epidemi dalam koloni tersebut. Kera gibbon ini mengalami penyakit pernafasan ringan sampai fatal. Gejala klinis terdiri dari demam, rhinitis serosa sampai purulen, batuk, anoreksia, depresi, dan gangguan pencernaan. Otopsi keempat kasus fatal menunjukkan paru-paru merah tua dan mengalami edema, yang berhubungan dengan pneumonia nekrohemoragika yang ditunjukkan pada pemeriksaan histologi [93]. Yang kedua, di tahun 1975, Malherbe dan koleganya mengisolasi virus mirip influenza dari tenggorokan 3 dari 20 ekor babon kuning (Papio cynocephalus) sehat yang telah diimpor ke Amerika Serikat dari Kenya [134]. Ketiga, satu dari 48 swab mulut dari kera macaca (Macaca fascicularis dan M. nemestrina) urban peliharaan maupun yang liar dari Kamboja ditemukan positif AIV pada PCR [99].
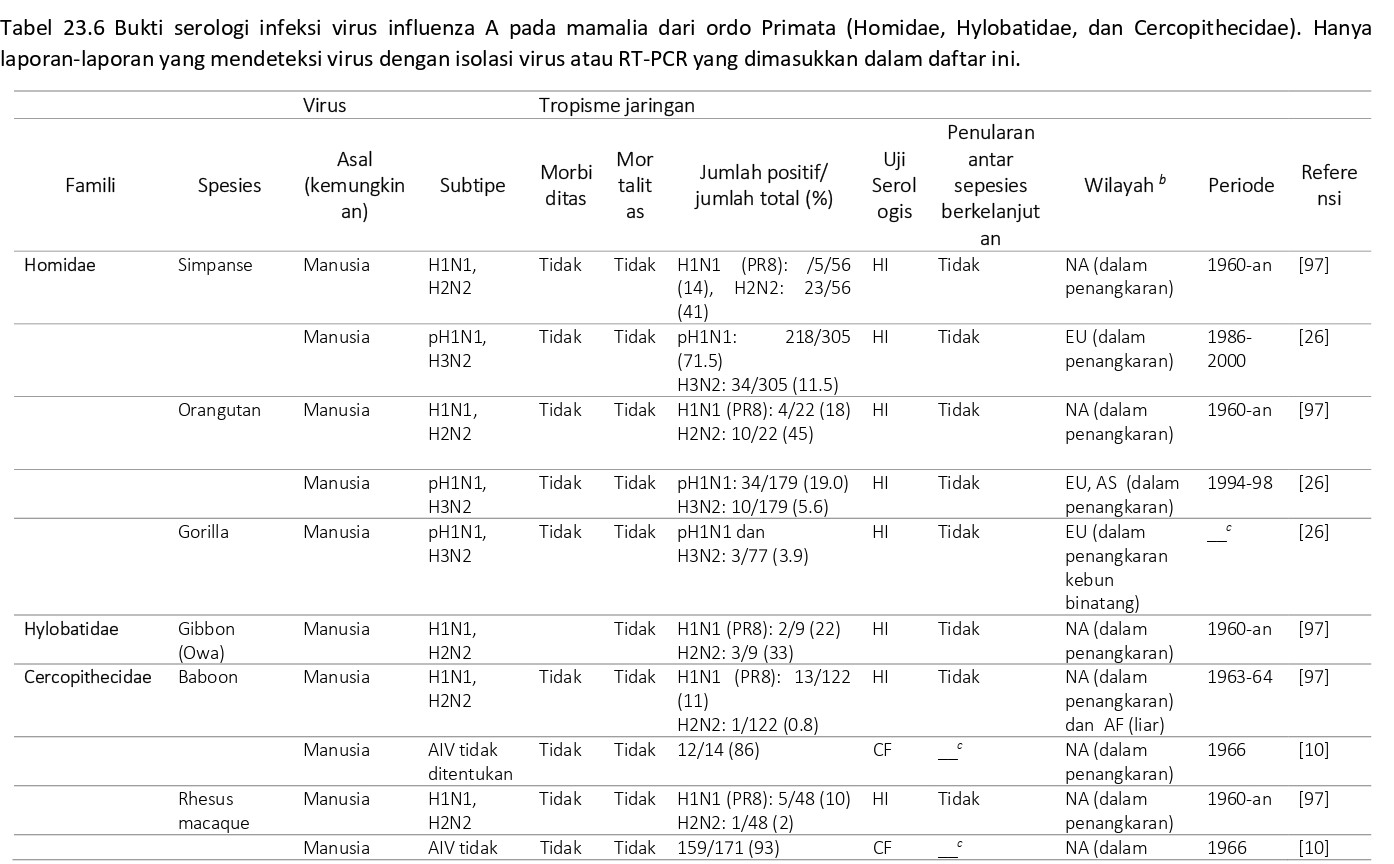
Bukti serologis infeksi virus AI pada primata non manusia (NHP) telah dilaporkan dalam beberapa artikel (Tabel 23.6). Data ini menunjukkan bahwa NHP sering terpapar dan terinfeksi virus AI, tapi cukup resisten terhadap berkembangnya penyakit. Kemungkinan sumber virus AI baik pada NHP yang dipelihara di penangkaran maupun yang hidup bebas adalah manusia yang sering berkontak dengan hewan tersebut. Akan tetapi, sumber lain virus AI (misalnya burung) juga tidak dapat dikecualikan.
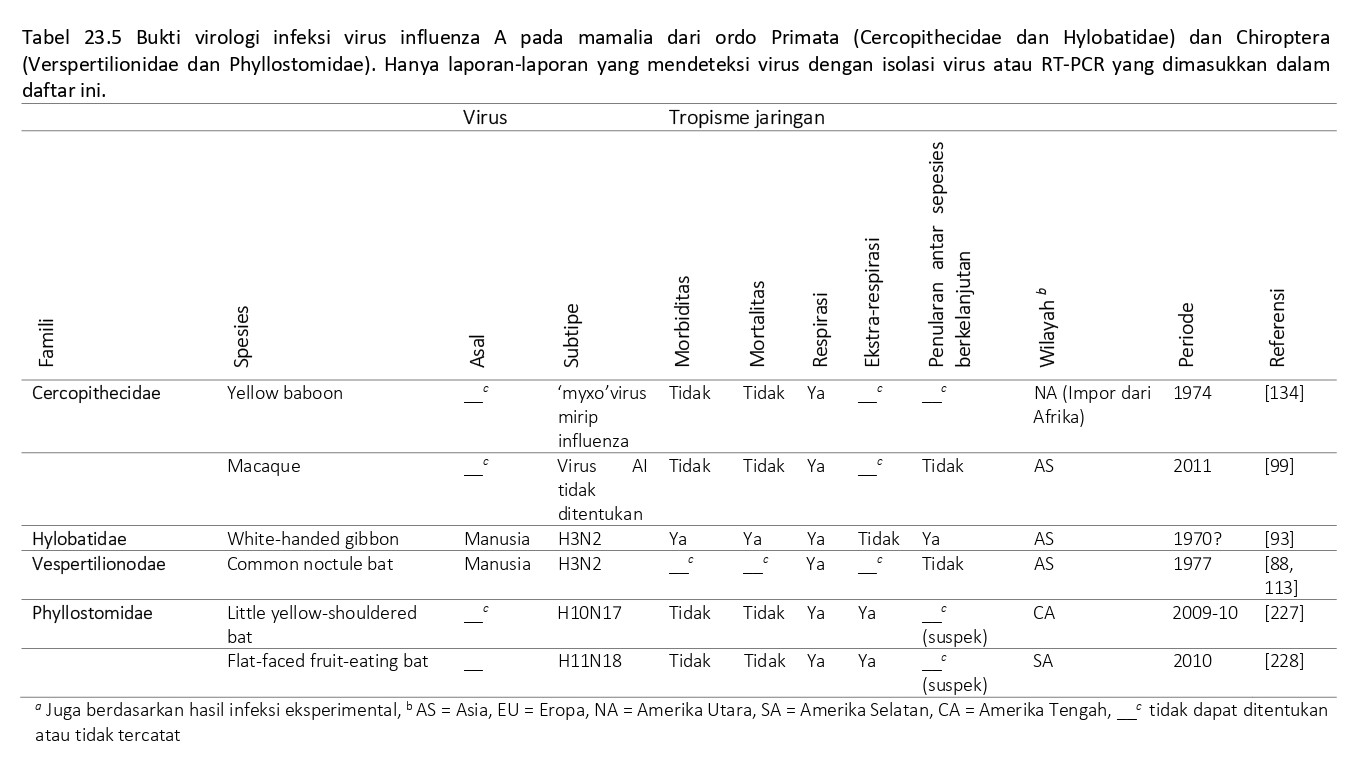
Inokulasi eksperimental terhadap virus AI telah menunjukkan bahwa banyak spesies primata non-manusia (NHP) yang rentan baik terhadap infeksi virus AI maupun terhadap penyakit yang disebabkan olehnya. Pada tahun 1920-an dan 1930-an, simpanse (Pan troglodytes) mengalami sakit mirip influenza setelah diinokulasi dengan basuhan hidung dari pasien manusia yang terkena influenza [50, 126]. Di tahun 1969, Kalter dan kolega menginokulasikan virus H3N2 kepada baboon (Papio spesies), yang menularkan virus kepada baboon sentinel tetapi tidak menimbulkan gejala pernafasan yang jelas [96]. Beberapa spesies NPH telah ditemukan rentan terhadap infeksi virus AI eksperimental dan mengembangkan penyakit respirasi. Spesies yang paling banyak dipelajari adalah monyet tupai (Saimiri sciureus) [19, 146, 194, 24, 205, 215, 229] dan cynomolgus, rhesus, pigtailed, dan bonnet macaques (Macaca spesies) [15, 16, 18, 25, 66, 80, 89, 91, 95, 137, 161, 236, 249].

Virus-virus influenza pada ordo Chiroptera
Tradisionalnya, reservoir awal seluruh virus AI dianggap sebagai burung air liar [153]. Dogma ini baru-baru ini dibalikkan dengan penemuan virus AI dengan subtipe HA yang baru (H17 dan H18) dan subtipe NA yang baru (N10 dan N11) pada kelelawar pemakan buah dari Amerika Tengah dan Selatan [227, 228] (Table 23.5). Hal ini sangat mengejutkan, karena sebelumnya hanya terdapat satu laporan yang dipublikasikan tentang infeksi virus AI pada kelelawar (yang termasuk ke dalam Ordo Chiroptera), saat virus AI H3N2 dikultur dan diisolasi dari paru-paru kelelawar noctule biasa pemakan serangga (Nyctalus noctula) dari Kazakhstan [113].
Virus AI pertama dari subtipe yang tidak diketahui, yaitu H17N10 terdeteksi pada kelelawar bahu kuning (yellow-shouldered-bats/ Sturnira lilium) dari Guatemala melalui sekuensing generasi baru dari sampel swab rektal dan organ dalam, meliputi paru-paru, hati, usus, dan ginjal. Virus AI subtipe kedua yang tidak diketahui, yaitu H18N11 terdeteksi pada kelelawar buah bermuka rata (flat-faced fruit bat/ Artibeus planirostris) dari Peru melalui sekuensing generasi baru dari sampel swab rektal dan sampel usus (sampel hati dan limpa menunjukkan hasil negatif). Deteksi virus yang konsisten pada usus dan swab rektal mengindikasikan bahwa virus AI baru yang berasal dari kelelawar ini bereplikasi di dalam usus. Virus-virus ini tidak dapat di propagasi dalam kultur sel ataupun telur. Tidak ada gejala klinis yang dilaporkan pada kelelawar yang di sampling dalam keadaan hidup [227, 228].
Analisis serologis dari beberapa spesies kelelawar Peruvian, termasuk spesies Artibeus, menunjukkan hasil pengujian serum yang tinggi (50%, 55 dari 110) yang mengandung antibodi spesifik terhadap rekombinan protein H18 dan N11 dengan uji ELISA. Serupa itu pula, antibodi spesifik terhadap protein H17 rekombinan ditemukan melalui uji ELISA pada 38% (85 sampel) dari 228 sampel serum dari delapan spesies kelelawar dari Guatemala yang dikumpulkan dari tahun 2009-2010 [228]. Tong dan koleganya menginterpretasikan tingginya seroprevalensi dari infeksi virus AI kelelawar yang identik pada banyak spesies yang berada dalam cakupan lokasi geografis yang berjauhan sebagai indikasi infeksi endemis yang tersebar luas dengan adanya penularan berkelanjutan dari kelelawar ke kelelawar lainnya pada kelelawar dunia baru [228]. Meskipun begitu, tidak ada bukti virologis yang ditemukan untuk virus AI semacam itu dari survey besar yang melibatkan 26 spesies kelelawar dari Eropa Tengah, di dunia lama [59].
Virus AI dari kelelawar yang memiliki segmen gen yang baru ditemukan yang mengkode protein HA utama permukaan amplop (H17 dan H18) dan NA (N10 dan N11). Mereka berbeda dalam fungsi dan bentuknya dari semua protein HA (H1-H16) dan NA (N1-N9) yang sebelumnya telah diketahui. H17 dari kelelawar menunjukkan rata-rata 45% kesamaan sekuens asam amino dengan HA yang berasal dari subtipe AI yang telah diketahui sebelumnya. Motif sekuens dari asam sialik (SA) tempat perlekatan reseptor telah teridentifikasi pada virus AI H17 kelelawar, meskipun perubahan posisi spesifiknya galaktosa-SA linkage mengindikasikan preferensi ligand selain reseptor SA [227]. Zhu dan koleganya memang menunjukkan tempat perlekatan reseptor HA H17 yang sebelumnya dianggap sangat asam, menyebabkan tidak menguntungkan untuk melekatkan reseptor SA bermuatan negatif [254]. Tidak seperti gen HA dan gen internal, N10 kelelawar tidak biasanya sangat berbeda dari NA yang sudah dikenal. Ia hanya menunjukkan kesamaan sekuens asam amino sebesar 24% dengan subtipe NA dari virus NA. Menariknya, kesamaan sekuens bahkan lebih rendah daripada kesamaan antara NA dari virus AI dan virus influenza [227].Akan tetapi, struktur kristal N10 menyerupai struktur NA virus AI lainnya (misalnya tempat N-glycosilasi yang sangat tersimpan N146 yang ada di semua NA virus AI). Akan tetapi, uji MUNANA enzimatik menunjukkan kurangnya aktivitas neuraminidase seperti biasanya [120].
H18 dari kelelawar menunjukkan kesamaan 49,1 % sekuensing asam amino dengan subtipe HA lainnya, dan hanya 60,2% kesamaannya dengan H17. NA dari N11 kelelawar (lebih akuratnya disebut sebagai NA-protein mirip” atau NAL) hanya memiliki kesamaan identitas 29,6% dengan NA yang lainnya [228]. Selain itu HA dari H17 dan H18 tidak menunjukkan perlekatan spesifik dengan sialosides yang mengevaluasi dengan sialoside microarray dan glycan ELISA [229, 254], dan juga telah ditemukan bahwa protein mirip NA pada N10 dan N11 tidak berlekatan atau membelah SA [120, 228]. Dibandingkan dengan virus AI non-kelelawar, hasil ini mengindikasikan bahwa H18N11 dan H17N10 pada kelelawar tidak memediasi pelekatan sel hospes dan pelepasan melalui reseptor SA. Reseptor atau mekanisme yang digunakan virus AI kelelawar untuk pelekatan sel hospes, fusi, pemasukan, dan pelepasannya masih belum teridentifikasi [219, 227, 228].
Sekuens asam amino dari gen internal yang tersisa dari virus AI H17N10 dan H18N11 menunjukkan sebagian besar motif sekuens fungsional yang telah diketahui pada virus AI lain. Protein polimerasi kompleks (PB2, PB1, PA dan NP) dari keduanya menunjukkan transkripsi virus fungsional melalui jalan reporter mini genom pada human dan sel primata. Transkripsi ini dibatalkan saat PB1 dihilangkan dari mini genom [227, 228]. Selain itu, telah ditetapkan bahwa N-terminal domain dari PA (PAn) dari H17N10 memiliki aktivitas endonuklease yang tergantung kepada mangan atau magnesium yang memproduksi primer RNA kecil yang penting untuk inisiasi transkripsi gen virus seperti halnya virus AI lainnya [221].
Analisis filogenetik dari sekuensing genetik primer molekul HA dari virus AI H17 dan H18 dari kelelawar mengindikasikan bahwa mereka termasuk ke dalam kelompok HA 1 (bersama H1, H2, H5, H6, H8, H9, H11, H12, H13, dan H16), dan tidak termasuk ke dalam grup HA 2 (H3, H4, H8, H10, H14, dan H15). N10 dan N11 dengan molekul mirip NA yang lebih bervariasi tidak termasuk kedalam grup NA 1 dan 2 yang ada, akan tetapi dikategorikan ke dalam grup 3 mirip influenza A (Gambar 23.4) [242]. Meskipun gen-gen internalnya hampir mirip dengan virus AI lain yang sudah dikenal, Wu dan koleganya menyarankan bahwa berdasarkan gen-gen NA dan HA-nya yang berbeda, virus-virus ini haruslah diberi nama “virus mirip influenza” [242]. Sumber NA mirip influenza ini tidak diketahui, tetapi mungkin merupakan keturunan virus tipe influenza tidak diketahui selain tipe influenza A, B atau C, baik sudah punah maupun belum teridentifikasi [120]. Posisi enam gen internal virus H17N10 dari kelawat dalam pohon filogeni berada di antara pemecahan virus AI dan virus influenza B. tetapi gennya lebih dekat dengan gen virus tipe AI [227]. Tong dan koleganya menyimpulkan dari temuan mereka bahwa virus AI yang baru ditemukan ini seharusnya telah berevolusi di dalam tubuh kelelawar selama periode yang sangat lama [228]. Secara singkat, temuan ini meliputi keragaman genetik virus yang lebih tinggi daripada yang sebelumnya telah diketahui ada, yang bercabang ke dalam banyak subtipe HA dan NA dengan mekanisme alternatif diduga SA-independen atau reseptor untuk mekasukan dan pelepasan dari sel hospes, dan distribusi geografis dua virus AI kelelawar monofiletik ini yang tersebar luas.
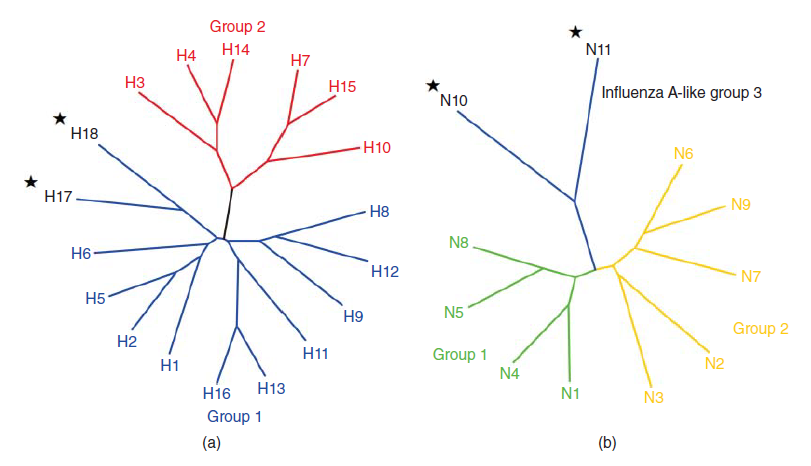
Gambar 23.4 Pohon filogeni yang menunjukkan gen hemagglutinin (HA) dan neuraminidase (NA) genes pada virus-virus innfluenza H17N10 and H18N11 yang diturunkan dari kelelawar (ditandai dengan tanda bintang) dibandingkan dengan jarak relatif dari gen HA and NA dari seluruh subtipe virus influenza A yang telah dikenal sebelumnya. Dicetak ulang dari Trends in Microbiology, April 2014, Vol. 22, No. 4, pp. 183–191, Wu Y., Wu Y., Tefsen B., Shi Y., Gao G. F. Bat-derived influenza-like viruses H17N10 and H18N11, dengan izin from Elsevier.
Dari dua protein permukaan utama, HA dan NA dari virus AI H17N10 dan H18N11 kelelawar tidak memiliki fungsi perlekatan sel dan pembelahan virus seperti virus AI biasanya. Akan tetapi, gen internalnya yang bertanggungjawab untuk transkripsi virus yang lebih tersembunyi terlihat fungsional dalam percobaan in vitro. Gen-gen ini dianggap memiliki potensi untuk saling bergantian dengan virus AI yang sudah dikenal yang memiliki HA dan NA klasik fungsional. Hal ini telah menimbulkan pertanyaan serius di bidang saintifik maupun kesehatan masyarakat tentang apakah reasortansi genomik semacam itu dapat terjadi, dan dengan demikian akan mampu menciptakan virus influenza infeksius yang mampu menimbulkan penyakit pada spesies selain spesies kelelawar dimana virus tersebut terdeteksi [227, 228, 242]. Selain itu, kelelawar diketahui membawa banyak virus yang memiliki potensi penyakit zoonosis yang cukup tinggi [29, 108], dan seringkali dianggap sebagai “kotak harta karun” yang membawa banyak virus yang belum diketahui [29]. Memang pada saat ini penemuan virus baru pada kelelawar masih terus berjalan [51, 52]. Pada umumnya, kelelawar memiliki karakteristik spesifik yang dapat mempermudah evolusi dan penyebaran virus-virus baru, termasuk virus AIV. Termasuk ke dalam ordo taksonomi Chiroptera yang meliputi setidaknya 1150 spesies di seluruh dunia, kelelawar adalah hewan mamalia dengan masa hidup yang panjang dengan jumlah sangat banyak di dunia, yang bermigrasi dan mendiami wilayah perkotaan, pedesaan dan alam liar, yang sangat berpotensi berkontak dengan manusia, hewan ternak dan hewan hewan liar lain. Selain tiu, mereka menempati tempat-tempat bertengger bergerombol dengan kepadatan sangat tinggi di koloni-koloni yang berisi banyak spesies bersama-sama, yang secara langsung memastikan transmisi virus dari kelelawar ke kelelawar lain [29]. Kelelawar telah dianggap sebagai reservoir mamalia baru yang berpotensi menjadi salah satu reservoir penting untuk virus influenza.
Virus-virus influenza pada ordo Rodentia dan Lagomorpha
Meskipun terdapat sekitar 2300 spesies dalam ordo Rodentia dan sekitar 80 spesies dalam ordo Lagomorpha [24], infeksi alami virus IA sangat jarang dilaporkan pada spesies yang termasuk kedalam dua ordo ini [55, 63, 198, 199]. Antibodi spesifik terhadap virus AI mengindikasikan adanya infeksi virus AI manusia terdeteksi melalui uji HI dan CFT (complement fixation test) pada salah satu kelinci domestik (Oryctolagus cuniculus) dan satu chipmunk (Tamias striatus). Hal ini merupakan bagian dari studi pemetaan serologis untuk antibodi terhadap virus AI H3N2 (A/Hong Kong/1/1968) pada enak ekor chipmunk liar, 25 ekor roundhog (Marmota monax), 13 ekor cottontail rabbits (Sylvilagus spesies), 42 ekor snowshoe hares (Lepus americanus), dan 106 pet ekor kelinci peliharaan dari wilayah Ottawa, Canada, yang disampel antara tahun 1966 sampai 1970 [63].
Enam ekor dari enam tikus kecil rumahan (Mus musculus) yang ditangkap di sebuah peternakan gamebird di Idaho, Amerika Serikat selama wabah LPAI H5N8 tahun 2008 ditemukan memiliki antibodi positif terhadap AI melalui pengujian NP-ELISA tidak langsung [199]. Enam ekor tikus coklat/ brown rat (Rattus norvegicus), satu ekor harvest mouse (Reithrodontomys megalotis), dan satu deer mouse (Peromyscus maniculatus) yang ditangkap kemudian dilakukan uji di dalam satu studi yang sama kesemuanya menunjukkan hasil seronegatif. Inokulasi intranasal eksperimental yang dilaksanakan setelahnya pada tikus rumahan yang naif secara serologis dengan isolat dari burung liar (H3N6, H3N8, dan H4N6) atau isolat dari ayam (H6N2 dan H4N8) mengakibatkan adanya replikasi virus di dalam turbinata hidung, trakea, dan paru-paru. Isolat virus asal burung liar bereplikasi dalam titer yang lebih tinggi di dalam titer tikus daripada isolat asal ayam. Hasil yang didapat ini mengindikasikan bahwa tikus rumahan mungkin menjadi faktor resiko dalam penularan virus AI kepada peternakan unggas dan gamebird [199].
Virus-virus influenza pada ordo spesies lainnya
Wabah infeksi AI H1N1 musiman terjadi pada pemakan semut raksasa (giant anteater/Myrmecophaga tridactyla) yang termasuk kedalam famili Myrmecophagidae, dalam ordo Pilosa) di Kebun Binatang Nashville, Amerika pada Bulan Februari 2007. Kesebelas hewan di dalam kelompoknya menunjukkan gejala klinis leleran dan kongesti hidung yang parah, tidak nafsu makan dan letargi. Virus yang diisolasi teridentifikasi sebagai virus AI dan menunjukkan lebih dari 99% kesamaan identitas nukleotidanya dengan virus AI musiman H1N1 pada manusia dari isolat Tennesee/UR06-0119/2007. Pemakan semut tidak berkontak dengan siapapun kecuali dengan petugas pemeliharanya, yang saat itu menderita penyakit pernafasan, dan diduga menjadi sumber infeksi [151].
Laporan tentang infeksi AI pada reptil dan amfibi, meskipun jarang, menekankan begitu luasnya kisaran hospes virus ini. Pada tahun 2006, virus AI terdeteksi dalam 4 dari 37 sampel darah buaya tangkaran yang diuji PCR untuk mendeteksi gen matriks virus AI, di Florida, Amerika Serikat, diantaranya Chinese alligator (Alligator sinensis), Schneider’s drwaf caiman (Paleosuchus trigonatus), Nile crocodile (Crocodylus niloticus) dan broad-snouted caiman (Caiman latirostris). Antibodi terhadap virus AI terdeteksi melalui pengujian agar gel immunodiffusion (AGID) dalam serum semua hewan kecuali pada broad snouted caiman. Buaya-buaya ini dipelihara didalam kandang terbuka sehingga mudah bersinggungan dengan burung liar, beberapa diantaranya dimakan oleh buaya, dan mungkin saja merupakan sumber infeksi. Hal ini didukung oleh analisis sekuensing gen protein non struktural 1 (NS) sebagai produk PCR, yang mengungkapkan bahwa lebih dari 99.7% homolog dengan gen NS1 dari isolat asal itik [46]. Salah satu studi lainnya oleh Mancini dan koleganya [135], menunnukkan bahwa hewan poikilotermik memiliki kerentanan terhadap virus AI (dan virus influenza B). Antibodi terhadap virus AI H1N1 dan H3N2 pada manusia, H7N7 dan H3N8 pada kuda terdeteksi melalui pengujian HI dalam serum yang dikumpulkan dari ular dan amfibi liar di Brazil, diantaranya pit vipers (Bothrops jararaca dan B. jararacussu), Cascavel rattlesnakes (Crotalus durissus terrificus), Rococo toads (Bufo paracnemis) dan American bulfrogs (Lithobates catesbeianus, sebelumnya Rana catesbeiana) [135].
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

