Oleh: Erica Spackman, Giovanni Cattoli dan David L. Suarez
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Pengenalan
Deteksi dan diagnosis infeksi virus influenza A (AIV) pada hewan membutuhkan uji laboratorium karena penyakit yang disebabkan AIV tidak menunjukkan gejala yang patognomonik. Diagnosa dan surveilans influenza pada hewan berfokus pada deteksi virus atau antibodi spesifik. Apakah salah satunya mentarget virus atau antibodi tergantung dengan tujuan pengujian. Karakterisasi lebih lanjut dari satu isolat atau spesimen antibodi dapat dilakukan dengan tujuan unutuk menentukan subtipe atau fitur-fitur biologik lainnya. Pengujian spesifik yang akan dilakukan akan bervariasi tergantung spesies, tujuan pengujian dan sumber daya yang tersedia.
Merefleksi pentingnya virus AIV baik bagi hewan domestik maupun kesehatan masyarakat, banyak tes pengujian telah dilaporkan di dalam literatur dan telah tersedia secara komersial. Faktanya virus AIV sering digunakan sebagai agen untuk membuktikan suatu konsep (proof-of-concept) dalam pengembangan teknologi diagnostik baru. Sebagai tambahan, karenanya pentingnya virus AIV, harmonisasi beberapa metode diagnostik dan deteksi telah dibuat untuk spesies tertentu dan kelompok hewan tertentu (misalnya unggas dan kuda). Standarisasi metode pengujian sering dilakukan pada level internasional (misal OIE) atau pada level regional ataupun nasional (misal juknis yang dikeluarkan pemerintah federal, rencana pengembangan unggas nasional di Amerika Serikat). Sebaliknya, terkadang hanya da sedikit petunjuk teknik yang tersedia untuk spesies-spesies lainnya. SOP dan detail mengenai metode diagnostik yang yang paling penting dapat ditemukan pada beberapa referensi [10, 48, 61, 72] dan pada situs OIE (www.oie.int).
Tipe-tipe sampel
Tipe-tipe sampel dan metode prosesing tergantung dengan banyak faktor yang tidak berhubungan, seperti tujuan pengujian, tipe-tipe pengujian yang digunakan dan speses target. Tidak jarang untuk satu sampel dilakukan lebih dari satu pengujian, terutama jika hasil salah satu pengujian, misalnya antigen capture immunoassays (ACIAs), harus dikonfirmasi dengan test kedua yang lebih sensitif, seperti real-time reverse transcription polymerase chain reaction (rRT-PCR) atau isolasi virus (VI).
Swab oropharing (atau trakea) dan swab kloaka adalah tipe spesimen yang secara luas digunakan untuk spesies unggas, meskipun jaringan juga diambil untuk beberapa kasus. Jaringan bukanlah sampel optimal untuk mendeteksi low-pathogenic (LP) avian influenza virus (AIV), akan tetapi trakea dan paru-paru direkomendasikan jika sampling jaringan dilakukan. Banyak jaringan dapat disampling untuk deteksi high-pathogenicity (HP) AIV, diantaranya paru-paru, otak, jantung, ginjal dan limpa.
Swab oropharing, yang didalamnya termasuk juga swab celah choana, lebih disukai daripada swab trakea karena alasan berikut: (1) bahan-bahan material dari sinus dimana virus bereplikasi terkumpul pada celah choana; (2) swab ini kurang infasif dan tidak ada resiko kerusakan trakea; (3) hanya sedikit keahlian yang diperlukan, karena esofagus lebih mudah diswab dan dapat dikira sebagai trakea oleh petugas yang tidak terlatih. Sebuah penelitian menggunakan rRT-PCR pada spesimen dari hewan yang diinfeksi secara eksperimental telah menunjukkan bahwa swab oropharing dan swab trakea sama-sama efektif untuk deteksi virus influenza pada spesies unggas [69].
Pada banyak kasus pendekatan optimal untuk sampling adalah dengan mengoleksi spesimen dari oropharing dan kloaka sekaligus. Meskipun tropisme virus AIV pada saluran pernafasan atau pencernaan seringkali spesifik per sepesies, terdapat beberapa pengecualian tergantung strain, tergantung pada bagaina galur keturunan beradaptasi pada satu spesies. Aturan umumnya adalah bahwa LPAIV pada unggas-unggas air (baik domestik maupun liar) akan memiliki tropisme yang lebih tinggi untuk replikasi di salurah pencernaan, dan karena itulah virus akan dilepaskan melalui rute kloaka, sehingga deteksi akan lebih baik dengan swab kloaka [2, 60, 73]. Sebaliknya pada unggas-unggas gallinacea, seperti ayam dan kalkun, virus LPAIV biasanya memiliki tropisme pada saluran pernafasan, sehingga tebaik menggunakan swab oropharing dan swab trakea untuk koleksi virus infektif. Penting untuk disebutkan bahwa data tentang spesies unggas lainnya (merpati, camar, unggas laut, dsb) tidak lengkap untuk membuat rekomendasi yang tegas dalam penggunaan metode swab satu atau yang lainnya, karena itulah kedua metode swab harus dilakukan. Sebuah contoh paling baru yang menunjukkan pengecualian aturan praktis tropisme respiratori = gallinacea dan intestinal = unggas air adalah virus dari galur keturunan H7N9 yang bereplikasi dengan baik pada saluran pernafasan atas baik unggas galinaseus maupun unggas air. Karena itulah saat melakukan surveilans pada gaur keturunan virus ini, swab oropharing atau swab trakea dapat direkomendasikan untuk brung air dan ayam [49].
Secara lebih umum, beberapa studi telah menunjukkan bahwa sensitivitas maksimal di dalam populasi dapat dicapai dengan melakukan koleksi dan testing sampel swab oropharing (atau trakea) dan swab kloaka, meskipun banyak penyidik penyakit tidak memperhitungkan bahwa dengan menaikkan jumlah sampel maka akan meningkatkan biaya sampling [33]. Meskipun begitu, sebuah pendekatan telah diadopsi untuk sampel unggas liar yaitu dengan menempatkan sampel dari dua metode di dalam satu tabung. Dua studi independent telah menunjukkan pendekatan ini telah menunjukkan meningkatnya jumlah sampel positif kalau dibandingkan dengan hanya menggunakan sampel swab kloaka saja.
Karena tropisme jaringan dari virus IAV cenderung konsisten pada salurah pernafasan pada mamalia maka sampel optimal pada spesies mamalia (babi, kuda dan anjing) adalah melalui swab nasal (hidung). Cairan oral telah terbukti efektif dalam mendeteksi IAV pada kawanan babi [18, 28, 56]. seperti yang terjadi pada unggas, jaringan paru juga dapat digunakan untuk samplng post-mortem.
Pooling sampel swab dengan menempatkan banyak sampel di dalam satu tabung saat koleksi dapat membantu mengurangi biaya dengan mengkonsolidasikan sampel tetapi sampel yang berasal dari speseies dan grup yang berbeda tidak boleh di pool (Gambar 2.1). jaringan dari hewan yang berbeda tidak boleh di pool karena jika satu hewan telah memiliki antibodi maka dia dapat menetralisasi virus yang berasal dari hewan satunya jika sampel dari kedua hewan tersebut diproses secara bersama-sama. Selanjutnya, jaringan tidak boleh di pool dengan bahan material swab. Pooling bahan sampel dapat pula mendilusi sampel psotif dalam laboratorium diagnostik dan meningkatkan resiko kontaminasi silang, dan tidak direkomendasikan. Sebanyak maksimal 11 swab oral dari ayam yang diinfeksi secara eksperimental telah sukses di pool untuk rRT-PCR dan VI [35, 64], dan sebanyak 5 sampel telah sukses di pool untuk deteksi virus melalui rRT-PCR dalam sebuah studi yang menggunakan spiked swabs [26].
Gambar 1.1 Pooling swab spesimen untuk unggas. Sebanyak sampai 11 swab oropharing/trakea atau swab kloaka dapat di pool per vial jika swab dikumpulkan dari spesies yang sama dan unggas tersebut dikelompokkan bersama sebagai bagian dari flok yang sama atau berada di lokasi atau pasar yang sama.
Koleksi, transport dan penyimpanan sampel
Prosedur yang benar dalam koleksi, transport dan penyimpanan sampel sangat krusial dalam mendapatkan hasil uji yang akurat. Sampel swab harus di koleksi di dalam media mengandung protein yang ter-buffer dengan baik dan berkadar garam seimbang (misal brain-heart infusion broth atau tryptose phosphat broth) [23, 64]. Influenza tidak stabil didalam buffer garam tanpa protein, seperti phosphate-buffered saline, dan sensitivitas isolasi virus akan berkurang [23, 64]. Sampel jangan pernah dikirim dalam keadaan kering, karena hal itu terbukti mengurangi sensitivitas rRT-PCR juga VI [55, 64]. Antibiotika dapat ditambahkan ke dalam media transfer kecuali jika ada keperluan untuk melakukan pengujian terhadap agen bakterial.
Saat melakukan transport sampel sangat penting untuk mempertahankan rantai dingin (cold chain). Secara ideal, sampel harus dibawa ke laboratorium diagnostik dalam waktu 24 jam setelah koleksi, dan harus disimpan dalam suhu ruangan pendingin (sekitar 4oC). Es basah (wet ice) dapat digunakan untuk membuat sampel tetap dingin. Tidak boleh dilakukan pembekuan, karena siklus beku-cair akan mendegradasi RNA dan virus. Material swab telah diketahui tetap stabil sampai 14 hari pada suhu 4oC, sementara periode pembekuan mengurangi deteksi virus melalui rRT-PCR [25, 46].
Metadata yang berasosiasi dengan sampel adalah bagian kunci dari koleksi sampel. Tanggal koleksi, tipe sampel, lokasi (termasuk koordinat global positioning system (GPS) jika memungkinkan), kondisi klinis hewan, umur hewan, spesies dan status vaksinasi (untuk hewan domestik) harus direkam. Informasi-informasi ini harus disimpan bersama dengan sampel. Saat pengambilan sampel pada unggas liar utuk surveilans AIV, sangat penting untuk menggunakan nama sientifik, karena nama hewan lokal dapat hanya diketahui secara regional dan tidak dikenali secara universal. Secara historis, tidak terhitung banyaknya sampel yang dilabeli hanya sebagai ‘itik’, yang membuatnya tidak cukup untuk meningkatkan pemahaman kita tentang biologi virus AIV karena ada banyak sekali spesies itik, dengan habitat, rute migrasi, dan genetik yang sangat bervariasi.
Karena transport sampel diagnostik dapat menjadi sangat sulit dikarenakan baik regulasi pengiriman untuk material yang potensial infeksius dan karena rantai dingin harus dipertahankan, pada situasi bahwa hanya metode molekular (misal rRT-PCR, sekuensing) digunakan, kartu Flinders Technology Associates (FTA) (Whatman-GE Healthcare and Bio-sciences, Pittsburgh, PA) dapat digunakan. Sampel cair mungkin hilang dalam kartu kertas yang dibuat secara khusus ini, dan ketika sampel mengering virus akan mengalami inaktivasi dan RNA akan tersimpan. Kartu kemudian dapat dikirimkan dengan sedikit batasan dalam pengiriman dengan sampel yang mengandung virus hidup. RNA virus avian influenza dapat terawetkan di dalam kartu FTA selama 5 bulan pada suhu lingkungan [1], meskipun sensitivitasnya akan menjadi lebih rendah dibandingkan dengan swab material [1,32,32]. Metode perservasi RNA virus yang tidak membutuhkan rantai dingin adalah dengan koleksi sampel swab kloaka dari unggas liar di dalam etanol 100% untuk skrining dengan rRT-PCR [57]. Meskipun metode ini ditemukan berhasil untuk rRT-PCR, sepasang swab harus dikoleksi di dalam media transfer virus tradisional dan dipertahankan dalam suhu rendah untuk isolasi virus [57], sehingga metode ini tidak cocok digunakan untuk mendapatkan isolat virus. Kekurangan lainnya adalah etanol 100% harus dikirim sebagai bahan kimia mudah terbakar. Media transfer lain yang tersedia secara komersial akan mengaktifasi sampel dalam penyimpanan lama pada suhu lingkungan, tetapi dalam situasi saat ini dimana tidak ada perbandingan terkontrol secara scientifik terhadap sampel-sampel dari unggas, maka produk-produk ini tidak direkomendasikan saat ini.
Deteksi Virus
Deteksi virus untuk mengidentifikasi infeksi aktif dapt dicapai dengan melakukan VI atau menggunakan (ACIA (Tabel 2.1). selain itu, asam nukleat virus dapat ditargetkan dengan tes molekuler (misal rRT-PCR) (Gambar 2.2). Tipikalnya, rRT-PCR atau ACIA digunakan untuk skrining sampel dan kemudian isolasi virus dilakukan untuk mengkonfirmasi hasil pemeriksaan.
Isolasi virus
Standar referensi untuk diagnosa AIV adalah isolasi virus (VI), dan meskipun metode lain dapat digunakan untuk membuat diagnosa praduga, VI sangat penting untuk mengkonfirmasi keberadaan virus pada kasus indeks dan untuk melakukan karakterisasi lebih jauh terhadap virus. Telur ayam berembrio (ECE) dari flok yang bebas dari patogen tertentu (specific pathogen-fee flock) atau flock yang negative terhadap virus IAV atau antibodi IAV dianggap sebagai sistem hospes paling sensitif untuk isolasi baik virus IAV dari unggas maupun mamalia. Sel Madin-Darby canine kidney (MDCK) juga digunakan secara luas dalam isolasi IAV dari spesimen hewan (unggas atau mamalia). Meskipun virus IAV akan bereplikasi dalam jalur sel lain dan telur berembrio dari spesies unggas lain, ECE dan MDCK lebih luas digunakan. Bagaimana pemilihan sistem hospes laboratorium yang paling optimal tergantung pada strain virus. Beberapa galur keturunan virus hanya akan bereplikasi dalam ECE, sedangkan yang lainnya hanya di sel MDCK, dan beberapa bereplikasi dengan baik di kedua sistem.
Kita tidak selalu bisa menyimpulkan sistem mana yang paling baik jika berdasarkan asal spesies sebuah sampel. Sebagai contoh, virus-virus babi atau mirip virus babi, misalnya isolat H3N2, dan virus-virus galur keturunan H1N1 bisa saja tidak tumbuh dengan baik pada ECE, sehingga sel MDCK lebih disukai. Karena kalkun dapat diinfeksi oleh virus influenza babi (SIV), maka sample dari kalkun umumnya diproses untuk VI menggunakan ECE dan sel MDCK [63]. Banyak sel lajur lainnya mendukung replikasi IAV akan tetapi tidak dipakai secara luas.
Terdapat beberapa perbandingan terbatas antara ECE dan sel MDCK yang telah dilaporkan melalui sampel dari hospes yang berbeda. Untuk sampel yang berasal dari unggas liar, sistem ECE tampaknya lebih sensitif dan titer lebih tinggi pada ECE dibandingkan sel MDCK [43, 44], akan tetapi data yang ada kurang jelas untuk sampel yang berasal dari unggas domestik dan mamalia domestik, dan sel MDCK lebih disukai untuk sampel dari babi [81]. ECE dan sel MDCK dipertimbangkan memiliki sensitivitas yang sama untuk sampel dari kuda dan anjing [12, 20], meskipun beberapa isolat dari anjing dapat tumbuh lebih baik pada salah satu sistem [20]. Pada beberapa kasus, kedua metode dapat digunakan. Sebagai contoh, sampel dari kalkun yang diharapkan mengandung influenza babi sering diproses dalam ECE dan sel MDCK pada beberapa laboratorium rujukan.
Perbedaan lainnya antar kedua sistem salah satunya adalah biaya. Sel MDCK lebih murah [43] dan juga telah terobservasi bahwa virus influenza kuda mengalami lebih banyak seleksi pada sel MDCK daripada dari ECE. Hal ini dapat menjadi penting dalam beberapa situasi [29].
Karena tingginya sensitivitas VI, metode ini dapat digunakan untuk mendeteksi IAV dalam tahap infeksi aktif yang mana saja. Tergantung pada faktor-faktor yang berhubungan dengan hospes maupun virus, maka virus dapat dideteksi dalam 24 jam setelah infeksi pada individu unggas, dan untuk beberapa minggu post-eksposur dalam flok, kawanan ataupun populasi hewan [70]. Untuk mencapai sensitivitas optimal pada kedua sistem, mungkin perlu untuk mempasase spesimen secara serial (sering disebut sebagai ‘pasase buta’) dua atau tiga kali, akan tetapi hal ini meningkatkan waktu yang diperlukan untuk menyelesaikan pengujian, dan juga meningkatkan resiko hasil positif palsu karena adanya kontaminasi silang dari sampel.
Meskipun VI sangat sensitif, ia tidak bersifat sangat spesifik ataupun selektif karena ada agen-agen lain yang bisa saja terdapat di dalam spesimen akan tumbuh pada ECE atau sel kultur. Karena alasan inilah, cairan dari ECE atau sel MDCK harus dites tambahan untuk mengkonfirmasi kehadiran virus IAV. Cairan dari telur ataupun sel kultur yang diinokulasi menggunakan material tes biasanya diuji dulu dengan uji hemaglutinasi standar untuk mengetahui hemaglutinasi (HA) [73], atau diuji dengan ACIA untuk virus IAV. Untuk sampel unggas, sampel positif HA sering kali diuji kembali menggunakan uji hambatan hemaglutinasi (HI) atau rRT-PCR untuk membedakan AIV dari virus-virus lain yang dapat menyebabkan hemaglutinasi, seperti avian paramyxovirus 1 (misal Newcastle disease virus) pada spesimen dari unggas.
Keberadaan IAV pada sampel unggas maupun mamalia dapat dikonfirmasi dengan tes spesifik seperti ACIA, agar gel immunodiffusion (AGID) assay untuk antigen IAV, dan rRT-PCR untuk telur yang tidak diencerkan atau cairan sel kultur. Kemungkinan lainnya subtipe isolat bisa diidentifikasi dengan uji HI dan hambatan neuraminidase (NI) atau dengan sekuensing gen. sekuensing gen adalah metode paling akurat untuk mendeteksi subtipe HA dan NA virus IAV, karena reaksi silang dan negatif palsu diasosiasikan dengantes serologis dan RT-PCR.
Meskipun metode kultur sangat sensitif dalam mendeteksi IAV, ada beberapa pertimbangan praktikal yang harus diperhatikan. Pertama, VI relatif mahal, dan pada kasus dimana ECE tidak mudah ditingkat karena pembelian dan inkubasi telur harus dijadwalkan dengan baik dari awal. Kedua, saat melakukan VI virus infeksius dapat diamplifikasi sampai level yang tinggi, sehingga meningkatkan potensi kontaminasi silang antar sampel dan meningkatkan resiko eksposur virus infeksius kepada personel laboratorium. Untuk alasan ini, VI umumnya dilakukan pada laboratorium yang memiliki biosekuriti yang terdepan (misal BSL-3, BSL-3Ag, atau P3), terutama jika diduga bahwa spesimen mengandung HPAI (atau antigen dengan konsekuensi tinggi lain). Isolasi virus juga membutuhkan kemampuak teknis lvel tinggi dalam rangka menjalankan prosedur dan menginterpretasikan hasilnya. Hal ini karena sistem kultur hospes mendukung pertumbuhan banyak organisme yang dapat menambah kompleks
Tabel 2.1 Karakteristik beberapa uji diagnostik terpilih
| Uji | Target | Sensitivitas relatif | Spesifisitas relatif | Biaya relatif per sampel | Waktu sampai keluarnya hasil |
| Isolasi virus (VI) Antigen detection immunoassays (kit komersial) Realt-time RT-PCR Agar gel immunodiffusion (AGID) ELISA (kit komersial) Inhibisi hemaglutinasi (HA) Inhibisi Neuraminidase (NA) | Virus yang viable Protein IAV IAV RNA 1. nukleoprotein dan protein matriks virus influenza tipe A 2. antibodi terhadap nukleoprotein dan protein matriks virus influenza tipe A Antibodi terhadap influenza tipe A 1. Identifikasi subtipe HA 2. Antibodi terhadap subtipe HA secara spesifik 1. Identifikasi subtipe NA 2. Antibodi terhadap subtipe NA secara spesifik | Sangat tinggi Rendah Sangat tinggi Moderat Moderat Tinggi Moderat | Moderat Tinggi Sangat tinggi Tinggi Moderat Moderat sampai tinggi Moderat sampai tinggi | Tinggi Moderat Moderat Moderat Rendah Moderat sampai tinggi Moderat | 1 – 2 minggu 15 menit 3 jam 48 jam 2 – 3 jam 2 jam 3 jam |
(IAV = virus influenza A, RT-PCR = reverse transcriptase polymerase chain reaction)
proses diagnostik, seperti dijelaskan di atas. Ditambah lagi VI tergantung pada handling spesimen yang tepat dan benar. Jika sampel tidak dikoleksi, dikirimkan dan disimpan dengan kondisi yang baik dan tepat maka sampel bisa terdegradasi dan dapat mengandung virion aktif yang dapat menimbulkan hasil negatif palsu. Terakhir, VI membutuhkan waktu pemrosesan yang terlama diantara seluru prosedur uji deteksi IAV. Prosedur VI dapat mendeteksi virus dalam waktu 48 jam, akan tetapi untuk sampel negatif prosedur dapat memakan waktu 1 psampai 2 minggu untuk diselesaikan, tergantung pada jumlah pasase yang dilakukan dan kecepatan pertumbuhan virus untuk menghasilkan jumlah titer yang cukup tinggi untuk menjadikannya terdeteksi melalui uji HA ataupun metode lainnya.
Dan terakhir, ada beberapa situasi dimana VI lebih disukai dibandingkan metode lainnya, seperti misalnya penting untuk mengetahui apakah virus yang viable masih ada (misalnya saat mengkonfirmasi bahwa proses pembersihan dan desinfekasi berhasil menginaktivasi seluruh virus yang ada), atau saat diperlukan untuk mengevaluasi karakteristik antigenik dari isolat (misalnya untuk mengungkap adanya antigenik drift). Isolasi virus juga akan tetap menjadi senjata diagnostik utama karena isolat akan selalu diperlukan untuk mengetahui karakteristik biologi.
Antigen capture immunoassays (ACIAs)
Banyak kit ACIA komersial yang ditujukan untuk pemeriksaan influenza tipe A. Format lateral flow device (LFD) dan enzyme-linked immunosorbent assay (ELISA) tersedia, akan tetapi perizinan pemakaian bidang veteriner bervariasi antar negara. Sebelum ada kit yang dilisensikan untuk penggunaan bidang veteriner di Amerika Serikat dan lainnya, kit yang digunakan untuk uji pada manusia, seperti Directigen Flu A test, Becton-Dickenson, Franklin Lakes, NJ) telah digunakan dengan sukses untuk unggas dan spesies lain [11, 28, 80]. Selama kurun waktu terakhir beberapa kit telah dilisensikan untuk digunakan pada negara-negara yang berbeda di seluruh dunia.
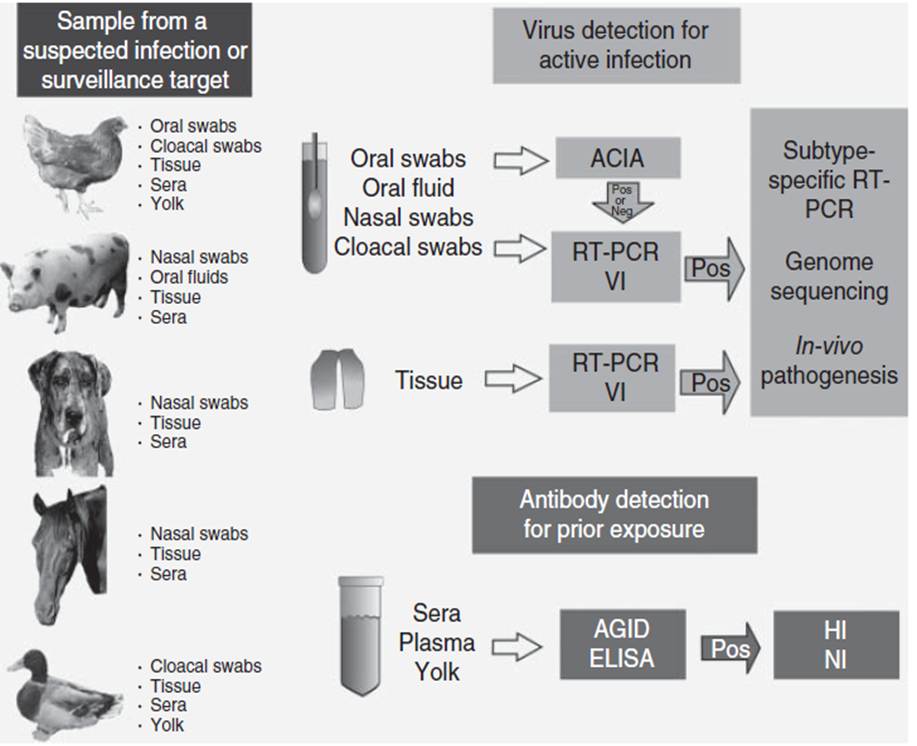
Gambar 2.2 Garis besar pendekatan umum pengujian diagnostik terhadap virus influenza A (IAV). Infeksi virus aktif dapat dideteksi dari material swab, cairan oral, atau jaringan dengan antigen capture immunoassay (ACIA), yang perlu dikonfirmasi dengan reverse trascriptase polymerase chain reaction (RT_PCR) atau isolasi virus (VI), atau dapat langsung dites secara langsung dengan RT-PCR atau VI. Sampel dan isolat positif lebih lanjut ditandai dengan RT-PCR pendeteksi subtipe-spesifik dan atau sekuens genome dan pada beberapa kasus, studi patogenesis in-vivo. Eksposur terhadap virus AIV dapat dievaluasi melalui deteksi antibodi dengan agar gel immunodiffusion (AGID) atau enzyme-linked immunoasorbent assay (ELISA). Spesifisitas subtipe pada sampel positif dapat ditentukan dengan uji inhibisi hemaglutinin (HI) atau inhibisi neuraminidase (NI).
Format LFD menggunakan antibodi monoklonal yang ditujukan terhadap highly-conserved nucleoprotein IAV untuk mengikat antigen virus didalam strip filter atau membran. Hasilnya dapat divisualisasikan dengan kemunculan garis atau pola pada test strip atau membran setelah terjadi reaksi immunokemikal kromatografik. Disebabkan karena meningkatnya minat tehadap virus H5N1 Asia, test H5 komersial telah dikembangkan, dan beberapa uji yang mirip juga akan dapat tersedia, akan tetapi laporan dari lapangan mengindikasikan bahwa sensitivitas dan spesifisitas nya tidak tinggi. Pengembangan uji deteksi antigen subtipe spesifik sulit karena antibodi monoklonal yang digunakan untuk uji-uji ini harus diarahkan terhadap antigen HA yang bervariasi, hal ini menjadikannya kurang dapat diandalkan daripada uji IAV spesifik.
Batasan utama dari kit deteksi antigen adalah sensitifitasnya yang rendah. Sebagian besar kit memiliki sensitivitas analitik sebesar rata-rata 104 sampai 105 dosis infeksi embrio (EID50) [11, 80]. Karena unggas yang menunjukkan gejala klinis atau yang mati karena infeksi AIV lebih mungkin melepaskan virus dengan level yang lebih tinggi, unggas-unggas inilah yang lebih tepat ditargetkan untuk di tes. Meskipun unggas yang terlihat sehat secara klini sebenarnya telah terinfeksi dan telah melepaskan virus dalam jumlah yang cukup untuk apat terdeteksi melalui uji, kemungkinan munculnya hasil negatif palsu cukup tinggi. Hl ini menyebabkan testing rutin unggas yang kelihatan sehat tidak direkomendasikan. Selain itu juga harus diketahui bahwa unggas yang sakit dan mati dapat melepaskan virus dalam titer yang tidak mencukupi untuk dapat dideteksi dengan uji ACIA (Spackman, data yang tidak dipublikasikan).
Pendekatan surveilans yang efektif untuk AIV sebelumnya dilaksanakan untuk penyidikan wabah LPAIV H7N2 tahun 2002 di Amerika Serikat. Pendekatan ini menggunakan sampling 10 ekor unggas secara perodik yang diambil dari unggas yang mati per harinya pada peternakan ayam dan kalkun yang terdapat di dalam zona surveilans dalam rangka mengidentifikasi flok yang terinfeksi [22]. Penggunakan target mortalitas per hari telah menjadi pendekatan standar dalam pelaksanaan surveilans beberapa penyakit pernafasan unggas di Amerika Serikat. Hasil positif yang ditunjukkan melalui uji ACIA berkorelasi baik dengan hasil dari uji-uji lainnya, akan tetapi hasil negatif dari ACIA tidak dapat diandalkan dan memerlukan konfirmasi lanjutan dari tes berikutnya.
Keuntungan UJI ACIA adalah bahwa uji ini sangat cepat, hasil keluar dalam waktu 15-20 menit, dan sangat spesifik. Selanjutnya, uji deteksi antigen komersial mudah digunakan secara mandiri. Karena itulah uji ini ideal untuk digunakan di peternakan sebagai uji kandang. Tes deteksi antigen juga digunakan pada laboratorium diagnostik sebagai uji screening spesimen klinis IAV, dan untuk mengindetifikasi isolat suspek IAV dalam material dimana titer virus cenderung memadai untuk deteksi menggunakan ACIA. Biaya uji per sampel menggunakan uji deteksi antigen komersial bervariasi tergantung perusahaan pembuatnya, akan tetapi lebih murah dibanding VIA dan sama dengan rRT-PCR. Harus dicatat bahwa kisaran tipe sampel yang dapat digunakan untuk uji ACIA itu terbatas. Sebagian besar uji ini hanya dapat menguji spesimen swab trakea, nasal, atau oropharing. Uji ini tidak tergantung spesies, akan tetapi hanya ada sedikit data yang tersedia untuk mendukung kehandalannya dalam menguji spesimen dari spesies-spesies yang tidak ada di dalam daftar yang tertera di label, dan hasil negatif harus disingkapi dengan hati-hati.
Uji-uji molecular/berbasis asam nukleat
Pada tahun-tahun belakangan ini penggunaan metode molekuler dalam mendeteksi asam nukleat virus telah menjadi sarana penting dalam mendeteksi IAC dan identifikasi subtipe HA dan neuraminidase (NA). Uji-uji berbasis RT-PCR adalah metode molekuler yang digunakan secara luas, terutama real-time RT-PECR. Metode amplifikasi alternatif juga tersedia, seperti nucleic acid sequence-based amplification (NASBA), dan metode isotermik untuk mengamplifikasikan asam nukleat [14-16, 42], loop-mediated isothermal amplification (LAMP) [6], dan insulated isothermal PCR (iiPCR) [5]. Meskipun NASBA dan LAMP serupa sensitivitasnya dengan rRT-PCR, metode ini tidak diadopsi secara luas seperti rRT-PCR, dan iiPCR terlalu baru sehingga sulit diprediksi apakah dia akan digunakan secara luas nantinya. Kit NASBA, LAMP dan iiPCR komersial tersedia untuk IAV dan subtipe-subtipe (HPAIV H5, A (H1N1)pdm09). Laporan uji LAMP tersedia dari website OFFLU (www.offlu.net); akan tetapi data validasi lengkap belum dipublikasikan.
Banyak uji rRT-PCR dan RT-PCR konvensional yang telah dilaporkan digunakan untuk deteksi IAV pada unggas, babi, anjing dan kuda [27, 37, 39, 40, 53, 54, 66, 68]. Uji RT-PCR telah dilaporkan mendeteksi subtipe-subtipe HA penting, yaitu H1, H1 A (H1N1)pdm09-spesifik, H2, H5 dan H7 [13, 45, 65] dan N1 atau N2 [74]. Virus HPAIV H5N1 Asia yang baru tampaknya menjadi target utama, dengan banyaknya laporan uji subtipe spesifik HA dan NA [24, 51, 79], meskpun hanya sedikit hasil uji yang tervalidasi secara lapangan. Prosedur pengujian yang dikelola oleh pemerintah dan jaringan dan organisasi internasional (misal OIE, USDA) seringkali adalah yang paling dapat diandalkan, karena mereka melakukan monitoring performa berkelanjutan terhadap galur keturunan IAV baru (misalnya A(H1N1)pdm09, A(H7N9), galur LPAIV tahun 2013 dari China), dan cepat diperbaharui dengan validasi yang diperlukan. Kit tes RT-PCR berizin dari USDA tersedia untuk deteksi influenza unggas dan babi di Amerika Serikat, dan beberapa tersedia di negara lainnya. Uji komersial dari perusahaan lokal juga tersedia di China dan Rusia, tetapi tidak jelas sensitivitas dan spesifisitasnya. Tersedianya tes komersial memjadikan mekanisme ketersediaan reagen standar, kontrol positif internal, dan kontrol kualitas reagen menjadi hilang. Kerugian penggunaan kita-untuk-semua adalah biaya yang lebih tinggi per uji nya dan sekuens primer dan probenya memiliki hak paten, sehingga analisis spesifisitas in-silico tidak dapat dilakukan oleh pengguna.
Metode molekular menawarkan banyak keuntungan untuk mendeteksi IAV. Diantaranya sensitivitas yang tinggi yang sama dengan VI [3, 11, 52, 65], spesifisitas yang tinggi, skala yang besar, kemampuan untuk mengakomodasi jenis sampel apapun dengan prosesing sampel yang tepat dan minimalisasi kontak dengan bahan-bahan infeksius karena virus telah diinaktivasi pada tahap awal prosesing sampel. Real-time RT-PCR yang lebih digunakan secara luas dibandingkan RT-PCR konvensional menawarkan keuntungan tambahan. Pertama, uji ini adalah salat satu uji molekular tercepat yang tersedia, hasil tersedia dalam waktu kurang dari 3 jam. Kedua, uji ini bersifat lebih spesifik jika dibandingkan dengan RT-PCR konvesional jika digunakan dengan probe hibridisasi. Ketiga, potensi kontaminasi silang berkurang karena sampel tidak dimanipulasi lagi setelah amplifikasi.
Kerugian utama baik metode rRT-PCR ataupun RT-PCR konvensional adalah biaya tinggi pembelian alat pada awalnya, yang telah menghalangi laboratorium-laboratorium kecil untuk menggunakan teknologi ini. Reagen rRT-PCR juga sangat mahal, dan meskipun RT-PCR lebih murah daripada isolasi virus, biayanya tetap tinggi, yang menjadi penghalang kegiatan surveilans. Reagennya memerlukan pendinginan, yang menjadi masalah pengujian di wilayan terpencil. Pengembangan reagen kering-beku untuk rRT-PCR telah diusahakan, tetapi jika dibandingkan dengan RT-PCR konvensional biaya reagen lebih mahal dan sensitivitasnya seringkali rendah [17, 75]. Biaya rRT-PCR juga mempengaruhi prosesing sampel (ekstraksi RNA), karena hal ini menambah biaya material dan biaya tenaga kerja. Kerugian rRT-PCR lainnya adalah akurasi identifikasi subtipe yang rendah karena tingginya variasi sekuens HA dan NA. Hasil positif palsu yang disebabkan reaksi silang dengan subtipe lain dan hasil negatif palsu juga telah teramati, dengan tingkat keakuratan secara keseluruhan dilaporkan sebesar 49,5% [62].
Sensitivitas RT-PCR yang tinggi memang meningkatkan resiko positif palsu karena juga mendeteksi kontaminasi silang level rendah. Sebaliknya berkurangnya sensitivitas dapat terjadi pada RT-PCR dikarenakan hambatan pada tipe sampel jika tidak diproses dengan baik dan tepat. Kedua resiko ini dapat dikelola dengan kontrol yang tepat, salah satunya kontrol ekstraksi RNA tidak bertemplate untuk menguji kontaminasi silang dan kontrol internal positif [17, 19], dan kontrol ekstraksi positif untuk memverifikasi ketiadaan inhibitor.
Metode Serologis
Deteksi antibodi adalah metode yang umum dan relatif murah untuk mendeteksi eksposur virus IAV terhadap hewan. Banyak format pengujian yang digunakan dalam deteksi antibodi IAV, seperti uji AGID, uji HI, dan Elisa. Diantara ketiga uji tersebut uji HI adalah satu-satunya format uji kuantitatif absolut.
Uji serologis dapat dilakukan dengan sera, plasma dan kuning telur dari spesies unggas, dan sera yang dielusi dari darah yang disimpan dalam kertar filter (misalnya strip Nobuto) [21]. Seperti halnya semua metode diagnostik, kondisi pengiriman sampel yang tepat sangat penting agar hasil akurat bisa didapatkan. Dengan pengecualian untuk darah yang disimpan pada kertas filter penyimpan, sampel harus disimpan dalam keadaan dingin, dan meskipun antibodi lebih tahan terhadap siklus beku-cair dibandingkan dengan virus hidup, pembekuan dan thawing sampel harus diminimalisir.
Salah satu guna utama dari uji antibodi unggas adalah untuk mendukung perdagangan, untuk mensertifikasi flok ataupun produk unggas bebas dari ekposure terhadap virus AIV. Untuk alasan inilah, uji antobodi dilakukan pada jutaan sampel per tahun pada unggas dari Amerika Serikat. Pengujian antibodi pada spesies mamalia dapat digunakan untuk mengevaluasi eksposur terhadap IAV atau respos tubuh hewan terhadap vaksinasi.
ELISA
ELISA yang digunakan untuk deteksi antibodi influenza A telah lama digunakan dan banyak metode ELISA untuk spesies yang berbeda (misal unggas, babi dan kuda) telah tersedia secara komersial. Sebagian besar test IAV mentargetkan antibodi nukleoprotein yang diproduksi pada awal infeksi, dan meskipun uji-uji ini dapat diandalkan untuk mengidentifikasi flok yang terinfeksi, uji ELISA tidak dapat digunakan untuk mengukur level antibodi protektif, karena antibodi nucleoproteinnya tidak dinetalisir. Meskipun baik format tidak langsung (sandwich) atupun blocking telah digunakan, penggunaan format blocking lebih luas, karena ELISA tidak spesifik untuk satu spesies, dan karena itulah dapat digunakan untuk melakukan surveilans banyak spesies unggas dan mamalia (meskipun data performa hanya tersedia untuk sejumlah spesies).
ELISA adalah format uji cepat dan mudah digunakan. Meskipun uji komersial lebih mahal dibandingkan dengan uji produksi rumahan, kontrol kualitas dan produksi reagen dilakukan oleh perusahaan pembuatnya. Biaya bahan ELISA komersial per sampel adalah 2 kali lipat biaya bahan pengujian AGID. Jumlah alat dan komponen terspesialiasi yang diperlukan minimal. Alat optical microtiter plate reader dibutuhkan untuk mengevaluasi hasil uji. Akan tetapi banyak laboratorium yang melakukan ELISA secara rutin juga memiliki palte washer otomatis dan bahwa liquid handling station untuk melarutkan sampel. Untuk deteksi antibodi AIV, hasil uji ELISA perlu dikonfirmasi dengan uji AGID atau HI untuk H5 atau H7, dan saat ini hanya satu ELISA antibodi AIV yang telah disertifikasi oleh OIE.
ELISA komersial yang dapat mendeteksi spesifik subtipe virus telah tersedia untuk H1, flu babi H3, subtipe H5 HA, dan subtipe N1 dan N2. Meskipun spesifisitasnya kurang dapat diandalkan jika dibandingkan dengan uji yang mentargetkan antibodi influenza tipe A, karena variasi protein HA. Jika diperlukan ELISA subtipe-spesifik, apakah dalam memilih tes komersial atau prosedur yang telah dilaporkan dalam literatur, sangat penting untuk meyakinkan bahwa terdapat verifikasi dan validasi data yang cukup untuk target spesies dan subtipenya.
Agar gel immunodiffusion (AGID)
Uji AGID telah digunakan sejak tahun 1970 untuk mendeteksi antibodi terhadap IAV [7]. Prinsip AGID adalah dengan memvisualisasikan reaksi immunopresipitasi dari antibodi dan antigen AIV setelah proses diffusi kedalam matriks agar. Meskipun AGID lebih mungkin digunakan untuk mendeteksi antigen influenza tipe A (misalnya untuk mengkonfirmasi keberadaan IAV pada cairan ECE atau supernatan kultur sel).
Uji AGID tidak mahal, sederhana, dan tidak memerlukan peralatan mahal dan suplai bahan diluar kebiasaan. Meskipun begitu, persiapan antigen dan sera kontrol dengan kualitas yang baik dan tepat membutuhkan biaya mahal dan menghabiskan banyak waktu. Untuk alasan ini, banyak laboratorium memakai antigen dan sera kontrol yang diproduksi oleh laboratorium rujukan, atau yang tersedia secara komersial. AGID membutuhkan kemampuan laboran sedang dan pelatihan interpretasi hasil uji. Hasil dapat tersedia untuk dibaca dalam waktu 24 jam, akan tetapi dapat memakan waktu sampai 48 jam bagi reaksi positif lemah untuk muncul.
Uji AGID memiliki sensitivitas moderat dan dapat mendeteksi antibodi post infeksi lebih dahulu dibandingkan dengan uji deteksi antibodi yang lain karena bereakai dengan IgM. Antibodi dapat dideteksi sekurang-kurangnya dalam 5 hari post infeksi, dan dapat dideteksi selama beberapa minggu atau bulan setelah infeksi [73], meskipun durasi dan respons antibodi dipengaruhi oleh tubuh hospes dan strain virus. Uji AGID cocok digunakan untuk sampel serum, plasma dan kuning telur [8]. Akan tetapi hasil AGID tidak konsisten untuk serum dari beberapa spesies unggas dan mamalia [20, 59, 71].
Uji Hambatan Hemaglutinasi [HI]
Uji HI dapat digunakan sebagai uji konfirmasi keberadaan IAV subtipe spesifik di dalam cairan telur atau supernatan kultur sel yang terhemaglutinasi, untuk dapat mengenali lebih jauh isolat IAV dengan mengidentifikasikan subtipe HA nya, atau untuk mengidentifikasi antibodi IAV spesifik subtipe dalam serum, plasma ataupun kuning telur [76].
Isolat suspek diidentifikasi dengan uji JI menggunakan panel antisera spesifik subtipe yang mewakili masing-masing subtipe HA. Karna reaksi positif palsu dapat disebabkan oleh penghambatan sterik saat reagen referensi dan bahan uji memiliki subtipe NA yang sama (tetapi subtipe HA-nya berbeda) [58], lebih dari satu serum referensi per satu subtipe HA seringkali diperlukan untuk meyakinkan spesifitas yang mencukup. Masalah yang ditimbulkan oleh penghambatan sterik ini dapat diatasi dengan penggunaan antisera disiapkan dengan vaksin DNA yang mengandung gen HA saja [38]. Sebagai tambahan, beberapa reaksi silang dapat terjadi antar subtipe HA dan hal ini menyebabkan hasil lebih sulit diinterpretasikan. Karena itulah spesifisitas uji HI sangat tergantung dengan kualitas reagen referensinya.
HI merupakan prosedur spesifik untuk isolasi virus AIV. Akan tetapi sejarahnya uji HI telah digunakan untuk meyakinkan ketiadaan virus avian paramyxovirus tipe 1 (APMV-1, juga dikenal sebagai virus ND) didalam bahan uji dengan melakukan uji inhibisi terhadap antibodi spesifik APMV-1. Hasil uji HI negatif dengan antiserum APMV-1 mengindikasikan bahwa APMV-1 tidak terdapat di dalam spesimen dan itu berarti spesimen itu suspek AIV.
Sebaliknya, uji HI dapat digunakan untuk mengidentifikasi subtipe HA dari antibodi AIV dalam spesiemen dengan menggunakan virus yang telah diketahui subtipenya sebagai antigen dalam pengujian. Panel yang mengandung keenam belas subtipe HA diperlukan untuk mengevaluasi seluruh subtipe yang mungkin, dan hasilnya harus diinterpretasikan dengan hati-hati dengan adanya kemungkinan reaksi silang, terutama pada sampel yang berasal dari unggas liar dimana hewan tersebut mungkin telah terekspos virus-virus dengan subtipe berbeda selama hidupnya.
Sensitivitas umumnya tidak menjadi perhatian khusus saat uji HI digunakan untuk mengidentifikasi isolat subtipe IAV karena uji ini digunakan dengan virus yang telah diamplifikasi (sebaliknya pada spesimen klinik, dimana konsentrasi virus mungkin rendah). Akan tetapi, sensitivitas uji HI untuk deteksi antibodi lebih diperhatikan. Berkurangnya sensitivitas dpat terjadi saat antigenik drift terjadi secara signifikan dalam sebuah subtipe, menyebabkan rendahnya reaktivitas antara antigen yang digunakan dalam uji HI dan antibodi yang ditemukan dalam serum yang diuji. Terlepas dari kekhawatiran ini, uji HI masih dianggap lebih sensitif dibandingkan AGID [41], dan akan mendeteksi antibodi terhadap AIV dalam jangka waktu lama post eskposure dibandingkan AGID. Uji HI juga tidak spesifik spesies.
Dari segi paktikal Uji HI ini cukup mahal dan membutuhkan tenaga ekstra saat digunakan untuk mengidentifikasi isolat atau saat digunakan sebagai uji screening untuk mendeteksi antibodi, disebabkan banyaknya jumlah antigen atau antisera yang dibutuhkan untuk mendeteksi keseluruhan 16 subtipe HA. Akan tetapi, keuntungan uji ini adalah cepat (hasil tersedia dalam waktu beberapa jam), sederhana, dan hanya membutuhkan kemampuan sedang untuk menginterpretasikan hasilnya. Uji HI dapat berguna untuk beberapa aplikasi spesifik. Sebagai contoh, untuk tujuan perdagangan beberapa negara mewajibkan pengujian HI untuk subtipe H5 dan H7, dan sewaktu terjadinya wabah saat subtipe HA target telah diketahui uji HI dapat digunakan lebih efisien karena menargetkan antigen spesifik. Keuntungan terbesar dari uji HI adalah bahwa antigen inaktif dapat digunakan, menghilangkan perlunya langkah biosekuriti dan biosafety spesial untuk laboratorium.
Uji Hambatan Neurominidase (NI)
Uji inhibisi/hambatan nuraminidase dapat digunakan untuk mendeteksi antibodi spesifik subtipe NA atau untuk mengidentifikasi subtipe NA dalam isolat. Prinsip uji NI adalah penghambatan aktivitas enzimatik neuraminidase dengan antibodi subtipe spesifik [4]. Untuk karakterisasi isolat-isolat baru, sebuah panel referensi antibodi yang berisikan kesembilan subtipe NA diperlukan untuk menjalankan uji NI. Uji ini memanfaatkan reaksi kolorimetrik (warna) yang tidak terjadi saat aktivitas neuraminidase diblokir, mengindikasikan adanya kecocokan antara antibodi dan subtipe virus yang diuji. Seperti pada uji HI, sensitivitas bukanlah karakteristik kritikal dari uji NI, karena isola virus yang digunakan, bukan sampel klinis. Spesifisitas uji NI bersifat moderat dan tergantung pada sera rujukan atau antigen yang digunakan [78].
Uji NI standar yang ada sekarang yaitu uji NI thiobarbituric acid (TBA) lebih kompleks daripada uji N. meskipun prosedurnya dapat selesai dalam waktu beberapa jam, uji ini biasanya dilakukan pada laboratorium rujukan karena substrat yang digunakan untuk pengujian berharga mahal dan bahan kimia yang digunakan berbahaya. Pengujian bisa dilakukan dengan format mikrotiter 96 sumuran atau di dalam tabung. Pengujian menggunakan microtiter membutuhkan piringan khusus berwarna putih untuk membuatnya lebih mudah membedakan perbedaan warna. Metode alternatif untuk deteksi antibodi NI yaitu enzyme-linked lectin assay (ELLA) [36], telah sering dipergunakan baru-baru ini [9, 34, 77]. Biaya ELLA lebih murah dan menggunakan reagen yang lebih aman dibandingkan uji TBA.
Karakterisasi Isolat Influenza
Setelah satu IAV diisolasi maka virus itu akan dapat dikarakterisasikan secara genetik dan biologik bila diperlukan. Jumlah karakterisasi yang diperlukan tergantung keadaan. Misalnya isolat subtipe yang tidak biasa untuk salah atu spesies, atau dari spesies yang tidak secara normalnya tidak terkait dengan infeksi influenza, akan memiliki prioritas yang lebih tinggi. Isolat dari diagnostik rutin (misalnya isolasi virus H3 dari babi) kecil kemungkinannya untuk dikarakterisasikan.
Karena rendahnya biaya sekuensing dan teknologinya yang terus berkembang, telah sangat umum untuk memproduksi sekuensing HA dan NA sebagai penanda minimum, dan bahkan sekuensing genom secara pebih juga diproduksi. Sekuensing adalah cara paling akurat untuk identifikasi subtipe HA dan NA. Sekuensing parsial situs pembelahan HA mulai menggantikan uji in-vivo, seperti intravenous pathogenicity index (IVPI), dalam mengindentifikasi keberadaan situs pembelahan beberapa asam amino dasar dan untuk mengklasifikasikan patotipe AIV. Daftar situs pembelahan molekul HA yang telah terdeteksi sampai saat ini untuk virus-virus avian influenza H5 dan H7 berpatogenitas tinggi dan rendah teus di perbaharui secara reguler dan tersedia untuk diakses di website OFFLU (www.offlu.net/fileadmin/home/en/resource-centre/pdf/Influenza_A_Cleavage_Sites.pdf). Untuk kasus index AIV, terutama virus H5 dan H7, uji in-vivo (misal IVPI) harus dilakukan untuk konfirmasi patotipenya.
Untuk semua IAV, sekuens gen dapat digunakan sebagai dasar analisa filogenetik yang memberikan informasi tentang isolat yang berkerabat dekat jika datanya tersedia, dan dapat memberikan informasi epidemiologik berharga. Seiring bertambahnya marker molekuler penanda virulensi dan kisaran hospes telah diindentifikasi dalam literatur, sifat-sifat biologiknya berpotensi untuk dapat diketahui. Influenza Research Database (www.fludb.org) [67] dan GISAID-EpiFlu database (http://platform.gisaid.org), memuat hasil sekuensing yang dimasukkan ke dalam database publik. Database ini memberikan daftar beranotasi sifat-sifat biologis berdasarkan informasi tentang spesies hospes yang telah dipublikasikan. Karakteristik lainnya dapat memuat studi patogenesis pada hospes asal atau spesies model untuk mengevaluasi kisaran hospes potensial atau karakteristik transmisi. Studi receptor-biding juga telah makin umum dilakukan.
Pendidikan dan Pelatihan
Peranan peternak, pemilik atau penjaga hewan dalam mendeteksi infeksi IAV pada hewan domestik tidak boleh dikesampingkan, karena pengenalan penyakit oleh mereka akan menginisiasi keseluruhan proses diagnostik. Karena itulah perlunya edukasi bagi mereka untuk dapat mendeteksi sejak dari awal infeksi, karena gejala klinis influenza bisa tidak kentara dan non spesifik (misal LPAI kadang pertama kali dikenali pada ayam dan kalkun karena berkurangnya konsumsi pakan dan air). Selain penjelasan tentang gejala klinis, edukasi dan pelatihan harus memuat penjelasan mengapa mendiagnosa penyakit influenza sangat penting, dan juga memberi gambaran bagaiman dan kapan harus meningkatkan biosekuriti, dan juga langkah-langkah biosafety yang tepat yang harus diimplementasikan.
Kesimpulan
Salah satu dari aspek kritikal dalam implementasi diagnostik dan uji deteksi untuk semua penyakit adalah sesuai dengan tujuannya. Aspek praktikal dari pengujian adalah sama pentingnya dengan performa analitisnya. Sebuah tes seperti rRT-PCR bisa saja memiliki sensitivitas dan spesifisitas yang superior, akan tetapi kecepatan uji dan kemudahan portabilitas kit pengujian ACIA menjadikannya ideal untuk pengujian langsung di peternakan, sementara rRT-PCR harus dilakukan di laboratorium karena memerlukan pemrosesan sampel. Sangat penting juga untuk menentukan tujuan dan hasil akhir yang diinginkan dari pengujian. Misalnya, surveilans aktif akan membutuhkan kepentingan diagnostik yang berbeda dengan surveilans yang dilakukan selama wabah/wabah. Pertanyaan lain yang perlu ditangani adalah tindakan apa yang harus dilakukan jika didapatkan hasil positif, dan konsekuensi hasil negatif palsu atau positif palsu. Dan terakhir, pedoman pengaturan harus diperhatikan pada saat mengimplementasikan diagnosa IAV, karena hal ini akan menentukan pengujian mana yang dapat digunakan dan bagaimana wabah/wabah atau kasus akan ditangani.
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

