Oleh David. E. Swayne
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Produksi dan perdagangan global kuda, babi, unggas dan produknya
Produksi dan perdagangan
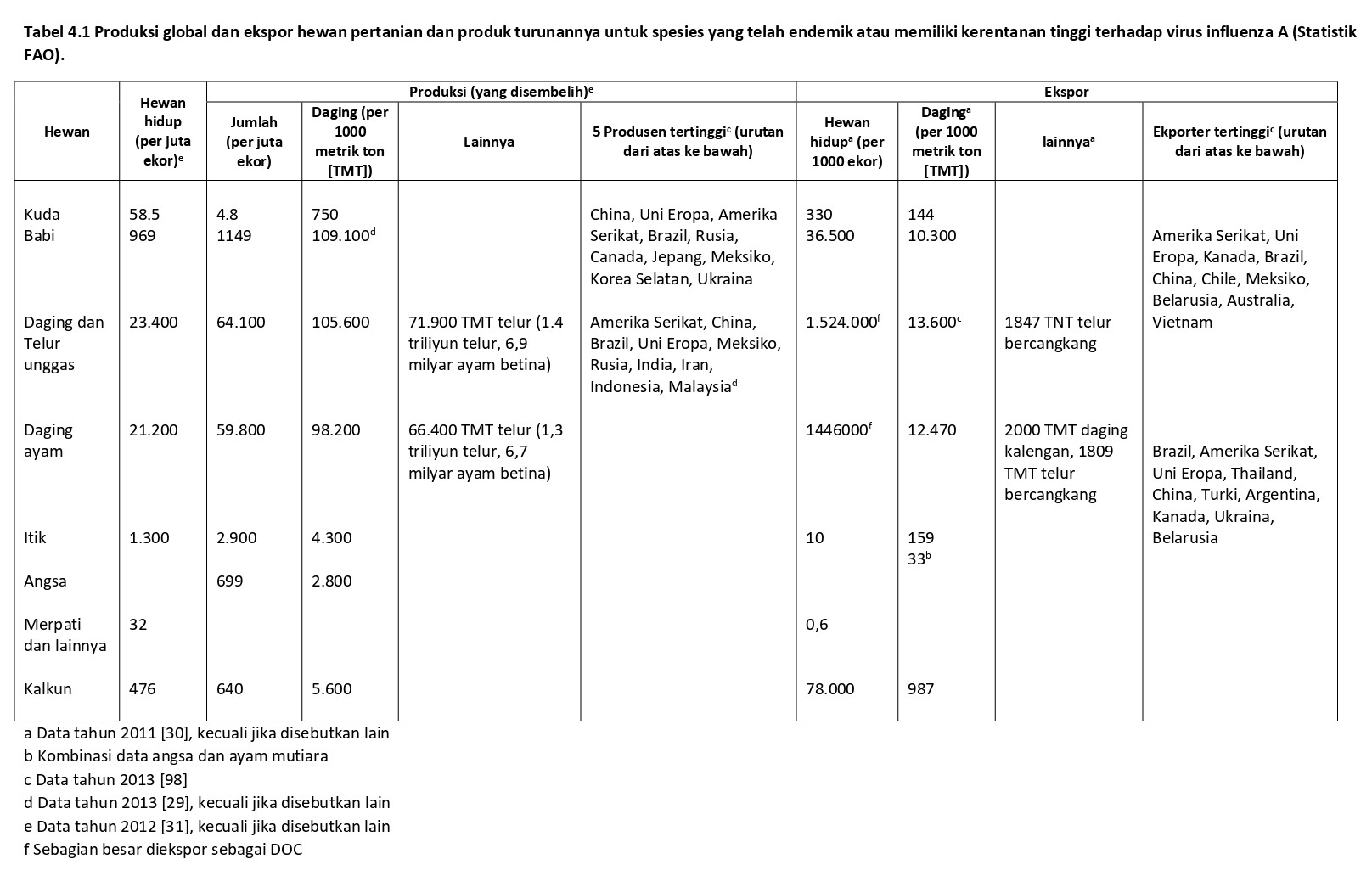
Unggas dan babi merupakan hewan ternak yang paling sering dipelihara, dan dalam skala global, merekala sumber protein untuk manusia dalam bentuk daging dan juga telur khusus untuk unggas (Tabel 4.1) [29-31, 98). Sebagian besar protein hewani diproduksi dan dikonsumsi secara domestik, akan tetapi 9,4% dari daging babi, 13,4% dari daging unggas, dan 2,6% dari telur didistrubusikan melalui perdagangan global. Daging babi adalah sumber konsumsi protein hewani nomor satu dalam diet manusia (109.100 juta metrik ton [thousand metric tons/TMT]), akan tetapi juga daging unggas (98.800 TMT) dan telur (159.200 TMT) digabungkan, ayam adalah penyumbang protein hewani terbesar (Tabel 4.1) [31]. Perdagangan hewan hidup lebih sedikit dibandingkan perdagangan produk daging. Akan tetapi, perdagangan unggas hidup dalam jumlah besar tampaknya adalah perdagangan day-old chick (DOC), dengan jumlah 1,4 milyar yang diekspor per tahunnya. Produsen utama dan ekspoter babi, unggas, dan produk-produknya adalah Brazil, Amerika Serikat, Uni Eropa (EU), dan China (Tabel 4.1). Sebagai perbandingan, perdagangan kuda sangat-sangat rendah, dan melibatkan hewan hidup, dengan persentasi terkait perdagangan daging kuda sangat-sangat kecil.
Spesies unggas utama yang dipelihara adalah ayam, akan tetapi kalkun, itik, angsa, puyuh jepang, ayam mutiara, dan berbagai spesies langka lainnya juga dipelihara dalam jumlah yang cukup signifikan, tergantung pada kultur dan budaya setempat, sistem produksi nasional dan pasar yang tersedia. Di negara-negara berkembang, sebagian besar produksi dan konsumsi dilakukan melalui peternakan komersial terintegrasi dan distribusi rantai dingin. Sebagai tambahan, ada sedikit kontribusi dari unggas yang dipelihara di pedesaan (village), organik, dan sistem pemasaran ungas hidup yang mensuplai konsumen dengan preferensi produk khusus seperti unggas hidup atau unggas yang baru disembelih. Sebaliknya, di banyak negara-negara berkembang sektor produksi unggas komersial terintegrasi dengan distribusi rantai dingin berskala lebih kecil. Sebagian besar unggas dipelihara di pedesaan atau sektor semi-komersil, dan pasar unggas hidup mensuplai populasi lokal dengan daging dan telur.
Standar untuk perdagangan yang aman
Virus Influenza A (IAV) menginfeksi dan menyebabkan penyakit pada hewan pertanian, terutama kuda, babi, dan berbagai macam unggas. Sebagai hasilnya, IAV berdampak pada perdagangan global hewan hidup dan produknya, meliputi daging, produk daging, telur, bulu, kulit, jeroan, lemak, dan produk-produk lainnya.
Produksi dan sistem distribusi domestik sangat kritikal sebagai upaya untuk memenuhi permintaan konsumen kuliner, demikian juga mensuplai pasar global dengan produk-produk lainnya, seperti hewan hidup, telur tetas, makanan hewan peliharaan, jeroan, lemak dan serat (misalnya bulu). Sistem-sistem ini meliputi tidak hanya produksi hewan pertanian yang bergarha secara ekonomi, akan tetapi juga berkontribusi kepada kontrol penyakit hewan dan pencegahan penyebaran penyakit. Hal ini dicapai dengan mengimplementasikan standar kebersiahan dan program pengendalian penyakit yang efektif. Dibawah kesepahaman aplikasi penatalaksanaan sanitasi dan pitosanitasi (SPS Agreement) dari World Trade Organization (WTO), Organisasi Kesehatan Hewan Dunia (OIE) diakui sebagai organisasi standar internasional untuk kesehatan hewan dan zoonosis oleh WTO. OIE menetapkan standar sanitasi berbasis sains untuk pencegahan penyakit melalui perdagangan internasional pada hewan darat dan produk-produknya [61]. Hal ini telah dicapai melalui pengembangan dan peninjauan standar yang sudah ada oleh komisi khusus, diikuti dengan diadopsinya standar-standar oleh delegasi OIE, yang merupakan kepala otoritas veteriner dari 180 negara anggota. Upaya-upaya ini penting untuk meyakinkan terjaganya kesehatan hewan dan kesehatan masyarakat sebagai akibat dari perdagangan internasional, juga untuk mencegah perdagangan yang tidak fair [106]. Aturan-aturan terkait perdagangan ditentukan oleh setiap otoritas nasional, dengan mengambil dasar standar internasional yang diadopsi oleh masing-masing negara. Akan tetapi, WTO memiliki mekanisme untuk menyelesaikan konflik untuk partner dagang yang tidak menyetujui persyaratan perdagangan yang sesuai dengan standar OIE [106]. OIE Terrestrial Animal Code memberikan standar sanitasi untuk kesehatan hewan dan keamanan pangan untuk perdagangan internasional.
Highly-pathogenicity avian influenza (HPAI), H5/H7 low-pathogenicity avian influenza (LPAI), dan influenza kuda adalah penyakit yang termasuk dalam daftar OIE dimana diharuskan melakukan pelaporan [59, 61]. Seluruh penyakit ini memiliki bagian tersendiri dalam Terrestrial Animal Health Code yang khusus membahas rekomendasi status kesehatan hewan dan perdagangan hewan [61], juga rekomendasi vaksin tes diagnostik dan vaksin dalam Manual of Diagnostic Tests and Vaccines for Terrestrial Animals [59, 61]. Avian influenza, yang sebelumnya disebut ‘notifiable animal influeza; (NAI) pada unggas termasuk penyakit yang dilaporkan ke OIE, mencakup seluruh virus HPAI dan LPAI H5/H7, akan tetapi tidak termasuk LPAI lainnya (subtipe H1-H4, H6, dan H8-H16).
IAV sebagai barrier perdagangan non-tarif
Infeksi IAV dan penyakit yang disebabkannya telah berakibat terganggunya perdagangan kuda, babi, unggas, dan produk-produknya untuk alasan resmi (berdasarkan standar internasional) dan alasan tidak resmi. Sebagai contoh pembatasan pergadangan resmi, sebuah negara dapat memberlakukan pembatasan perdagangan untuk importasi unggas hidup atau produk-produknya yang tidak mendapatkan perlakuan pencegahan dari negara-negara, zona, atau kompartemen (CZC) yang terinfeksi HPAI kedalam negara yang bebas HPAI, atau kuda yang berasal dari negara terjangkit EIV untuk masuk ke negara besar EIV, sepanjang negaar importir dapat mendemonstrasikan kepatuhan yang non-diskriminatif terhadap rekomendasi OIE, atau adanya pemberlakuan pengukuran resiko secara saintifik untuk mendemonstrasikan hak pemberlakukan pembatasan perdagangan untuk melindungi kesehatan hewan dan atau kesehatan manusia dalam suatu negara. Sebuah contoh pembatasan perdagangan tidak resmi salah satunya adalah kasus WTO baru-baru ini mengenai pelarangan importasi unggas dan produk unggas oleh India kepada Amerika Serikat dengan dasar pelaporan LPAI H5/H7. WTO memutuskan berpihak kepada USA karena alasan pelarangan oleh India (1) tidak berdasarkan OIE Terrestrial Animal Code, (ii) tidak dapat dibenarkan berdasarkan penilaian resiko secara saintifik, (iii) merupakan kasus yang sewenang-wenang dan diskriminasi yang tidak adil terhadap anggota WTO, (iv) sangat membatasi jika dibandingkan dengan upaya pengendalian penyakit yang dilakukan di dalam negeri, dan (v) tidak mengetahui wilayah yang bebas penyakit atau yang memiliki prevalensi penyakit yang rendah [107].
Pembatasan perdagangan yang tidak adil dapat menimbulkan dampak ekonomi. Sebagai contoh, pembatasan langsung yang diberlakukan oleh beberapa negara untuk importasi babi dan produk-produk terkait dari Kanada, Meksiko, dan USA selama awal wabah IAV H1N1 pdm09 pada manusia tidak berdasar pada bukti saintifik, akan tetapi merupakan hasil dari asumsi berlebihan bahwa virus tersebut disebarkan oleh babi dan produk terkait, diperparah dengan penggunaan sebutan “flu babi H1N1” oleh komunitas sains dan juga media [37]. Virus H1N1pdm09 pertama kali diidentifikasi pada saluran pernafasan manusia di Meksiko, dan kemudian menyebar melalui perjalanan manusia, dengan kasus-kasus yang terjadi berikutnya nerupakan akibat penyebaran dari manusia ke manusia. IAV tidak terdapat pada daging babi, dan meskipun telah disampaikan informasi yang benar oleh Centers for Disease Control and Prevention (CDC), World Health Organization (WHO), dan OIE bahwa virus H1N1pdm09 tidak disebarkan oleh babi dan bahwa manusia tidak dapat terinfeksi oleh virus jika produk babi ditangani dan dimasak dengan baik, pembatasan perdagangan masih diberlakukan terhadap produk babi asal Amerika Utara [60]. Kerugian awal meliputi penurunan global dari Lean Hog Futers sebesar 15% antara 27 April dan 30 April 2009 [89], dan di akhir tahun 2009, Meksiko mengalami defisit perdagangan babi sebesar 27 juta USD, dan USA mengalami penurunan nilai ekspor babi sebesar 11% jika dibandingkan dengan tahun 2008 [53, 66].
Resiko penyebaran virus Avian Influenza A pada hewan melalui perdagangan
Bukti saintifik harus digunakan untuk mengevaluasi resiko masuknya IAV melalui perdagangan pada hewan dan produk hewan menggunakan perangkat analisa resiko importasi [57]. Proses tersebut memungkinkan negara pengimpor dengan tujuan dan metode perlindungan dalam menilai resiko infeksi dan penyakit yang berhubungan dengan importasi hewan dan produk hewan, akan tetapi harus berdasar data yang transparan dan saintifik agar dapat dipertanggungjawabkan. Hasil keluaran analisis tersebut dapat berupa pelarangan importasi, pembolehan importasi beberapa atau seluruh produk dengan melalui proses mitigasi, atau pembolehan importasi dibawah sistem yang berlaku di negara eksportir. Komponen analisa resiko meliputi, identifikasi bahaya, penilaian resiko, manajemen resiko, dan komunikasi resiko (hazard identification, risk assessment, risk management, and risk communication [57]. Data saintifik yang dibutuhkan menentukan resiko infeksi dan penyakit disebabkan IAV dari importasi hewan dan produk hewan harus meliputi pemahaman patogenesis infeksi virus, rute kontak alami, spesies hospes yang dapat tertular, dan prevalensi infeksi IAV didalam negara itu dan produk-produk yang akan diberi pertimbangan.
Patogenesis dari infeksi virus Influenza A yang berbeda memiliki dampak resiko terhadap perdagangan
Virus influenza kuda (EIV), virus influenza babi (SIV), virus LPAI H5/H7 (H5/H7 LPAIV), dan virus HPAI (HPAIV) tidak menyebabkan infeksi persisten. Periode infeksi biasanya terbatas selama 7 sampai 10 hari, tetapi dapat berlangsung sampai 21 hari, dengan 21 hari dipergunakan oleh OIE sebagai periode inkubasi IAV, untuk memungkinkan karantina spesifik dan periode pengujian untuk memverifikasi status negatif IAV pada individu hewan atau kelompok hewan [59, 61]. Ditambah lagi, IAV umumnya beradaptasi dengan hospes, contohnya transmisi EIV yang mudah dan berkelanjutan dan terbatas diantara hewan-hewan dalam keluarga Equidae, dan bahwa SIV terbatas pada hewan dalam keluarga Suidae. Akan tetapi, dalam kasus AIV, transmisi cukup mudah dan berkelanjutan dapat terjadi pada unggas-unggas dalam ordo yang berbeda seperti Galliformes (unggas darat) dan Anseriformes (unggas air), akan tetapi tetap membutuhkan fase adaptasi [78].
EIV, SIV, dan LPAIV H5/H7 pada kuda, babi dan unggas, masing-masing menyebabkan infeksi dan penyakit pernafasan akut, dengan gejala klinis merefleksikan tropisme dari replikasi virus dan penyakit yang ditumbulkannya, dan ketiadaan IAV pada daging dan sebagian besar organ dalam (54, 55, 80). H5/H7 LPAIV dapat menginfeksi saluran gastroinstestinal, tetapi tidak menyebar secara sistemik. Pergerakan hewan yang terinfeksi IAV secara jelas menciptakan resiko tertinggi penyebaran virus, karena virus bereplikasi di dalam saluran pernafasan dan dilepaskan melalui saluran pernafasan (EIV, SIV, dan H5/H7 LPAIV) dan juga saluran pencernaan (H5/H7) menuju lingkungan luar. Beberapa barang yang berada di lingkungan luar tersbut, seperti alat dan bahan peternakan, pakaian dan sepatu, dapat terkontaminasi oleh virus dan menjadi sarana penyebaran virus yang efisien antar fasilitas. Karena itulah resiko tertinggi transmisi EIV, SIV, dan LPAIV H5/H7 adalah selama proses infeksi akut, dan akan melibatkan hewan hidup dan jeroan yang mengandung jaringan pernafasan, akan tetapi resiko transmisi melalui produk daging mentah bisa diabaikan [109].
Sebaliknya, infeksi HPAI pada unggas darat (seperti ayam, kalkun, puyuh, burung pegar, ayam hutan, dan ayam mutiara) menyebakan infeksi sistemik dan tersebar dengan angka mortalitas yang tinggi. HPAIV berada pada saluran pernafasan dan saluran makanan, organ dalam, otak, kulit, otot skeletal (daging), tulang dan darah, dan virus dilepaskan melalui sekresi hidung, ludah, dan feses [2, 3, 64, 80]. Sejak 1996, galur HPAIV Guangdong (H5N1, H5N6, H5N8, dst) telah diperlihatkan dapat menyebabkan infeksi sistemik pada unggas non gallinaseus, seperti itik, angsa dan emu [6, 40, 64, 96]. Sebelumnya itik dan angsa telah menunjukkan resistensi infeksi dairi HPAIV yang lainnya [2, 83]. Ciri-ciri infeksi HPAIV yang bersifat sistemik pada unggas berarti bahwa semua produk unggas, meliputi jeroan, bulu dan daging unggas, memiliki resiko mengandung virus HPAI. Resiko ini dapat dimitigasi dengan memberi perlakuan dengan panas seperri rendering (jeroan dan pakan hewan yang berasan dari daging unggas), pembersihan dan pemanasan (bulu), dimasak (daging), atau pasteurisasi (telur).
Resiko paparan
Transmisi virus IAV yang bersifat tropisme di saluran pernafasan dan transmisi infeksi kepada hospes yang rentan diinisiasi oleh inhalasi virus atau kontak viral dengan membrana mukosa, terutama yang terdapat pada salurah pernafasan, dan ini adalah rute alami dari transmisi dari hewan ke hewan lainnya. Akan tetapu, koneksi anatomis antar rongga mulut dan rongga hidung melalui pharing pada mamalia, dan choana pada unggas, dapat berkontribusi dalam eksposur virus pada saat makan, minum, atau bernafas [39].
Infeksi alami dan eksperimental dengan galur H5N1 Guangdong telah dilaporkan pada berbagai jenis karnivora, diantaranya kucing rumahan (Felis catus), harimau (Panthera tigris), leopard (Panthera pardus), dan musang batu (Martes foina), dan pada anjing domestik (Canis lupus familiaris) [38, 44, 67, 75, 108] dan burung pemulung, meliputi camar kepala coklat (Larus brunnicephalus), camar kepala hitam besar (Larus ichthyaetus), camar kepala hitam (Larus ribundus), gagak paruh besar (Corvus macrorhynchos), dan elang pegunungan (Nisaetus nipalensis) [27, 50, 72, 87]. Banyak infeksi ini dihubungkan dengan kontak dekat atau konsumsi unggas yang terinfeksi ataupu unggas liar. Babi yang merupakan omnivora, telah diinfeksi secara alamani dan eksperimental dengan H7N7 Belanda dan galur Guangdong H5N1 HPAIV [18]. Selama outbreak Belanda tahun 2003, infeksi pada babi terjadi pada peternakan yang didalamnya terdapat ayam yang terinfeksi, dan pada beberapa kasus babi telah diberi makan dengan telur retak yang didapat dari ayam yang terinfeksi [51]. Hal ini menunjukkan adanya infeksi baik dari kontak dekat dengan unggas yang terinfeksi maupun melalui konsumsi bahan mentah yang terinfeksi. Pemberian daging ayam terinfeksi HPAIV H5N1 pada babi secara eksperimental berkibat pada infeksi asimptomatik, diinisiasi melalui tonsil dan berlanjut ke dalam saluran pernafasan atas, atau infeksi eksperimental telah terjadi pada saluran pernafasan dengan inokulasi virus langsung di intranasal [49]. Meskipun begitu, infeksi alami pada babi dengan HPAIV H5N1 sangat jarang [14], dan pada sebagian besar penelitian, inokulasi secara eksperimental tidak selalu berakbiat adanya infeksi pada babi, sebagian besar asimptomatik [18, 36, 74]. Pada ayam yang juga omnivora, HPAIV H5N1 menyebabkan infeksi dan kematian yang tinggi jika virus berada dalam cairan yang dihasilkan dari inokulasi intranasal atau tembolok, atau dalam air, atau dalam daging yang terinfeksi melalui pemberian makan secara paksa [45].
Pada kasus hewan karnivora atau omnivora, infeksi secara teori merupakan akibat dari ekposure membrana mukosa gastrointestinal dan atau mulut, atau droplet yang mengandung virus yang terbentuk saat hancurnya karkas pada saat makan dapat menginfeksi konjungtiva dan atau mukosa pernafasan atas. Akan tetapi, dosis virus yang diperlukan untuk menyebabkan infeksi sangat bervariasi tergantung pada ekposure langsung melalui saluran pernafasan atau mulut. Sebagai contoh, ayam terekspos dengan HPAIV H5N1 melalui inokulasi gastik atau konsumsi oral di dalam daging atau air memerlukan rata-rata dosis infeksius embrio ayam (EID50) sebesar 1000 sampai 10000 kali lebih besar dari yang diperlukan untuk menyebabkan infkesi melalui inokulasi intranasal. Hal ini mengindikasikan bahwa infeksi HPAIV pada unggas adalah virus yang utamanya disebarkan melalui saluran pernafasan yang lebih menyukai ekposur melalui rute pernafasan, melalui droplet pernafasan dan fomite udara seperti debu, akan tetapi infeksi melalui ekposur mulut dapat terjadi jika unggas mengkonsumsi virus HPAIV dalam dosis tinggi, seperti yang terjadi selama kanibalisme karkas yang terinfeksi [45]. Serupa dengan itu, dalam studi terdahulu yang menggunakan musang dan mencit, ekposure gastrointestinal kurang berhasil dalam memproduksi infeksi HPAIV dibandingkan dengan inokulasi intranasal saat menggunakan dosis yang sama, atau memerlukan dosis gastrointestinal yang tinggi untuk memproduksi infeksi daripada ekposure melalui respiratori [48].
Resiko virus Influenza A terhadap manusia melalui perdagangan
Infeksi IAV hewan jarang terjadi pada manusia, dibuktikan dengan kasus EIV yang jarang terdokumentasikan, kurang dari 1000 kasus AIV yang terdokumentasi dalam waktu 50 tahun, dan kasus SIV sporadis pada manusia juga terjadi biasanya melibatkan transmisi manusia ke manusia yang terjadi setelah infeksi awal secara terbatas [10, 21, 33, 43, 63]. Sebaliknya, ribuan sampai jutaan kasus infeksi virus influenza A pada manusia disebabkan H1N1 dna H3N2 yang bersifat musiman di seluruh dunia setiap tahun [84, 88]. Sebagian besar infeksi AIV pada manusia disebabkan oleh dua galur HPAIV (contohnya galur 1996-2016 H5N1 Guangdong dan galur 2003 H7N7 Belanda), dan galur LPAIV H7N9 Eurasia [4, 25, 104]. Infeksi manusia yang lebih langka lagi juga disebabkan LPAIV dan HPAIV lainnya, menunjukkan bahwa infektivitas virus AIV pada manusia setengahnya bergantung pada strain. Infeksi SIV manusia disebabkan virus H1N1, H1N2, dan H3N2, dengan kasus yang baru-baru ini berasal dari varian virus H3N1 melalui eksposur pada pameran pertanian di Amerika Serikat (28]. Fakta ini mengindikasikan bahwa resiko infeksi IAV pada manusia lebih besar dari IAV manusia yang bersifat musiman daripada dari IAV yang berasal dari hewan.
Data epidemiologi yang cukup telah tersedia untuk epizotik virus HPAIV H5N1 Eurasia-Afrika dan H7N7 Belanda dan epizootik LPAIV H7N9 dengan infeksi manusia yang mengikutinya untuk mengambil kesimpulan-kesimpulan terkait resiko eksposur pada manusia dan portal masuknya virus yang berakibat pada infeksi pada manusia, dengan transmisi IAV hewan yang paling banyak merupakan akibat adanya kontak langsung antara hewan dan manusia dan dari ekposur melalui saluran pernafasan. Epizootik HPAIV H7N7 Belanda menyebabkan umumnya kasus klinis konjungtivitis, dengan gejala sakit mirip flu kadang-kadang dilaporkan, menunjukkan bahwa portal masuknya sebagian besar sering melalui mukosa conjugtiva [42]. Untuk kasus-kasus klinis, individu yang bekerja melakukan depopulasi dan tenaga dokter hewan unggas memiliki tingkat infeksi lebih banyak (41,2% dan 26,3%) daripada peternak unggas dan keluarganya (14.7%), lalu individu lain (7.7%). Hal ini menunjukkan bahwa resiko infeksi H7N7 selama outbreak lebih berhubungan dengan banyaknya eksposur virus melalui kontak dengan unggas yang terinfeksi. Selama panzootik HPAIV H5N1 dan LPAIV H7N9 berlanjut, infeksi pada manusia merupakan akibat dari ekposur secara kontak langsung atau tidak langsung yang sangat dekat dengan unggas yang terinfeksi (baik yang mati ataupun yang masih hidup) dalam perumahan, pedesaan atau pasar-pasar unggas hidup [47, 62, 73], dengan jalur masuk virus diperkirakan melalui jaringan respiratori dan/atau jaringan oropharing [26]. Akan tetapi, satu kasus dihubungkan dengan ekposur virus yang diperkirakan dari darah dan organ itik yang tidak dimasak, dan satu kasus lagi dihubungkan dengan kegiatan mencabuti bulu angsa mati yang terinfeksi HPAIV H5N1 [102, 103]. Meskipun kasus yang melibatkan konsumsi darah itik yang tidak dimask dapat menunjukkan adanya ekpsour melalui saluran gastrointestinal setelah ingesti virus melalui makanan mentah, bukti yang menunjukkan bahwa virus HPAIV bereplikasi dalam saluran intestinal manusia sangat kurang dan virus bisa saja masuk melalui kontak dengan mukosa oropharing dan saluran respiratori bagian atas [26]. Akan tetapi, eksposur dengan unggas yang terinfeksi HPAIV H5N1 tidak selalu berakhir dengan infeksi pada manusia. Studi di Kamboja menggambarkan kurangnya infeksi HPAIV H5N1 diantara penduduk desa yang selalu berkontak dekat dengan unggas terinfeksi HPAI H5N1, menunjukkan bahwa potensi transmisi dari unggas ke manusia sangat rendah [100]. Lebih jauh lagi, meskipun HPAIV berada dalam daging unggas yang terinfeksi
Aspek zoonosis dari infeksi IAV akan didiskusikan di Bab 5.
Resiko penyebaran virus influenza A melalui perdagangan
Aktivitas manusia adalah cara paling dominan dalam penyebaran IAV, meliputi perpindahan hewan terinfeksi dan beberapa produk, atau peralatan dan suplai yang terkontaminasi IAV, dari fasilitas, kompartemen dan wilayah dan negara. Di dalam suatu negara, pergerakan diatur oleh otoritas veteriner di tingkat negara bagiaan atau provinsi dan nasional, dalam hubungannya dengan kesehatan hewan dan produk yang berasal dari hewan tersebut, dalam rangka meminimalisir penyebaran agen penyakit hewan dan zoonosis seperti IAV. OIE Terrestrial Animal Health Code memberikan rekomendasi pelaksanaan sanitasi untuk perdagangan internasional yang aman, dan menekankan pada penilaian keamanan dan resiko importasi hewan dan produk hewan [61]. Tujuannya adalah untuk mencegah resiko yang tidak dapat diterima terhadap kesehatan hewan dan manusia demikian juga demi menghindari barrier perdagangan yang tidak adil atau terkait dengan politik. Perkembangan regulasi yang transparan dan objektif tentang regulasi impor berdasarkan standar internasional adalah penting dalam pencegahan masuknya IAV dan untuk perlindungan kesehatan hewan, dan potensi terganggunya kesehatan manusia, seiring juga memingkinkan berlanjutnya sistem perdagangan yang adil dan aman.
Level-level resiko penyebaran
Level resiko penyebaran IAV melalui perdagangan tergantung pada beberapa faktor, meliputi:
- Kemampuan mendemonstrasikan status bebas IAV dalam CZC melalui surveilans dan diagnostik yang cukup,
- Tipe-tipe IAV yang ada, seperti tropisme pernafasan (contoh EIV, SIV, dan LPAIV H5/H7) versus virus-virus sistemik (misal HPAIV),
- Importasi hewan hidup atau tipe produk spesifik yang diperdagangkan
- Penggunaan setiap tipe mitigasi, seperti misalnya vaksinasi pada hewan hidup atau inaktivasi AIV melalui treatment dengan panas
Petunjuk yang lengkap untuk melakukan analisis resiko importasi dapat ditemukan pada Bab 2.1 pada Terrestrial Animal Health Code.
Sejak pertengahan tahun 2000-an OIE telah mengenali level resiko berbeda-beda dari IAV saat mengimportasi hewan hidup, atau produk asal hewan tersebut [56]. Sebagai contoh, bila CZR yang mengekspor bebeas dari IAV berdasarkan metode pengujian yang tepat dan sampling surveilans yang cukup, dan jika CZC telah secara konsisten melaporkan temuan masalah kesehatan hewan kepada negara-negara anggota OIE, makan importasi hewan dan produk asal hewan tidak boleh dilarang berdasarkan status IAV tersebut.
Secara umum, resiko tertinggi menyebarnya IAV (EIV, SIV, H5/H7 LPAIV, dan HPAIV) melalui perdagangan adalah dari pergerakan hewan hidup yang terinfeksi virus secara akut dan terus mengeluarkan virus dari tubuhnya, dan importasi hanya boleh terjadi dari CZC yang bebas IAV, atau jika belum bebas dari IAV, importasi hanya diperbolehkan setelah langkah-langkah mitigasi untuk mengurangi resiko importasi IAV telah dilakukan, seperti karantina dan pengujian untuk menunjukkan bahwa sekelompok hewan yang akan diimpor bebas dari infeksi IAV. Akan tetapi, negara pengimpor tidak dapat membatasi perdagangan jika terdapat IAV dengan kategori yang spesifik terdapat di negara itu. Sebagai contoh importasi IAV melalui perdagangan hewan hidup terjadi di Australia pada tahun 2007, saat kuda uang telah terinfeksi virus secara subklinis dan telah divaksinasi telah dikarantina, namun tidak memenuhi protokol karantina sehingga menyebabkan EIV dapat menyebar keluar kompleks karantina, menyebabkan menyebarnya virus melalui fomit respiratori kepada populasi kuda Australia [11, 101]. Total biaya wabah EIV di Australia tahun 2007 adalah sekitar 381 juta USD. Pada saat artikel ini ditulis, hanya Australia, Islandian dan Selandia Baru yang bebas EIV.
Kurangnya jumlah virus yang berada di daging untuk EIV pada daging kuda, SIV pada daging babi, dan LPAIV H5/H7 pada daging unggas yang terinfeksi berarti bahwa importasi daging-daging tersebut memiliki resiko rendah jika meskipun diimpor dari negara yang belum bebas IAV.
Level-level resiko virus avian influenza melalui perdagangan
Jika menyangkut AIV, jika CZC pengekspor terdampak, maka resiko importasi HPAIV pada unggas lebih besar dari LPAIV H5/H7, dikarenakan infeksi alami HPAIV pada unggas yang bersifat sistemik (virus berada pada seluruh tubuh unggas terinfeksi), dan dampak ekonomi HPAI juga lebih besar jika dibandingkan dengan LPAI H5/H7.
Jika diliat dari komoditas spesifiknya, resiko importasi bervariasi tergantung pada produk spesifiknya, dan jika disusun dalam urutan resiko tertinggi sampai terendahnya adalah sebagai berikut:
- Unggas hidup (selain unggas umur satu hari)
- Burung hidup selain unggas domestik
- Unggas hidup umur satu hari
- Telur tetas
- Telur untuk konsumsi manusia
- Produk telur
- Produk yang berasal dari unggas, miisalnya semen, daging mentah, dan produk lain yang tidak mengalami pemrosesan
- Produk unggas yang telah mengalami pemrosesan untuk menginaktivasi AIV
Jika produk berasal dari CZC yang terdampak AIV, dapat dilakukan perlakuan untuk menginaktivasi IAV untk mengeliminasi resiko, jika eksporter telah mengambil langka-langkah tepa dalam pencegahan rekontaminasi produk akhir seperti yang direkomendasikan oleh OIE. Lebih jauh lagi, importasi daging mentah yang terinfeksi HPAIV atau produk-produk lainnya bisa jadi tidak mengakibatkan infeksi kecuali jika produk iu diberikan pada hospes yang rentan (misalnya memberikan sisa-sisa bagian tubuh mentah kepada unggas peilharaan rumah tangga atau membuangnya pada area yang dapat diakses oleh burung liar). Ditambah lagi, kuantitas virus yang diperlukan untuk menginfeksi unggas melalui daging mentah adalah 10 ribu sampai 100 ribu kali lebih besar daripada jumlah yang diperlukan untuk menyebabkan infeksi melalui eksposur dengan saluran pernafasan, dan hal ini harus dimasukkan juga kedalam penilaian faktor resiko [45]. Resiko analisis sebelumnya telah menunjukkan bahwa kemungkinan masuknya LPAIV H5/H7 melalui daging unggas impor berkisar mulai dari kategori ‘dapat diabaikan’ sampai ‘tidak ada sama sekali’ [68, 109].
Transfer AIV melalui perbatasan telah terjadi sebagai akibat dari perdagangan legal maupun ilegal dari unggas hidup, burung liar selain nggas, dan produk asal unggas. Sebelum tahun 1970, kurangnya pembatasan yang konsisten terhadap importasi unggas menyebabkan ketidaksengajaan masuknya penyakit unggas eksotik seperti Newcastle disease dan avian influenza. Hubungan wabah penyakit ND pada unggas di California Selatan dengan pergerakan unggas eksotik yang tidak dibatasi dari Amerika Tengah ke Amerika Serikat menyebabkan perkembangan dan augmentasi persyaratan karantina dan pengujian untuk burung peliharaan dan unggas impor di Amerika Serikat (tahun 1974), di Inggris (tahun 1976), dan negara-negara lain [1, 97]. Mengikuti implementasi pembatasan impor dan karantina dan pengujian unggas impor, AIV telah diisolasi pada beberapa kejadian dari burung yang diselundupkan atau masuk secara ilegal, atau unggas yang diimpor secara legal pada pusat-pusat karantina [85]. Sebaliknya, isolasi AIV dari produk unggas telah dilaporkan dalam jumlah yang lebih sedikit lagi. Pada dekade yang lalu, AIV telah diisolasi dari karkas dan daging unggas, termasuk HPAIV H5N1 dari daging unggas beku yang diimpor secara legal dari China ke Korea Selatan (di tahun 2001) [96] dan Jepang (di tahun 2003) [52], LPAIV H10N7 telah diisolasi dari paru-paru dan trakea pada karkas ayam dan itik yang diimpor secara ilegal dari China ke Italia (tahun 2006) [5]. Pada tahun 2007 wabah HPAI H5N1 terjadi pada satu peternakan kalkun di Suffolk, Inggris [24], dan meskipun sumber masuknya virus tidak diketahu secara jelas buktinya, bukti epidemiologi mengindikasikan bahwa masuknya virus kemungkna besar terjadi melalui importasi daging kalkun terinfeksi dari Hungaria yang berasan dari flok yang terinfeksi secara subklinis. Peneliti dari penelitian tersebut mengusulkan bahwa transmisi merupakan akibat dari kejadian-kejadian yang memiliki kemungkinan kecil, dimana burung camar memakan sisa-sisa dari pabrik pemrosesan ternak unggas, dan kemudian bertengger di dekat kandang kalkun dengan sistem biosekuruti rendah, menyebabkan wabah HPAI di kandang tersebut.
HPAIV H5N1 yang bervariasi telah diisolasi dari unggas dan manusia antara tahun 2003 dan 2004 telah ditunjuukan dalam daging yang diambil dari ayam, puyuh jepang, itik dan angsa yang terinfeksi secara alami maupun eksperimental [41, 77, 96]. Dalam sebuah studi ekperimental, virus HPAIV H5N1 A/chicken/South Korea/ES/2003 (Korea/03) ditemukan pada daging bagian dada dan paha dalam titer tinggi pada ayam yang diinokulasi secara intranasal, dan HPAIV telah ditransmisikan pada ayam broiler melalui pemberian pakan daging dada mentah dari ayam yang terinfeksi (Tabel 4.2), tetapi HPAIV H5N2 A/chicken/Pennsylvania/1370/1983 (PA/83) tidak bertransmisi dengan pemberian daging ayam terinfeksi [80]. Perbedaan transmisi ini adalah akibat perbedaan dari dosis tantang. Inisiasi wabah HPAI dari produk mentah yang diimpor via konsumsi hospes yang rentan memiliki kemungkinan yang rendah. Akan tetapi, insiden di Inggris, juga penelitian ekspiremental pemberian pakan dagaing mentah terinfeksi pada ayam menekankan perlunya standar sanitasi yang akan mencegah importasi aksidental produk terinfeksi HPAIV yang berpotensi mengakibatkan wabah HPAI. Karena itulah importasi daging unggas mentah dari CZC yang terdampak HPAI ke dalam CZC yang bebas HPAI adalah sebuah resiko yang tidak dapat diterima dan pembatasan perdagangan mungkin dapat diberlakukan dalam situasi tersebut.
Mitigasi resiko perdagangan
Metode terbaik untuk meyakinkan perdagangan yang aman dan adil untuk negara yang bebas AIV adalah melakukan importasi dari negara lain yang juga bebas IAV [56]. Status bebas IAV hanya dapat didemonstrasikan oleh negara yang telah melakukan surveilans serologis dan virologis dengan menerapkan uji sensitif dan menggunakan metode sampling acak maupun bertarget [56]., dan telag memiliki sejarah keterbukaan dalam pelaporan penyakit hewan kepada OIE. Status bebas dari IAV dapat didemonstrasikan untuk suatu negara atau bagian dari suatu negara, seperti zona (contoh: wilayah dengan karakteristik geografi yang khusus) atau sebuah kompartemen (contoh: unit fungsional yang terpisah dengan unit lain oleh manajemen praktek biosekuriti) [69]. Meskipun begitu, dibawah Kesepakatan SPS, negara pengimpor tidak dapat memaksakan tindakan sanitasi yang tidak sesuai dengan standar internasional kepada negara pengekspor. Jika sebuah negara memilih untuk mengaplikasikan tindakan yang lebih ketat melebihi standar internasional, hal ini harus didukung dengan penilaian resiko yang valid secara saintifik. Jika negara pengimpor terdampak oleh penyakit, negara itu hanya memerlukan tindakan yang seara dengan tindakan yang diberlakukan secara nasional. Beragam tipe strategi mitigasi dapat mengurangi resiko IAV dari importasi, dan akan didiskusikan di bawah ini.

Mengurangi resiko perdagangan hewan hidup
Mitigasi resiko hewan hidup untuk negara pengekspor dapat dicapai melalui aplikasi upaya pengamanan, seperti pemberlakuan zona atau kompartementalisasi, atau untuk negara pengimpor dengan mempersyaratkan vaksinasi, pengujian, dan atau karantina sebelum pemasukan hewan ke dalam negeri.
Vaksinasi
Vaksinasi dapat mengurangi atau mencegah replikasi EIV, SIV, LPAIV H5/H7, dan HPAIC pada saluran respiratori dan gastrointestinal hewan hospes yang rentan [13, 81, 95, 99]. Vaksinasi unggas mampu mencegah infeksi sistemik HPAIV [86]. Dalam level praktis, kadar HPAIV yang tinggi telah diisolasi dari daging dada ayam, itik, dan kalkun yang tidak divaksinasi setelah dilakukan uji tantang lewat intranasal dengan berbagai virus HPAIV H5N1, akan tetapi tidak ada virus yang ditemukan dari daging atau viscera unggas yang telah divaksinasi 3 minggu sebelumnya dengan virus yang sama [6, 80, 93]. Studi-studi ini mendemonstrasikan bahwa vaksinasi yang tepat dapat mengurangi resiko HPAIV pada daging dan viscera unggas.
Metode inaktivasi virus influenza A pada produk hewan
Metode treatmen yang bervariasi dapat diaplikasikan kepada produk hewan yang berasal dari CZC yang terinfeksi untuk menginaktivasi IAV dan membuat produk hewan menjadi aman digunakan. Pemanasan umumnya digunakan untuk menginaktivasi beragam virus, bakteri, jamur, dan protozoa baik yang bersifat patogenik maupun non-patogenik dalam produk makanan. Penggunaan pemanasan ini biasanya dicapai dengan proses memasak, pasteurisasi, atau proses rendering. Karakteristik fisiko-kemikal yang terjadi serupa pada setiap virus IAV dan meliputi proses inaktivasi termal.
Daging dan produk terkait
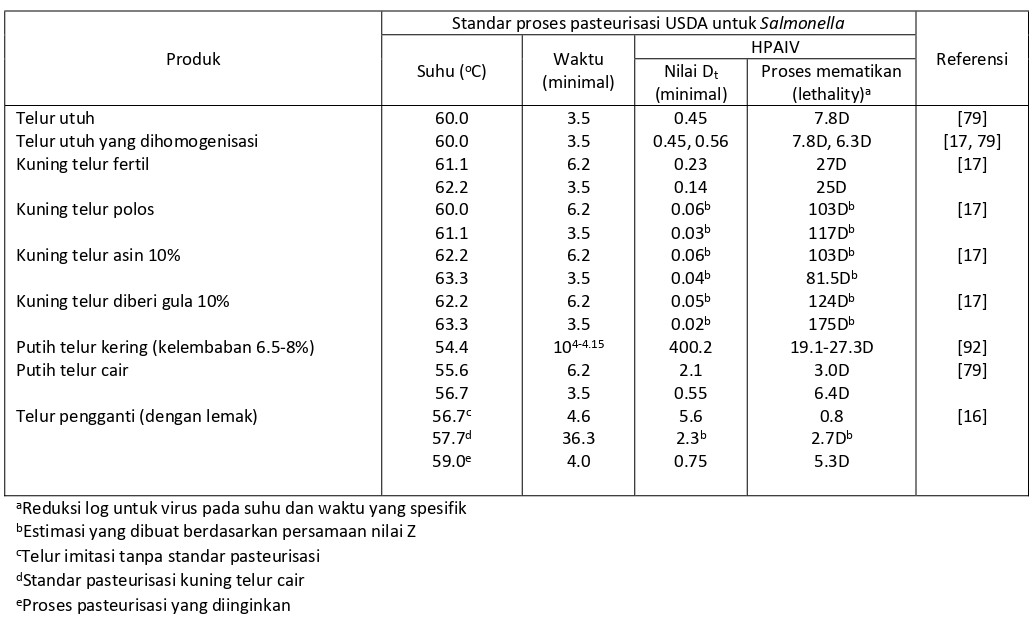
Karena HPAIV menyebabkan infeksi sistemik pada unggas dengan virus dalam daging [80], studi awal inaktivasi termal berfokus pada pengembangan metode micro assay yang dapat direproduksi kembali untuk mengukur inaktivasi virus dalam sampel daging dari ayam yang telah diinveksi melalui intranasal dengan HPAIV [76]. Penggunaan suhu masak minimal sebesar 70oC, virus infeksius HPAIV Korea/03 telah dideteksi dalam daging terinfeksi satu detik setelah perlakuan, akan tetapi tidak setelah lima detik [76]. Studi mendetail tentang inaktivasi termal virus HPAIV Korea/03 menetapkan persamaan garis inaktivasi, nilai Dt (waktu yang diperlukan untuk mengurangi titer infeksius dengan satu log10 pada suhu spesifik), waktu memasak minimum pada berbagai suhu, dan perbandingannya dengan petunjuk waktu-suhu minimum yang ditetapkan oleh USDA Food Safety Inspection Service (FSIS) untuk mereduksi Salmonella sampai 107 (Tabel 4.3) [91]. Studi ini mengestimasikan titer maksimum sebesar 108.7 dosis infeksius rata-rata dari embrio ayam (EID50) untuk HPAIV H5N1 per gram daging ayam (data atau paha). Seperti yang ditunjukkan dalam tabel 4.3, persamaan garis inaktivasi untuk HPAIV dalam daging ayam dan paha memprediksikan inaktivasi HPAI dalam 100 gram sampel setelah waktu tunggu selama 4.4 detik pada suhu 70oC (158oF), atau waktu tunggu selama 0.64 detik pada standar suhu masak yang ditetapkan USDA pada suhu 73.9 (165oF). Dalam kerangka petunjuk USDA/FSIS untuk mereduksi Salmonella, kombinasi waktu-suhu yang ditetapkan melebihi yang telah diprediksi untuk menginaktivasi HPAIV H5N1 pada daging ayam. Berbagai studi telah mengkonfirmasi bahwa memasak daging sampai suhu 73.9oC (165oF) akan menginaktivasi virus IAV dalam daging atau di atas permukaan [79, 90, 91].
Produk telur
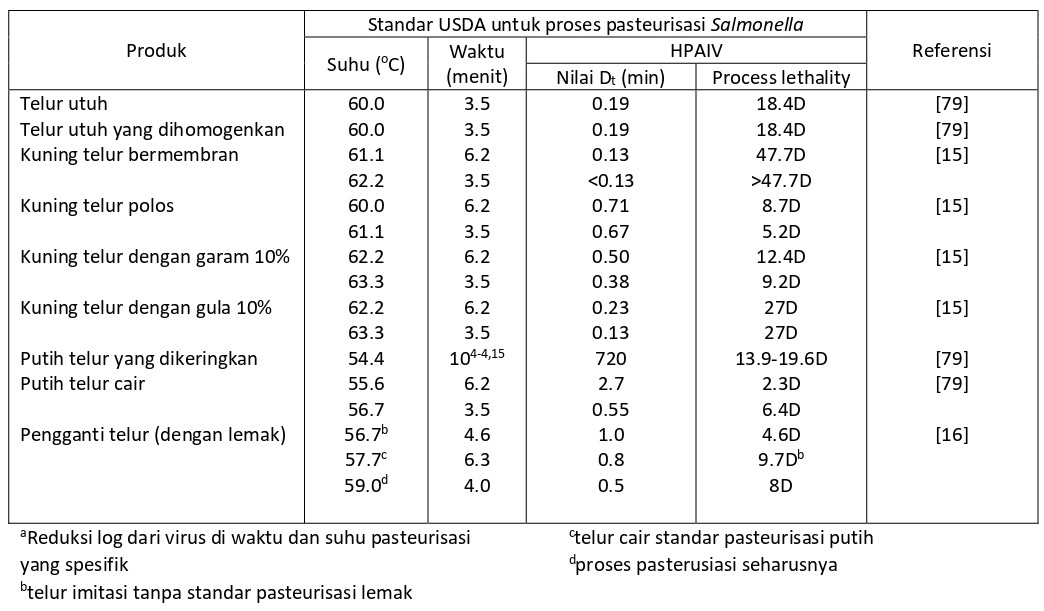
Virus LPAIV H5/H7 yang dikeluarkan melalui kloaka (jalur keluar paling umum untuk saluran digesti dan reproduksi), dan karena itu dapat ditemukan pada permukaan telur yang dikeluarkan oleh ayam yang terinfeksi [79]. Akan tetapi, isolasi virus LPAIV H5/H7 dan H5/H7 non-LPAIV dari isi telur belum dilaporkan sampai saat ini. Karena itulah telur yang diproduksi dalam CZC yang terinfeksi LPAIV H5/H7 tetap dapat diimpor ke negara yang bebas AIV asalkan permukaan cangkang telur telah disanitasi untuk mengeliminasi virus LPAIV H5/H7 yang mungkin ada dan telur disimpan dalam bahan kemas yang baru [56].
Sebaliknya, akan beresiko jika mengimpor telur yang telah disanitasikan akan tetapi berasal dari CZC yang terinfeksi HPAI ke dalam negara bebas AIV, karena virus tidak hanya terdapat pada permukaan cangkang telur, tetapi juga didalam telur yang dikeluarkan oleh ayam betina yang terinfeksi sebelum mereka mati [79]. Tetapi, perlakuan dengan pemanasan dengan cairan atau produk telur yang dikeringkan dapat menginaktivasi HPAIV dan menjadikan produk aman untuk diperdagangkan. Proses pasteurisasi yang menggunakan suhu yang lebih rendah daripada suhu yang digunakan untuk memasak, biasanya digunakan untuk menginaktivasi mikro-organisme yang berada di dalam telur. Ini memungkinkan terjaganya komponen telur yang fungsional, seperti warna dan viskositas albumin dan kuning telur. Pada sebuah studi eksperimental, titer HPAIV maksimum yang dilaporkan.

Produk-produk lain
Bulu angsa adalah komoditas ekspor yang umum berasal dari Asia, dan digunakan sebagai insulasi atau isian bantal, selimut, kantong tidur, jaket dingin, dan pakaian lainnnya. Karena AIV dan IAV lainnya sangat rentan terhadap panas, deterjen, dan berbagai bahan kimia [9], bulu atau produk-produk serupa lainnya dapat diperlakukan dengan pengasapan atau deterjen untuk membunuh virus IAV yang mungkin saja ada. Akan tetapi, perlakukan seperti itu harus memenuhi persyaratan terstandarisasi yang memberikan perlindungan yang seragam untuk suatu produk dan membunuh virus tanpa merubah kualitas fisik bulu yang diberi perlakuan. Jeroan dari hewan ternak dan unggas digunakan sebagai bahan makanan hewan peliharaan. Mitigasir esiko importasi jeroan yang mengandung jaringan respiratori (resiko EIV, SIV, dan LPAIV H5/H7), gastrointestinal (LPAIV H5/H7) dan seluruh organ dalam, kulit dan daging (HPAIV) digunakan sebagai bahan baku pakan untuk hewan peliharaan dapat dicapai dengan perlakuan dengan panas untuk membunuh virus IAV, tergantung pada hospes yang merupakan sumber produk. Sisa-sisa daging, jeroan, kulit dan lemak dihaluskan, dicampur dan diberi perlakuan dengan panas selama 30 menit pada suhu 118oC untuk menon-aktifkan beberapa patogen, dalam sebuah proses yang disebut rendering, untuk memproduksi pakan daging sebagai sumber protein untuk pakan hewan [46]. Proses ini sangat melebihi persyaratan minimal untuk inaktivasi termal untuk virus IAV, berdasarkan model LPAIV H5/H7 dan treatment seperti itu telah mampu menhancurkan RNA virus [46].
Tabel 4.4 Estimasi waktu pasteurisasi untuk telur yang dikontaminasi dengan HPAIV, dan estimasi jumlah reduksi log10 pada HPAI yang dicapai oleh standar pasteurisasi.
Resiko keamanan pangan?
Kasus natural dan eksperimental telah mendemonstrasikan sifat-sifat infeksi sistemik pada unggas, meliputi keberadaan virus pada daging dan telur [2,3, 6,40, 64, 65, 80, 96], akan tetapi IAV tidak ada pada daging hewan yang terinfeksi EIV, SIV dan H5/H7 LPAIV [54, 55, 80]. Terdapat 694 kasus H5N1, 90 kasus H7N7, dan satu kasus HPAIV H7N3 pada manusia, dengan fatalitas masing-masing 401 orang, 1 orang dan nol [20, 22, 105]. Sebagian infeksi HPAIV pada manusia merupakan akibat kontak dekat tengan unggas terinfeksi HPAIV yang hidup atau sudah mati [63]. Meskipun konsumsi makanan yang terinfeksi (kue/puding darah itik mentah) telah diasosiasikan dengan satu kasus infeksi HPAIV H5N1 pada manusia [103], tidak ada data epidemiologi yang cukup untuk mengkonfirmasi bahwa konsumsi produk yang terinfeksi merupakan salah satu rute transmisi [26]. Beberapa faktor membatasi dampak potensial HPAIV terhadap keamanan pangan. Yang pertama, tidak seperti bakteri yang hidup bebas seperti Salmonella typhimurium dan Escherichia coli, yang dapay terus tumbuh dalam produk makanan pasca panen atau pasca pemotongan, HPAIV hanya mampu tumbuh dalam sel hewan hidup. Replikasi HPAIV berhenti setelah hospesnya mati, membatasi kemungkinan masuknya virus di bahan makanan. Yang kedua, reseptor yang diperlukan untuk perlekatan dan replikasi HPAIV terdapat utamanya pada paru-paru, dan tidak dideskripsikan berada pada saluran pencernaan manusia. Hal ini menyiratkan bahwa HPAIV lebih mungkin menginfeksi manusia melalui saluran pernafasan. Dan terakhir, proses memasak yang sempurna akan menginaktivasi setiap virus HPAIV yang mungkin ada [26, 91]. Dari semua ini, data- data yang ada menyarankan bahwa HPAIV saat ini bukanlah masalah keamanan pangan yang signifikan untuk manusia. Akan tetapi, karena sebagian besar kasus HPAIV pada manusia telah dihubungkan dengan kontak langsung dengan unggas terinfeksi, flok yang sudah diketahui terlutlar HPAIV tidak boleh diproses sebagai bahan makanan untuk rumah tangga, pasar unggas hidup, ataupun rumah potong hewan. Paparan kontak dengan manusia dapat terjadi saat menangkap, memegang, membawa dalam transportasi, atau menyembelih unggas sakit. Infeksi pada manusia mungkin dapat terjadi karena menghirup droplet kecil, debu, ataupun aerosol yang mengandung virus, atau dengan menyentuh hidung, conjuctiva, atau membran mukosa mulut dengan tangan yang terinfeksi.
Tabel 4.5 Estimasi waktu pasteurisasi untuk telur yang diinfeksikan dengan H5/H7 LPAIVa dan estimasi angka pengurangan log10 dari H5/H7 LPAI dicapai dengan standar pasteurisasi industri.
Infeksi LPAIV H5/H7, LPAIV non-H5/H7, dan HPAIV berbeda pada unggas dan manusia. Pada unggas, LPAIV H5/H7 dan LPAIV non H5/H7 menyebabkan infeksi respiratori dan gastrointestinal, dan virus tidak terdeteksi pada daging unggas maupun isi dalam telur [79, 80]. Pada manusia, terdapat 476 kasus H7N9 yang terdokumentasikan dan 18 infeksi LPAIV lain yang tercatat dalam jangka waktu 30 tahun, dengan sebagian besarnya menunjukkan infeksi respiratori, dan beberapa menunjukkan gejala konjungtivitis saja [22, 32]. Angka fatalitas tercatat rendah, kecuali LPAIV H7N9 yang telah menyebabkan 175 kematian [104]. Karena infeksi pada unggas hanya bertahan sekitar 7 sampai 10 hari, maka flok yang terinfeksi H5/H7 dan LPAIV non-H5N7 dapat dipasarkan dengan aman setelah sembuh dari infeksi. Pemasaran flok yang telah sembuh secara terkontrol memberikan waktu bagi peternak untuk menutup kerugian dan memberi perasaan aman bagi peternak, pekerja peternakan dan konsumen [34, 35]. Status bebas infeksi AIV sepenuhnya dapat dikonfirmasi dengan melakukan pengujian AIV terhadap kematian normal per harinya di dalam flok dengan tes RT-PCR atau pen-site antigen capture test menggunakan swab oropharing atau trakea sebelum memesarkan dan memproses unggas [23, 70, 71]. Karkas yang diproses tidak boleh mengandung jaringan respiratori maupun digesti.
Kesimpulan
Unggas dan babi adalah hewan ternak yang paling banyak dipelihara di dunia, dan pada level global mereka adalah sumber utama protein hewani untuk diet makanan manusia melalui konsumsi daging dan telur. Produksi dan dan sistem distribusi domestik, juga produk impor, sangat penting dalam rangka memenuhi permintaan konsumen untuk kuliner juga untuk memenuhi suplai pasar dengan produk-produk lainnya seperti hewan hidup, pakan daging, jeroan, lemak, telur tetas, dan bulu. OIR Terrestrial Animal Health Code memberikan standar untuk perdagangan internasional, dan menekankan pada penilaian resiko berbasis sains untuk mewujudkan importasi yang aman bagi hewan dan produk hewan. Tujuannya dalah untuk mencegah resiko yang tidak dapat dibenarkan pada kesehatan hewan dan kesehatan manusia, juga melindungi terhadap pembatasan perdagangan yang tidak adil ataupun yang bermuatan politis.
Aktivitas manusia adalah cara penularan paling sering dalam penyebaran IAV. Ini telah terjadi melalui pergerakan hewan terinfeksi dan produk terkait hewan terinfeksi dalam jumlah yang lebih kecil, atau alat-alat dan bahan yang terkontaminasi IAV, antar fasilitas, kompartemen, wilayah dan negara yang berbeda. Level resiko penyebaran IAV hewan melalui perdagangan tegantung pada beberapa faktor, meliputi faktor sebagai berikut:
- Ada atau tidaknya IAV dalam CZC yang didemonstrasikan melalui surveilans yang cukup dan diagnostik hewan hospes, demikian juga pelaporan yang transparan,
- Tipe-tipe IAV yang ada, seperti virus respiratori (EIV, SIV, H5/H7 LPAIV) atau virus sistemik (HPAIV),
- Komoditas yang diperdagangkan, seperti hewan hidup, jeroan mentah atau yang sudah dimasak (termasuk paru-paru dan jaringan respiratori), daging dan produk lainnya,
- Penggunaan mitigasi yang mana saja, seperti vaksinasi hewan hidup, atau perlakuan untuk menginaktivasi virus IAV.
Karena HPAIV menyebabkan infeksi sistemik pada unggas, resiko transfer melalui perdagangang lebih besar daripada infeksi LPAIV H5/H7, EIV, dan SIV. Transfer virus melewati perbatasan telah terjadi melalui perdagangan legal maupun ilegal dari hewan hidup dan produk hewan asal hewan, dan hal ini menekankan perlunya standar sanitasi untuk mencegah importasi aksidental dari IAV kedalam CZC yang bebas IAV. Importasi LPAIV EIV, SIV, dan H5/H7 melalui perdagangan hewan hidup dapat dimitigasi melalui karantina dan pengujian spesies hewan rentan, dan penggunaan vaksin untuk mengurangi kerentanan terhadap IAV. Resiko importasi virus-virus ini melalui daging hampir tidak berarti dan dapat diabaikan, karena virus-virus ini tidak terdapat pada jaringan non-respiratorik (misalnya daging). Sebaliknya, HPAI menyebabkan infeksi sistemik pada unggas, virus terdeteksi pada seluruh jaringan, termasuk daging. Berbagai strategi mitigasi dapat digunakan untuk mengurangi resiko, seperti vaksinasi hewan pada CZC yang terinfeksi HPAI, atau penggunaan proses inaktivasi seperti memasak dan pasteurisasi produk yang didapat dari CZC terdampak.
Dari perspektif kesehatan manusia, infeksi IAV utamanya diperoleh dari eksposur melalui aerosol dan fomit yang mengandung virus IAV yang berasal dari manusia, dan ada sejumlah kecil kasus yang berasal dari SIV, sejumlah kasus AIV yang lebih kecil utamanya HPAIV dari galur HA Guangdong (H5N1 dan H5N6, 1996-2016) dan H7N7 galur Belanda (2003), dan LPAIV H7N9 di China, dan tidak ada kasus EIV yang terkonfirmasi. Sebagian besar kasus SIV merupakan akibat dari ekposur manusia dengan babi pada saat pameran ternak babi (pameran negara atau negara bagian di Amerika Serikat) dengan infeksi yang terjadi bersamaan pada hewan babi yang dipamerkan. Sebagian infeksi HPAI telah terjadi mengikuti eksposur langsung maupun tidak langsung di pasar unggas hidup atau sistem produksi pedesaan. Data terbaru memberi indikasi bahwa virus IAV hewan lebih merupakan masalah kesehatan hewan daripada masalah kesehatan masyarakat ataupun masalah keamanan pangan.
Pengakuan/Rekognisi
Penulis mengucapkan terima kasih kepada A. Thiermann untuk memberikan critical review dan saran-sarannya untuk perbaikan naskah ini.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

