Oleh Nancy J. Cox, Susan C. Trock dan Timothy M. Uyeki
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Pengenalan
Kemunculan dan penyebaran virus influenza A yang berasal dari hewan (novel virus) [IAV) berpotensi menimbulkan pandemi influenza global, yang disertai dengan morbiditas dan mortalitas yang tersebar luas secara global [52]. Sangat mungkin bahwa pandemi influenza di masa lalu terjadi setelah adanya transmisi langsung virus IAV yang berasal dari hewan ke manusia, atau setelah terjadinya genetic reassorment antara virus yang berasal dari manusia dan virus yang berasal dari hewan mamalia. Karena pandemi di masa lalu tidak dapat diprediksikan dan diukur dampaknya, negara-negara anggota World Health Organization (WHO) setuju untuk melaporkan infeksi novel virus influenza pada manusia sebagai persyaratan dari Regulasi Kesehatan Internasional Tahun 2005 [238] yang diimplementasikan pada tahun 2007. Sebelumnya, pelaporan kasus influenza A yang berasal dari hewan atau virus baru (novel) sangat dirahasiakan dan seringkali tidak lengkap.
Agar virus IAV baru (novel) dapat mengakibatkan infeksi pada manusia dan menyebabkan pandemi, virus harus mampu menimbulkan penyakit dan lebih penting lagi harus memiliki kemampuan transmisi dari manusia ke manusia lain. Meskipun kejadian itu jarang terjadi, utamanya disebabkan batasan spesies hospes untuk virus yang ada pada spesies yang berbeda, pandemi pada manusia telah menyerang dengan tiba-tiba pada empat peristiwa yang terjadi sejak tahun 1900 (Tabel 5.1). Analisa genetik terhadap empat kejadian pandemi ini telah dapat mengidentifikasi gen dari setiap hewan hospes dimana virus tersebut berasal. Sebagai contoh, sekuensing 8 gen dari virus penyebab pandemi tahun 1918 mengungkapkan bahwa virus ini mungkin muncul dari virus yang sepenuhnya menginfeksi unggas (AIV) beradaptasi untuk menginfeksi mamalia [166, 167, 192, 193]. Sebaliknya, kedua varian virus H2N2 yang telah menyebabkan pandemi “Flu Asia” tahun 1957-1958 dan virus H3N2 yang telah menyebabkan pandemi “flu Hong Kong” tahun 1968-1969 berasal dari genetic reassortment segmen gen virus influenza A dan virus avian influenza berpatogenitas rendah (LAIV) yang sebelumnya bersirkulasi di lapangan (Tabel 5.10. virus H2N2 memiliki gen-gen hemagglutinin (HA), neuraminidase (NA), dan protein polimerase dasar (PB1) dari virus unggas, dimana virus H3N2 memiliki gen HA dan PB1 dari virus unggas [109, 132, 175].
Pandemi H1N1 tahun 1918 yang sangat menghancurkan mengakibatkan estimasi kematian sebesar 50 sampai 100 juta kematian di seluruh dunia selama tiga ‘gelombang’ penyakit [138]. Pandemi H2N2 tahun 1957 dan H3N2 tahun 1968 bersifat lebih ringan, akan tetapi tetap menghasilkan estimasi kematian sebesar masing-masing 70.000 dan 34.000 di Amerika Serikat [148]. Pandemi H1N1 2009 mengejutkan dunia tidak hanya karena dimulai di Meksiko, dan upaya persiapan terhadap pandemi pada masa itu hanya berfokus pada virus avian influenza berpatogenitas tinggi (HPAIV) H5N1 yang telah menjadi endemik pada unggas di setidaknya enam negara, tetapi juga karena ke delapan gen yang ada pada virus H1N1 tahun 2009 berasal dari babi [79]. Meskipun pandemi H1N1 tahun 2009 relatif ringan, diestimasikan telah mengakibatkan 200.000 kematian di seluruh dunia, dengan yang terdampak paling besar adalah individu berumur muda [56]. Mengikuti keempat pandemi ini, virus yang menyebabkan pandemi telah menyesuaikan diri di dalam populasi manusia dan terus menerus berevolusi melalui antigenik drift sepanjang waktu, menyebabkan banyak pandemi pada manusia dan menyebabkan dampak kumulatif kesehatan masyarakat yang substansial. Sebagai contoh, telah diestimasikan bahwa sirkulasi virus influenza musiman menyebabkan angka rawat inap tahunan sebesar 200 ribu, dan kematian tahunan sebesar 3 ribu sampai 49 ribu hanya di Amerika Serikat saja, dan kematian tahunan sebesar 300 ribu sampai 500 ribu di seluruh dunia [27, 194, 231].

Karena adanya keragaman yang luas diantara virus IAV (misalnya 18 subtipe HA dan 11 subtipe NA) yang ada pada hospes non-manusia, tidak dimungkinkan untuk memprediksi subtipe yang mana yang akan menyebabkan pandemi influenza berikutnya dan kapan pandemi itu akan terjadi. Akan tetapi, kita tahu bahwa kemungkinan munculnya pandemi influenza berikutnya sangat tinggi karena virus HPAIV subtipe H5NX dan virus LPAI subtipe H5N2, H6N1, H7N2, H7N3, H7N9, H9N9, H10N7, dan H10N8 bersirkulasi secara luas pada unggas dan telah diperlihatkan memiliki kemampuan untuk melompati batasan spesies untuk menginfeksi manusia. Dan lagi, variasi reasortan virus H1N1, H1N2, dan H3N1 yang endemik pada populasi babi juga telah menginfeksi manusia, dan berpotensi sebagai ancaman pandemi yang siginifikan, dibuktikan dengan adanya pandemi H1N1 tahun 2009.
Meskipun infeksi AIV jarang terdeteksi pada manusia sebelum outbreak HPAI H5N1 di Hong Kong, penelitian awal uji tantang pada manusia menggunakan 10 virus IAV yang berbeda mengindikasikan bahwa manusia dapat terinfeksi oleh setidaknya tiga subtipe virus yang digunakan dalam penelitian, yaitu H4N8, H6N1, dan H10N7 [11]. Selama 41 tahun antara tahun 1959 sampai 2000, hanya ada 72 infeksi yang dilaporkan pada manusia oleh virus IAV yang berasal dari hewan [75, 100, 228, 135]. Peningkatan surveillans influenza secara global ditambah dengan penggunaan metode molekuler sensitif untuk mendeteksi infeksi vrius IAV yang berasal dari hewan membuat 1400 kasus pada manusia dapat terlaporkan antara tahun 2000 sampai 2014 [100]. Faktor lain yang mungkin berkontribusi pada peningkatan dalam deteksi kasus pada manusia diantaranya peningkatan kepadatan populasi manusia, babi dan unggas, dan juga meningkatnya perjalanan dan perdagangan global [100, 101]. Kebanyakan infeksi virus IAV yang berasal dari hewan pada manusia akhir-akhir ini disebabkan oleh tiga subtipe berbeda, yaitu HPAIV H5N1, LPAIV H7N9, dan virus IAV varian H3N2 (dari babi) [100].
HPAIV H5N1 yang bersifat panzootik pada unggas, sejauh ini telah menyebabkan 700 laporan infeksi pada manusia, dan sangat mungkin menjadi ancaman terhadap kesehatan masyarakat global karena menyebabkan tingkat kematian kasus sebesar 60% diantara manusia yang terinfeksi. Konsekuensi yang berpotensi menghancurkan dapat terjadi jika virus-virus ini mendapatkan kemampuan untuk menular secara efisien diantara manusia. Akan tetapi, virus IAV unggas dan babi lainnya juga harus diperhatikan. Selama dua tahun terakhir ini sebanyak 470 infeksi pada manusia yang disebabkan oleh LPAIV H7N9 telah dilaporkan pada WHO. Penting dicatat bahwa infeksi H7N9 pada manusia berakumulasi dalam tingkat yang lebih cepat dibandingkan dengan kasus HPAI H5N1. Hal ini mungkin karena memiliki mutasi yang memberikan adaptasi parsial terhadap mamalia dan kemampuan yang lebih besar untuk menginfeksi manusia dibandingkan virus H5N1. Meskipun belum diketahui jumlah dan sifat mutasi yang tepat yang diperlukan untuk menghasilkan transmisi effisien dari manusia ke manusia untuk virus H5N1, H7N9 dan IAV lainnya yang ada sekarang ini, telah dimengerti dengan baik bahwa mutasi adaptif tambahan dan atau genetic reassortment dengan IAV pada manusia dapat membuat virus ini lebih dapat ditransmisikan antar manusia. Meskipun virus IAV H5N1 dan H7N9 memiliki ancaman pandemi yang signifikan, infeksi pada manusia akhir-akhir ini ditambah dengan dengan studi serologi manusia mengindikasikan bahwa virus IAV H1N1 Eurasia dari babi juga memiliki ancaman pandemi pada manusia, karena tidak adanya antibodi terhadap virus ini dalam populasi manusia [95]. Di sini kita akan mendiskusikan infeksi zoonotik virus IAV pada manusia dan implikasi kesehatan masyarakat yang ditimbulkannya.
Diagnosa infeksi virus influenza A yang berasal dari hewan
Infeksi virus influenza sulit untuk diindentifikasi hanya dengan pemeriksaan klinis dan temuan laboratoris rutin saja. Karena itulah pengujian diagnostik spesifik harus digunakan untuk menentukan apakah pasien terinfeksi dan untuk memberi petunjuk manajemen pasien. Pengujian tersebut diantaranya metode deteksi molekuler, isolasi dan identifikasi virus, deteksi virus langsung dalam spesimen klinis (respiratori), uji cepat pada point-of-care, dan uji serologis.
Metode molekuler saat ini diaplikasikan secara luas untuk mendiagnosa infeksi virus influenza, dan telah menjadi ‘standar emas’ untuk deteksi virus, karena meningkatnya sensitivitas pada uji ini dibandingkan dengan kultur virus dan metode lawas lainnya. Transkripsi terbalik dari RNA virus yang diikuti dengan amplifikasi reaksi polimerase berantai (RT-PCR) telag digunakan secara luas dalam beberapa tahun ini [108, 234]. Baru-baru ini, metode PCR menggunakan probe flouresen untuk mendeteksi dan atau kuantifikasi DNA yang sudah diamplifikasi secara ‘real time’ telah banyak digunakan [70, 135]. Penggunanaan real-time RT-PCR (rRT-PCR) mempersingkat waktu untuk mengeluarkan hasil yaitu hanya dalam sekitar 4 jam saja, meningkatkan sensitivitas dan spesifisitas diagnosis, memungkinkan kuantifikasi gen target, dan mengurangi resiko kontaminasi silang PCR melalui penggunakan sistem tertutup [108]. Dengan menggunakan primer dan probe yang menargetkan gen yang diawetkan, seperti gen matriks (M) virus influenza, bersama gen lain yang ditargetkan pada subtipe HA dan NA dari IAV yang spesifik, dimungkinkan untuk menentukan tipe dan subtipe dari infeksi virus IAV dalam hitungan jam setelah spesimen klinis diterima di laboratorium. Karena cepatnya evolusi gen HA dan NA pada virus IAV sangat penting untuk secara konstan mengevaluasi ketersediaan data sekuensing untuk menentukan apakah perlu untuk mengupdate primer dan atau probe setelah beberapa waktu.
Meskipun uji rRT-PCR memiliki sensitivitas dan spesifisitas tinggi, dan uji ‘point-of-care’ mudah dan cepat, sangat krusial untuk mendapatkan isolat virus untuk menguji adanya perubahan antigenik dan kelemahannya terhadap anti virus, dan untuk mendapatkan sekuen gen penuh (whole genome sequence) untuk infeksi IAV yang bersifat zoonosis. Informasi ini penting untuk kepentingan kesehatan masyarakat, dan bahwa isolat virus digunakan untuk memproduksi vaksin influenza pre-pandemi dan saat pandemi. Sangat penting untuk diperhatikan bahwa isolasi virus untuk spesimen klinis yang diapatkan dari manusia yang terinfeksi HPAIV harus dilakukan pada fasilitas laboratoium dengan peningkatan ke level Biosafety 3. WHO juga telah mengeluarkan petunjuk penanganan spesimen yang baik untuk kasus suspek H5N1 [241]. Pengujian RRT-PCR yang dilakukan dalam kondisi level Biosafety 2 adalah metode yang lebih disukai untuk mendiagnosi infeksi IAV asal hewan pada manusia [33]. Di Amerika Serikat, seluruh laboratorium kesehatan di seluruh negara bagian, beberapa laboratorium kesehatan masyarakat lokal, dan Pusat Pengendalian dan Pencegahan Penyakit (Centers for Disease Control and Prevention/CDC) mampu melakukan pengujian RRT-PCR untuk berbagai infeksi IAV asal hewan.
Sebelum penggunaan uji PCR secara luas untuk deteksi virus, isolasi IAV dalam kultur sel dan telur diikuti dengan uji HI untuk mengidentifikasi tipe dan subtipe virus adalah “standar emas’ dalam diagnosa influenza pada manusia. Isolat virus kemudian ditentukan tipenya, subtipenya, dan selanjutnya ditentukan antigen dan genetiknya. Hasil isolasi virus umumnya tidak keluar dalam satu minggu atau lebih, meskpun beberapa laboratorium menggunakan metode kultur cepat yang memungkinkan virus didapatkan dalam 18 sampai 24 jam [262]. Fluoroimmunoassays, radioimmunoassays, dan enzyme immunoassays juga dapat digunakan untuk mendapatkan hasil dalam beberapa jam, akan tetapi uji ini sering kurang sensitif dibandingkan isolasi virus, membutuhkan peralatan dan reagen laboratorium yang spesifik, dan sangat jarang digunakan [108].
Sejumlah uji pada masa ‘point-of-care’ yang tersedia secara komersial menggunakan immunoassays untuk mendeteksi protein virus influenza dalam spesimen. Sebagian dari uji ‘point-of-care’ yang saat ini tersedia dapat mendeteksi baik IAV maupun virus influenza B (IBV), dan dapat membedakan keduanya. Akan tetapi beberapa diantaranya hanya mendeteksi IAV atau IBV saja, atau tidak membedakan keduanya. Secara umum, uji-uji diagnostik ini sangat berguna untuk menentukan dalam 15 menit apakah influenza merupakan penyebab wabah di suatu fasilitas kesehatan atau bersirkulasi dalam populasi pasien. Uji-uji ini telah dilaporkan memiliki kisaran sensitivitas yang luas (50 – 70%) dan spesifisitas (90-95%), untuk mendeteksi infeksi influenza musiman [36%], dan kurang sensitif untuk mendeteksi infeksi novel dan IAV asal hewan [8, 9, 72]. Baru-baru ini, uji diagnostik ‘point-of-care’ cepat yang baru telah tersedia dengan sensitivitas yang lebih tinggi (>60 – 70%) untuk mendeteksi IAV musiman pada spesimen respiratori. Ini termasuk juga pengujian yang menggunakan alat analisis untuk mendeteksi antigen virus influenza musiman, dan uji molekular cepat dengan sensitivitas yang lebih tinggi daripada uji deteksi antigen. Uji molekuler lainnya yang tersedia untuk mendeteksi RNA virus influenza dalam spesimen resporatorik dalam 1 sampai 2 jam, akan tetapi uji-uji ini harus dilakukan di laboratorium klinis yang mampu menjalankan uji diagnostik dengan kompleksitas sedang.
Infeksi IAV asal hewan pada manusia juga bisa dideteksi dengan mengikur kenaikan antibodi spesifik influenza dalam sampel serum yang diambil saat infeksi akut dan setelah kesembuhan dari pasien. Karena diperlukannya dua pasang serum, serodiagnosis untuk infeksinya bersifat retrospektif (melihat ke sejarah pasien) karena itulah tidak berguna untuk manajemen pasien. Teknik untuk mengukur antibodi terhadap influenza dalam sera meliputi uji HI, netralisasi virus, dan enzyme immunoassays. Secara umum, uji-uji ini dianggap sensitif, dan dapat memberikan satu-satunya jalan untuk mendokumentasikan infkesi influenza pada situasi dimana spesimen respiratorik tidak tersedia. Uji mikonetralisasi (MN) secara umum lebih sensitif dan spesifik daripada uji HI untuk mendeteksi antibodi, dan telah menjadi ‘standar emas’ untuk mendeteksi antibodi IAV dalam serum manusia. Pengujian ini sensitif dan spesifik, dapat mengeluarkan hasil dalam 2 hari atau kurang, dan dapat mendeteksi antibodi spesifik subtipe virus tertentu pada titer yang tidak terdeteksi oleh uji HI [174].
Infeksi LPAIV pada manusia
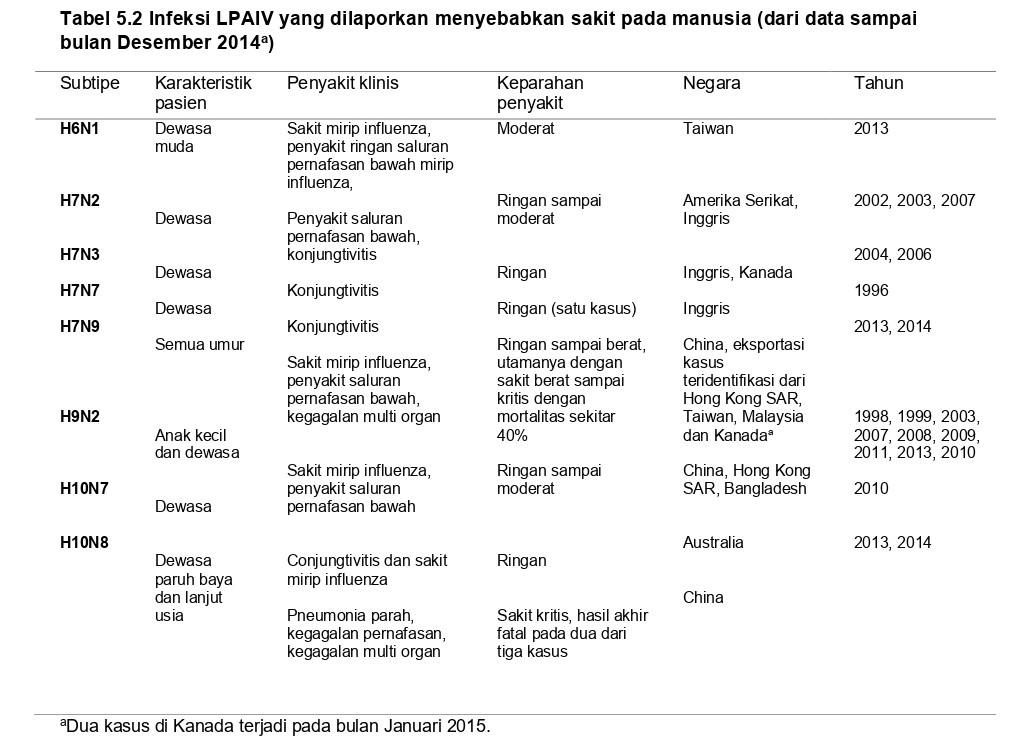
Infeksi LPAIV dengan subtipe berbeda (diantaranya H6N1, H7N2, H7N3, H7N7, H7N9, H9N2, H10N7, H10N8) secara sporadis pada manusia telah dilaporkan dapat menyebabkan sakit pada manusia (Tabel 5.2). sebagian besar infeksi virus LPAI ini telah dihubungkan baik dengan kontak langsung dengan unggas maupun dengan kontak tidak langsung, seperti mengunjungi pasar unggas hidup. Meskipun sebagian infeksi pada manusia telah dihubungkan dengan ekposur selama wabah berlangsung, banyak kasus lain timbul setelah ekposur dengan unggas tanpa adanya wabah yang terindentifikasi pada unggas tersebut, dan beberapa kasus LPAI pada manusia lainnya sumber eksposur tetap belum diketahui.
Beberapa subtipe LPAIV telah dilaporkan menyebabkan penyakit pada manusia dengan keparahan yang berbeda-beda, mulai dari penyakit saluran pernafasan atas ringan, moderat, sampai berat ditambah dengan komplikasi, beberapa infeksi berakhir dengan kesembuhan total sementara lainnya berakhir dengan kematian (Tabel 5.2). Sebelum kemunculan LPAIV H7N9 di China tahun 2013, temuan klinis infeksi LPAIV yang paling umum adalah konjungtivitis, yang terobservasi pada manusia dewasa yang terinfeksi subtipe H7 dan H10. Sakit mirip influenza (Influenza-like ilness/ILI) dengan demam dan sindrom dan gejala saluran pernafasan atas juga telah dilaporkan pada pasien yang terinfeksi LPAIV H7N2, H7N3, dan H9N2, sementara subtipe H6N1 dilaporkan menyebabkan pneumonia ringan pada satu pasien [218]. Penyakit saluran pernafasan atas dengan keparahan moderat sampai fatal telah dilaporkan pada infeksi H9N2, H7N2, dan H10N8 pada individu dengan immmunosupresi atau komorbid lainnya (Tabel 5.2). Infeksi HPAIV, LPAIV, dan AIV asal hewan lainnya dideskripsikan berdasarkan subtipenya di bawah ini, dimulai dengan wabah infeksi LPAIV H7N9 yang saat ini (2017) sedang berlangsung di China. Informasi tentang LPAIV dan HPAIV pada manusia dapat ditemukan pada Bagian berikutnya dari seri buku ini.
Infeksi LPAIV H7N9 pada manusia
Pada bulan Februari dan Maret 2013, tiga kasus infeksi LPAIV H7N9 awal pada manusia terjadi di wilayah China bagian timur [77]. Ketiga kasus H7N9 ini adalah pada manusia yang mengalami pneumonia berat dan meninggal akibat kegagalan bernafas, menimbulkan kekhawatiran bahwa pandemi H7N9 bisa saja muncul.
Wabah infeksi LPAIV H7N9 yang luas terjadi setelahnya di China selama musim semi tahun 2013 dan musim gugur dan musim dingin tahun 2013 – 2014, dan terus berlanjut. Awalnya kasus LPAI H7N9 pada manusia teridentifikasi di provinsi China bagian timur, kemudian di China bagian selatan. Kasus H7N9 pada manusia kemudian dilaporkan dari wilayah geografi yang lebih luas di China, termasuk wilayah barat laut yang jauh. Kasus infeksi H7N9 pada manusia dihubungkan dengan eksposur dan infeksi di China daratan juga telah diidentifikasi di Hong Kong SAR, Taiwan, Malaysia dan Kanada. Sebagian besar kasus infeksi LPAIV H7N9 telah mengalami pneumonia berat yang membutuhkan perawatan di rumah sakit, dan mayoritas pasien yang masuk ke unit gawat darurat untuk menerima rawatan intensif karena kegagalan pernafasan berakibat angka kematian yang tinggi [76, 126]. H7N9 adalah LPAIV pertama yang telah menyebabkan angka kesakitan dan penyakit fatal pada manusia dengan frekuensi tinggi secara konstan. Pada akhir Desember 2014, sekitar 470 kasus H7N9 pada manusia telah dilaporkkan, dengan angka fatalitas kasus (CFR) sebesar rata-rata 38%. Meskipun sejumlah besar kasus ini terjadi dalam waktu yang relatif singkat, salah satu studi menunjukkan bahwa jumlah kasus yang dilaporkan jauh berada di bawah kasus infeksi LPAIV H7N9 yang sebenarnya [249]. Kasus LPAI H7N9 mencapai puncaknya pada kondisi temperatur lebih dingin dan kelembaban lebih rendah pada bulan-bulan musim gugur dan musim dingin pada kedua tahun terjadinya wabah, menunjukkan pola musiman yang mirip dengan flu musiman.
Spektrum umur lebar pada kasus-kasus yang dilaporkan, dengan umur rata-rata 60 tahun, dan kasus infeksi pada pria dua kali lebih banyak daripada wanita [100]. Hal ini kontras dengan umur rata-rata infeksi untuk virus HPAI H5N1 yaitu 18 tahun, dan distribusi kasus berdasarkan jenis kelamin yang hampir sama [156]. Alasan perbedaan ini belum dimengerti, akan tetapi diduga dikarenakan bahwa pria berumur lebih tua lebih sering mengunjungi pasar unggas hidup. Studi kontrol kasus melaporkan bahwa keberadaan kondisi medis kronis merupakan faktor resiko infeksi LPAIV H7N9 [3]. Faktor resiko kematian untuk pasien H7N9 meliputi umur yang lebih tua dan penyakit paru-paru kronis [103]. Kekhawatiran terhadap pandemi influensa juga meningkat dengan teridentifikasinya klaster-klaster sporadis H7N9 pada manusia, termasuk beberapa klaster dimana transmisi virus H7N9 antar manusia ke manusia yang bersifat terbatas dan tidak berkelanjutan mungkin saja terjadi [126, 165].
Virus H7N9 telah diisolasi dari beberapa pasar unggas hidup yang telah dikunjungi sebelum munculnya gejala pada kasus manusia dan studi epidemiologi dan virologi telah menunjukkan bahwa banyak kasus infeksi LPAIV H7N9 di perkotaan dihubungkan dengan ekposur pada pasar unggas hidup [10, 42, 92, 126]. Sebuah kasus kontrol kasus melaporkan bahwa ekposur pada pasar unggas hidup, meskpiun tanpa kontak dekat dengan unggas, merupakan faktor resiko signifikan untuk infeksi H7N9 [133]. Studi yang lain melaporkan kontak langsung dengan unggas dan ekposur lingkungan terhadap unggas merupakan faktor resiko infeksi H7N9 [3]. Studi serologis terhadap pekerja bidang unggas di wilayah dimana dilaporkannya kasus pada manusia mengungkap bahwa sekitar 6% diantara mereka memiliki antibodi terhadap virus H7N9, sedangkan tidak ada antibodi yang terdeteksi pada populasi umum [247]. Lebih jauh lagi, sebuah studi mengestimasikan penutupan pasar unggas hidup mengurangi jumlah rata-rata penambahan kasus infeksi H7N9 per hari sampai 97-99% pada empat kota besar di China Timur selama tahun 2013 [252].
Sebagian besar pasien dengan infeksi H7N9 yang dirawat dengan oseltamivir menerima perawatan yang terlambat, umumnya menerima perawatan di rumah sakit rata-rata setelah 7 hari munculnya gejala [76]. Beberapa pasien ini mengembangkan ketahanan terhadap oseltamivir yang dihubungkan dengan subsitusi R292K pada neuraminidase virus, susbtitusi ini juga berakibat menurunnya efek inhibitor peramivir terhadap virus. Beberapa pasien ini juga telah menerima perawatan dengan kortikosteroid, mengalami pengeluaran virus yang berkepanjangan, dan mengalami penyakit kritis dan hasil akhir yang fatal [96].
Beberapa isolat virus H7N9 dari manusia telah diperlihatkan memiliki tropisme terhadap reseptor mirip unggas (α2,3-linked sialik acid) dan mirip manusia (α2,6 linked sialik acid) di saluran pernafasan, dan dapat menginfeksi sel epitel saluran pernafasan atas dan bawah dan bereplikasi dengan efisien pada kultur ex-vivo jaringan bronchus dan paru-paru [39, 204, 215, 256]. Studi infeksi H7N9 secara eksperimental pada musang menunjukkan bahwa transmisi lewat droplet respiratori lebih mudah untuk virus H7N9 dibandingkan virus H5N1, akan tetapi tidak lebih mudah dibandingkan virus IAV musiman [14, 245, 259]. Dual tropisme untuk kedua reseptor mirip unggas dan mirip manusia mengindikasikan bahwa virus LPAIV H7N9 kemungkinan akan terus bersirkulasi pada unggas domestik dan pasar unggas hidup, dan mengakibatkan infeksi pada manusia. Karakteristik ini, selain juga marker molekuler lainnya yang digunakan untuk beradaptasi pada mamalia dalam genome virus H7N9, meningkatkan kekhawatiran tentang potensi terus beradaptasinya virus H7N9 yang dapat menimbulkan pandemi.
Infeksi LPAIV H7NX lainnya pada manusia
Sebelum wabah LPAI H7N9 yang dramatis di China selama 2013, telah ada beberapa laporan infeksi H7NX pada manusia, dan sebagian besar kasus ini secara klinis bukanlah infeksi berat. Sebagai contoh, tahun 1996 wanita berumur 43 tahun mengalami conjungtivitis unilateral 1 hari setelah sehelai jerami secara tidak sengaja masuk ke matanya saat membersihkan kandang itik yang digunakan untuk memelihara 26 itik yang tampak sehat secara klinis. Virus LPAIV H7N7 diisolasi dari spesimen swab konjungtiva yang diambil dari wanita tersebut [121]. Di Amerika Serikat, selama wabah H7N2 yang meliputi banyak negara bagian diantara populasi ayam dan kalkun pada peternakan unggas komersial tahun 2002, petugas pemusnahan yang bertugas untuk memusnahkan unggas mengalami ILI dengan demam dan gejala sakit pernafasan atas, dan telah dikonfirmasi secara serologis terinfeksi LPAIV H7N2 [38]. Di Inggris pada tahun 2006, pekerja pada peternakan yang mengalami wabah H7N2 pada unggas didiagnosa mengalami konjungtivitis dan virus LPAIV H7N3 diisolasi dari usap konjungtiva, nasopharing dan tenggorokan [119, 146]. Setelahnya empat infeksi H7N2 pada manusia terdeteksi melalui pengujian RT-PCR terhadap spesimen konjungtiva dan respiratori dari orang dewasa yang berontak dengan unggas yang dihubungkan dengan wabah H7N2 di Inggris selama tahun 2007 [69]. Tiga dari kasus-kasus ini dirawat di rumah sakit karena penyakit saluran pernafasan bawah, dan salah satunya mengalami konjungtivitis [69]. Meskipun begitu, di Amerika Serikat sumber infeksi LPAIV H7N2 tidak dapat tidak dapat dipastikan untuk penderita dewasa dengan penyakit immunosupresi yang dirawat di rumah sakit karena demam dan sakit saluran pernafasan bawah dan virus H7N9 diisolasi dari spesimen respiratorinya [153]. Tidak ada data klinis terkontrol terhadap efektivitas treatment antiviral untuk infeksi LPAIV H7NX, dan pada banyak kasus infeksi H7NX dengan sakit ringan sampai sedang telah dikonfirmasi setelah resolusi penyakit tanpa pengobatan antiviral.
Infeksi LPAIV H9N2 pada manusia
Total sebanyak 15 manusia yang terinfeksi LPAI H9N2 telah dilaporkan, dimana lima kasus pertama memiliki onset ILI pada bulan Juli dan Agustus 1998 di China daratan [253]. Laporan ini memuat pula enam kasus pediatri yang menjadi sakit pada November 1999. Virus LPAIV H9N2 diisolasi dari infeksi manusia tahun 1998 secara genetik memiliki hubungan dengan virus H9N2 galur G9 yang bersirkulasi pada ayam, sementara isolat virus tahun 1999 adalah virus reassortan dari galur G1 dan G9 [253]. Pada tahun 1999, dua orang anak yang tidak memiliki hubungan di Hong Kong SAR, China diperiksa dengan gejala sakit ringan dan self-limiting, kemudian dimasukkan ke rumah sakit yang berbeda [160]. Virus H9N2 yang diisolasi dari dua kasus ini terkait secara antigenik dengan virus galur G1 yang telah diisolasi dari burung puyuh di Hong Kong tahun 1997 [91, 130]. Investigasi lanjutan terhadap kontak dekat untuk dua kasus ini tidak menemukan bukti adanya transmisi manusia ke manusia [202]. Pada N-oember 2003, virus H9N2 telah diisolasi dari anak berusia 5 tahun di Hong Kong yang dilaporkan tidak pernah berkontak dengan unggas [21]; virus ini serupa dengan virus mirip Y280 yang bersirkulasi di populasi unggas di wilayah itu. Tidak ada informasi yang tersedia yang menyatakan adanya eksposur terhadap unggas pada beberapa kasus H9N2 pada manusia lainnya yang telah dilaporkan [229]. Dua kasus tambahan infeksi H9N2 diidentifikasi selama tahun 2008 dan 2009 pada pasien wanita penderita penyakit immunosupresi di Hong Kong [43]. Satu kasus terjadi pada bayi perempuan berumur 3 bulan yang mengalami leukemia limfoblastik akut, dan kasus kedua pada orang dewasa dengan penyakit graft-versus-host setelah menjalani transplantasi sumsum tulang belakang; kedua pasien berhasil sembuh. Analisis genetik virus yang didapat dari kedua pasien ini mengungkap bahwa salah satunya berasal dari jalur keturunan G1 dan yang satunya berasal dari jalur keturunan Y280 [43]. Kasus tunggal H9N2 pada manusia telah dilaporkan di Bangladesh, dimana anak perempuan berusia empat tahun dengan onset penyakit respiratori pada Februari 2011 dibawa untuk mendapatkan perawatan medis di Dhaka [99]. Spesimen basuh hidung dari pharing dari pasien ini mendapatkan virus H9N2 dari jalur keturunan G1. Pada akhirnya anak perempuan tersebut sembuh dan tidak ada bukti adanya transmisi. Pada tahun 2013, dua kasus infeksi LPAI H9N2 pada manusia muncul lagi di Hong Kong, dimana anak laki-laki berumur 7 tahun mengalami onset klinis di bulan November dan pria berumur 86 tahun dilaporkan mengalami onset klinis pada bulan Desember [85, 86].
Informasi demografi yang tersedia untuk 15 kasus H9N2 menyebutkan dua kasus pada orang dewasa termasuk wanita berumur 47 tahun dan pria berumur 86 tahun. Kasus pada anak mencatat usia tujuh dari delapan anak yang terinfeksi berumur antara 3 bulan sampai 7 tahun. Lima dari enam anak yang diketahui jenis kelaminnya adalah perempuan. Meskipun beberapa kasus memiliki penyakit penyerta, semua pasien sembuh sepenuhnya, dan tidak ada bukti transmisi LPAIV H9N2 kepada anggota keluarga ataupun petugas kesehatan. Pada beberapa kasus telah memiliki riwayat kontak dengan unggas hidup ataupun yang sudah disembelih atau telah mengunjungi pasar unggas sebelum onset munculnya gejala.
Virus LPAIV H9N2 sangat menarik karena mereka telah terdistribusikan secara luas pada unggas air liar dan unggas domestik di China, Asia Tenggara, India dan Timur Tengah, dan telah bersirkulasi setidaknya sejak tahun 1994 [89]. Kesuksesan virus H9N2 lebih jauh ditunjukkan dengan fakta bahwa enam gen internal virus H9N2 telah ditransfer kepada virus HPAIV H5N1, dan LPAIV H7N9 dan H10N8 melalui genetic reassortment [100]. Menariknya, virus LPAIV H9N2 yang diisolaso dari unggas di China bagian selatan antara tahun 2009 sampai 2013 telah ditunjukkan memiliki kesukaan mengikat diri dengan reseptor mirip manusia (α2,6 linked sialik acid), dan beberapa dapat melakukan transmisi pada musang melalui droplet respiratori [127]. Lebih jauh lagi, LPAIV H9N2 juga menginfeksi babi. Empat virus LPAIV H9N2 diisolasi dari sampel yang diambil pada tahun 1999 dari babi yang ada di RPH Hong Kong, dan dua diantaranya memiliki kesamaan dengan virus dari galur keturunan Y280 yang bersirkulasi pada unggas dan burung air pada saat yang bersamaan. Kedua virus lainnya lebih dekat dengan virus yang diisolasi dari ayam pada tahun 1994, mengindikasikan adanya introduksi yang terpisah dari spesies unggas kedalam populasi babi [158]. Kemampuan virus untuk menginfeksi dan menyebar dalam populasi babi konsisten dengan kemampuannya untuk berikatan dengan reseptor mirip manusia, dan ditambah dengan kapabilitas transmisi pada musang akan mengindikasikan bahwa virus LPAIV H9N2 memiliki ancaman pandemi terus-menerus terhadap manusia.
Infeksi LPAIV H10NX pada manusia
Satu dari 10 subtipe IAV yang berbeda digunakan untuk uji tantang pada sukarelawan pada studi awal adalah virus LPAIV H10N7. Menariknya, 15 sukarelawan ditantang dengan LPAIV H10N7 A/turkey/Minnesota/3/79, dan spesimen bilas hidung dikumpulkan dari enam sukarelawan 3 sampai 4 hari setelah tantangan menghasilkan isolat virus. Delapan sukarelawan menunjukkan penyakit klinis yang ringan atau sangat ringan setelah uji tantang virus, sementara tidak ada yang menunjukkan peningkatan antibodi HI sebesar empat kali lipat atau lebih tinggi terhadap virus tersebut.
Pada tahun 2004, LPAIV H10N7 diisolasi dari dua orang anak, keduanya berumur dibawah 1 tahun dan tinggal di Mesir [155], dan telah dicatat bahwa virus H10N7 telah diisolasi dari itik liar di kota yang sama. Tidak ada bukti adanya kasus manusia tambahan di area itu. Pada awal 2010, bukti telah didapatkan untuk infeksi manusia oleh LPAIV H10N7 di Australia selama wabah virus yang sama pada bulan Maret pada fasilitas perunggasan komersial dimana unggas menunjukkan penurunan produksi telur [7]. Sebelum melakukan prosessing, unggas dari peternakan yang terinfeksi terdeteksi negatif terhadap virus tersebut dan tidak menunjukan gejala sakit. Akan tetapi dalam 7 hari setelah unggas diproses, lima pekerja Rumah Potong Unggas menunjukkan gejala konjungtivitis dengan rinore (hidung berair/pilek), dan sepertiga dari mereka melakorkan konjungtivitis, rinore, dan sakit tenggorokan. Meskipun isolasi virus tidak berhasil dilakukan, sekuensing parsial dari genome dari sampel yang diambil dari dua pekerja yang menimbulkan gejala mengindentifikasi virus H10N7 dengan hasil sekuens genome parsial identik dengan yang ditemukan dari virurs dari flok yang terinfeksi. Tidak ada satupun pekerja yang diuji diagnostik menggunakan uji HI atau MN menunjukkan peningkatan titer antibodi terhadap virus H10 [7].
Kasus H10N8 pada manusia pertama kali adalah pada wanita berumur 73 tahun yang dirawat di rumah sakit di China [41, 196] dengan penyakit pernafasan dan demam pada November 2013, dan setelah itu meninggal dunia. Kasus kedua infeksi LPAIV H10N9 yang dirawat di rumah sakit dilaporkan pada bulan Januari 2014 pada seorang wanita China berumur 55 tahun yang berhasil selamat dari penyakit yang parah. Kasus H10N8 ketiga pada pria berumur 75 tahun dengan onset penyakit bulan Februari tahun itu, dan menyerah terhadap infeksi H10N8 setelah masuk rumah sakit [78, 219, 225]. Ketiga penderita dalam kasus ini dilaporkan memiliki kondisi medis penyerta, dan dua kasus melaporkan bahwa mereka mengunjungi pasar unggas hidup beberapa hari sebelum onset penyakit [254]. Tidak ada bukti andanya transmisi antar manusia. Virus LPAIV H10N8 yang menyebabkan infeksi pada manusia adalah virus reasortan dengan gen HA dan NA dari virus H10N8 dan enam segmen gen lainnya dari virus H9N2.
Virus LPAIV H10 telah diisolasi sebelumnya dari pasar unggas hidup di provinsi Guangxi melalui sampel yang diambil tahun 2009-2011 [161]. Pada Januari 2012, LPAIV H10N8 telah diisolasi dari itik yang disampel dari pasar unggas hidup di provinsi Guangdong [104]. Sebuah studi baru-baru ini telah menunjukkan bahwa prevalensi LPAIV H10N8 telah meningkat pada pasar unggas hidup di China [246]. Lebih jauh lagi, sebuah studi tentang pengikatan reseptor viurs IAV H10 menunjukkan bahwa virus-virus ini memiliki kesukaan tinggi pada reseptor yang mirip dengan reseptor pada manusa [203], konsisten dengan percobaan yang sukses menginfeksikan virus LPAIV H10N7 pada manusia yang dilaporkan pada studi yang lebih awal lagi [11].
Infeksi LPAIV H6N1 pada manusia
Diantara 11 sukarelawan yang diuji antang dengan virus H6N1 A/duck/Pennsylvania/486/69 pada studi awal, ada tiga orang menunjukkan gejala tidak enak badan ringan atau sangat ringan, dan tidak ada satupun dari sukarelawan yang menunjukkan gejala yang konsisten dengan ILI [11]. Virus diisolasi melalui spesimen basuh hidung dikoleksi 3 sampai 4 hari pasca inokulasi dari dua sukarelawan yang terinfeksi. Akan tetapi, antibodi HI tidak terdeteksi pada seluruh sukarelawan [11].
Kasus H6N1 pertama pada manusia terdeteksi pada Mei 2013 di Taiwan [218]. Pasien tersebut, yaitu wanita berusia 20 tahun, atang dengan gejala ILI, dan diberikan perawatan di rumah sakit dan diberi pengobatan dengan oseltamivir dimulai 3 hari setelah munculnya gejala. Pasien menyangkal berkontak dengan unggas sebelum mengalami gejala sakit. Proses tracking dengan 17 kontak dekat dan 19 pekerja medis mengidentifikasi bahwa ada 6 orang yang mengalami demam atau sakit saluran pernafasan setelah kontak dengan kasus awal. Swab yang dikumpulkan dari orang-orang yang mengalami gejala semuanya gegatif terhadap bukti adanya infeksi virus H6 [218], meskipun harus diperhatikan bahwa swab dikumpulkan dari orang-orang ini setelah mereka sembuh. Tidak ada kasus terkonfirmasi H6N1 lain yang teridentifikasi, dan pasien mengalami kesembuhan dengan lancar.
LPAIV dari subtipe H6N1 telah diisolasi dari unggas domestik di Taiwan sejak tahun 1972 [123, 211]. Virus Avian H6NX juga telah diisolasi dari unggas liar dan unggas domestik yang asimptomatik pada banyak negara di seluruh dunia [98, 212, 216]. Perlu untuk dicatat bahwa beberapa LPAIV H6N1 yang bersirkulasi pada unggas di Taiwan sejak 2005 memiliki tambahan G2285 pada HA yang juga ada pada isolat yang didapat dari kasus pertama pada manusia [218]. Tidak diketahui apakah residu ini menambahkan kemungkinan berikatannya virus H6 pada reseptor yang mirip dengan reseptor manusia (human-like receptors). Akan tetapi, karakterisasi spesifisitas pengikatan reseptor dari lebih dari 250 virus H6NX yang diisolasi dari pasar unggas hidup di China bagian selatan mengungkapkan bahwa sekitar 20% dari virus berikatan dengan α2,6-link asam sialik, dan sedikit dari virus ini ditransmisikan melalui kontak hewan percobaan pada sebuah percobaan transmisi, mengindikasikan bahwa virus-virus ini juga memiliki potensi pandemi manusia seiring adaptasi lebih lanjut [212].
Infeksi HPAIV pada manusia
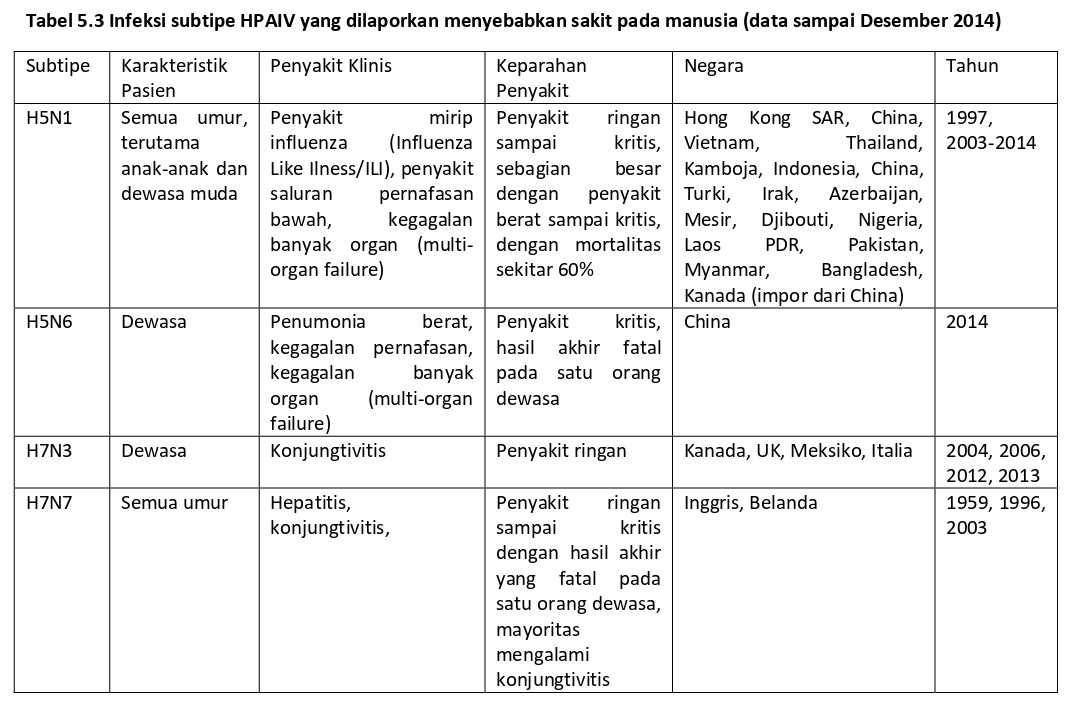
Virus HPAIV dari subtipe H5 (H5N1, H5N6) dan subtipe H7 (H7N3, H7N7) telah menyebabkan spektrum penyakit manusia yang luas (Tabel 5.3). sebagian besar kasis infeksi HPAI H5 pada manusia telah diasosiasikan dengan eksposur pada unggas. Penyebaran epizootik H5N1 HPAI yang tengah berlangsung telah berakibat setidaknya 700 kasus pada manusia dengan angka kematian yang tinggi di 16 negara dan wilayah sejak 1997 (Gambar 5.1). semenjak HPAIV H5N1 terus bersirkulasi, berevolusi dan mengalami reassortansi dengan virus AIV lainnya diantara unggas-unggas di negara-negara berbeda, infeksi HPAIV H5N1 dan HPAI H5NX lainnya diperkirakan akan muncul lagi. Sebagai contoh, surveilan aktif terhadap avian influenza pada unggas di Mesir telah menunjukkan bahwa infeksi bersama antara HPAIV H5N1 dan LPAIV H9N2 cukup sering terdeteksi [110]. Lebih jauh lagi, dua infeksi pada manusia oleh virus hasil reassortan HPAIV H5N6 dilaporkan di China selama 2014 [230, 233]. Kedua infeksi, yang menyerang orang dewasa, berakibat sakit parah dan kematian, dan kedua kasus memiliki kontak dengan unggas. Infeksi HPAIV H7N3 dan H7N7 pada manusia telah didokumentasikan dengan baik, dan kasus tambahan diperkirakan dapat muncul di masa depan seiring munculnya wabah pada unggas.
Infeksi HPAIV H7NX pada manusia
Sakit pada manusia yang disebabkan oleh HPAIV H7 telah berkisar antara sakit relatif ringan (H7N3 dan H7N7) sampai sakit yang fatal (H7N7). Kasus yang pertama dikenal yang didentifikasi tahun 1959 adalah seorang pria berumur 46 tahun yang setelah bepergian ke Asia, Timur Tengah, dan Eropa, didiagnosa mengindap hepatitis. Virus HPAIV H7N7 ditemukan dari spesimen darah yang diambil lebih dari satu bulan sejak pria itu kembali ke Amerika Serikat [63]. Antibodi terhadap H7N1 tidak terdeteksi pada serum convalescent dari pasien ini, dan hubungan virus HPAIV H7N7 dengan kasus ini tidak jelas.
Pada tahun 2003, selama tersebar luasnya wabah HPAI H7N7 diantara unggas di peternakan-peternakan komersial di Belanda, sebanyak 89 kasus H7N7 pada manusia telah diidentifikasi [117]. Majoritas kasus H7N7 (88%) mengalami hanya konjungtivitis saja, sementara lima orang mengalami ILI dan konjungtivitis, dua orang hanya mengalami ILI saja, dan empat orang mengalami gejala selain itu. Petugas pemusnahan unggas dan dokter hewan yang terlibat dengan wabah ini memiliki estimasi attack rate tertinggi untuk infeksi akibat LPAI H7N7. Hanya satu dari kasus terkonfirmasi H7N7 telah menjalani terapi antiviral kemoprofilaksis menggunakan oseltamivir, dan hanya tiga kasus menerima terapi dengan oseltamivir [117]. Semua kasus tersebut sembuh dengan baik kecuali pada seorang dokter hewan berumur 57 tahun yang mengalami demam tinggi dan sakit kepala berat tanpa adanya sindrom respirasi dua hari setelah mengunjungi peternakan yang ayam-ayamnya terinfeksi HPAI H7N7. Sembilan hari setelah eksposur dan dan tujuh hari setelah onset penyakit, ia dirawat di rumah sakit karena pneumonia, setelahnya keadaannya semakin menurun dan ia meninggal dunia tiga belas hari setelah onset gejala klinis [74, 117]. H7N7 yang diisolasi ari kasus ini memiiliki perbedaan yang jauh dibandingkan virus H7N7 yang diisolasi dari pasien-pasien lain, akan tetapi mirip dengan virus yang diisolasi dari unggas pada wilayah yang sama [74, 141]. Total sebanyak 86 kasus primer infeksi HPAIV H7N7 terindentifikasi dari estimasi sekitar 4500 orang yang terekspos unggas yang terinfeksi H7N7 [117]. Individu-individu ini kemungkinan tertular HPAIV H7N7 melalui kontak langsung atau kontak dekat dengan unggas tertular atau material yang terkontaminasi. Tiga kasus H7N7 sekunder telah diidentifikasi pada anggota keluarga tanpa sejarah ekposur dengan unggas, akan tetapi berkontak dengan kasus primer H7N7, menunjukkan adanya transmisi H7N7 secara terbatas dari manusia ke manusia [117]. Selama wabah ini terjadi, telah terkonfirmasi bahwa dua anggota keluarga dari satu pria pekerja peternakan unggas yang terinfeksi H7N7 juga terinfeksi H7N7, yaitu anak perempuannya berumur 13 tahun mengalami konjungtivitis dan ILI dan istrinya berumur 37 tahun mengalami konjungtivitis [177]. Keduanya menerima pengobatan oseltamivir dan sembuh. Ayah berumur 44 tahun dari seorang pekerja peternakan yang menderita konjungtivitis juga akhirnya mengalami konjungtivitis satu hari setelah onset konjungtivitis terkait virus H7N7 muncul pada anaknya.
Sakit yang sangat ringan dilaporkan pada infeksi HPAIV H7N3 pada dua individual yang terlibat dalam aktivitas pemusnahan unggas selama terjadinya wabah besar di British Columbia, Kanada, selama tahun 2004 [37, 186]. Kasus pertama adalah seorang pria pekerja peternakan berusia 40 tahun yang tidak mengenakan google pelindung mata selama proses pemusnahan, dan mengalami konjungtivitis unilateral dan coryza 3 hari pasca kontak dengan unggas mati [198]. Virus H7N3 telah diisolasi spesimen nasal dari penderita. Meskipun virus ini diperkirakan sebagai HPAIV, analisis detail menunjukkan bahwa pekerja peternakan itu memang terinfeksi LPAIV H7N3. Hal ini mengindikasikan bahwa baik LPAIV H7N3 dan HPAIV sama-sama bersirkulasi selama terjadainya wabah pada unggas ini [186]. Kasus kedua adalah pada pekerja peternakan unggas berumur 45 tahun yang mengenakan kacamata pelindung yang tidak menghalangi kontak langsung antara mata dengan bulu unggas, mengalami konjungtivitis unilateral dan sakit kepala satu hari setelah eksposur. HPAIV H7N3 diisolasi dari swab konjungtiva pasien ini [198]. Kedua kasus H7N3 tahun 2004 ini diobati menggunakan oseltamivir dan sembuh sepenuhnya. Baru-baru ini, HPAIV H7N3 telah terdeteksi dari swab konjungtiva yang diambil dari dua pekerja peternakan unggas yang mengalami konjungtivitis selama wabah HPAI H7N3 menyebar di Meksiko selama tahun 2012 [134]. Pada tahun 2013 selama wabah HPAIV H7N3 pada unggas di Italia, tiga pekerja peternakan unggas diidentifikasi mengalami konjungtivitis tanpa adanya sindrom respiratori [163]. HPAIV H7N7 telah dideteksi pada swab konjungtiva pada ketiga individidu ini.
Diagnosa serologis dari infeksi HPAIV H7 tampaknya terbatas pada kurangnya respons antibodi yang terdeteksi kepada subtipe ini setelah infeksi lokal (konjungtivitis). Sebagai contoh, tidak ada antibodi H7 bisa dideteksi dengan uji HI atau MN menggunakan serum yang dikoleksi tidak lebih dari 21 hari setelah penyakit muncul pada dua kasus terkonfirmasi di Kanada [198]. Di Belanda, satu studi kohort rumah tangga terhadap 62 anggota keluarga yang tidak berkontak dengan unggas dari 25 orang pekerja peternakan unggas yang merupakan kasus indeks H7N7 menemukan bahwa delapan orang mengalami konjungtivitis atau ILI, dan empat dari lima orang memiliki antibodi HI terhadap virus H7. Meskipun begitu, studi ini menggunakan standar titer antibodi sebesar ≥ 1:10 dan 33 dari 56 partisipan memiliki antibodi H7 yang terdeteksi, sebagian besar tidak memiliki keluhan kesehatan, dan tidak ada yang memiliki bukti netralisir antibodi terhadap virus H7N7 saat dilakukan pengujian menggunakan uji MN [68]. Karena sebagian besar infeksi HPAIV H7 menunjukkan penyakit ringan, berakibat konjungtivitis dan ILI, sangat mungkin bahwa infeksi HPAIV H7 banyak yang tidak terdeteksi, bahkan selama wabah HPAI H7 yang telah diketahui.
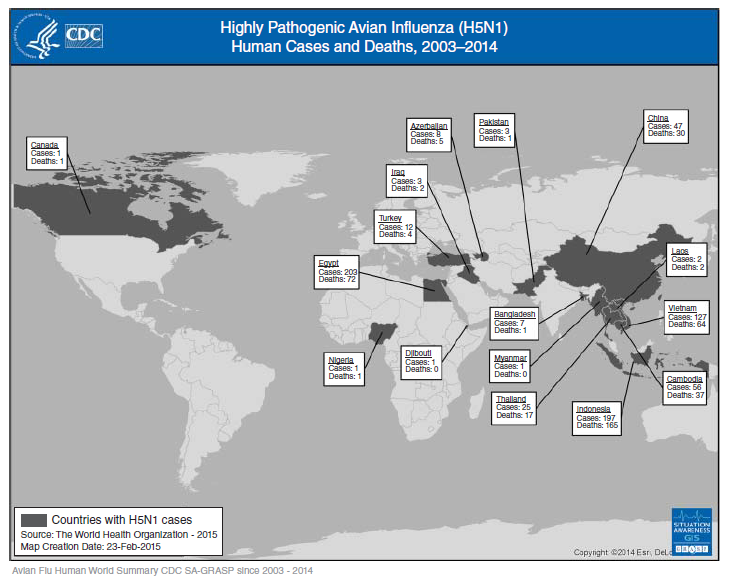
Gambar 5.1 Distribusi geografis kasus HPAI H5N1 yang dilaporkan kepada World Health Organization antara bulan November 2003 dan Desember 2014. Sumber: World Health Organization (WHO) dan Centers for Disease Control and Prevention (CDC).
HPAIV H7NX telah secepatnya dihilangkan dari unggas oleh otoritas pertanian setelah terdeteksi pada sebagian besar negara, akan tetapi berlanjutnya sirkulasi H7N3 di Meksiko adalah indikasi bahwa sumber daya yang diperlukan tidak selalu tersedia di setiap tempat. Seperti LPAIV, HPAIV H7NX memiliki potensi ancaman pandemi untuk dua alasan utama. Yang pertama, HPAIV H7 tersebar luas di alam dan dapat berubah memiliki patogenitas tinggi selama replikasi dan pasase pada unggas. Yang kedua, beberapa virus H7 mampu berikatan dengan reseptor mirip manusia dan menyebar pada musang pada sebuah eksperimen transmisi [13].
Infeksi virus HPAI H5N1 dan H5N6 pada manusia
Meskipun HPAIV H5N1 pertama kali diisolasi dari unggas pada tahun 1959, infeksi pada manusia dengan subtipe influenza ini tidak dikenali sampai tahun 1997, dimana kasus HPAI H5N1 pada manusia telah dideteksi sehubungan dengan kematian unggas pada pada pasar unggas hidup di Hong Kong [40]. Selama wabah 1997 di Hong Kong, terdeteksi adanya 18 kasus pada manusia yang menyebabkan 6 kematian. Tidak ada kasus tambahan lagi yang dilaporkan sebelum awal tahun 2003, saat dua kasus HPAI H5N1 dilaporkan pada penduduk Hong Kong yang baru saja bepergian ke Provinsi Fujian, China bagian selatan [159]. Dari pertengahan sampai akhir tahun 2003, HAPIV H5N1 telah menyebar dari unggas yang berada di China bagian selatan ke Asia Tenggaram dan menyebabkan menyebarnya wabah pada unggas di banyak negara Asia, dengan adanya kasus terkait H5N1 pada manusia [217, 229]. Sejak akhir tahun 2005, H5N1 telah menyebar diantara burung liar dan unggas di Eropa, Timur Tengah, dan Afrika, kematian beragam spesies burung liar dan unggas telah terdeteksi pada lebih dari 60 negara pada tahun 2007. Natar tahun 1997 dan 2014, hampir 700 kasus infeksi HPAI H5N1 pada manusia telah dilaporkan pada 16 negara dan wilayah berikut (diurutkan berdasarkan kronologi), yaitu: Hong Kong SAR, China, Vietnam, Thailand, Kamboja, Indonesia, Republik Rakyat China, Turki, Irak, Azebaijan, Mesir, Djibouti, Nigeria, Lao PDR, Pakistan, Myanmar dan Kanada (Gambar 5.1). Hanya ada satu kasus impor yang dilaporkan di Amerika Utara, seorang yang melakukan perjalanan ke China kembali ke Kanada pada akhir Desember 2013, dan meninggal pada Januari 2014 setelah dirawat di rumah sakit. HPAIV H5N1 diisolasi dari spesimen bronchoalveolar dari pasien ini [154]. Sebagian besar kasus H5N1 pada manusia sampai saat ini telah menyebabkan sakit yang berat, dengan tingkat fatalitas sekitar 60%.
Meskipun umur median pada wabah Hong Kong 1997 adalah 9,5 tahun, kasus H5N1 pada manusia telah muncul pada kisaran umur yang luas (antara 1 tahun sampai 60 tahun), dan hampir seluruh kasus sebelumya sehat. Diantara 18 kasus Hong Kong, terjadi 6 kasus fatal yaitu 2 orang anak dan 4 orang dewasa. Faktor resiko yang paling signifikan untuk infeksi HPAIV H5N1 adalah mengunjungi pasar unggas hidup seminggu sebelum onset penakit [140]. Tidak ada kasus H5N1 lain yang diidentifikasi setelah pemerintah Hong Kong mengimplementasikan pemusnahan luas terhadap sekitar 1,4 juta unggas, menghentikan sementara importasi unggas dari China daratan, dan memberlakukan upaya peningkatan biosekuriti pada pasar unggas hidup [40]. Studi epidemiologidilakukan diantara pekerja medis yang merawat pasien H5N1 mengidentifikasi dua individu yang mengalami peningkatan antibodi penetral HPAIV H5N1 sebanyak 4 kali lipat dalam serum pasangannya (paired sera), menunjukkan bahwa infeksi HPAI atau LPAI H5N1 tanpa gejala juga terjadi mengikuti eksposur terhadap unggas terinfeksi HPAIV H5N1 di Hong Kong [18].
Pada Februari 2003, dua penduduk Hong Kong yaitu laki-laki berumur 33 tahun dan anak laki-lakinya berumur 9 tahun, dirawat di rumah sakit dan virus HPAI H5N1 telah diisolasi dari spesimen respiratori pada kedua kasus [159]. Kedua kasus terkonfirmasi ini ditemukan diantara lima orang anggota keluarga yang bepergian pada akhir Januari 2003 dari Hong Kong ke Provinsi Fujian, China. Selama kunjungan itu, anak perempuan berumur 7 tahun yang merupakan anak dari penderita dewasa mengalami pneumonia dan meninggal dunia, akan tetapi tidak ada uji laboratorium yang dilakukan. Keempat anggota keluarga yang tersisa setelah itu kembali ke Hong Kong dimana ayah dan anak laki-lakinya akhirnya menderita sakit dan dibawa ke rumah sakit. Ayahnya akhirnya mengalami penyakit paru-paru yang berat dan mengalami sindrom tekanan respiratori akut (acure respiratory distress syndrome/ARDS), dan meninggal dunia, sementara anak laki-lakinya berhasil bertahan hidup [159].
Penyebaran wabah HPAI H5N1 diantara populasi unggas domestik terjadi di Vietnam dan Thailand pada akhir tahun 2013 dan awal tahun 2004, dan berhubungan dengan kasus H5N1 pada manusia di negara-negara ini adalah yang disebut sebagai ‘gelombang pertama’ (dari November 2003 sampai Maret 2004), dengan mortalitas sebesar 68%. Selama periode ini, Vietnam melaporkan 22 kasus dengan 15 kematian, dan Thailand melaporkan 12 kasus dengan 8 kematian. Harus dicatat bahwa kasus H5N1 yang fatal pada laki-laki berumur 24 tahun yang awalnya diduga sebagai kasus SARS, dan yang mati karena kegagalan respiratori pada bulan November 2003 di Beijing, China, juga akhirnya terkonfirmasi sebagai infeksi HPAIV H5N1 [261]. ‘Gelombang kedua’ kasus H5N1 pada manusia di Vietnam (4 kasus dengan 4 kematian) dan Thailand (5 kasus dengan 4 kematian) terjadi antara Agustus dan Oktober 2004, dan dihubungkan dengan wabah pada unggas. ‘Gelombang ketiga’ kasus H5N1 pada manusia dimulai di bulan Desember 2004 dan berlangsung sampai pertengahan tahun 2005, dengan sebagian besar kasus dilaporkan di Vietnam dan Kamboja. Tampaknya ‘gelombang keempat’ dimulai pada Juni dan Juli 2005, diamana kasus H5N1 pertama kali diidentifikasi di Indonesia, dan kasus H5N1 didentifikasi pada negara-negara yang sebelumnya tidak ditemukan kasus dihubungkan dengan penyebaran clade 2 HPAIV H5N1 diantara unggas dari Asia ke Eropa Timur (Azerbaijan dan Turki), Timur Tengah (Irak dan Mesir), dan Afrika selama pertengahan kedua tahun 2005 dan selama tahun 2006. Pada tahun 2007, kasus H5N1 pada manusia di Nigeria dan Laos pertama kali dilaporkan dan kasus-kasus terus bermunculan di Mesir dan Indonesia [229].
Pada tahun 2011, FAO telah mendeklarasikan enam negara dimana HPAI H5N1 telah menjadi endemik dan bersirkulasi pada populasi unggas, yaitu Bangladesh, China, Mesir, India, Indonesia dan Vietnam [71]. Wabah periodik HPAI H5N1 diantara unggas juga terjadi pada negara-negara yang berdekatan seperti Kamboja dan Laos, dengan transmisi sporadis kepada manusia. Sejak 2007, jumlah kasus infeksi HPAI H5N1 pada manusia per tahunnya telah menurun, akan tetapi kasus-kasus sporadis masih terus terjadi di Bangladesh, Kamboja, China, Mesir, Indonesia dan Vietnam. Kasus infeksi HPAIV H5N1 pada manusia menunjukkan gejala musiman, dengan puncak terjadi selama bulan-bulan musim dingin bersuhu lebih dingin dan kelembapan rendah, ketika juga terjadi peningkatan wabah HPAI H5N1 musiman pada unggas [136] (Gambar 5.2).
Epidemiologi deskriptif untuk kasus H5N1 sebelum tahun 2003 mengindikasikan bahwa anak-anak dan dewasa muda telah terdampak secara tidak proporsional. Median umur dari 617 kasus infeksi HPAIV H5N1 yang dilaporkan sampai April 2013 adalah 18 tahun, sama dengan analisis sebelumnya yang menganalisa 256 kasus dari 10 negara [156, 236]. Sebagian bear kasus (89%) berumur kurang dari 40 tahun. Secara statistik tidak ada perbedaan signifikan antar jenis kelamin diseluruh kelompok umur. Angka kematian keseluruhan adalah sekitar 60% dengan angka fataliti per kasus tertinggi pada umur 10 – 19 tahun (76%), dan terendah pada umur 50 tahun atau lebih (40%). Untuk kasus-kasus yang fatal, durasi median dari onset penyakit sampai mengalami kematian adalah 9 hari (kisaran 2 sampai 31 hari). Di Indonesia, median umur dari 54 kasua H5N1 adalah 18.5 tahun (kisaran 18 bulan samoai 45 tahun), 53% lebih muda dari 20 tahun, dan 24% adalah anak-anak dibawah umur 10 tahun [178]. Kematian secara total pada keseluruh 54 kasus H5N1 di Indonesia adalah 76%, dan angka kematian lebih tinggi pada perempuan daripada laki-laki.
Tiga studi analitis telah mengkonfirmasi observasi dari investigasi kasus bahwa kontak langsung dengan unggas sakit maupun mati adalah faktor resiko primer untuk terjadinya infeksi, dan bahwa H5N1 adalah penyakit zoonosis [6, 66, 257]. Satu studi kontrol kasus di China juga melaporkan bahwa faktor resiko independen lainnya meliputi eksposur tidak langsung terahadap unggas sakit atau mati, dan mengunjungi pasar unggas hidup [257]. Banyak kasus penderita sebelumnya berkontak langsung dengan unggas sakit ataupun mati, terutama ayam. Satu studi observasional di Azebaijan menghubungkan transmisi H5N1 dengan kontak langsung dengan angsa liar yang mati [82]. Studi observasional di China menemukan bahwa kasua H5N1 pada area perkotaan tidak mencatat kontak dengan unggas sakit ataupun mati, akan tetapi telah mengunjungi pasar unggas hidup sebelum onset penyakit, menunjukkan bahwa eksposur lingkungan yang berhubungan dengan mengunjungi pasar unggas hidup bisa jadi merupakan faktor resiko infeksi HPAIV H5N1 [251]. Sebagai contoh, kontak dengan fomite atau inhalasi dari material feses yang berupa aerosol atau material bulu unggas yang terkontaminasi dengan HPAIV H5N1 dapat terjadi selama kunjungan ke pasar unggas hidup. Sebuah studi terhadap 54 kasus H5N1 di Indonesia melaporkan bahwa sumber infeksi atau eksposur terhadap HPAIV H5N1 tidak dapat diidentifikasi untuk 24% kasus [178].
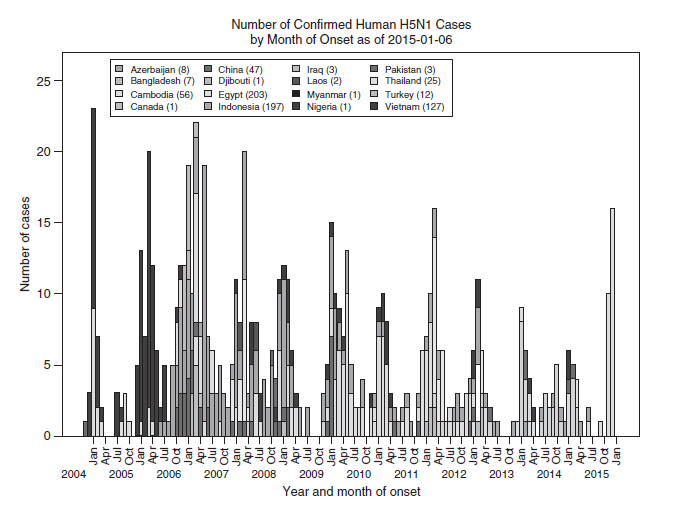
Grafik 5.1 Kurva epidemiologi kasus HPAI H5N1 pada manusia, dengan onset tahun dan negara, dari November 2003 sampai Desember 2014. Sumber: Centers for Disease Control and Prevention (CDC).
Konsumsi darah itik beku yang tidak dimasak juga telah berimplikasi sebagai kemungkinan rute infeksi HPAIV H5N1 [12]. Kontak dengan pupuk yang mengandung feses baru dari unggas, permukaan yang terkonaminasi feses unggas ataupun hewan lain ayam dan inokulasi sendiri melalui salurah respiratori juga merupakan faktor resiko yang mungkin terjadi. Meskipun infeksi HPAIV H5N1 pada hewan non unggas telah didokumentasikan, meliputi babi [44, 125], anjing [189, 191], kucing [120, 124, 169, 188, 248], musang batu [224], civet Owste [171], harimau dan leopard [111], tidak ada kasus pada manusia yang dihubungkan dengan eksposur terhadap hewan-hewan mamalia tersebut. Minum, mandi, atau berenang di air yang terkontaminasi HPAIV H5N1 mungkin memiliki resiko rendah dengan resiko transmisi virus H5N1 kepada manusia yang belum diketahui. Peranan jumlah eksposur atau respons dosis dalam transmisi HPAIV H5N1 pada manusia juga masih belum diketahui.
Transmisi H5N1 dari manusia ke manusia yang terbatas dan tidak berkelanjutan telah diamati baru-baru ini telah diobservasi namun jarang ditemukan, atau bisa dikecualikan pada beberapa kasus dimana kontak sangat dekat dalam jangka waktu yang panjang dengan kasus berat di rumah atau di rumah sakir. Hal ini telah terjadi pada awalnya, meskipun tidak secara eksklusif, diantara anggota keluarga yang berhubungan darah. Studi seroepidemiologi terhadap pekerja kesehatan di di Hong Kong mengidentifikasi dua individu yang berkontak dengan pasien H5N1, akan tetapi menyangkal memiliki kontak dengan unggas, dan telah memiliki bukti serologis adanya infeksi virus H5N1 pada tahun 117 [22]. Transmisi nosokomial HPAIV H5N1 dari individu kasus H5N1 ke seorang perawat telah dilaporkan di Vietnam [12]. Transmisi HPAIV H5N1 dari manusia ke manusia secara terbatas dan tidak berkelanjutan tidak dapat dikecualikan pada setidaknya dua klaster di Indonesia pada tahun 2005 [107]. Kemungkinan adanya infeksi nosokomial virus HPAIV H5N1 dari anak perempuan berumur 11 tahun kepada ibunya yang berumur 26 tahun dan bibinya yang berumur 32 tahun mungkin terjadi melalui kontak sangat dekat yang terjadi saat merawat anak perempuan yang sedang sakit tersebut [200]. Transmisi HPAIV H5N1 dari manusia ke manusia secara terbatas dan tidak berkelanjutan juga dipercaya telah terjadi pada klaster keluarga dari delapan kasus H5N1 dengan tujuh kematian di Sumatera Utara, Indonesia, di tahun 2006 [28]. Transmisi HPAIV H5N1 dipercaya telah terjadi dari kasus indeks kepada enam anggota keluarga yang berhubungan darah melalui kontak dekat di rumah individu kasus indeks saat dia sedang sakit, dan dengan transmisi selanjutnya dari satu individu penderita ke anak laki-lakinya karena kontak sangat dekat di rumah sakit. Transmisi nosokomial HPAIV H5N1 dari manusia ke manusia secara terbatas dan tidak berkelanjutan dari individu penderita dengan sakit yang parah pada anak laki-lakinya mungkin terjadi melalui eksposur tanpa perlindungan di China tahun 2007 [213]. Studi seroepidemiologi yang dilakukan pada pekerja kesehatan yang terekspos dengan pasien H5N1 selama 2004 melaporkan tidak ada bukti adanya transmisi HPAIV H5N1 dari pasien ke pekerja kesehatan [4, 129, 176].
Kluster sporadis kasus H5N1 pada manusia dengan dua kasus yang terkonfirmasi secara epidemiologi telah diidentifikasi pada beberapa negara, dengan kluster yang mencakup 20-25% kasus H5N1 pada beberapa kejadian. Bukti paling awal klaster H5N1 di Hong Kong selama wabah tahun 1997, saat dua kasus H5N1 pada pediatri diidentifikasi dari saudara sepupu yang bermain bersama tetapi tidak tinggal di rumah yang sama [40]. Klaster selanjutnya adalah diantara anggota keluarga yang melakukan perjalanan ke Provinsi Fujian, China tahun 2003, dimana dua kasus H5N1 terkonfirmasi dan satu kasus terduga H5N1 telah diidentifikasi [159]. Sebagian besar klaster H5H1 sampai hari ini dipercaya merupakan akibat transmisi dari unggas ke manusia setelah eksposur yang umum (misal eksposur dengan unggas sakit ataupun mati atau burung liar yang mati) [82, 107, 150]. Meskipun sebagian besar klaster melibakan dua sampai tiga kasus, klaster terbesar sampai hari ini telah terindentifikasi di Indonesia dengan 8 kasus (tujuh kasus terkonfirmasi dan satu terduga) dan tujuh kematian [28].
Lebih dari 90% kasus klaster H5N1 telah terjadi diantara anggota keluarga yang berhubungan darah, menunjukkan kemungkinan kerentanan genetis, atau faktor lain yang dapat mempengaruhi kerentanan terhadap infeksi HPAIV H5N1 [105]. Sangat mungkin bahwa insidensi dan ukuran beberapa klaster kurang menunjukkan angka sebenarnya karena spesimen untuk pengujian tidak selalu tersedia dari individu yang terduga H5N1 [178]. Klaster bersifat signifikan tanda-tanda utama bahwa strain HPAIV H5N1 telah berubah menjadi lebih mudah bertransmisi diantara manusia dapat dilihat dari meningkatnya ukuran klaster keluarga, atau peningkatan kasus diantara keluarga dekat yang yang tidak berhubungan darah. Pemahaman terhadap epidemiologi, karakteristik klinis, dan temuan virologi pada klaster-klaster tersebut sangat kritikal dalam memfasilitasi respons cepat.
Data dari studi seroprevalen yang dilakkan sejak 1997 yang dikumpulkan untuk menganalisa Resiko infkesi H5N1 pada manusia diantara orang-orang yang tereskpos dengan unggas menunjukkan bahwa resiko transmisi dari unggas ke manusia sangat rendah. Survey serologis per klaster menemukan tidak ada bukti adanya antibodi netralisasi virus H5N1 pada 351 partisipan dari 93 rumah tangga di sebuah desa di Kamboja dimana wabah HPAI H5N1 telah terjadi baik pada unggas manupun manusia [208]. Serosurvey ini telah dilakukan sekitar 2 bulan setelah wabah H5N1 pada unggas terjadi dan kasus H5N1 pada manusia telah terindentifikasi pada tahun 2205. Serosurvey lain yang dilakukan di pedesaan Kamboja sekitar tujuh minggu setelah dua kasus H5N1 pada manusia telah terjadi di tahun 2006 melaporkan bahwa 1% (7 dari 674) dari penduduk desa seropositif terhadap antibodi netralisasi H5N1 [209]. Seluruh individu yang seropositif berumur 18 tahun atau lebih muda dari itu. Studi serupa yang dilakukan dengan subjek para penduduk desa di Kamboja tahun 2007 melaporkan seroprevalensi sebesar 2,6% (18 dari 700) pada partisipan yang disampling 9 minggu setelah kasus H5N1 pada manusia telah diidentifikasi [24]. Pada serosurvey pedesaan tahun 2006 dan 2007, individu yang seropositif terhadap antibodi netralisasi H5N1 secara signifikan lebih mungkin mendapatkan hasil kontrol seronegatif dalam melaporkan mandi atau berenang di kolam air rumah tangga [24, 209]. Studi seroepidemiologi dari 901 partisipan dari empat desa di Thailand dimana setidaknya ada satu kasus H5N1 pada manusia telah diindetifikasi di tahun 2005 menemukan bahwa tidak ada bukti adanya antibodi netralisasi H5N1 [62]. Sebuah serosurvey dari 110 pekerja perunggasan di Guangdong, China menemukan hanya satu orang dengan bukti adanya antibodi netralisasi H5N1 [214]., dan studi serupa dari 295 Pekerja perunggasan di Nigeria Utara menemukan tidak adanya bukti antibodi netralisasi H5N1 [151]. Serosurvey yang dilakukan terhadap pekerja perunggasan di peternakan dan pasar unggas hidup di Bangladesh pada tahun 2009 tidak menemukan adanya bukti antibodi netralisasi H5N1 pada 212 partisipan [143]. Di Mesir survei serologis yang dilakukan diantara individu yang terekspos dengan unggas melaporkan 2% seroprevalen dengan antibodi penetralisir H5N1 (15 dari 750 partisipan) [84]. Ke-15 partisipan seropositif memiliki unggas peliharaan di rumahnya. Studi seroprevalensi cross-sectional terbatas ini menunjukkan bahwa infeksi virus H5N1 pada manusia sangat jarang terjadi bahkan diantara individu yang berkontak dekat tanpa proteksi dengan unggas yang sakit ataupun mati. Memperhitungkan kemungkinan bahwa jutaan orang telah berkontak dengan unggas sakit atau mati yang terinfeksi virus HPAI H5N1 di banyak negara, transmisi virus H5N1 dari unggas kepada manusia jelas merupakan kejadian yang jarang terjadi. Akan tetapi harus dicatat bahwa tidak ada uji serologis standar yang diterima secara internasional untuk mendeteksi antibodi terhadap H5N1 atau kesepahaman definisi hasil uji serologi, dan beberapa survey serologi telah melaporkan hasil deteksi antibodi H5 inhibisi hemaglutinin daripada antibodi penetralisir. Lebih jauh lagi, pemahaman kita terhadap sejarah alami munculnya respons imun tidak lengkap baik untuk kasus terkonfirmsi H5N1 dengan tingkat keparahan yang berat maupun ringan secara klinis, dan tidak semua individu yang terinfeksi mengembangkan antibodi yang dapat terdeteksi. Data yang terbatas tentang respon antibodi penetral pada kasus terkonfirmasi H5N1 menunjukkan bahwa pada manusia yang menunjukkan bukti adanya infeksi asimptomatik atau sakit yang ringan secara klinis, titer antibodi menurun setelah 6 sampai 12 bulan, tetapi antibodi tetap dalam titer yang lebih tinggi dalam jangka waktu lebih lama pada penderita penyakit berat yang bertahan hidup [115]. Karena itu, melakukan sampling setelah bebrapa bulan atau bahkan satu tahun setelah eksposur terhadap virus H5N1 atau setelah infeksi potensial dapat berakibat tidak terjaringnya kasus infeksi asimptomatik atau penyakit dengan gejala ringan. Koleksi spesimen serum secara serial (bertahap) dari penderita H5N1 yang bertahan hidup dapat membantu menggambarkan kinetika respons imun terhadap infeksi HPAIV H5N1 dalam suatu waktu dan menginterpretasikan hasil dari studi seroprevalensi antibodi H5N1.
Data klinis untuk pasien terinfeksi HPAIV H5N1 telah dipublikasikan dalam laporan-laporan kasus, kasus serial dan review komprehensif [201, 244]. Estimasi periode inkubasi untuk kasus infeksi H5N1 tampaknya berlangsung sekitar 2 – 5 hari, dan umumnya 1 minggu atau kurang dari itu mengikuti eksposur dengan unggas sakit atau mati, akan tetapi bisa saja lebih lama pada kasus tertentu yang mengunjungi pasar unggas hidup [12, 45,50, 93, 97, 150, 250]. Dalam situasi dimana transmisi HPAIV H5N1 dari manusia ke manusia secara terbatas dan tidak berkelanjutan dipercaya telah terjadi, estimasi periode inkubasi adanya 4 – 9 hari untuk kasus yang muncul di Thailand dan 4 – 5 hari di China [200, 213]. Penyakit awalnya memiliki karakteristik demam tinggi dengan gejala penyakit pernafasan bawah, meliputi batik, nafas pendek, dipsnea, dan takipnea, terjadi dalam 1 -4 hari pasca onset. Gejala lainnya pada stadium awal infeksi H5N1 meliputi sakit kepala, sakit tenggorokan, diarre, muntah, sakit pada bagian perut, mialgia dan rinorea.
Meskipun hampir seluruh kasus H5N1 dibawa ke rumah sakit karena gejala demam, pneumonia dan hipoksia, presentasi gejala yang tidak biasa juga telah dilaporkan, seperti demam dengan diare, nausea, dan muntah [5], dan demam dengan diare, dan kejang-kejang yang melanjut menjadi koma dengan diagnosa klinis ensefalitis [59]. Durasi median dari onset penyakit sampai masuk ke rumah sakit pada 194 kasus H5N1 adalah 4 hari (kisaran 0 – 18 hari) [237]. Temuan laborairuym yang umum saat pasien pertama masuk rumah sakit meliputi leukopenia, limfopenia, trombositopenia ringan sampai moderat, dan meningkatnya transaminase [12, 201, 244]. Temuan radiografi bagian dada pada pasien H5N1 meliputi infiltrasi difus, multifokal, atau berbentuk pulau-pulau (patchy), inflintrasi interstitial, dan konsolidasi multisegmen dan lobular (Gambar 5.3 dan 5.4). Progresi sampai menjadi pneumonia bilateral dan kegagalan pernafasan yang memerlukan pemasangan mekanisme ventilasi invasif umum ditemukan. Komplikasi pada pasien H5N1 meliputi, ARDS, disfungsi multiorgan dengan penyakit ginjal dan jantung, dan koagulasi intravaskular terdissmeniasi (disseminated intravascular coagulation/DIC) dan sindroma shock mirip sepsis. DIC dan kegagalan multi organ telah dilaporkan pada kasus H5N1 pada wanita dengan kehamilan 4 bulan di China [183].
Pelepasan virus HPAIV H5N1 yang berkepanjangan sampai lebih dari 16 hari pada saluran respiratori telah dilaporkan dan sebagian besar pasien H51N1 tampaknya dapat menularkan penyakir setidaknya dalam waktu dua minggu [12]. RNA virus H5N1 atau isolasi virus H5N1 telah dilaporkan ada dalam spesimen usap rektal dan feses dari diare pada kasus-kasus fatal [20, 59]. HPAIV H5N1 juga telah diisolasi dari cairan serebrospinal [5], serum [5, 183], dan plasma [46] dari pasien yang sakit kritis, mengindikasikan bahwa viremia terjadi pada stadium akhir penyakit H5N1 dan bahwa hal ini mungkin berkontribusi pada patogenesis infeksi HPAIV H5N1. Satu studi otopsi melaporkan temuan mRNA virus pada jaringan usus, menunjukkan bahwa replikasi virus H5N1 bisa saja terjadi pada saluran ganstrointestinal [199]. Studi lebih lanjut diperlukan untuk memahami signifikansi deteksi HPAIV H5N1 pada pasien dengan diare dan untuk memperjelas pernanan saluran gastrointestinal dalam patogenesin HPAIV H5N1.
Meskipun sebagian besar kasus H5N1 telah menunjukkan penyakit berat, beberapa penyakit yang ringan secara klinis telah dilaporkan pada anak-anak. Pada tahun 1997 wabah di Hong Kong, tujuh dari sebelas kasus pediatri terkonfirmasi H5N1 mengalami influenza yang tidak kompleks, sementara empat diantaranya sakit sangat parah dan dua meninggal dunia [40]. Tingkat dan frekuensi kasus H5N1 yang ringan dan asimptomatik secara klinis tidak diketahui, utamanya karena surveilans belum berfokus pada orang dengan gejala ringan. Setidaknya empat pasien H5N1 dengan gejala klinis ringan telah diidentifikasi selama investigasi lapangan pada kasus indeks yang lebih parah di Turki dan Indonesia [105, 150]. Infeksi HPAIV H5N1 telah diidentifikasi pada sejumlah kecil pasien pediatri yang mengalami gejala mirip influenza (ILI) saat surveilans influenza aktif di Dhaka, Bangladesh [19, 99]. Meskipun begitu, serosurvey cross-sectional terbatas menunjukkan bahwa infeksi H5N1 dengan gejala ringan atau asimptomatik jarang ditemui [24, 62, 84, 128, 143, 208, 209, 214]. Studi diperlukan untuk menginvestigasi apakan faktor genetik atau faktor-faktor lainnya, seperti yang mempengaruhi ekspresi respon inflamasi hospes, dapat mempengaruhi keparahan penyakit mengikuti infeksi HPAIV H5N1.
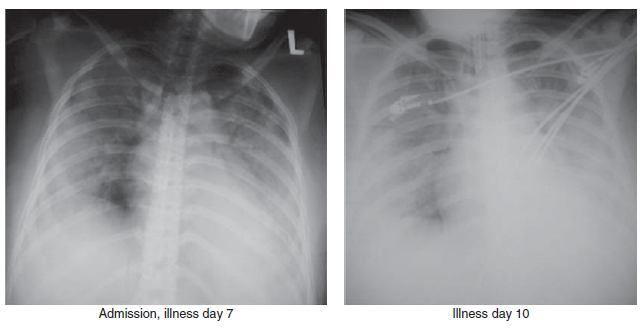
Gambar 5.2 Temuan radiografi bagian dada pada pasien wanita berumur 37 tahun yang terinfeksi fatal virus HPAI H5N1 clade 2.1. Konsolidasi bilateral lobus paru bawah dengan infiltrasi titik (patches) pada bidang paru bagian atas terlihat pada hari ke-7 perawatan. Meskipun telah menggunakan ventilasi mekanis, pasien akhirnya tetap mengalami sindrom kesulitan bernafas akut (ARDS) pada hari ke-10, dan meninggal di hari ke-11. Sumber: T.Uyeki, Centers for Disease Control and Prevention (CDC).
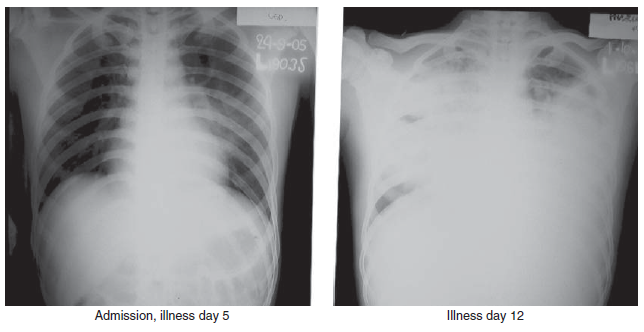
Gambar 5.3 Temuan radiografi bagian dada dari kasus infeksi virus HPAI H5N1 clade 2.1 pada pria berumur 21 tahun yang sembuh. Inflitrasi terlihat pada bidang tengah paru-paru kiri saat pemeriksaan hari ke-5. Satu minggu kemudian, infiltrat terkonsolidasi dan diffu terlihat pada seluruh bidang paru-paru. Pasien ini mengalami kesembuhan tanpa penggunakan ventilasi mekanik. Sumber: T. Uyeki, Centers for Disease Control and Prevention (CDC).
WHO telah mempublikasikan petunjuk untuk menyelidiki kasus suspek H5N1 pada manusia [240]. Temuan kasus pada sebagian besar negara telah berfokus pada pasien yang dirawat di rumah sakit dengan penyakit pernafasan berat yang memiliki sejarah kontak dengan unggas. Koleksi spesimen respiratori yang tepat dari terduga kasus/kasus suspek sangat kritikal, karena usap tenggorokan telah diperlihatkan memiliki tingkat deteksi lebih tinggi untuk HPAIV H5N1 dibandingkan dengan usap nasofaring ataupun hidung. Spesimen saluran pernafasan bawah memiliki virus lebih banyak dibandingkan usap nasal maupun tenggorokan, dan merupakan rute terbaik untuk diagnosis H5N1 [49]. Koleksi spesimen respiratori secara berulang (serial) dari beragam tempat koleksi dalam banyak hari dari pasien suspek H5N1 akan memingkatkan kemungkinan deteksi HPAIV H5N1. Petunjuk koleksi, transportasi, dan pengiriman spesimen klinis juga tersedia pada sumber lain [227], dan diagnosa infeksi H5N1 akan dijelaskan pada bagian Diagnosa. Definisi kasus untuk klasifikasi kasus H5N1 juga tersedia, dan WHO meminta baik kasus suspek ataupun kasus H5N1 yang terkonfirmasi dengan hasil laboratorium harus dilaporkan [239]. Kasus H5N1 pada manusia yang sudah terkonfirmasi harus dilaporkan kepada WHO dalam waktu 24 jam setelah diagnosis berdasarkan regulasi kesehatan internasional [238].
Manajemen klinis dari pasien suspek maupun terkonfirmasi virus HN1 harus berfokus pada perawatan medis supportif dan mendesak inisasi perawatan antiviral untuk pasien, dan implementasi prosedur kontrol infeksi yang tepat. Pasien harus diisolasi secepatnya dan ditempatkan dalam ruangan terpisah. Upaya kontrol infeksi harus diimplementasikan dengan tepat, meliputi standar, kontak dan pencegahan droplet. Petunjuk WHO yang sudah diperbaharui telah berdasarkan pemahaman saat ini bahwa transmisi HPAIV H5N1 dari manusia ke manusia sangat besar kemungkinannya terjadi melalui droplet besar, dan transmisi dari manusia ke manusia tetap merupakan kejadian yang jarang terjadi. Pencegahan penularan lewat udara (airborne) harus diikuti untuk prosedur-prosedur yang memproduksi aerosol. Peralatan pelindung personal, meliputi baju pelindung sekali pakai, sarung tangan, masker operasi, respirator N-95 atau yang setara untuk prosedur yang memproduksi aerosol, dan pelindung mata, harus dikenakan oleh semua tenaga kesehatan dan pengunjung yang akan berkontak dengan pasien suspek maupun terkonfirmasi H5N1. WHO telah mempublikasikan petunjuk pengendalian infeksi yang telah diperbaharui [226]. Di Amerika Serikat, direkomendasikan kepada seluruh tenaga kesehatan, selain untuk mengikuti strategi pencegahan influenza musiman, untuk juga mengenakan masker N-95 atau yang setara dan pelindung mata saat memberikan perawatan untuk pasien suspek maupun terkonfirmasi H5N1, tidak perduli apakah prosedur perawatan memproduksi aerosol ataupun tidak [32, 37]. Semua sekresi respiratori dan cairan tubuh, termasuk darah dan feses pasien infeksi HPAIV H5N1, harus diperlakukan sebagai bahan infeksius.
Karena sebagian besar pasien H5N1 diberikan perawatan pada keadaan penyakit yang sudah parah, sebagian besar umumnya dirawat karena pneumonia, sumplemen oksigen harus diberikan bersama perawatan supportif lainnya, seperti manajemen cairan dan ventilasi mekanikal invasif untuk kegagalan pernafasan. Meskipun tidak ada data dari pengujian klinis, terapi antiviral dengan oseltamivir direkomedasikan untuk semua kasus, dan terapi harus diinisiasi secepat mungkin [177]. Data observasional menyarankan bahwa terapi oseltamivir dapat mengurangi kematian pada pasein H5N1 jika dimulai dalam waktu dua hari setelah onset penyakit, dan bahwa memulai terapi oseltamivir pada hari ke 6 – 8 setelah onset penyakit masih memberikan manfaat potensial terhadap angka bertahan hidup pasien [2, 106]. Dosis optimal dan durasi pemberian oseltamivir tidak diketahui, dan dosis yang lebih tinggi dan durasi pemberian yang lebih lama juga dapat dipertimbangkan [232, 236]. Salah satu studi terkontrol tentang dosis ganda versus dosis tunggal standar terapi oseltamivir dari 326 pasien yang dirawat di rumah sakait karena influenza, termasuk 17 orang pasien infeksi HPAIV H5N1, tidak menemukan manfaat pemberian oseltamivir dengan dosis lebih tinggi [190]. Terapi kombinasi menggunakan oeltamivir dan amantadine dapat dipertimbangkan pada negara-negara yang diketahui memiliki HPAIV H5N1 yang sensitif terhadap amantadine. Resistensi tehadap amantadine dan rimantadine telah dilaporkan untuk virus H5N1 clade 1 dan clade 2.1. Resistansi oseltamivir pada virus HPAIV H5N1 telah didokumentasikan dalam laporan kasus [61, 122]. Pengunaaan inhibitor neuraminidase secara intravena seperti peramivir atau zanamivir juga dapat dipertimbangkan. Kortikosteroid tidak dianjurkan, kecuali pada pasien shock sepsis refraktori persisten dengan dugaan insufisiensi adrenal [177]. Kemoprofilaksis dengan antibiotik tidak direkomendasikan, dan terapi antibiotik harus mengikuti petunjuk berdasarkan bukti untuk pneumonia komuniti, dan diarahkan oleh hasil pengujian laboratorium mikrobiologi [177]. Sejumlah kecil pasein H5N1 telah menerima immunoterapi dengan plasma orang yang sembuh (convalescent) atau dari partisipan dalam uji vaksin H5N1 [213, 223, 251, 255].
Patogenesis infeksi HPAI H5N1 tampaknya dipacu oleh tingginya replikasi virus dan respons abdormal sistem imun hospes. HPAIV H5N1 lebih suka berikatan dengan sel yang memiliki reseptor asam sialik yang berikatan dengan galaktose melalui ikatan α2,3 (S A α-2,3 Gal) yang terutama ditemukan pada saluran pernafasan bawah manusia pada sel bronkiolar dan alveolar [181, 205]. Ini dapat menjelaskan mengapa sebagian besar pasien H5N1 mengembangkan gejala dan simtom penyakit pernafasan bawah, dan mengapa hampir semua pasien H5N1 mengembangkan penyakit paru-paru berat. Virus HPAI H5N1 yang ditemukan lebih besar pada spesimen saluran pernafasan bawah daripada spesimen saluran pernafasan atas [60]. Akan tetapi, HPAIV H5N1 telah diisolasi dari spesimen saluran pernafasan atas pada beberapa kasus, biasanya pada stadium akhir penyakit, dan HPAIV H5N1 juga telah diperlihatkan menginfeksi jaringan saluran pernafasan atas [147]. Salah satu studi observasi menemukan bahwa jumlah keluaran virus (viral load) yang tinggi pada faring berkorelasi dengan hipersitokinemia pada kasus-kasus H5N1 yang fatal [60]. Tingginya level plasma IL-6, IL-8, IL-10 dan interferon γ ditemukan pada kasus H5N1 yang fatal jika dibandingkan dengan kasus yang tidak fatal atau pasien influenza manusia biasa [60]. Studi ini meyatakan bahwa tingginya replikasi HPAIV H51 dapat memicu disregulasi sitokin, dan bahwa perawatan antivirus yang cepat pada awal penyakit mungkin penting dalam pencegakan hipersitokinemia. Disseminasi virus HPAIV H5N1 keluar paru-paru menuju saluran gastorintestinal [20, 59], cairan serebrospinal [5], dan darah [5, 46, 183] telah didokumentasikan, dan mungkin merupakan faktor penyebab disfungsi multi-organ. Sebagian besar patogenesis infeksi HPAIV H5N1 sampai saat ini dikarenakan virus yang merusak sel-sel dan atau virus yang memicu respon inflamasi abnormal dari hospes. Hemofagositosis telah dilaporkan sebagai salah satu komplikasi infeksi pada beberapa pasien H5N1, dan bisa jadi merupakan akibat dari hipersitokinemia [195]. Etiologi limfopenia yang teramati pada sebagian besar kasus H5N1 tidak sepenuhnya dapat dimengerti, akan tetapi dapat melibatkam apoptosis differensial yang diinduksi oleh HPAIV H5N1. Pemahaman lebih jauh tentang patogenesis infeksi HPAIV H5N1 dapat memfasilitasi pengembangan terapi bertarget.
Pada tahun 2014, kasus pertama HPAIV H5N6 pada manusia telah dilaporkan pada pasien yang meninggal karena pneumonia berat di Provinsi Sichuan, China [232]. HPAIV H5N6 terdeteksi melalui spesiemn saluran pernafasan dari pasien ini. Sejak HPAIV H5N6 terdeteksi pada unggas di China, Vietnam dan Laos PDR, terdapat potensi munculnya kasus-kasus transmisi HPAIV H5N6 ke manusia yang terekspos virus tersebut.
Seperti yang telah disebutkan sebelumnya, HPAIV H5N1 bersifat enzootik pada unggas setidaknya di enam negara, dengan virus-virus H5 HA clade tertentu disebarkan oleh burung liar. Ditambah lagi, virus-virus H5N1 telah mengalami vent reassortment genetik berkali-kali pada populasi unggas, berakibat menyebarnya HPAIV H5N8 ke Jepang, Korea, beberapa negara di Eropa, dan Amerika Utara dari tahun 2013 sampai 2014. Di Amerika Utara virus-virus H5N8 ini telah mengalami reassortment dengan virus dari jalur keturunan Amerika Utara yang memiliki gen neuraminidase N2, berakibat terdeteksinya HPAIV H5N2 pada unggas di wilayah ini. Meskipun tidak ada kasus HPAI H5N2 ataupun H5N8 yang telah dideteksi, kemampuan HPAIV H5N1 untuk melakukan reasortansi dengan virus AIV lainnya pada unggas, dan kemampuannya untuk menyebar melalui jarak yang sangat luas dengan bermigrasi melalui burung liar, menggarisbawahi tantangan pengendalian HPAI H5 pada spesies unggas, yang penting dalam rangka menurunkan angka eksposur terhadap manusia dan mengurangi resiko pandemi dari virus-virus ini.
Upaya yang direkomendasikan untuk responden terhadap wabah LPAI dan HPAI
Orang-orang yang terlibat dalam aktivitas pemusnahan dan disinfeksi dan pekerja perunggasan yang terlibat dalam merespon terduga wabah LPAI ataupun HPAI pada unggas harus dilengkapi dengan peralatan pelindung personal (personal ptotective equipment/PPE) yang tepat dan telah dididik tentang gejala dan simptom infeksi AIV pada unggas dan pada manusia. Mereka juga harus mengetahui upaya-upaya pengendalian infeksi melalui biosekuriti, meliputi penggunaan PPE secara lengkap (kaca mata pelindung, pakaian pelindung dan sarung tangan karet sekali pakai, respirator N95 sekali pakai atau yang setara, dan sepatu boot yang bisa didisinfeksi), dan mengamati cara memakai dan melepaskan PPE, melakukan disinfeksi dan menjaga higienitas tangan (hand hygiene) dengan benar.
Antivirus kemoprofilaksis dengan oseltamivir yang diresepkan dapat direkomendasikan sampai 10 hari setelah ekposur dengan unggas yang terinfeksi HPAIV ataupun LPAIV. Petugas kesehatan masyarakat dan tenaga kesehatan harus bertanggungjawab terhadap monitoring para pekerja untuk dapat mentaati aturan pakai, memonitor kejadian efek samping yang terkait dengan kemoprofilaksis oseltamivir, dan memonitor setiap gejala dan simptom infeksi IAV, meliputi gejala mirip influenza (ILI) dan konjungtivitis larena LPAIV. Monitoring harus dilakukan sampai 10 hari setelah eksposur terakhir dengan unggas terinfeksi. Monitoring mandiri yang dilakukan oleh para pekerja dapat dipergunakan jika sumber daya yang diperlukan tidak memungkinkan dilakukannya monitoring secara aktif oleh para tenaga kesehatan yang ditunjuk terhadap seluruh pekerja yang terekspos virus. Pejabat kesehatan harus diberi informasi tentang setiap gejala sakit dan spesimen klinis yang tepat (spesimen konjungtival, nasal dan tenggorokan) yang dikoleksi dalam rangka pengujian rRT-PCR untuk mendeteksi influenza musiman dan subtipe AIV terduga pada laboratorium yang memiliki kualifikasi. Serum berpasangan (paired) atau setelah pasien sembuh (convalescent) juga dapat dikoleksi untuk pengujian serologis. Para responder harus diberikan vaksin influenza manusia setiap tahun untuk mengurangi resiko koinfeksi dan kemungkinan reassortment dengan virus IAV manusia dan AIV. Petunjuk waktu sementara untuk para responder juga tersedia [32, 65, 152, 242].
Infeksi varian virus influenza A pada manusia
Infeksi virus pada manusia yang normalnya bersirkulasi pada populasi babi pertama kali dideteksi dengan isolasi virus selama tahun 1970, dimana salah satu kasus paling terkenal mengakibatkan digalakkannya kampanye vaksinasi influenza babi di Amerika Serikat, dimana lebih dari 47 juta orang telah divaksin [179]. Sayangnya, peningkatan jumlah kasus sindrom Guillain-Barre secara signifikan yang dihubungkan dengan vaksinasi menyebabkan penghentian kampanye vaksinasi. Selama tiga dekati ke depannya hanya ada satu atau dua kasus sproradis virus H5N1v pada manusia yang terdeteksi setiap tahunnya [188]. Akan tetapi setelah munculnya virus H1N1 asal babi di Meksiko yang menyebabkan pandemi 2009, ada peningkatan kemampuan luar biasa dari banyak laboratorium di seluruh dunia dalam penggunaan metode molekular unttuk mendeteksi kasus pada manusia yang disebabkan IAV asal hewan, dan lebih banyak pula ketertarikan pada pendeteksian awal adan pelaporan infeksi virus influenza asal babi pada manusia. Sebagai akibatnya, lusinan kasus pada manusia di Amerika Serikat telah dideteksi dan dilaporkan pada tahun 2011, dan lebih dari 300 kasus telah dilaporkan pada tahu berikutnya. Hal ini semakin memingkatkan ketertarikan dalam pendeteksian kasus-kasus serupa.
Karena adanya kekhawatiran tentang numenklatur lama virus ini, anggota dari World Health Organization’s Global Influenza Surveillance and Response System (GISRS), Food and Agriculture Organization of the United Nations (FAO), and the World Organisation for Animal Health (OIE) telah bersepakat pada akhir tahun 2011 dan awal tahun 2012 untuk menggunakan terminologi standar saat melaporkan virus-virus asal babi yang telah menginfeksi manusia. Pada awalnya, terminologi baru diadopsi untuk mendeskripsikan virus-virus H3N2 asal babi yang telah menginfeksi manusia, akan tetapi terminologi ini akahirnya diaplikasikan pada influenza A H1N1 asal babi dan virus H1N2 yang diisolasi dari manusia [235]. Karena itulah saat virus influeza yang diketahui telah bersirkulasi pada babi didapatkan juga pada manusia yang sakit dan berbeda dengan uang selama ini telah bersirkulasi pada manusia, maka virus tersebut disebut sebagai varian virus influenza. Catatan lain tentang varian virus adalah penggunaan huruf keci; “v” setelah nama virus (contohnya H3N2v) dimana huruf “v” mengindikasikan “varian”. Terminologi ini berguna karena IAV yang bersirkulasi pada babi kadang kala sangat mudah ditransmisikan pada manusia yang berkontak dengat dengan babi yang terinfeksi. Tambahan lagi, virus influenza A manusia juga bertransmisi dari manusia kepada babi, dan kemudian dapat menetap dan berevolusi secara terpisah pada spesies babi [206]. Karena itu, berbeda dengan situasi dimana AIV, yang hanya bertransmisi dari burung ke manusia, ada sebuah ‘jalur bolak-balik’ pada virus influenza A yang bersirkulasi pada manusia dan babi, dengan transmisi yang terjadi secara dua arah. Ilustrasi paling dramatis dari transmisi dua arah ini terjadi pada tahun 2009, dimana virus H1N1 yang dipercaya berasal dari babi menyebabkan pandemi global influenza manusia yang dimulai di Meksiko. Virus pandemi H1N1 ini sebelumnya ditransmisikan oleh manusia kembali kepada babi pada banyak belahan dunia, dan saat ini bersifat endemis pada populasi babi secara global. Distribusi virus-virus ini pada babi akan didiskusikan dengan lebih mendetail pada Bab 18 serial buku ini, dan juga diberikan review di beberapa sumber lain [206, 260].
Infeksi varian virus H3N2 pada manusia
Virus H3N2 pada manusia pertama kali diisolasi dari babi di Taiwan segera setelah pandemi tahun 1968, diikuti dengan isolasi di Hong Kong antara tahun 1976 sampai 1982, dan di Italia tahun 1997 dan 1983 [23, 260]. Isolat selanjutnya dari virus H3N2 dari babi di Italia selama periode 1958-1989 memiliki gen HA dan NA yang serupa dengan manusia, sementara gen internal berasal dari unggas, mendemonstrasikan bahwa virus H3N2 pada manusia yang sebelumnya telah ditransmisikan dpada babi telah mengalami reassortansi dengan AIV selama bersikulasi bersamaan pada babi [23]. Akan tetapi tidak sampai akhir 1990an virus H3N2 sukses berkedudukan pada populasi babi di Amerika Utara [258]. Bukti sekarang menunjukkan bahwa ada pengenalan virus temporal yang berbeda dari virus H3N2 manusia kepada babi di Amerika Utara, dengan event reasertment yang berikutnya terjadi berakibat masuknya gen HA dan NA dari virus influenza manusia kedalam bentuk dasar virus triple reassortant yang bersirkulasi pada babi. Karakteristik virus pada babi dengan gen internal triple reassortant (TRIG) akan didisikusikan dengan menyeluruh di Bab 18 di buku ini.
Isolasi virus H2N2v yang pertama pada manusia terjadi pada dua anak di Belanda pada tahun 1993 [48]. Anak-anak itu hidup pada wilayah berbeda di negara itu tidak memiliki hubungan epidemiologi, dan keduanya menunjukkan gejala penyakit ringan dan sembuh. Virus H3N2 yang serupa telah diisolasi dari anak berumur sepuluh bulan yang mengalami penyakit respiratori ringan di Hong Kong pada tahun 1999 [88]. Virus yang diisolasi dari anak ini secara filogeni serupada dengan virus H3N2 yang diisolasi pada dua anak di Belanda, dab juga mirip dengan virus H3N2 yang bersirkulasi pada babi Eurasia [88].
Virus H3N2v telah diisolasi pada tahun 2005 dari usap hidung yang diambil dari pekerja peternakan di Kanada yang mengalami gejala mirip influenza (ILI) dengan onset 3 hari setelah menyadari adanya penyakit serupa pada babi yang dirawatnya [149]. Pekerja peternakan tersebut diberikan antiviral dan sembuh. Virus H3N2v yang serupa diisolasi pada tahun berikutnya di Kanada dari anak beumur 7 bulan yang dirawat di rumah sakit ang hidup di peternakan komunal dimana babi dipelihara [172]. Meskipun ada bukti serologis dari transmisi terbatas pada komunitas dan rumah tangga dan infeksi diantara babi-babi di peternakan, virus tidak ditemukan pada individu-individu lain di peternakan itu atau dari babi-babi yang dipelihara.
Pada tahun 2009 dan 2010, tujuh infeksi virus H3N2v pada manusia dilaporkan di Amerika Serikat, dimana dua kasus memiliki onset klinis pada tahun 2009. Keseluruhan penderita sembuh secara total [51, 182]. Investigasi menunjukkan bahwa transmisi didalam rumah tangga bisa saja terjadi pada satu kasus di tahun 2010. Virus yang diisolasi dari setiap penderita dikarakterisasikan sebagai virus triple reassortant atau TRIG dengan HA yang secara filogenetik sangat berkerabat dekat dengan gen HA dari virus IAV manusia yang bersirkulasi pada awal 1990-an [182]. Sebelum onset penyakit klinis, enam dari tujuk penderita telah mengalami kontak langsung maupun tidak langsung dengan babi pada tempat-tempat meliputi pasar hewan, pameran ternak babi, dan peternakan. Babi-babi dilaporkan tampak sakit hanya pada satu dari kejadian kontak. Sampling pada sebuah pameran ternak babi di Ohio pada waktu yang bertumupkan selama tahun 2009 – 2011 selama musim pameran mengindikasikan bahwa virus H3N2 yang diisolasi pada babi di tahun 2010 dan 2011 secara antigenik serupa dengan virus H3N2 yang diisolasi dari manusia selama tahun 2009 dan 2010 [73].
Dua belas kasus H3N2v tambahan juga dilaporkan selama tahun 2011 dari lima negara bagian di Amerika Serikat, dengan bulan Juli sebagai bulan paling awal onset [34]. Sebelas dari kasus-kasus ini adalah pada individu berumur kurang dari 10 tahun, dan semuanya sembuh total. Isolat virus dari kasus-kasus ini berbeda dengan virus H3N2 yang telah dianalasiasa sebelumnya bahwa gen M yang terdapat di dalam virus merupakan turunan dari virus pandemi H1N1, sementara tujuh segmen gen lainnya berasal dari IAV TRIG dari babi [131] (Tabel 5.4). Kemungkinan transmisi terbatas dari manusia ke manusia bisa jadi terjadi di dua rumah tangga dan tiga kasus pada anak-anak [34, 243]. Studi selanjutnya mengevaluasi antibodi cross reaktif terhadap virus H3N2v dengan gen matriks virus pandemi dilakukan di Norwegia, Kanada dan Amerika Serikat [25, 184, 185, 210]. Studi-studi ini menggunakan uji HI dan MN, dan mengungkap bahwa hanya ada sedikit atau bahkan tidak ada antibodi cross reaktif terhadap virus H3N2v yang dapat dideteksi diantara anak-anak dibawah umur 10 tahun, mengindikasikan bahwa kelompok umur ini memiliki resiko tertinggi terjadinya indeksi. Sebaliknya, studi-studi ini menunjukkan bahwa 35-70% dari yang berumur 20 sampai 40 tahun memiliki titer antibodi yang dianggap protektif terhadap virus ini, yang mungkin sangat menbatasi infeksi pada kelompok umur ini.
Selama tahun berikutnya, Centers for Disease Control and Prevention di Amerika Serikat menerima laporan 209 kasus H3N2v dari 10 negara bagian Amerika Serikat [26]. Dari kesemuanya ini, 306 kasus melaporkan onset klinis antara 9 Juli dan 7 September 2012 [102], dan sebagian besar kasus melaporkan kontak langsung maupun tidak langsung dengan babi pada pameran-pameran pertanian, seperti pameran di tinggkat kota amupun negara bagian, sebelum keluarnya onset, dengan kasus yang dilaporkan terutama terjadi di Ohio (n = 107) dan Indiana (n = 138). Kasus yang umumnya muncul dengan gejala influenza musiman pada manusia seeprti demam, batuk dan kelemahan badan, dan sebagian besar akhirnya sembuh, akan tetapi 16 kasus memerlukan perawatan di rumah sakit. Ohio melaporkan 11 dari 16 kasus yang dirawat di rumah sakit, termasuk satu kematian [31]. Median umur dari 306 kasus ini adangal 7 tahun, 283 individu (92,5%) berumur kurang dari 18 tahun, dan 50% berumur 5-11 tahun [102]. Lebih dari 90% kasus melaporkan ekposur langsung ataupun tidak langsung dengan babi dalam waktu 4 hari onset penyakit, dengan salah satu kontak eksposur tidak langsung meliputi menghadiri event dimana babi-babi dipamerkan, atau berada sekitar 2 meter dari babi tanpa menyentuhnya atau berkontak langsung dengan babi. Bukti menunjukkan adanya transmisi terbatas dari orang ke orang pada 15 kejadian [102].
Bersamaan dengan wabah H3N2v ini pada manusia, sampling respiratori pada babi pada beberapa pameran pertanian yang diduga juga sedang berlangsung. Pada tahun 2012, pada salah satu pameran di Indiana, empat kasus H3N2v diidentifikasi dan 12 babi telah di sampling; keseluruhan babi yang disampling positif virus H3N2 [35]. Analisa genetik virus yang ditemukan pada manusia dan babi mengindikasikan bahwa virus-virus ini berhubungan dengan secara genetik dan bahwa virus-virus ini mengandung gen matriks pandemi H1N1 (Tabel 5.4), serupa dengan virus H3N2v yang diisolasi tahun 2011 [35, 131]. Bukti lebih lanjut adanya transmisi zoonosis virus H3N2 dari babi ke manusia telah dilaporkan di Ohio, dimana babi yang dipamerkan dalam tujuh pameran yang berhubungan dengan kasus pada manusia juga ditemukan virus H3N2 dalam tubuhnya. Sekuensing gen virus dari babi dan manusia pada pameran ini memiliki homologi lebih dari 99% [16], mengindikasikan bahwa virus telah ditransmisikan dari babi ke manusia. Babi-babi yang positif virus juga diidentifikasi pada tiga pameran tambahan di Ohio, dimana tidak ada satupun kasus manusia diasosiasikan dengan festival itu [16], dan pada sebagian besar kasus babi yang positif virus H3N2 tidak menunjukkan gejala (asimptomatik) [17].
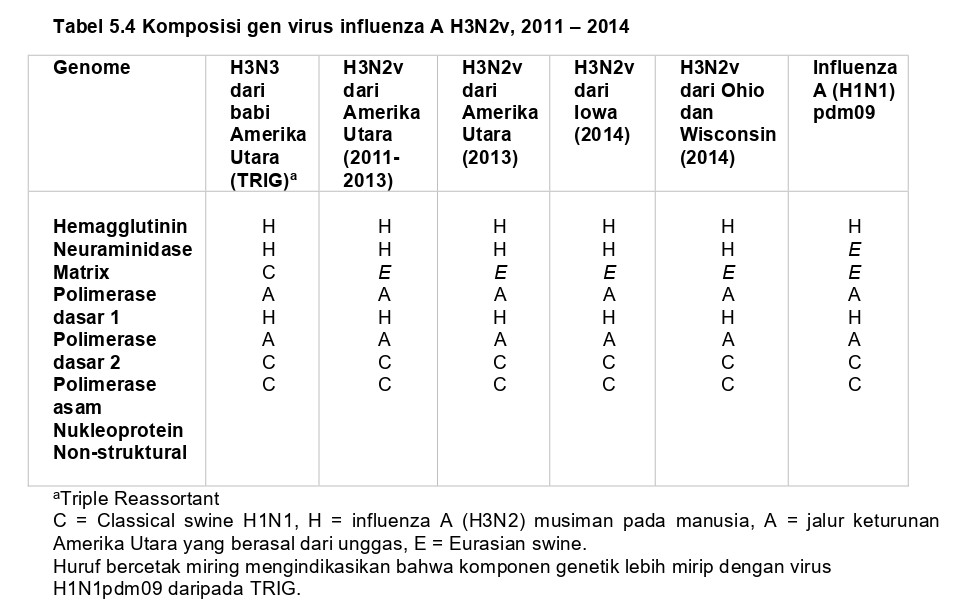
Tahun 2013 total ada 19 kasus infeksi virus H3N2v di Amerika Serikat, 18 kasus individu berumur dibawah 18 tahun, dimana hal ini konsisten dengan obervasi sebelumnya [26]. Tiga kasus infeksi virus H3N2v tambahan dilaporkan di Amerika Serikat selama tahun 2014, kesemuanya adalah anak-anak yang melaporkan kontak langsung dengan babi sebelum onset munculnya gejala klinis [15]. Beragam genotipe virus H3N2v yang dideteksi antara tahun 2011 dan 2014 diperlihatkan pada tabel 5.4
Infeksi varian virus H1NX pada manusia
Kasus infeksi pertama varian virus H1N1, yang pertam kali dilaporkan pada tahun 1976, melibatkan anak laki-laki berumur 16 tahun yang telah didiagnosa terkena penyakit Hodgkin’s di tahun 1974 setelah terinfeksi virus influenza asal babi [187]. Pasien ini hidup di peternakan dimana ia membantu merawat babi di peternakan itu, dimana ditemukan dua babi dewasa memiliki titer antibodi HI terhadap virus yang ditemukan pada pasien tersebut sebesar ≥ 1:640 didalam tubuhnya [187].
Selama bulan Januari dan Februari tahun 1976, virus H1N1v telah diisolasi dari lima rekrutan militer di Fort Dix, New Jersey. Semua rekrutan ini dirawat di rumah sakit karena penyakit saluran pernafasan akut, dan salah satunya meninggal dunia [81]. Onset klinis penyakit pernafasan akut pada pasien-pasien ini antara tanggal 16 Januari dan 3 Februari [83], dan analisa laboratorium dari virus yang diisolasi menunjuukan bahwa virus itu serupa dengan virus yang telah bersirkulasi pada babi sejak 1983, dan bahwa virus ini memiliki kemiripan antigentik dengan virus influenza babi yang diisolasi pada tahun 1975 [112]. Pengujian serologis mengidentifikasi 8 indvidu lain dengan titer HI ≥ 1:20, kesemuanya dirawat di rumah sakit karena penyakit respiratori akut [80]. Meskipun pengujian laboratorium tidak bisa mengkonfirmasi kasus tamahan, estimasi bagawa sekitar 230 individu yang ditempatkan di Fort Dix mungkin telah terinfeksi adalah berdasarkan pada penampakan klinis, kohort dari rekrutan militer yang dalam pelatihan pada waktu-waktu tertentu, dan pengujian serologis dari serum tunggal dari beberapa individu dalam kelompok pada setiap kohort [94]. Respons yang dicatat dalam wawancara mengindikasikan bahwa tak ada satupun kasus yang berkontak dengan babi dalam kurun waktu 6 bulan sebelum menjadi sakit, dan tidak ada babi dalam kompleks militer tersebut [80]. Studi tambahan menginiaksikan bahwa terdapat penyebaran secara terbatas pada markas pelatihan militer, tanpa adanya bukti kasus lagi setelah 14 Februari, atau kasus yang terjadi di dalam komunitas [83, 94]. Masih belum diketahui bagaimana caranya virus pertama kali masuk kedalam kompleks Fort Dix dan mengapa virus tersebut tidak mudah bertransmisi dari satu orang ke orang lainnya [197].
Dua kasus tambahan infeksi virus H1N1v pada manusia lainnya telah dilaporkan pada tahun 1976 di Wisconsin. Salah satunya adalah laki-laki berumur 22 tahun dengan onset penyakit mirip influenza (ILI) di bulan November, dan pada saat itu sampel yang diambil dari enam dari delapan babi yang sakit pada peternakan dimana ia bekerja menunjukkan virus influenza yang sama [30]. Pada bulan Desember, kasus kedua telah diidentifikasi pada anak laki-laki berumur 13 tahun yang tinggal pada peternakan yang terdapat babi yang sakit secara klinis pada saat yang sama dengan onset penyakit pada pasien [29, 67]. Meskipun kasus-kasus ini tidak memiliki hubungan epidemiologis, keduanya memiliki kontak langsung dengan babi yang sakit sebelum onset penyakit.
Pada tahun-tahun berikutnya, kasus infeksi sporadis virus H1N1v pada manusia telah dilaporkan. Dua kasus berada di Texas dan terjadi pada tahun 1979 dan 1980. Keduanya menunjukkan gejala serupa influenza (ILI) dan telah sembuh. Satu kasus adalah mahasiswa yang sebelumnya bekerja pada pameran besar ternak babi sebelum onset penyakit dan kasus kedua adalah anak laki-kali berumur 6 tahun yang telah mengunjungi pameran ternak babi pada sebuah pertunjukan hewan ternak dua hari sebelum onset penyakit [54]. Tidak ada bukti transmisi kepada individu lainnya pada masing-masing kasus. Pada Februari 1982, virus varian H1N1 yang serupa dengan virus yang diisolasi di Fort Dix tahun 1976 telah ditemukan saat autopsi pada anak yang meninggal karena pneumonia yang berkembang dengan sangat cepat (fulminant pneumonia) dan mengalami leukimia limfoblastik akut [157]. Investigasi terhadap anggota keluarga dan kontak anak ini mengindikasikan bahwa tidak ada bukti transmisi di dalam komunitasnya [157].
Selama tahun 1986 tiga infeksi virus H1N1v dilaporkan di Eropa, dengan satu kasus di Belanda dan dua kasus di Swiss [57, 58]. Kesemua kasus mengalimi kesembuhan, tidak ada bukti transmisi pada manusia. Akan tetapi virus tampaknya menyebar dengan cepat diantara populasi babi di negara-negara ini. Sebelum adanya laporan ini, tiga kasus infeksi H1N1v lainnya telah dilaporkan di wilayah negara Rusia yang berada di benua Asia pada tahun 1983 [47].
Selama September 1988, seorang wanita berumur 32 tahun yang tampak normal dan sedang hamil 36 minggu menjadi sakit dengan gejala pernafasan empat hari setelah mengunjungi pameran ternak babi pada pameran pertanian lokal di Wisconsin. Ia dirawat di rumah sakit karena kesulitan bernafas, dan setelah itu meninggal dunia [137, 173]. Babi-babi pada pameran yang dikunjunginya dilaporkan menunjukkan gejala mirip influenza, akan tetapi tidak ada sampel yang dikoleksi dari babi-babi tersebut pada saat itu. Investigasi sampel serum yang diambil dari babi-babi dalam pameran menunjukkan bahwa infeksi tambahan bisa saja telah terjadi [220].
Selama Juli 1991, laki-laki berumur 27 tahun yang sebelumnya sehat dirawat di sebuah rumah sakit di Maryland karena kesulitan bernafas, dan virus H1N1v diisolasi dari sputum pasien 4 hari setelah masuk rumah sakit [222]. Tidak ada patogen lain yang teridentifikasi, dan pasien meninggal setelahnya. Investigasi kasus ini mengungkapkan bahwa pasien telah berkontak fisik dekat dengan babi yang sakit pada sebuah penelitian sebelum menunjukkan onset penyakit, akan tetapi tidak ada bukti penyebaran dari orang ke orang lainnya. Pada tahun 1994, dua pekerja laboratorium menjadi terinfeksi virus H1N1v, tampaknya terjadi ketika mengoleksi usap hidung dari babi-babi yang telah diinfeksikan secara eksperimental dengan virus A/swine/Indiana/1726/88 [221]. Tidak ada bukti adanya pekerja laboratorium lain yang juga terinfeksi, dan kedua kasus mengalami kesembuhan.
Selama musim panas 1993, anak perempuan berumur 5 tahun yang sebelumnya berkontak dekat dengan babi di peternakan dimana dia tinggal di Belanda dirawat di rumah sakit karena pneumonia, dan virus H1N1v telah diisolasi dari spesimen saluran pernafasan bahwah yang diambil dari pasien ini. Isolat virus H1N1v ini secara antigenik dan genetik mirip dengan virus IAV babi mirip virus unggas yang bersirkulasi pada babi Eropa pada saat itu [168]. Penelitian ini juga menunjukkan bahwa virus H1N1v yang lebih tua dari kasus uang terjadi tahun 1968 di Belanda secara antigenik dan genetik serupa dengan kasus yang telah dideskripsikan di atas, dan dengan virus-virus yang beredar secara bersamaan di babi Eropa [168]. Pada tahun 1995, seorang wanita berumur 37 tahun yang bekerja pada sebuah peternakan babi di Minnesota menjadi sakit dengan kesulitan bernafas, dirawat di rumah sakit dan meninggal 3 hari sesudah masuk rumah sakit [114, 142]. Pasien tambahan di Amerika Serikat yang darinya berhasil diisolasi virus H1N1V pada tahun 1998 juga telah dilaporkan [142].
Pada Februari 2002, seorang peternak berumur 50 tahun di Swiss pemilik babi yang sebelumnya menunjukkan penyakit pernafasan akhirnya mengembangkan gejala penyakit pernafasan mirip dengan influenza. Virus H1N1v yang berhubungan paling dekat dengan virus H1N1 mirip unggas yang bersirkulasi pada babi Eropa telah diisolasi dari spesimen yang diambil dari pasien ini [87]. Pasien akhirnya mengalami kesembuhan dengan lancar, dan tidak ada bukti transmisi dari manusia ke manusia yang dilaporkan.
Kasus infeksi virus TRIG H1N1v pada manusia telah dilaporkan selama tahun 2005 pada anak laki-laki berumur 17 tahun di Wisconsin yang mengalami gejala mirip influenza (ILI) [145]. Sebelum onset penyakit penderita telah berkontak langsung dengan babi saat membantu proses penyembelihan. Pasien mengalami kesembuhan dalam 4 hari dan tidak ada bukti transmisi dari manusia ke manusia. Satu kasus tambahan lagi melibatkan isolasi H1N1v dari seorang peternak babi di Iowa pada 2005 [142].
Antara tahun 2005 dan 2009, 10 kasus tambahan infeksi virus TRIG H1N1v telah dilaporkan di Amerika Serikat [180], dengan dua dari kasus tahun 2007 berhubungan dengan salah satu pameran ternak tingkat kota. Pada tahun 2007 wabah penyakit pernafasan terjadi diantara babi-babi dan orang-orang yang berkumpul di pameran kota di Ohio, dimana virus influenza H1N1 ditemukan pada usap hidung dari tujuh babi yang sakit secara klinis dan dua orang yang sakit [113]. Kedua kasus pada manusia (seorang ayah dan anak perempuannya) telah menangani babi-babi yang akan dipamerkan dalam pameran [113], dan keduanya akhirnya sembuh. Hasil sekuensing dan PCR mengindikasikan bahwa virus yang diisolasi dari kasys-kasus ini adalah virus-virus TRIG yang identikal [113], dan perbandingan lebih lanjut terhadap virus-virus ini mengindikasikan bahwa mereka berhubungan dekat dengan virus IAV yang bersirkulasi secara bersamaan pada populasi babi [207].
Kasus tambahan infeksi H1N1v telah dilaporkan selama tahun 2008 pada laki-laki berumur 19 tahun dari South Dakota yang menjadi sakit dengan gejala serupa influenza (ILI), yang akhirnya sembuh [55]. Sebelum onset penyakit dia telah berpartisipasi pada event penjurian yang melibatkan 10 ekor babi yang secara klinis tampak normal, akan tetapi tidak ada sampel yang diambil dari babi-babi itu. Dua orang pelajar lainnya yang juga terekspos dengan babi pada pameran itu seropositif terhadap antibodi H1N1v, mengindikasikan bahwa kejadian transmisi lain juga mungkin telah terjadi [55].
Di Spanyol isolasi virus H1N1 dari wanita berumur 50 tahun yang menjadi sakit pada bulan November 2008 telah dilaporkan. Virus H1N1v ini secara antigenik dan genetik serupa dengan yang bersirkulasi pada babi-babi Eropa [1]. Wanita itu bekerja pada peternakan yang terdapat babi, dan meskipun tidak ada babi yang dirawat wanita itu tampak sakit, dia berkontak dekat dengan babi-babi itu sebelum onset penyakitnya.
Meskipun cukup jarang terjadi, infeksi virus H1N2v juga telah dilaporkan dan telah direview pada sumber lain [116]. Mayoritas kasus-kasus ini telah terjadi pada anak-anak dengan penampakan klinis yang mirip dengan influenza musiman. HA pada virus H1N2v serupa dengan virus H1N1 manusia, menyebabkan deteksi infeksi pada manusia cukup menantang, karena pengujian laboratorium mungkin tidak dapat membedakannya dengan influenza H1N1pdm09 musiman. Meskipun satu kasus mungkin tidak terdeteksi, even klaster seperti wabah serupa influenza (ILI) diantara peserta pameran babi atau event-event serupa lebih mungkin untuk dideteksi dan kemudia diselidiki lebih jauh, seperti pada empat kasus infeksi H1N2v diantara individual yang berkontak dengan babi di pameran Minnesota tahun 2012 [162].
Pameran ternak babi menciptakan lingkungan unik yang mengumpulkan babi dan anak-anak muda di tempat yang sama dalam interface yang langsung dan wajar. Investigasi bersama antara kesehatan hewan dan kesehatan masyarakat terhadap kasus-kasus pada manusia yang disebabkan oleh varian IAV pada interface hewan dan manusi telah menambahkan pemahaman kita tentang bagaimana infeksi itu terjadi, dan telah memberikan wawasan tentang kesempatan pencegahan secara praktis. Sebagai hasilnya, para ahli kesehatan hewan dan kesehatan manusia di Amerika Serikat bekerjasama membuat dokumen spesifik tentang pencegahan infeksi varian virus influenza manusia pada event pameran babi [144]. Pengembangan dokumen kolaboratif ini didorong oleh meningkatnya jumlah infeksi H3N2v yang terdeteksi di Amerika Serikat selama tahun 2012. Diharapkan petunjuk yang dibuat ini dan dokumen serupa lainnya yang dibuat di tempat lain akan memiliki dampak terhadap transmisi influenza antara babi dan manusia pada waktu dan tempat dimana mereka mengalami kontak dekat.
Kesimpulan
Beragam subtipe LPAIV, HPAIV, dan IAV babi telah dapat bertransmisi ke manusia, terutama lewat kontak langsung maupun tidak langsung dengan unggas atau babi yang terinfeksi. Transmisi IVA yang berada pada populasi hewan kepada manusia akan terjadi pada masa depat, dikarenakan praktek-praktek pemeliharaan hewan yang ada sekarang ini, dan meningkatnya populasi orang, babi, dan unggas di planet ini. Karena itulah kita harus merespons terhadap ancaman terus menerus yang dimiliki virus-virus ini terhadap kesehatan masyarakat. Perbaikan surveilans virologis pada manusia, babi dan unggas akan membantu mengindentifikasi kemunculan subtipe virus influenza baru yang memiliki potensi pandemi, dan untuk memfasilitasi karakterisasi antigenik dan genetik dari virus-virus penyebab penyakit. Karakterisasi tersebut, bersama dengan pengujian resistensi antivirus, akan membantu perubahan leven ancaman yang dimiliki virus-virus ini terhadap kesehatan masyarakat. Meskipun celah terbesar dalam surveilans influenza terdapat pada negara-negara berkembang, penguatan surveilans dan kapasitas respons terhadap IAV asal unggas dan babi diperlukan di seluruh dunia.
Keparahan penyakit pada manusia karena infeksi AIV sangat bervariasi, akan tetapi jelas bahwa infeksi HPAIV H5N1 tipikalnya lebih parah daripada yang disebabkan oleh virus IAV asal hewan yang lainnya. Untuk alasan ini, perhatian dan ypaya persiapan terhadap pandemi berfokus terutama oada menyebarluasnya epizootik HPAI H5N1 dari akhir tahun 2003 sampai setelah pandemi H1N1 tahun 2009, dimana beberapa sumber daya telah dialokasikan untuk surveilans influenza pada babi, terutama di Amerika Serikat dan beberapa negara tertentu di Eropa. Lebih dari satu dekade meningkatnya perhatian terhadap kasus-kasus H5N1 pada manusia telah berakibat kemajuan pemahaman kita tentang aspek-aspek epidemiologi, virologi, dan klinis infeksi HPAIV H5N1. Angka kematian yang mencolok karena infeksi HPAIV H5N1 untuk berbagai spesies, dan menyebarnya HPAIV H5N1 ke beberapa benua, juga telah memberikan jendela dimana kita bisa melihat bagaimana virus pandemi dapat berevolusi dari AIV yang jarang bertransmisi ke manusia menjadi bentuk lainnya yang bisa saja bertransmisi lebih baik dan pada akhirnya dapat menyebabkan pandemi. Meskipun jumlah negara yang mengalami endemi ataupun wabah HPAIV H5N1 secara berulang diantara unggas terus berkurang sejak puncaknya di tahun 2006-2007, infeksi pada manusia terus terjadi di Asia Selatan (Bangladesh dan India), Asia Tenggara (Kamboja, Vietnam, dan Indonesia), Asia Timur (China), dan Timur Tengah (Mesir), memiliki ancaman yang terus menerus tehadap kesehatan masyarakat kaena HPAIV H5N1 terus berevolusi melalui mutasi dan reassortment.
Meskipun lebih dari 15 tahun ini fokus lebih banyak berpusat pada HPAIV H5N1, dampak kesehatan masyarakat yang ditimbulkan oleh LPAIV tidak boleh dikecilkan. Dua pandemi influenza di abad ke dua pulu telah disebabkan oleh IAV yang muncul akibat genetic reassortment antara LPAIV dan IAV manusia yang bersirkulasi pada tahun 1957 untuk pandemi Asia dan 1968 untuk pandemi Hong Kong. Pentingnya infeksi LPAIV pada manusia telah lebih jauh digarisbawahi oleh wabah LPAI H7N9 yang saat ini tengah berlangsung pada manusia di China, dimana sebagian besar kasus menunjukkan penyakit pernafasan berat. Ditambah lagi, kemunculan tiba-tiba reasortan baru virus LPAIV H7N9 yang tidak menunjukkan penyakit pada unggas, akan tetapi menimbulkan penyakit berat pada manusia, merupakan sebuah pengingat bahwa kita harus selalu waspada terhadap hal-hal yang tidak diharapkan, dalam hal ini mengacu pada influenza. Ditambah lahi, beberapa infeksi pernafasan pada manusia juga telah disebabkan oleh LPAIV H6N1 dan H10N8. Perbedaan level patogenitas dari subtipe LPAIV tertentu (misalkan H7N9) untuk unggas dibandingkan dengan manusia telah membuat bingung para peneliti, akan tetapi penelitian baru-baru ini mengidentifikasikan bahwa virulensi pada manusia dapat diatributkan kepada faktor virulensi mamalia yang dikodekan oleh gen hemaglutinin unggas pada subtipe H1, H6, H7 dan H10 [164]. Penelitian lainnya mengungkapkan pertanda transkripsi serupa pada mencit yang diinfeksi dengan virus 1918, LPAIV H7N9, dan HPAIV H7N7 dan H5N1. Pada penelitian ini, level patogenitas yang tinggi diasosiasikan dengan meningkatnya transkripsi metabolisme lipid dan gen sinyal koagulasi [139]. Lebih jauh lagi, evolusi dan reassortment yang terus-menerus antara virus-virus LPAIV dengan sesamanya, HPAIV dan sesamanya, dan antara virus-virus LPAIV dan HPAIV yang bersirkulasi diantara unggas domestik dan unggas luar mendikte bahwa surveilans AIV yang menginfeksi unggas, burung-burung liar, dan manusia harus terus ditingkatkan untuk mengidentifikasi kemunculan AIV baru yang terus menerus yang merupakan ancaman munculnya pandemi.
Perkembangan saintifik yang paling signifikan telah dibuat dalam memperluas pemahaman kita tentang karakteristik virus AIV yang menginfeksi manusia. Akan tetapi, masih terdapat jurang yang besar dalam pemahaman kita tentang aspek epidemiologi dan aspek klinis infeksi pada manusia, dan tentang bagaimana interaksi antara manusia dan hewan mempengaruhi resiko trasnmisi virus AIV kepada manusa yang berkontak dengan burung pada berbagai variasi tempat dan kejadian. Diperlukan lebih banyak penelitian untuk meningkatkan pemahaman tentang infeksi AIV pada manusia, terutama tentang bagaimana inisiasi infeksi virus HPAI H5N1 dan LPAI H7N9 pada saluran pernafasan. Masih terdapat pertanyaan yang belum terjawab tentang respons imun pada manusia yang terinfeksi AIV, termasuk juga metode pengujian serologis mana yang paling tepat untuk mendeteksi infeksi LPAIN dan HPAIV pada manusia. Lebih jauh lagi, patogenesis infeksi baik oleh LPAVI dan HPAIV pada manusia tidak dimengerti dengan jelas. Khususnya kita harus menentukan apakah ada faktor genetik atau biologi lainnya yang dapat mempengaruhi infeksi dan atau keparahan penyakit setelah infeksi. Dan pada akhirnya, karena tidak ada terapi yang terbukti untuk kasus-kasus infeksi parah yang disebabkan oleh HPAIV H5N1 atau LPAIV H7N9, pengembangan terapi baru diperlukan secara mendesak. Sebagai contoh, potensi kemanfaatan kombinasi terapi antivital dan terapi imun untuk pasien dengan penyakit berat yang disebabkan oleh HPAIV H5N1 dan LPAIV H7N9 harus dipelajari.
Meskipun penyakit pada manusia yang disebabkan oleh virus H1N1v dan H3N2v biasanya kurang berat dibanding yang disebabkan oleh AIV, terdapat beberapa kasus berat dan fatal, biasanya pada individu dengan kondisi kesehatan yang mendasarinya yang menempatkan mereka dalam resiko komplikasi yang lebih besar. Fakta bahwa pandemi 2009 disebabkan oleh virus IAV H1N1 ressortan yang mengandung delapan gen yang berasal dari IAV asal babi memggarisbawahi pentingnya kewaspadaan yang terus menerus terhadap infeksi virus yang berasal dari babi. Dan penting juga untuk dipikirkan bahwa saat ini populasi manusia telah memiliki level antibodi yang tinggi terhadap virus klasik H1N1 dan H3N2 yang bersirkulasi pada babi, menyebabkan rendahnya kemungkinan penyebaran virus-virus ini secara luas pada populasi manusia. Akan tetapi, karena virus IAV pada babi dan manusia berbagi spesifisitas reseptor sel hospes yang sama dan mudah mengalami transmisi dua arah, kita dapat memperkirakan bahwa infeksi virus H3N2v, H1N1v, dan H1N2v akan terus terjadi. Harus dicatat pula bahwa populasi manusia hanya memiliki sedikit atau tidak ada antibodi yang terdeteksi terhadap virus IAV H1N1 mirip virus unggas yang bersirkulasi pada babi di Eropa dan Asia, dan bahwa karena alasan ini IAV dari babi ini merupakan ancaman yang unik.
Antara tahun 2000 dan 2014 terdapat peningkatan dramatis baik jumlah infeksi zoonotik IAV dan jumlah subtipe influenza A yang menyebabkannya, jika dibandingkan dengan periode sebelumnya [101]. Peningkatan ini menjadikan perlunya pengembangan metode sistematik dan transparan dalam mengevaluasi resiko yang berhubungan dengan setiap subtipe yang berbeda sehingga sumber daya yang ada dapat dialokasikan kepada yang memiliki potensi menimbulkan pandemi paling besar. Sebagai respons terhadap peningkatan jumlah subtipe virus influenza A yang menyebabakan kasus infeksi zoonotik, Influenza Risk Assessment Tool (IRAT) baru-baru ini dikembangkan secara kolaborasi dengan input dari para ahli di bidang epidemiologi infleunza, virologi, kedokteran hewan dan manusia, ekologi hewan, dan penilaian resiko [53]. IRAT telah digunakan sebagai petunjuk persiapan kandidat vaksin virus (candidate vaccine viruses/CVVs) pre-pandemi, karena vaksin influenza merupakan landasan pencegahan dan pengendalian. Sarana ini juga telah digunakan untuk memberi petunjuk CCVs yang mana yang akan diberikan pada perusaahn pembuat vaksin sebagai dasar produksi bibit virus, produksi uji klinis, dan produksi vaksin H5N1 dan H7N9 pre-pandemi untuk disimpan sebagai cadangan stok bagi Amerika Serikat [53]. Penilaian resiko influenza sesuai waktu yang tepat terhadap virus yang baru saja muncul bergantung pada kecepatan berbagi virus dan data dari infeksi IAV zoonotik bersamaan dengan pengembangan tes diagnosa cepat dan distribusinya sehingga kasus tambahan berikutnya pada manusia dapat diidentifikasi secara epat. Upaya-upaya ini harus dilengkapi juga dengan penelitian-penelitian ciri-ciri kerenatanan antigenik dan antiviral virus-virus ini, juga kemampuannya dalam menyebabkan penyakit dan kemampuannya transmisinya diantara mamalia. Pengetahuan tentang level imunitas pada manusia dan distribusi geografi dan spesies pada hewan mempercepat pengembangan informasi yang diperlukan untuk penilaian resiko influenza [53]. Pendekatan ‘one Healt’ secara jelas sangat penting dalam pengumpulan informasi yang akan digunakan melalui IRAT sehingga pekerjaan penentuan potensi pandemi virus-virus IAV dapat diprioritaskan dengan tepat.
Meskipun kesiapan terhadap pandemi adalah aktivitas kesehatan masyarakat yang penting, kunci dalam mengurangi resiko kesehatan masyarakat dan untuk mencegah infeksi virus IAV dari unggas dan babi kepada manusia adalah pencegahan dan kontrol wabah pada hewan melalui perbaikan biosekuriti, vaksinasi dan respons cepat terhadap wabah. Juga penting untuk melindungi orang-orang dalam resiko dari eksposur saat selama operasi pemusnahan unggas dan pameran ternak babi. Sebagai cacatan, terkhusus pencegahan dan kontrol infeksi pada manusia yang disebabkan oleh virus H7N9 dan virus variannya cukup menantang, karena infeksi pada unggas dan babi ini, sangat sering tanpa menimbulkan gejala. Mengurangi jumlah kasus pada manusia memerlukan perbaikan kolaborasi, komunikasi dan koordinasi antar para ahli kesehatan masyarakat veteriner dan kesehatan masyarakat di seluruh dunia dengan mengadopsi pendekatan ‘One Health’. Otoritas kesehatan masyarakat dan kesehatan masyarakat veteriner juga harus bekerja erat selama investigasi wabah dan saat pengembangan dan implementasi upaya-upaya mengurangi eksposur manisia dengan unggas dan babi yang terinfeksi. Sebuah contok yang sangat baik tentang respons multi disiplin dan inter-institusi terhadap wabah avian influenza yang merupakan subjek kekhawatiran otoritas kesehatan masyarakat dan kesehatan hewan terjadi baru-baru ini di Kamboja [170]. Pendirian aktivitas-aktivitas bersama seperti yang dilakukan di Kamboja untuk menjawab pertanyaan-pertanyaan dan untuk mengisi celah surveilans virus IAV unggas dan babi di negara-negara lain juga diperlukan. Selanjutnya, perspektif ‘One Health’ jangka panjang akan mengembangkan dan memperkuat kapasitas epidemiologi dan laboratoriun global dalam penyidikan virus influenza A untuk memberikan manfaat baik kepada kesehatan hewan maupun kesehatan masyarakat. Ditambah lagi, perbaikan biosekuriti bersama dengan pengembangan dan penggunaan kapasitas nasional dan lokal untuk merespon secara cepat terhadap wabah virus unggas maupun variannya pada manusia akan mempercepat kesiapan pandemi global.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

