Oleh Leslie D. Sims, John Weaver dan David E. Swayne
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Sejarah manusia dan unggas
Dalam rangka mengerti tentang ekologi dan epidemiologi dari avian influenza (AI), diperlukan sebuah tinjauan tentang aktivitas manusia terkait produksi unggas, terutama sejak akhir abad ke-19. Tinjauan ini juga akan membantu untuk memberi pemahaman tetnang peranan spesies-spesies avian dalam kehidupan manusia sebagai symbol keagamaan, hewan peliharaan dan untuk hiburan dan makanan dalam budaya-budaya berbeda. Bagaimana unggas-unggas ini dipelihara dengan tujuan-tujuan tersebut, kemudian dipindahkan, dan dijual berkontribusi signifikan terhadap transmisi dan persistensi virus AI (AIV).
Ayam
Ayam domestik (Gallus gallus domesticus) memiliki asal dari beberapa spesies ayam hutan liar dari Asia Tenggara. Tidak ada nenek moyang ayam modern yang masih hidup di zaman sekarang, dan perdebatan tentang asal nenek moyang yang benar terus berlanjut [8, 40]. Kontributor terbesarnya dipercaya berasal dari ayam hutan merah (Gallus gallus), akan tetapi bisa jadi terdapat kontribusi lain dari tiga spesies ayam hutan lainnya. Bukti arkeologis ayam domestik yang pertama berasal dari tahun 6000 SM di China, akan tetapi waktu dan tempat pertama kalinya domestikasi terjadi mungkin lebih terjadi lebih awal dari itu dan terjadi di Asia Tenggara. Kemudian migrasi manusia bergerak menuju kearah utara, membawa ayam peliharaan bersama mereka. Pada tahun 2500 SM, ayam telah ditemukan di Eropa dan Asia Barat. Ayam pada awalnya digunakan untuk tujuan keagamaan dan tidak digunakan sebagai sumber makanan sampai beberapa waktu setelah itu. Pada hari ini, unggas masih memainkan peranan sebagai simbol keagamaan, seperti pelepasan burung passerine ke alam liar sebagai bagian dari ritual agama Buddha di beberapa tempat di Asia [65], dan unggas yang dijual di pasar unggas hidup (LBM) di kepulauan Karibia untuk ritual Santeria dan lainnya. Aktivitas utama dalam pembesaran unggas pada awalnya untuk tujuan kesenangan melalui sabung ayam [179], sebuah aktivitas yang sampai saat ini masih memegang peranan yang penting di beberapa negara, seperti Thailand, dan kegiatan ini dihubungkan dengan terpaparnya manusia secara fatal dengan virus HPAI H5N1 (HPAIV). Orang Mesir merupakan yang pertama kalinya berfokus pada ayam sebagai komoditas pertanian yang penting dan mengembangkan inkubator telur buatan. Beberapa dari inkubator ini dapat memuat 10.000 sampai 15.000 butir telur dan memerlukan flok ayam yang besar untuk dapat menyokong pencapaian agrikultural yang sebesar itu. Ayam juga dipelihara di kebudayaan Yunani kuno, akan tetapi Romawi yang membawa ayam kedalam pusat kehidupan kebudayaan Barat dan kemudian mengembangkan ilmu pengetahuan dalam memelihara ayam untuk dipergunakan dalam kehidupan sehari-hari. Prinsip-prinsip pemeliharaan yang ditetapkan oleh orang Romawi masih digunakan sampai abad ke-19.
Dalam kebudayaan Eropa modern, pemeliharaan ras murni dimulai dari abad ke-18 dan kemudian mencapai puncaknya di tahun 1800 di Eropa dan Amerika Utara, dimana memelihara ayam menjadi sebuah trend yang digilai dengan tujuan pameran, kesukaan pribadi, dan hewan peliharaan. Periode ini dikenal sebagai “chickenmania” atau “poultrymania”, dimana orang-orang semuanya memelihara ayam, baik orang biasa maupun bangsawan. Selama periode itu, pameran unggas dalam skala nasional, regional dan internasional menjadi popular, yang menghapuskan isolasi geografis populasi unggas, dan kemudian juga menghapuskan isolasi geografis terkait penyakit unggas. Meskipun telur dan kadang-kadang juga daging merupakan sebuah hasil sampingan dari “poultrymania”, fungsi utama unggas adalah sebagai objek kesenangan dan untuk pertunjukan. Pameran unggas masih menjadi penting di awal abad ke-20, dan bertanggung jawab dalam penyebaran penyakit setidaknya satu kasus HPAI yang menyebar secara luas di Eropa [93]. Sampai saat ini ayam-ayam hias masih dipamerkan dalam pameran dan pertunjukkan pertanian.
Era komersialisasi ayam
Organisasi perunggasan dalam rangka produksi pangan di masa modern dimulai pada akhir tahun 1800-an di Eropa. Pertama kalinya untuk menghasilkan telur dan kemudian sebagai sumber daging [40, 179]. Upaya awal pemeliharaan ini sangat sangat sederhana jika dinilai dari standar modern. Seiring dengan naiknya peranan unggas sebagai sumber makanan untuk semua orang terbukti pada sebuah sensus yang diadakan pada tahun 1910 di Amerika Serikat, yang melaporkan 280 juta ayam yang dipelihara pada 5,5 juta peternakan, dengan rata-rata 51 ekor unggas per peternakan. Sekitar 80% peternakan memelihara unggas [179]. Pada saat itu kebanyak flok unggas berukuran kecil dan rata-rata memuat 50-200 ekor unggas dan dibesarkan dengan akses ke luar ruangan (outdoor). Hal ini serupa dengan situasi yang ada di negara-negara berkembang di paruh pertama abad ke-dua puluh. Sebagai contoh, di Vietnam tahun 2005 diperkirakan terdapat lebih dari 7,9 juta rumah tangga yang terlibat dalam produksi perunggasan tradisional ekstensif, dengan jumlah rata-rata unggas per flok sebanyak 32 ekor, mewakili sekitar 94% dari seluruh produsen unggas dan sekitar 70% dari total produksi unggas [84].
Di Amerika, tren menuju produksi unggas indoor (dalam ruangan) dimulai pada tahun 1800-an di California. Dimulai dengan pengembangan fasilitas penetasan komersial pertama untuk ayam petelur, yang mengirimkan anak ayam White Leghirn hasil tetasannya ke seluruh California. Ini adalah awal dai tren transportasi DOC dalam jumlah besar melewati jarak yang jauh, seperti transportasi transcontinental yang merupakan ciri khas industri perunggasan sekarang ini. Di tahun 1905, nilai unggas di Amerika Serikat adalah 500 juta dolar, dan pada tahun 1910 jumlah unggas yang dipanen berada di peringkat kedua dalam jumlah panen setelah jagung. Pada tahun 1912, wilayah Petaluma mengirimkan sekitar 100 juta telur per tahunnya, dan wilayah itu memiliki lebih dari satu ekor ayam. Produksi kemudian mencaoat 450 juta butir telur pada tahun 1918. Satu fasilitas penetasan memproduksi 150.000 ekor DOC dalam 3 minggu. Pada tahun 1940, peternakan ayam yang terbesar adalah peternakan ayam petelur yang memelihara 250.000 ekor ayam di Petaluma, California. Tren yang menuju pada produksi industri berskala besar berakibat pada munculnya populasi sangat rentan yang terdiri dari unggas yang memiliki genetik serupa yang dipelihara dalam ruangan tertutup. Upaya biosekuriti yang diambil untuk mencegah masuknya patogen mengurangi resiko masuknya virus AI kedalam populasi flok-flok dalam ruangan ini, akan tetapi jika upaya biosekuriti ini berhasil ditembus maka konsekuensinya sangat tinggi bagi peternakan-peternakan ini. Pada sebagian besar negara hanya terdapat sedikit perencanaan yang dikembangkan oleh sektor perunggasan, dimana banyak peternakan berkembang disekitar sumber input dan berdekatan dengan pasar perkotaan, menciptakan konsentrasi peternakan yang besar yang dapat memfasilitasi transmisi penyakit jika tidak dikelola dengan hati-hati [26, 176]. Beberapa peternakan ini berlokasi di wilayah-wilayah yang memancing unggas migrasi, seperti di Italia utara dan Lembah Fraser di Kanada. Hal ini telah mengakibatkan wabah AI dikarenakan transmisi virus dari burung liar kepada unggas yang pada beberapa kasus diikuti dengan persebaran antar peternakan [26, 137].
Produksi daging tertinggal dari produksi telur, karena unggas yang memproduksi daging sebelumnya merupakan hasil sampingan dari industri telur (misalnya afkiran, anak ayam jantan, dan ayam jantan yang dikebiri untuk digemukan (capon) [179]. Akan tetapi, upaya perbaikan genetik dan nutrisi pada tahun 1950-an membawa pada perkembangan tipe ayam pedaging dengan efisiensi pakan yang terus ditingkatkan, dan pertumbuhan yang cepat melalui persilangan ayam stok Cornish dan White Plyouth Rock [40, 179]. Di Amerika Serikat dan Eropa di pertengahan 1990-an, sebuah flok unggas yang besar akan berisi 3000-4000 ekor unggas. Flok dengan ukuran yang sama besarnya masih umum ditemukan saat ini di negara-negara berkembang, akan tetapi tren di beberapa tempat masih menyukai flok berukuran besar, dan hal ini diperparah dengan adanya wabah HPAI H5N1 karena perusahaan-perusahaan yang terintegrasi mengurangi ketergantungannya terhadap kontraktor peternak berskala kecil. Pada saat artikel ini ditulis, peternakan yang berisi sekitar satu juta ekor unggas masih ada, dimana unggas dipisah-pisahkan dalam kandang-kandang dan dibesarkan dalam penjagaan biosekuriti yang ketat. Meskipun demikian, peternakan tipe ini juga telah terinfeksi virus AI [73], termasuk HPAI.
Di seluruh dunia ayam adalah spesies unggas utama yang dibesarkan sebagai sumber makanan, baik daging maupun telur. Jumlah ayam telah meningkat secara dramatis di banyak tempat di dunia dalam waktu 30 tahun terakhir. Sebagai contoh, antara tahun 1980 dan 2010 terjadi peningkatan jumlah unggas sebanyak tiga sampai lima kali lipat di sebagian Asia dan Brazil [55]. Signifikansi peningkatan jumlah ini dari perspektif epidemiologi tergantung pada banyak faktor, meliputi tipe unggas (termasuk spesies dan derajat kesamaan genetik), dan cara pemeliharaan, transportasi, dan penjualannya, juga konsentrasi unggas di peternakan. Di beberapa negara, seperti di Belanda, kepadatan peternakan unggas telah meningkat dengan dramatis, dan hal ini berimplikasi terhadap transmisi virus influenza di tempat-tempat dimana kepadatan peternakan sangat tinggi [189].
Meningkatnya populasi unggas di China telah diikuti dengan berkurangnya produsen unggas berskala kecil, teritama di provinsi-provinsi wilayah timur yang berbatasan dengan laut/wilayah pesisir dimana terdapat kesempatan lowongan kerja alternatif selain peternakan. Di wilayah-wilayah ini hanya ada sedikit ketergantungan terhadap produk asal unggas untuk pemenuhan ketahanan pangan dan keuangan, akan tetapi ketergantungan tersebut tetap tinggi di beberapa bagian wilayah China dan di negara-negara seperti Vietnam, Indonesia, dan Mesir. Antara tahun 1996 dan 2005 jumlah peternakan unggas di China berkurang dari 104 juta menjadi 34.6 juta. Antara tahun 2007 dan 2008 sebanyak 2 juta produsen ayam broiler berhenti berproduksi, dan tren ini diperkirakan akan terus berlanjut [96, 177, 217]. Di negara-negara lain, seperti Thailand, sebagian besar peningkatan produksi unggas terjadi pada peternakan industri berskala besar, akan tetapi unggas masih tetap dipelihara oleh rumah tangga, tidak hanya untuk konsumsi rumahan, akan tetapi juga untuk alasan sosial, rekreasional, dan kultural [53].
Pada banyak negara, standar biosekuriti pada beberapa peternakan tidak berada pada level yang sama dengan yang diperlukan untuk menghadapi ancaman terhadap avian influenza dan patogen-patogen lainnya [60, 133, 183]. Banyak faktor mempengaruhi apakah petani/peternak mengimplementasikan upaya-upaya pengendalian ini, meliputi ancaman-ancaman dari pennyakit lain, persepsi terhadap resiko, dan biaya peningkatan fasilitas yang sudah ada, terutama di lokasi-lokasi dimana akses terhadap investasi modal masih terbatas. Ditambah lagi, di negara-negara dimana virus dari keturunan H5 Goose/Guangdong-(Gs/GD) masih tetap tersebar luas, sejumlah besar unggas masih dijual melalui sistem pasar unggas hidup (LBM), dimana diantara pasar-pasar tersebut masih banyak yang memiliki hygiene dan biosekuriti yang buruk. Sudah terlihat peningkatan yang luar biasa di beberapa pasar di beberapa negara sejak terjadinya penularan wabah HPAI H5N1, dan yang lebih terkini yakni LPAI H7N9 di China. Akan tetapi, virus AIV terus saja bersirkulasi pada beberapa pasar, dan sangat sulit untuk bisa merubah perilaku para pedagang, meskipun telah ada peningkatan pengetahuan tentang penyakit dan seringnya kemunculan kasus penyakit zoonosis yang berhubungan langsung dengan unggas hidup di pasar [126]. Program pengendalian yang komprehensif berakibat meningkatnya surveilas, juga disertai membaiknya fasilitas dan manajemen di pasar unggas hidup (LBM) telah berhasil mengeliminasi virus LPAI H7N2 yang telah menetap selama 13 tahun di pasar unggas hidup di Kota New York, dan berhasil mengurangi kemungkinan unggas yang dijual di pasar terinfeksi oleh virus AIV [214].
Tipe ayam yang dibesarkan di peternakan bervariasi, dengan sebagian besar unggas disuplai dari perusahaan bibit unggas internasional. Beberapa bagian Asia memiliki preferensi untuk memelihara ayam yang pertumbuhannya lambat, biasanya merupakan persilangan dari ayam lokal dan ayam bibit yang pertumbuhannya lebih cepat seperti misalnya Israeli Kabir yang mempertahankan rasa daging yang lebih kaya dan warna paruh yang kuning, juga bulu dan lemak yang berasal dari unggas lokal induknya [112]. Di beberapa wilayah lainnya, seperti Indonesia, ayam broiler komersial yang berukuran kecil dan berharga murah lebih disukai [30].
Sistem pembesaran ayam di banyak negara maju sekarang telah berkembang dari memelihara hewan seluruhnya di luar ruangan menjadi produksi unggas yang sepenuhnya di ruang tertutup, dan kemudian berubah lagi dengan meningkatnya tren produksi unggas di luar ruangan dengan diumbar (free-range) yang sesuai dengan permintaan konsumen. Hal ini berakibat banyaknya flok unggas yang dipelihara dengan diumbar di luar ruangan. Jikalau tidak dilakukan upaya pencegahan dengan menyediakan pakan dan air yang terlindungi, resiko infeksi virus AIV dari burung liar akuatik di peternakan-peternakan jenis ini bakal meningkat [42, 63].
Integrasi vertikal dan kepemilikan perusahaan besar sekarang telah menyebar di sektor perunggasan komersial secara global. Pengujian unggas internal perusahaan biasanya dilakukan, dan meskipun hal ini dapat meningkatkan kecepatan pengujian untuk suatu penyakit, hal ini juga dapat berakibat tidak dilakukannya pelaporan atau keterlambatan pelaporan AI kepada otoritas veteriner. Kasus HPAI H5N1 yang terjadi di banyak negara di Asia, dikenali telah terjadi, namun tidak dilaporkan pada saat virus pertama kali muncul di Asia Tenggara pada tahun 2003 [174].
Ayam pedaging/broiler modern telah dibiakkan untuk produksi intensif, dan respons nya terhadap stimulasi antigen berbeda dengan ayam petelur/layer [100]. Berkurangnya aktifitas respons imun pada ayam pedaging memberikan implikasi bahwa ayam tersebut telah dibesarkan dan dijual dalam kondisi kurang optimal. Ayam pedaging komersial juga memiliki umur yang pendek, sehingga sulit untuk mengimplementasikan program vaksinasi Ai kecuali vaksinasi di penetasan menggunakan vaksin vector dapat dikembangkan dan diaplikasikan secara efektif.
Pada tahun 2013 diperkirakan terdapat populasi ayam sebesar 21 milyar ekor di seluruh dunia, dengan lebih dari 50%-nya (11,9 milyar ekor) dipelihara di Asia [55]. China merupakan pemimpin dunia dalam jumlah unggas, dengan populasi sebesar lebih dari 5 milyar ekor ayam. Perlu dicatat bahwa sebagian besar negara dimana virus HPAI H5 keturunan Gs/GD telah menjadi endemik terletak di Asia, dimana meningkatnya propulasi unggas tidak selalu diikuti dengan upaya biosekuriti yang memadai.
Kalkun
Domestikasi kalkun terjadi di Amerika Tengah, mungkin di Meksiko antara tahun 200 SM dan 700 M, dan muncul pada awalnya dari memelihara kalkun subspecies Meksiko (Meleagris gallopavo gallopavo) [40]. Kalkun domestik berukuran kecil ini dibawa dari dunia baru ke Eropa oleh para penjelajah Spanyol, mulai dari awal abad ke-16, dan kembali ke dunia baru pada tahun 1607 di timur laut Amerika, dimana mereka disilangkan dengan kalkun liar timur (Meleagridis gallopavo silvestris) untuk menghasilkan burung yang lebih besar dan kuat. Seleksi ciri khas burung yang berdada besar dan bidang diawali oleh Jesse Throssel di Kanada dan dikembangkan lebih lanjut di Amerika Utara pada awal tahun 1920-an. Pada awalnya, produknya menggunakan metode pemeliharaan tradisional secara ekstensif dimana unggas dibesarkan sebagai komoditas untuk pasar perayaan musiman. Dimulai dari tahun 1950-an, produksi terkosentrasi dimulai mengikuti perkembangan rumah-rumah produksi unggas dengan lingkungan yang terkendali serta metode-metode kemoterapeutik untuk mencegah penyakit protozoa yang dikenal sebagai ‘blackhead’. Produksi industrial umumnya ada di negara maju. Salah satu pendorong pemeliharaan kalkun di luar ruangan di Amerika Serikat adalah munculnya avian influenza. Secara global pada tahun 2013 terdapat sekitar 460 juta ekor kalkun, dengan lebih dari 75%-nya ada di Amerika Serikat. Amerika Serikat memiliki populasi sebesar 250 juta ekor, sementara Asia memiliki populasi kalkun hanya sebesar 12 juta ekor saja [55]
Unggas Air
Itik domestik terdiri dari dua spesies yang berbeda, yang disebu domestik atau tipe itik-Mallard, meliputi tipe itik Peking dan itik Indian Runner (Anas platyrhynchos), yang berasal dari Asia dan Eropa, dan itik Muscovy/ Entok (Cairina moschata) yang pada awalnya berasal dari wilayah beriklim tropis dan subtropis di Amerika Selatan bagian tengah dan utara [40]. Tipe itik Mallard mewakili mayoritas itik domestik yang dipelihara. Mallard didomestikasi melalui dua kejadian yang terpisah, yakni yang pertama di Asia Tenggara beberapa ribu tahun yang lalu, dan kemudian di Eropa selama abad pertengahan. Domestikasi itik tampaknya sangat mungkin terjadi setelah munculnya virus AI, karena itulah mungkin beberapa populasi itik domestik telah terinfeksi virus AI sejak saat itu [172]. Itik domestik adalah spesies unggas minoritas di Eropa, akan tetapi merupakan spesien unggas penting di sebagian Asia Selatan dan Asia Timur, dimana mereka dipelihara untuk menghasilkan daging dan itik. Sekitar 81% populasi itik di Asia, dengan China dan Vietnam mencakup 65% total populasi dunia. Sebagian besar produksinya adalah outdoor, akan tetapi terdapat juga produksi industrial untuk unggas pedaging, terutama di Eropa dan Amerika Utara, akan terapi juga baru-baru ini muncul di Asia. Itik seringkali digembalakan di sawah, dan dalam proses menggembalakan itik tersebut dapat menempuh jarak yang cukup jauh. Itik Peking dikembangkan di Long Island, Amerika Serikat di pertengahan tahun 1800-an, dan produksi itik secara intensif terjadi disana pada awal abad ke-20. Cara pemeliharaan itik telah memainkan peranan yang penting dalam persistensi, evolusi, dan penyebaran virus HPAI H5N1 dan virus AI lainnya. Itik yang dibesarkan di luar ruangan berbagi lingkungan hidup dengan unggas air liar, memberikan kesempatan terjadinya transmisi virus AI secara dua arah.
Itik entok (Muscovy) dibawa dari Amerika ke Eropa, terutama Perancis, dan ke Afrika oleh para penjelajah Spanyol dan Portugis, akan tetapi juga dibawa ke Asia, dimana dia beradaptasi dengan baik pada iklim yang panas [40]. Entok masih merupakan spesies unggas yang minoritas, dengan produksi komersial yang terbesar berada di Perancis, negara-negara Eropa Timur, Taiwan, dan Asia Tenggara, terutama sebagai pengahasil daging. Entok biasanya ditemukan dipelihara oleh rumah tangga di pedesaan di Asia, dan digunakan untuk mengerami telur spesies unggas lain. Produksi di belahan dunia lain, terutama di Afrika dan Amerika Selatan utamanya sebagai unggas pedesaan dengan produksi daging dan telur dalam jumlah sedikit. Spesies hibrida steril yang melupakan persilangan itik domestik dan itik Entok, yang disebut mallard/itik serati, merupakan komoditas komersial penting di Asia Tenggara, terutama di Taiwan, dan di Perancis.
Ada dua tipe angsa domestik, Ras timur, seperti misalnya Chinese dan African, berasal dari angsa liar (Anser cygnoides) di China yang dimulai dari sekitar 4500 tahun yang lalu. Ras barat seperti Embden dan Toulouse, berasal dari angsa liar graylag (Anser Anser) di Mesir (dipelihara mulai 1500 sebelum masehi) dan mungkin di Jerman [40]. Angsa terutamanya dipelihara di China, dengan sejumlah kecilnya dipelihara di Eropa Timur, dengan sebagian besar angsa dipelihara di luar ruangan, melalui kombinasi produksi indoor dan outdoor atau di lingkungan desa, meskipun ada beberapa produksi industri komersial. Di negara-negara maju lainnya, produksi angsa adalah industri kecil, dan hanya sedikit angsa yang dipelihara di negara-negara maju.
Produksi itik dan angsa mencakup sekitar 7.5% produksi unggas dunia [146]. Berdasarkan perkiraan dari FAO, China adalah produser nomor satu baik untuk itik (populasi sebanyak 658 juta ekor di tahun 2013), dan kalkun (populasi sebesar 285 juta ekor) yang mencakup sebesar 58% dan 84% dari jumlah populasi global dua spesies ini (1.18 milyar ekor itik dan 340 juta ekor angsa). Negara-negara penghasil itik dengan jumlah besar selain China antara lain Vietnam (populasi 82,9 juta ekor), Indonesia (50,9 juta ekor), Malaysia (51 juta), dan Bangladesh (46,5 juta). Eropa Timur merupakan rumah dari sekitar 19 juta ekor angsa domestik [55]. Selain daging, telur itik, hati itik, dan bulu itik dan angsa merupakan produk ekspor yang cukup signifikan. Bulu digunakan untuk bahan isian jaket, kantong tidur, bantal, dan sebagainya. Tidak terkendalinya perdagangan komoditas ini dapat mengandung resiko transmisi virus AI.
Unggas minoritas lainnya
Berbagai spesies unggas lainnya juga dibesarkan untuk mendapatkan daging, telur, bulu dan kulitnya di seluruh dunia, akan tetapi hanya berlaku sebagai kontributor kecil saja di dalam produksi pertanian. Akan tetapi di beberapa negara dengan sistem pasar basah, beberapa spesies minor merupakan kontributor yang penting bagi kelangsungan hidup masyarakat. Diantaranya meliputi burung ratites, terutama Burung Unta (Struthio camelus) dan emu (Dromaius novaehollandiae) dan juga burung puyuh Jepang (Coturnix coturnix japonicus), burung puyuh bobwhite (Colinus virginianus), ring-necked pheasant (Phasianus colchicus), chukar partridge (Alectoris chukar), guinea fowl (Numida meleagris), dan burung dara (Columba livia). Burung puyuh Afrika Selatan dibesarkan di luar ruangan, dan telah terbukti sangat sulit untuk melindungi flok-flok burung unta terhadap infeksi virus LPAI dari subtipe H5 [131].
Di dunia ini terdapat perdagangan unggas dan produk unggas yang besar. Sebagian besar unggas hidup yang dijual melawati perbatasan negara adalah anak ayam (DOC). Hal ini secara umum memiliki resiko transmisi virus AI level rendah, terutama jika pedoman OIE dalam perdagangan unggas telah diikuti, akan tetapi, terdapat beberapa kasus laporan dimana DOC mungkin telah memainkan peranan dalam transmisi virus AI, termasuk satu kasus di Laos [231]. Daging unggas dan telur memiliki resiko rendah dalam transmisi virus AI. Daging dari unggas yang terinfeksi dengan HPAI bisa memiliki level virus yang tinggi, telur dapat terkontaminasi virus HPAI jika berasal dari flok terinfeksi, dan beberapa kasus telah dilaporkan dimana isi dalam telur mengandung virus AI. Wabah Avian Influenza (seperti yang didefinisikan oleh OIE) biasanya diikuti dengan pembatasan perdagangan unggas dan produk asal unggas, yang kemudian akan mengurangi resiko pemasukan virus melalui jalur resmi dari komoditas-komoditas ini. Penyelundupan ayam betina afkir dan anak ayam muda dikenali sebagai salah satu faktor resiko masuknya virus HPAI H5 Gs/GD ke Vietnam.
Ekologi dan epidemiologi virus influenza secara umum
Ekologi dan epidemiologi virus influenza A (IAV) bersifat kompleks, melibatkan banyak hospes burung yang hidup bebas, yang dibesarkan di penangkaran, dan unggas domestik demikian juga berbagai hospes mamalia liar dan domestik di lingkungan yang berbeda-beda (Gambar 1.1). virus AI berasal dari famili Orthomyxoviridae, genus Influenzavirus A, dan memiliki delapan segmen gen [38]. Virus AI yang ditemukan pada burung diklasifikasikan berdasarkan glikoprotein permukaannya kedalam 16 subtipe berbeda berdasarkan hemagglutinin (H1-16) dan berdasarkan neuraminidasenya (N1-9). Dua tipe tambahan H dan N (H17N10 dan H18N11) telah ditemukan pada kelelawar [119].
Unggas akuatik yang hidup bebas sebagai reservoir purba virus avian influenza
Burung yang hidup bebas tidak boleh dipandang hanya sebagai satu entitas “burung liar” yang menetap dalam satu ekosistem dengan resiko yang setara terhadap infeksi virus LPAI. Akan tetapi harus dipandang bahwa burung-burung ini adalah sekumpulan hewan dengan genetik dan fenotip berbeda yang menempati berbagai habitat dan ekosistem. Terutama kelas Aves yang memiliki 29 ordo, 187 famili, sekitar 2000 genera dan lebih dari 9600 spesies [62]. Virus LPAI telah diperlihatkan mampu untuk menginfeksi secara alami lebih dari 105 spesies avian yang mewakili 12 ordo yang ada [132, 187, 188, 228]. Akan tetapi, jumlah sebenarnya dari spesies avian yang mempu menerima infeksi secara alami diperkirakan lebih banyak lagi dari yang sudah tercatat [6].
Sebagian besar virus LPAI telah diisolasi dari burung-burung air dari ordo Anseriformes (itik, angsa) dan Charadriiformes (burung pesisir [turnstones dan sandpipers], camar, terns, murre, dan guillemots) [188]. Burung-burung semacam itu dianggap sebagai reservoir utama virus LPAI, dengan virus AI yang paling sering ditemukan adalah dari Anseriformes (terutama subtipe H3, H4, dan H6) dan dari Charadriiformes (terutama subtipe H3, H9, H11, dan H13) (Gambar 1.1, Tabel 1.1) [3, 4, 6, 116, dan 184]. Ditambah lagi, virus LPAI telah diisolasi dari burung akuatik dalam ordo Ciconiiformes (herons dan ibis), Gaviiformes (loons), Gruiformes (grebe), dan Procellariiformes (shearwater). Di waktu-waktu yang langka, virus LPAI telah diisolaso dari burung non-akuatik dalam ordo Piciformes (woodpecker/burung pelatuk), Passeriformes (burung bertengger, seperti sparrow, starling, mynah, finch, dan weaverbird/burung penenun), Columbiformes (merpati dan burung dara), dan Galliformes (burung pegar dan ayam hutan) [187, 188]. Akan tetapi, spesies non-akuatik tidak dianggap sebagai reservoir virus LPAI, infeksi pada spesies-spesies ini diduga terjadi melalui tumpahan/spillover dari unggas domestik yang terinfeksi [187]. Infeksi virus LPAI pada burung yang hidup bebas biasanya tidak menimbulkan gejala dan virus-virus semacam itu disebarkan dalam spesies yang sama ataupun ke spesies burung lain yang hidup dalam satu ekosistem bersama [205]. Sebagian besar burung yang hidup bebas lainnya antara sudah terekspos ataupun sudah terinfeksi virus LPAI, terutama burung upland game atau burung darat dari ordo Galliformes (ayam hutan, kalkun liar, burung puyuh Bobwhite, dll), karena penggunaan habitat dan tingkah laku [139].
Sebaliknya dari virus LPAI, sebelum tahun 2002 virus HPAI jarang diisolasi dari burung yang hidup bebas [218], dan keberadaan reservoir virus pada burung liar dalam waktu lama juga telah ditunjukkan [154]. Akan tetapi, sejak 2002 virus HPAI H5 Gs/GD telah diisolasi dari berbagai burung yang hidup bebas baik yang masih hidup maupun yang sudah mati, dan pada burung yang hidup secara spasial diasosiasikan dengan wabah penyakit pada burung liar maupun unggas. Sebagai tambahan dari burung-burung yang termasuk ke dalam daftar yang telah disebutkan di atas, virus HPAI H5 telah diisolasi dari burung-burung yang termasuk kedalam ordo Falconiformes (falcon, elang, rajawali, elang buzzards, dan burung pemangsa dunia lama), Phoenicopteriformes (flamingo), Strigiformes (burung hantu) [218], dan Passeriformes dalam kisaran yang lebih luas lagi, termasuk burung gagak dan magpie. Dalam beberapa kasus infeksi pada burung liar ini merupakan akibat paparan dari unggas domestik yang telah terinfeksi sebelumnya, dan banyak dari burung-burung yang hidup bebas ini memiliki kebiasaan pemakan bangkai atau karnivor yang dapat mengakibatkan transmisi melalui konsumsi karkas unggas maupun burung liar yang terinfeksi.
Dari tahun 2003 dan seterusnya telah jelas bahwa burung liar mampu untuk menyebarkan virus HPAI H5N1 melalui jarak yang jauh. Hal ini pertama kali dibuktikan dengan kasus yang diasosiasikan dengan virus HPAI H5 Gs/GD terdeteksi di Jepang di tahun 2003-2004. Pola wabah konsisten dengan pemasukan virus melalui burung liar. Setelahnya telah terjadi setidaknya empat kejadian pemasukan virus HPAI H5 Gs/GD yang berbeda namun saling berhubungan ke Korea Selatan dan Jepang.
Peranan burung liar dalam transfer virus HPAI H5 Gs/GD melalui jarak yang jauh ditetapkan pada tahun 2005 pada saat burung liar ditemukan mati karena penyakit ini di danau-danau di lokasi yang terpencil yang dikunjungi oleh burung migrasi di Mongolia dan Rusia di tempat-tempat dimana tidak ada unggas. Virus itu kemudian dibawa ke Timur Tengah dan Eropa, dan selama itu terjadi beberapa pemasukan virus ke Danube Delta dan Laut Hitam bagian barat. Virus juga sudah masuk ke Afrika Barat dan Mesir, dan burung liar dianggap oleh beberapa ahli sebagai penyebab utama masuknya virus tersebut. Akan tetapi, status reservoir jangka panjang virus HPAI H5 keturunan ini pada burung akuatik yang hidup bebas belum di demonstrasikan, karena tidak ada satupun virus HPAI H5 keturunan Gs/GD yang ditemukan pada populasi burung liar lebih dari tiga tahun (Lihat Bab 9).
Pada musim dingin tahun 2014-2015, unggas liar sekali lagi diduga terlibat dalam transmisi jarak jauh virus HPAI H5 keturunan Gs/GD dimana untuk pertama kalinya virus-virus dari dua clade yang berbeda (clade 2.3.4.4 dan 2.3.2.1c) dideteksi di Rusia pada saat yang sama, dan kemudian terdeteksi pula di Amerika Utara dan Eropa (Bulgaria, Rumania) dan India (Clade 2.3.2.1c). Rute persisnya masuknya virus-virus ini masih belum diketahui untuk beberapa kejadian yang sudah terjadi, namun bukti-bukti molekuler sangat kuat menyarankan bahwa proses pemasukan virus adalah dari burung liar, meskipun terdapat celah yang sangat besar dalam alur migrasi yang sudah diketahui dalam proses masuknya virus clade 2.3.4.4 ke Eropa.
Reservoir utama infeksi virus HPAI H5 keturunan Gs/GD dan tempat propagasi virus-virus ini adalah itik domestik di sebagian Asia dan Mesir. Unggas berpindah melewati pasar-pasar unggas hidup dan kandang-kandang pengepul yang tidak dikelola dengan baik juga memainkan peranan di wilayah-wilayah ini [87, 192], dan di beberapa negara kemungkinan virus bertahan hidup pada unggas di pedesaan dan peternakan besar yang buruk pengelolaanya.
Secara sejarahnya, virus HPAI telah muncul dari virus LPAI setelah bersirkulasi di unggas galinaseus dan merupakan akibat dari mutasi situs pembelahan proteolitik pada protein hemagglutinin [199]. Akan tetapi, virus HPAI H5 keturunan Gs/GD tetap memiliki patogenitas tinggi dan telah terus bersirkulasi pada unggas dan burung liar sejak pertama kali diidentifikasi pada angsa di Guangdong di tahun 1996. Diskusi mendetail tentang AI dan burung yang hidup bebas disajikan di Bab 7.
Virus Influenza A pada mamalia
Virus AI (sebagian besar subtipenya) telah menyebabkan infeksi di banyak spesies mamalia, virus-virus ini atau beberapa dari gen mereka berasal dari virus AI yang menetap pada reservoir burung liar (Gambar 1.1). Umumnya virus AI tidak bersifat memilih-milih, tidak seperti banyak bakteri usus (yang berpindah dengan mudah dari satu spesies hospes ke spesies lainnya). Pada banyak kejadian, virus ini menunjukkan beberapa adaptasi terhadap hospes, karena itu ia memerlukan waktu yang lama untuk beradaptasi (tahunan bahkan beberapa dekade) kepada spesies hospes baru dan kemudian menjadi endemik. Akan tetapi transmisi silang dari burung ke mamalia, termasuk manusia, dapat terjadi. Beberapa virus AI mampu untuk menginfeksi mamalia tanpa memerlukan adaptasi terlebih dahulu [122]. Transmisi virus zoonosis ini selanjutnya setelah menginfeksi mamalia masih jarang terjadi, menunjukkan bahwa adaptasi tambahan atau reassortment antara berbagai gen virus AI diperlukan untuk mendapatkan transmisi yang stabil dan berkelanjutan.
Bukti serologis terhadap infeksi virus A yang beragam telah terdeteksi pada manusia [86, 89]. Faktor virus yang memfasilitasi berpindahnya dari burung ke mamalia telah ditelaan dan masih terdapat banyak celah pemahaman di sana-sini. Kita belum memiliki pemahaman secara menyeluruh terhadap kondisi-kondisi yang memfasilitasi perpindahan antar spesies, meskipun penelitian tentang hal ini telah dilakukan selama bertahun-tahun [122]. Beberapa perubahan yang memafasilitasi infeksi pada mamalia dapat muncul selama replikasi pada unggas domestik, seperti misalnya perubahan pada spesifisitas reseptor, dimana pada kasus-kasus lainnya perubahan-perubahan ini telah ada pada virus yang berasal dari burung liar [122].
Sejak virus HPAI H5N1 keturunan Gs/GD muncul sebagai penyebab penyakit berat pada unggas dan manusia pada tahun 1997, terbit kekhawatiran bahwa virus ini dapat mengembangkan kemampuan bertransmisi secara efektif antar mamalia, menciptakan pandemi flu manusia yang baru dan berat. Transmisi virus HPAI H5N1 melalui pernafasan telah dicoba kembali pada musang percobaan dalam sebuah penelitian “gain of function” [76, 91], akan tetapi sejauh ini hanya ada transmisi terbatas dalam transmisi telah terjadi pada manusia yang disebabkan oleh virus influenza zoonotik strain lapangan [229].
Virus AI pada awalnya berasal dari burung bertanggung jawab terhadap terjadinya infeksi pada mamalia dalam tiga situasi umum:
- Infeksi epidemic dengan virus yang telah beradaptasi dengan hospes seperti misalnya flu babi, flu kuda, sebagian besar strain flu manusia dan baru-baru ini muncul yaitu flu anjing.
- Infeksi sporadis, terbatas pada infeksi epizootik seperti pada mink, anjing laut, ikan paus, dan bebera babi, dan beberapa kasus pada manusia yang terinfeksi virus LPAI yang berasal dari burung liar ataupun unggas domestik, seperti virus yang berasal dari subtipe H9N2 dan H7N9.
- Infeksi sporadis yang baru-baru ini terjadi disebabkan oleh virus H5 keturunan Gs/GD seperti yang terjadi pada harimau, singa, leopard, kucing rumahan, anjing, musang Owston, musang batu, babi (kadang-kadang) dan sekitar 450 kasus yang telah dilaporkan pada manusia.
Infeksi endemik virus yang telah beradaptasi pada hospes
Infeksi virus AI secara endemik telah menetap pada babi, kuda, anjing dan manusia, menyebabkan infeksi umum saluran pernafasan bawah dan atas dan merupakan penyakit yang sering muncul (Gambar 1.1). virus-virus dengan hospes yang spesifik ini terutama menjadi menetap disebabkan oleh segmen gen dari virus AI dan virus AI yang telah beradaptasi dengan hospes yang mengalami reasortansi untuk memproduksi virus hasil reasortansi atau yang disebut virus hibrid. Pada kuda, strain virus AI klasik adalah subtipe H7N7, yang pertama kali dideskripsikan pada awal tahun 1950-an, akan tetapi kemudian tidak terdeteksi lagi sejak tahun 1970. Strain itu kemudian digantikan oleh strain H3N8 [211]. Lebih jauh lagi, pada awal tahun 200-an, strain virus muncul dari strain H3N8 dari kuda teridentifikasi pada seekor anjing pacuan jenis Greyhound di Florida yang mengalami penyakit pernafasan berat, dan kemudian influenza H3N8 telah menjadi penyebab umum batuk kenel ‘kennel cough’ pada anjing di Amerika Serikat (Gambar 1.1) [27, 39]. Virus influenza lainnya dalam subtipe H3N2 berasal dari virus LPAI juga telah menetap pada anjing di Asia [136, 223]. Melalui proses reasortansi, beberapa strain dari virus ini telah mendapatkan gen M dari virus H1N1 penyebab pandemi pada manusia pada tahun 2009 [85].
Untuk babi, laporan pertama kali penyakit pernafasan yang dihubungkan dengan influenza terjadi selama bulan Agustus 1918 di Illinois, Amerika Serikat, yang diikuti dengan gelombang penyakit flu spanyol H1N1 pada musim semi yang terjadi pada manusia tahun 1918, memberikan kemungkinan adanya transmisi awal virus H1N1 dari manusia ke hewan babi [46, 208]. Virus AI H1N1 diisolasi pada tahun 1931 dari babi yang mengalami penyakit pernafasan, dan ditentukan sebagai penyebab influenza pada babi [167]. Virus H1N1 ini merupakan sumber penyebab influenza babi H1N1 klasik yang ada di Amerika Utara sampai hari ini [167]. Pada tahun 1979, virus AI H1N1 muncul apda babi di Eropa dan merupakan virus influenza A utama pada babi yang ada di Eropa [46]. Pada pertengahan 1980-an di Eropa dan pertengahan 1990-an di Amerika Serikat, influenza H3N2 muncul pada babi, yang sampai ini masih terdeteksi. Strain reasortan antara H1N1 dan H3N2 telah diisolasi dari babi, termasuk diantaranya subtipe H1N2 dan H3N1 [215]. Bukti genetik dari sekuens gen virus menunjukkan bahwa babi merupakan sumber virus yang menyebabkan pandemi influenza H1N1 pada manusia pada tahun 2009, meskipun pada awalnya beberapa gen yang terdapat pada virus ini diturunkan langsung dari virus AI [178]. Reasortansi yang cukup besar juga terdeteksi pada babi diantara pandemi pada manusia dan virus influenza babi [148].
Pada manusia, influenza A endemik biasanya menyebabkan penyakit pernafasan pada manusia yang bersifat self-limited (sembuh sendiri), akan tetapi dapat menyebabkan angka kematian yang cukup signifikan pada lansia, wanita hamil, dan individu yang mengelami perlemahan sistem imun. Secara periodik, subtipe-subtipe baru terus bermunculan, menyebabkan pandemi dan mengganti sirkulasi virus lama dengan virus baru, atau co-sirkulasi virus virus baru dan virus subtipe AI lama yang sudah menjadi endemik. Sebagai contoh, pandemi tahun 1918 mungkin disebabkan masuknya virus baru H1N1 asal unggas yang kemudian beradaptasi secara lambat, ataupun terjadinya reasortansi gen antara virus AI dan gen virus AI manusia yang telah ada sebelumnya [150, 151, 207, 233]. Analisis sekuensing gen virus AI telah menunjukkan bahwa pandemi virus AI tahun 1957 (H2N2) dan 1968 (H3N2) masing-masing merupakan akibat reasortansi tiga gen AIV yaitu HA, NA dan PB1 dan dua gen AIV, yaitu HA dan PB1 dengan lima dan enam gen AIV pada manusia (secara berurutan) [95, 149, 158, 160]. H2N2 menggantikan subtipe H1N1 pada tahun 1957 dan H3N2 menggantikan H2N2 pada tahun 1968, akan tetapi subtipe H1N1 muncul kembali pada tahun 1977, dan saat ini kedua strain ini yakni H1N1 dan H3N2 saat ini sama-sama bersirkulasi di seluruh dunia, meskipun subtipe H3N2 lebih dominan. Ekuilibrium ini kemudian berubah ketika virus penyebab pandemi H1N1 2009 muncul dari babi. Ini adalah kali pertama pandemi influenza manusia telah disebabkan oleh virus dengan subtipe yang sama dengan strain yang telah bersirkulasi secara endemik. Hal ini terjadi karena terdapat perbedaan antigenik yang besar antara virus H1N1 pada babi dan manusia, dan keberadaan kombinasi gen internal dalam virus ini yang memfasilitasi transimisi antar manusia [178].
Penyakit yang disebabkan oleh virus penyebab pandemi dapat memberi dampak kepada kelompok umur yang berebda dengan kelompok umur yang terdampak oleh virus endemik, tergantung pada imunitas yang telah ada sebelumnya etrhadap virus, dan juga tergantung pada strain yang pertama kali menginfeksi setiap orang yang terekspos virus tersebut, sebuah peristiwa yang disebut “antigenic imprinting” [233].
Detail tentang infeksi endemik virus AI yang telah beradaptasi pada hospes dapat ditemukan pada Bab 5 (implikasi kesehatan masyarakat veteriner untuk manusia), Bab 16-19 (influenza pada babi), Bab 20 dan 21 (influenza pada kuda), dan Bab 22 (influenza pada anjing).
Infeksi sporadis virus LPAI pada mamalia
Beberapa virus LPAI telah menyebabkan penyakit pernafasan pada mink (H10N4 dan H10N7) [51], anjing laut (H7N7, H4N5, H3N3, H3N8, pH1N1 dan H10N7) [15, 23, 61, 79], dan ikan paus (H1N1, H13N2, dan H13N9) [81, 114]. Infeksi yang terjadi sampai saat ini masih terbatas per individu hewan, akan tetapi beberapa kejadian epidemi telah dilaporkan. Masih kurang adanya bukti kasus-kasus ini akan menjadi endemik ataupun tetap menjadi endemik [23, 50, 61, 81, 108, 114, 226]. Infeksi sporadis dan sembuh sendiri telah dilaporkan pada babi yang disebabkan oleh virus LPAI H1N7, H4N6, dan H9N2 [19, 94, 129, 234], dan telah terjadi cukup banyak infkesi virus H9N2 pada babi di China. Infeksi virus LPAI pada manusia yang berhasil sembuh sempurna juga telah tercatat, termasyk kasus yang hanya terdeteksi melalui uji serologis. Sebagian besar strain yang terlibat tidak menjadi menetap, akan tetapi secara sporadis beberapa virus LPAI H7N1 dan H9N2 telah menyebabkan sejumlah kasus individual pada manusia dalam jumlah terbatas [28, 138]. Kemunculan virus LPAI H7N9 pada tahun 2013 yang mampu melewati batasan speses sekali lagi menunjukkan bahwa virus AI tidak mengikuti suatu aturan yang jelas. Virus-virus dengan subtipe ini muncul sebagai penyebab penyakit yang parah pada manusia di China pada tahun 2013. Sebagian besar kasus telah dihubungkan dengan keberadaan pasar unggas hidup (LPM) dimana virus bersirkulasi pada unggas. Virus ini berpatogenitas rendah pada unggasm dan infeksi secara eksperimental pada ayam tidak menimbulkan sedikitpun gejala penyakit [135]. Virus ini mungkin telah dapat lebih siap untuk menembus batasan spesies sebagai akibat dari perubahan gen NP yang memberikan peningkatan resistensi terhadap protein Mx [152].
Detail tentang infeksi virus AI pada mamalia dapat ditemukan pada Bab 23.
Infeksi sporadis virus HPAI pada manusia
Beberapa virus HPAI telah menyebabkan infeksi dan kematian pada mamalia, termasuk manusia, akan tetapi virus-virus ini belum menetap sebagai endemik, dan transmisi antar mamalia masih terbatas. Sejak tahun 1997, virus HPIA H5 Gs/GD telah menyebabkan kasus infeksi sporadis dan kematian pada kucing-kucing besar (harimau dan leopard), kucing rumahan, anjing, luwak sawit Owston, musang batu, babi domestik [35, 97, 104, 153, 181, 236], dan manusia. Virus HPAI H7N7 menyebabkan infeksi tanpa gejala pada babi selama wabah tahun 2003 di Belanda [113], dan kasus tunggal infeksi virus H5N2 telah dilaporkan selama wabah tahun 1983-1984 di Amerika Serikat [21]. Kasus infeksi pada manusia karena virus HPAI H7N7 dan H7N3 juga telah dilaporkan. Kebanyakan dari kasus ini melibatkan kontak dekat dengan burung yang terinfeksi, dan terutama pada kasus H5N1, mode kontak spesifik meliputi kegiatan menyiapkan unggas yang sakit ataupun mati untuk dikonsumsi ataupun konsumsi produk mentah seperti darah itik ataupun karkas unggas terinfeksi yang tidak dimasak, atau mengunjungi pasar-pasar yang menjual unggas hidup [28, 58].
Informasi yang menggambarkan secara detain infeksi pada manusia oleh virus AI dapat ditemukan pada Bab 5.
Unggas domestik dan burung dalam penangkaran
Manusia telah menciptakan niche baru untuk burung diluar habitat alami mereka melalui penangkaran dan domestikasi [198]. Pada beberapa kasus lingkungan baru ini telah memudahkan terjadinya transmisi, adaptasi, dan menetapnya virus AI diluar reservoir burung liar akuatik ke spesies lainnya, termasuk unggas gallinaseus yang bukan merupakan hospes alami virus AI [195]. Pemeliharaan di luar ruangan dan kurangnya biosekuriti memudahkan pemasukan, adapatasi, pemeliharaan dan penyebaran virus AI pada burung dalam penangkaran dan unggas domestik. Unggas domestik dilaporkan telah terinfeksi oleh semua subtipe LPAI dari H1 -H13 dan virus HPAI dari subtipe H5 dan H7, akan tetapi yang paling sering dilaporkan adalah subtipe H1, H5, H6, H7 dan H9.
Pada umumnya, virus LPAI telah diisolasi dari unggas domestik, paling sering (dalam urutan menurun) pada kalkun, itik, dan ayam. Virus-virus ini juga telah diisolasi, meskipun jarang, dari burung liar dalam penangkaran yang dipelihara sebagai hewan peliharaan, atau di tempat-tempat karantina, atau koleksi pribadi, pelindungan margasatwa dan taman zoologi [3, 6]. Meskipun begitu, insidensi dan distribusi sangat bervariasi tergantung kepada wilayah geografis, spesies burung, umur burung, waktu dalam tahun itu, dan sistem lingkungan ataupun sistem pertanian dimana unggas itu berada [205]. Sisa Bab ini akan berfokus pada epidemiologi Ai pada unggas domestik dan burung dalam penangkaran.
Konsep yang digunakan untuk memahami patobiologi
Definisi dari beberapa istilah patobiologi dan penjelasan beberapa konsep penyakit sangat penting dalam memahami ekologi dan epidemiologi yang kompleks dari virus AI (Gambar 12.1 dan Tabel 12.1) [203]. Paparan virus AI dapat menginisiasi proses infeksi, akan tetapi pengendalian paparan virus dapat mencegah infeksi pada hewan domestik maupun dalam penangkaran. Sebagai contoh, paparan dapat dicegah untuk hewan yang berada di negara, zona atay kompartemen bebas AI (CZC) atau jika hewan berada dalam kompartemen bebas AI yang terdampak AI akan tetapi langkah biosekuriti telah cukup untuk mencegah virus AI keluar dari fasilitas petenakan dan tempat-tempat lainnya. Akan tetapi, jika paparan virus tetap terjadi, infeksi hanya akan terjadi jika rute paparannya sesuai, dosis paparan berada di atas garis batas infeksi, imunitas yang cukup belum terbentuk pada hospes, dan strain virus AI telah beradaptasi dengan baik dengan spesies hospes tersebut. Hasil akhir infeksi semacam itu dapat berupa terjadinya infeksi tanpa gejala klinis, penyakit ringan, samapi penyakit parah dengan kematian yang tinggi. Untuk virus AI dengan tingkat adaptasi hospes yang rendah, infeksi mungkin memerlukan dosis paparan yang tinggi atau faktor sekunder untuk meningkatkan kerentanan hospes. Bahkan setelah itu jika terjadi, infeksi mungkin hanya berakibat replikasi virus dan pendedahannya di lingkungan, tanpa menimbulkan penyakit. Sebaliknya, strain AI dengan adaptasi tinggi terhadap spesies hospes biasanya hanya memerlukan dosis paparan virus yang rendah untuk memproduksi infeksi [204]. Secara umum, strain virus AI secara oprtimal beratapdasi untuk satu spesies hospes, meskipun spesies hospes yang berkerabat dekat mungkin dapat menjadi rentan meskipun virus tersebut muncul dari spesies lain. Sebagai contoh, virus HPAI H5 keturunan Gs/GD berevolusi di Asia dimana hanya sedikit kalkun yang dipelihara, akan tetapi kalkun hanya memerlukan sedikit saja dosis infeksius virus ini dibandingkan ayam ataupun Itik [2]. Pada kasus yang lainnya, spesies lain mungkin dapat menjadi rentan dan menjadi terinfeksi ketika terpapar, akan tetapi strain virus AI itu akan menunjukkan adaptasi yang lebih rendah yang dibuktikan dengan titer replikasi yang lebih rendah, yang mengakibatkan tidak adanya atau hanya transmisi minimal ke hospes selanjutnya. Pada senahoan besar unggas akuatik yang hidup bebas, virus LPAI yang telah beradaptasi secara optimal akan bereplikasi pada saluran pencernaan dan dikeluarkan melalui feses. Akan tetapi, saat virus-virus ini disebarkan ke unggas domestik melalui paparan dan adaptasi yang progresif, maka hasil akhirnya dapat berbeda. Pada banyak kasus di unggas, ketika titer replikasi vurus LPAI meningkat, maka meningkat pula keparahan perubahan patobiologik seperti lesi makroskopis pada sistem pernafasan, pencernaan dan reproduksi. Akan tetapi, kenyataannya dapat berbeda, seperti yang telah ditunjukkan virus LPAI H7N9 di China dari tahun 2013 sampai seterusnya yang bereplikasi sampai titer sangat tinggi pada ayam akan tetapi tidak menimbulkan penyakit. Strains virus paling patogenik menyebabkan kerusakan sel yang berat dan kematian. Virus HPAI bereplikasi secara sistemik dan dapat berakibat kerusakan parah terhadap organ-organ penting yang mengakibatkan kematian tinggi pada populasi yang terpapar. Keparahan gejala penyakit juga dapat ditentukan oleh genetik hospes, status imun, dan keberaaan penyakit penyerta. Secara umum, virus AI yang dapat bertransmisi dalam satu populasi spesies tertentu mengimplikasikan adaptasi cukup yang memungkinkan menyebarnya virus secara alami dari hospes ke hospes dari yang terinfeksi ke hospes rentan dari spesies yang sama ataupun spesies yang memiliki hubungan kekerabatan. Transmisi tergantung kepada faktor yang kompleks dan banyak, diantaranya:
- Magnitudo, rute dan durasi pengeluaran virus
- Spesies hospes, status imun, kepadatan populasi, dan metode pemeliharaan
- Kondisi lingkungan yang meningkatkan kemungkinan virus dapat bertahan hidup
- Kesempatan penyebaran virus secara mekanis melalui manusia, burung ataupun peralatan [21]
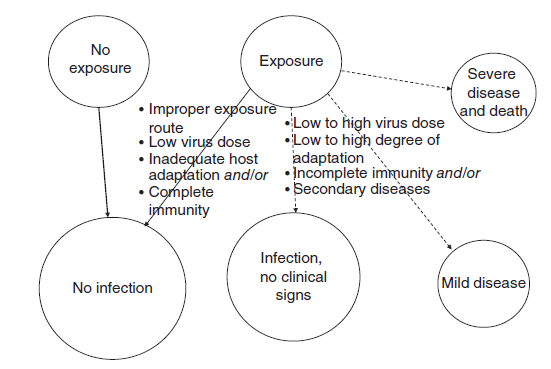
Gambar 12.1 Konsep patobiologi untuk memahami Avian Influenza pada unggas. Sumber: D. Swayne, U.S. Departement of Agriculture/ Agricultural Research Service.

Paparan dan transmisi
Di tempat-tempat dimana virus AI bersirkulasi, paparan adalah Langkah pertama dalam transmisi dan inisiasi infeksi. Secara konsep, virus AI dapat masuk ke dalam flok unggas melalui kontak langsung maupun tidak langsung dengan virus tersebut. Terdapat enam cara pemasukan virus (Gambar 12.2):
- Kontak langsung dengan burung yang terinfeksi AI
- Paparan dengan peralatan maupun material yang terkontaminasi virus AI, terutama dari sekresi, bulu, ataupun feses
- Pergerakan orang yang membawa virus AI pada sepatu mereka ataupun baju mereka
- Air ataupun pakan yang terinfeksi virus AI
- Virus AI yang bergerak di udara
- Lalat dan tikus
Cara pemasukan virus yang paling efisien melalui kontak langsung dengan unggas yang terinfeksi yang mengeluarkan virus AI dalam jumlah besar ke lingkungan melalui sekresi respiratori dan feses (burung berperan sebagai vektor biologis). Burung yang terinfeksi dapat berupa burung yang hidup bebas maupun unggas domestik. Akan tetapi, burung dapat terpapar virus AI secara tidak langsung, misalnya melalui peralatan atau material (fomites) yang terkontaminasi oleh sekresi respiratorik, feses, ataupun debu dari burung yang terinfeksi (misalnya peralatan atau material yang berlaku sebagai vektor mekanin). Manusia telah menjadi sumber paparan tidak langsung melalui sepatu, baju dan tangan yang terkontaminasi virus saat individu berkontak langsung dengan burung yang terinfeksi ataupun dengan sekresi atau ekskresinya (misalnya manusia berlaku sebagai vektor mekanik). Ditambah lagi, burung terpapar virus AI melalui kontak dengan air yang terkontaminasi. Burung yang telah terpapar dapat meliputi burung air akuatik liar, itik domestik, ayam, dan mungkin juga kalkun [77, 177], akan tetapi dapat meliputi tipe unggas apa saha yang dipelihara dalam sistem LPM saat air minum ataupun lingkungan sekitar telah terkontaminasi. Beberapa bukti paparan virus AI melalui partikel debu yang terkontaminasi atau droplet air dalam udara dan pergerakan oleh angin. Sampling udara dengan volume tinggi di luar fasilitas peternakan terdampak wabah HPAI H5N2 tahun 1983-1984 di Amerika Serikat telah mendeteksi virus AI dalam sampel yang diambil sampai 45 meter dari peternakan, tetapi tidak ditemukan lebih jauh dari jarak itu [21]. Selama wabah HPAI H7N3 di Kanada, dosis infeksius rata-rata dalam kultur jaringan (TCID50)/m3 sebesar 102.4 terdeteksi melalui sampling udara volume rendah didalam peternakan yang unggasnya terinfeksi, ditemukan juga asam nukleat virus AI dalam dosis rendah diluar peternakan terdampak [147].
Dispersi virus AI melalui aerosol, debu dan bulu diajukan sebagai cara-cara perpindahan virus dari peternakan yang terdampak wabah HPAI H7N2 di Kanada, terutama pada saat aktivitas depopulasi yang menimbulkan debu dan aerosol yang tertiup angin [18, 130]. Juga ada beberapa flok pada saat wabah HPAI H5N1 tahun 1983-1984 di Amerika Serikat yang tampaknya telah terinfeksi karena tersebarnya alas kandang atau manure yag terinfeksi dan tidak dikomposkan pada padang-padang yang berdekatan [21]. Akan tetapi pada wabah-wabah lain, seperti wabah LPAI H7N2 di Virginia, Amerika Serikat di tahun 2002, distribusi spasial peternakan yang terdampak tidak konsisten dengan persebaran melalui angin, akan tetapi malah menunjukkan penularan melalui pergerakan fomites yang dibawa oleh manusia sebagai sumber penularan utama antar peternakan [1]. Penelitian eksperimental telah menunukkan bahwa rute udara/angin bukanlah cara penularan utama dalam transmisi virus [11, 57, 82, 124, 125], meskipun beberapa virus dalam subtipe H9N2 dapat ditularkan melalui udara dalam jarak dekat antar unggas, dan juga modellinng wabah HPAI H7N7 di Belanda tahun 2007 menunjukkan bahwa persebaran virus melalui angin berkontribusi dalam penularan 18% dari dari wabah [23]. Transmisi virus HPAI H5N1 melalui udara pada ayam dan musang telah direplikasi kembali melalui simulasi pasar dimana ayam yang terinfeksi disembelih dan disiapkan untuk dikonsumsi (D. E. Swayne, data yang tidak dipublikasikan), dan transmisi melalui udara telah didalilkan sebagai salah satu cara masuknya virus dalam peetrnakan di Amerika Utara selama epidemi H5N2 tahun 2014-2015.
Virus influenza dari spesies lain juga dapat berpindah pada unggas, seperti yang dilaporkan saat wabah pandemi virus H1N1 pada kalkun sebagai akibat adanya kontaminasi pada saat inseminasi buatan [134].
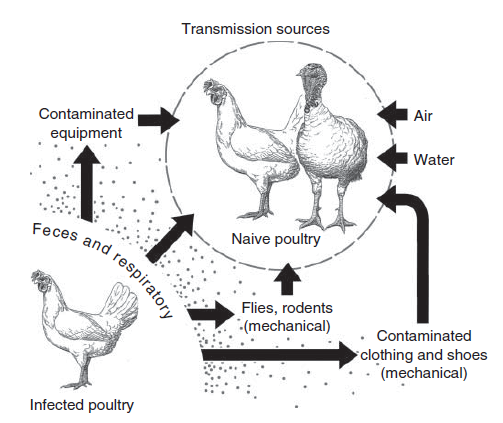
Gambar 12.2 Enam cara atau mode pemasukan virus AI ke dalam populasi unggas. Sumber: K. Carter, University of Georgia, dan D. Swayne, U.S. Department of Agriculture Research Service.
Meskipun terdapat banyak bukti penyebaran virus AI secara horizontal, bukti adanya transmisi secara vertikal sangat sedikit [10, 21, 45]. Akan tetapi, virus HPAI memang memproduksi infeksi sistemik pada ayam betina, dan pada beberapa butir telur terakhir yang ditelurkan oleh ayam betina tersebut sebelum mati terdapat virus HPAI di permukaan telur dan dalam isi telur [10, 13, 25]. Karena virus AI membunuh embrio, inkubasi telur yang terinfeksi tidak berhasil menetaskan telur [10]. Akan tetapi, pembersihan material feses dari permukaan telur dan desinfeksi telur mungkin diperlukan untuk mencegah penyebaran virus dalam fasilitas penetasan jika telur berasal dari flok yang terinfeksi AI [21]. Sampai saat ini tidak ada penelitian yang menyelidiki apa yang terjadi pada virus AI yang berada di permukaan telur pada saat inkubasi/penetasan. Temperature yang dicapai dalam proses penetasan diharapkan mampu mengurangi konsentrasi residu virus di permukaan kerabang telur dalam masa 21 hari inkubasi, akan tetapi mungkin tidak dapat mengeliminasi semua virus yang ada. Sebagian besar virus LPAI dan HPAI menyebabkan berkurangnya produksi telur atau bahkan menghentikan produksi telur sama sekali, yang semakin menghambat potensi penularan virus AI secara vertikal.
Harus disebutkan secara khusus tentan LPM dan pengumpul/pedagang ternak, yang jika tidak diatur dengan benar maka akan tetap terus terinfeksi, menimbulkan resiko terhadap setiap ekor unggas yang masuk ke pasar ataupun kandang pengumpul. Transmisi yang terjadi di tempat-tempat ini dapat terjadi melalui rute transmisi yang telah disebutkan di atas, dan termasuk juga kontak langsung dengan alat transportasi dan kandang-kandang untuk membawa ternak yang telah terkontaminasi.
Adaptasi dan transmisibilitas
Virus AI menunjukkan berbagai variasi adaptasi hospes, yang memberikan dampak terhadap infektivitas dan transmisibilitas/kemampuan transmisi virus. Mudahnya transmisi strain individual virus AI sampai batas tertentu dipengaruhi oleh seberapa dekat hubungan genetik antar hospes, dan juga derajat adaptasi hospes yang diekspresikan oleh strain virus secara individual. Mengikuti paparan yang terjadi, transmisi virus AI terjadi paling sering dan cepat antar individu dalam satu spesies yang sama dimana strain virus telah beradaptasi dengan sangat baik (transmisi intraspesies) [198]. Transmisi antar spesies memang terjadi, dan paling sering terjadi antar individu yang memiliki hubungan kekerabatan spesies yang dekar, terutama yang berasal dari keluarga yang sama dalam taksonomi, misalnya antara ayam, kalkun, burung puyuh,, burung pegar, dan ayam guinea (semuanya termasuk dalam Ordo Galliformes, famili Phasianidae). Transmisi antar spesies juga telah dilaporkan antar unggas yang tidak memiliki hubungan kekerabatan dekat, misalnya dari itik mallard liar (Ordo Anseriformes) kepada kalkun (Ordo Galliformes), akan tetapi transfer virus semacam itu sangat jarang dibandingkan dengan hospes yang berkerabat dekat [198]. Sejumlah wabah HPAI diawali dengan masuknya virus LPAI dari burung liar, atau pada beberapa kasus melalui masuknya virus HPAI secara langsung seperti yang telah terjadi pada virus HPAI H5 keturunan Gs/GD sejak tahun 2002. Transfer virus AI semacam itu yang terjadi dari burung air kepada unggas domestik menjadi sebuah kekhawatiran yang konstan. Sebagai contoh, banyak virus AI telah muncul di Asia Timur dan Asia Tenggara, telah berevolusi dalam populasi itik domestik, dan juga telah menginfeksi unggas yang hidup di darat. Semua hal ini mungkin telah terjadi pada virus LPAI dari subtipe H7N9. Pemasaran unggas yang melibatkan banyak spesies dalam pasar unggas hidup (LPM) juga memfasilitasi transmisi antar spesies, dan transmisi ini dapat terjadi juga di peternakan atau peternakan rumahan yang memelihara banyak spesies unggas berbeda. Terdapat banyak tipe virus AI pada unggas daratan di Asia. Transmisi antar spesies juga terjadi antar spesies dari kelas filogeni yang berbeda. Sebagai contoh transmisi dari ayam (kelas Aves) ke manusia (kelas Mamalia) telah dilaporkan [198], meskipun hal ini tidak terjadi begitu saja, karena pada umumnya terdapat kontak intens antara manusia dan unggas, terutama di pasar unggas, dan hanya terjadi transmisi dan infeksi dalam jumlah kecil. Pengecualian dari jarangnya transmisi antar spesies ditunjukkan oleh mudahnya transmisi dan tingginya frekuensi transfer virus flu babi H1 dan virus AI H3 pada kalkun saat kedua spesies itu dibesarkan dalam peternakan yang sama atau dibesarkan di tempat yang secara geografis berdekatan [121, 196, 198, 206]. Faktor lain yang dapat meningkatkan transmisi virus antar spesies dan frekuensi infeksinya meliputi percampuran spesies berbeda dalam satu tempat (contohnya bercampurnya itik dan angsa domestik dengan ayam dan kalkun), keberadaan ungga muda yang lebih rentan terhadap infeksi, kepadatan unggas yang tinggi (yang meningkatkan kemungkinan paparan melalui meningkatnya virus yang dikeluarkan dan tingginya kontak), dan cuaca lembab dan dingin (yang meningkatkan tingkat bertahannya virus di lingkungan, terutama dengan keberadaan material organik) [198].
Faktor yang memungkinkan terjadinya transmisi
Salah satu contoh adaptasi strain virus AI dan dampaknya terhadap transmisi adalah pada saat terjadinya wabah LPAI H7N2 di Virginia pada tahun 2022. Dalam zona wabah, ditemukan lebih banyak peternakan kalkun yang terdampak virus LPAI H7N2 dibandingkan dengan peternakan ayam yang terdampak. Hal ini sebagiannya dapat dijelaskan dengan data eksperimental yang menunjukkan bahwa kalkun hanya memerlukan 100-250 kali lebih sedikit virus untuk menyebabkan infeksi dibandingkan dengan ayam, yang mengindikasikan bahwa virus LPAI H7N2 ini lebih baik adaptasinya, dan lebih menular pada kalkun dibandingkan ayam [111]. Serupa dengan itu, kerentanan kalkun yang lebih besar terhadap virus dibandingkan dengan ayam telah tercatat pula untuk virus LPAI yang berasal dari unggas akuatik liar, yang menjelaskan bahwa mengapa flok kalkun di Amerika Utara telah lebih sering terinfeksi virus AI dari burung air liar dibandingkan dengan ayam [145. Burung puyuh jepang dan burung pegar juga mungkin memiliki tingkat kerentanan yang lebih besar terhadap LPAI yang berasal dari burung liar jika dibandingkan dengan ayam [89, 107, 141, 204]. Juga telah didemonstrasikan bahwa tingkat kerentananan kalkun terhadap virus HPAI H5N1 adalah sebesar dosis 100 kali lebih rendah dibandingkan dosis infeksius yang diperlukan untuk menginfeksi ayam [2]. Akan tetapi, pengujian terhadap virus H5N8 dan H5N2 keturunan Gs/GD dari barat laut Amerika Serikat yang diisolasi pada bulan Desember 2014, menunjukkan bahwa virus-virus ini telah beradaptasi pada unggas air, karena dosis virus sebesar 102 EID menghasilkan 100% infeksi pada itik mallard, akan tetapi diperlukan 200-5000 kali dosis virus untuk menginfeksi ayam dan kalkun. Transmisi kontak lebih besar sedikit pada kalkun dibandingkan ayam. Mekanisme adaptasi spesies hanya sedikit dimengerti akan tetapi mungkin berhubungan dengan berbagai faktor genetik dan biokimia, seperti afinitas pengikatan reseptorm efesiensi perlepasan oleh neuraminidase, dan efisiensi dimana gen polymerase virus AI diekspresikan dan kemampuannya untuk emngambil alih sistem berbasis sel yang diperlukan untuk memproduksi virus AI [103].
Adaptasi spesies terhadap virus AI telah diperlihatkan sebagai proses yang sulit dan memerlukan banyak Langkah saat melakukan transfer dari unggas air liar ke unggas galinaseus domestik [70, 139]. Sebagai contoh, di Minnesota selama tahun 1980an dan 1990an, kasus indeks AI pada kalkun dimulai sebagai infeksi asimptomatik pada kalkun yang dibesarkan di umbaran selama awal musim gugur, infeksi terdeteksi melalui serokonversi yang diambil dari beberapa unggas saat akan disembelih. Infeksi pada kalkun ini didahului oleh infeksi virus AI sekitar 6 sampai 8 minggu sebelumnya pada itik sentinel yang ditempatkan diantara itik yang hidup bebas [67]. Virus AI yang baru masuk ini kemudian menyebar melalui beberapa flok kalkun selama beberapa bulan sebelum akhirnya beradaptasi secara optimal pada kalkun. Virus AI yang telah beradaptasi pada kalkun memproduksi infeksi dengan presentasi unggas tertular yang tinggi dalam flok yang terdampak, penurunan produksi telur, dan transmisi virus antar flok menjadi lebih mudah [70, 139]. Akan tetapi, transfer virus AI dari burung air liar (ordo Anseriformes) kepada itik dan angsa domestik memang lebih mudah daripada transmisi kepada kalkun [204], hanya memerlukan adaptasi minimal karena adanya hubungan kekerabatan yang dekat antara spesies itik liar dan itik domestik, dan karena lebih seringnya itik maupun angsa domestik yang diumbar berkontak dengan unggas air liar di lapangan. Banyak virus AI dari burung-burung pesisir dan burung camar (ordo Charadriiformes) tidak bereplikasi pada itik domestik (ordo Anseriformes) yang diinokulasi secara intranasal, mengindikasikan bahwa transfer virus AI antar beberapa spesies unggas air liar lebih sulit terjadi dan mungkin memerlukan beberapa langkah adaptasi [78, 187, 228]. Informasi ini mengindikasikan bahwa virus AI mengekspresikan berbagai derajat adaptasi hospes untuk setiap spesies avian yang berbeda, dan jika kita menyebut virus AI semacam itu dari spesies burung yang berbeda sebagai ‘virus AI’, yang mengimplikasikan bahwa semua virus sama-sama mampu untuk menginfeksi semua unggas, adalah sebuah penyebutan yang salah. Sangat tidak akurat pula untuk mengkategorisasikan virus AI kuda, manusia dan babi sebagai “Virus AI mamalia”, karena setiap virus tesebut memiliki kemampuan yang berbeda untuk menginfeksi spesies mamalia yang berbeda. Sangat jarangnya kejadian berhasilnya virus AI melompati batasan spesies yang diikuti dengan suksesnya adaptasi virus menunjukkan bahwa respons adaptif merupakan proses yang kompleks dan dipengaruhi banyak faktor selain faktor paparan [103]. Evolusi virus HPAI H5N1 keturunan Gs/GD juga mendemonstrasikan betapa kompleksnya evolusi virus. Strain virus yang terdeteksi di Hong Kong tahun 1997 tidak beradaptasi dengan baik pada itik domestik, akan tetapi pada tahun 2000, strain virus reasortan yang mampu menginfeksi itik domestik bersirkulasi di China dan telah terdeteksi pada itik domestik impor di Hong Kong. Dianggap mungkin bahwa readaptasi virus ini kembali ke itik merupakan langkah krusial dalam epidemiologi penyakit ini, adalah salah satu alasan virus ini dapat menjadi endemik, dan mungkin memainkan peranan dalam transmisi virus ke burung liar karena berdiam di habitat yang sama. Juga perlu untuk dicatat bahwa, di awal 2016, virus LPAI H7N9 yang telah diisolasi sejak tahun 2013 tidak beradaptasi dengan baik pada itik domestik, dan tidak seperti virus H5, virus ini tidak terdeteksi pada burung liar migrasi atau dipindahkan ke negara lain melalui burung migrasi.
Periode inkubasi dan infeksius
Untuk HPAI pada ayam, periode inkubasi (waktu mulai dari terpapar virus sampai munculnya gejala klinis) berkisar antara beberapa jam saja pada unggas yang diinokulasi secara intravena, sampai 24 jam pada ayam yang diinokulasi secara intranasal, sampai 3 hari pada individul unggas yang terinfeksi secara alami. Periode inkubasi pada flok ayam yang terinfeksi bisa sampai 14 harI [41, 45]. Akan tetapi, pengeluaran virus terjadi lebih awal sebelum gejala klinis muncul, dan bisa jadi lebih lama dari penyakit klinisnya. Periode infeksius berlangsung dimulai dari saat virus pertama kali dikeluarkan dampai ketika virus tidak terdeteksi lagi melalui swab orofaring dan kloaka, atau di dalam atau pada bulu [205]. Periode pre-paten atau pre-infeksius (laten) mengindikasikan jeda waktu antara terpapar virus sampai pengeluaran virus dari dalam tubuh unggas. Penggunaan periode infeksius sangat krusial untuk investigasi penyakit dan untuk pencegahan transmisi dan menginisiasi pengendalian penyakit. Periode inkubasi penggunaanya hanya terbatas, karena banyak spesies, seperti itik domestik yang terinfeksi oleh beberapa strain virus HPAI H5N1, mungkin saja tidak menunjukkan gejala sakit saat terinfeksi, akan tetapi masih mengeluarkan virus. Juga penting untuk mempertimbangkan periode pre-paten (laten) (yaitu waktu antara paparan virus sampai pengeluaran/shedding virus), karena hal ini krusial untuk melacak infeksi, terutama ketika unggas yang berpotensi telah terinfeksi telah dipindahkan keluar peternakan setelah terpapar virus.
Panjang periode laten, inkubasi, dan infeksius tergantung pada dosis virus, rute paparan, spesies yang terpapar, status imunitas unggas terpapar, dan berbagai faktor lingkungan [45]. Studi eksperimental yang dilakukan pada virus HPAI H5N1 keturunan Gs/GD menunjukkan bahwa virus ini memiliki periode laten yang sangat pendek [17]. Hal ini berimplikasi signifikan terhadap perkembangan wabah, yang dipengaruhi oleh periode laten dan basic reproduction number (R0) untuk penyakit. R0 adalah sebuah ukuran infektivitas infektivitas, dan telah diukur R0 untuk beberapa virus AI [17, 155]. Untuk menyebarnya epidemi, R0 harus lebih dari 1; untuk pengendalian penyakit R0 harus kurang dari 1. R0 bersifat spesifik kepada agen penyakit dan tingkat kontak antar hewan rentan. Hal ini bervariasi tergantung faktor hospes, diantaranya spesies atauras, resistansi dan status imun, juga durasi waktu hospes dapat bertahan hidup. R0 bagi LPAI umumnya lebih besar daripada virus HPAI, karena virus HPAI lebih fatal daripada LPAI yang mengurangi kemungkinan transmisi virus [155]. Estimasinya bervariasi tergantung pada metodologi yang digunakan dan sistem produksi perunggasan yang dilakukan. Untuk virus H5 keturunan Gs/GD, R0 telah dihitung dengan kisaran 1.95 – 2.68 [210, 224], meskipun perhitungan ini terutama berdasarkan infeksi pada produksi perunggasan di pedesaan. Nilai R0 yang sebesar ini mengindikasikan infeksi infeksi dengan level moderat, akan tetapi masih rendah jika dibandingkan dengan banyak agen infeksius lain. Akan tetapi, meskipun dengan nilai R0 yang relatif rendah ini penyakit masih menyebar dengan cepat dalam satu flok, dan hal ini juga telah tercatat di lapangan [210], mungkin karena periode laten yang mengikuti infeksi untuk virus ini pendek [17].
Sistem eksperimental yang didesain untuk mengukur R0 tidak dapat mereplikasi struktur lingkungan dan kontak yang kompleks dalam sebuah peternakan, dan hanya dapat memberikan petunjuk tentang ukuran yang sebenarnya. Sebagai contoh, angka kontak efektif antar unggas terinfeksi dan unggas tidak terinfeksi yang dipelihara dalam kandang diharapkan akan meningkat jika air minum terkontaminasi virus dari unggas yang terinfeksi, dan jika unggas dalam setiap baris kandang berbagi aliran air minum yang sama. R0 juga dapat digunakan untuk menentukan level proteksi yang diperlukan dari vaksinasi untuk menghentikan transmisi virus dalam populasi tersebut. Seiring meningkatnya R0, meningkat pula proporsi flok yang perlu divaksin untuk dapat mencegah infeksi secara efektif, dan setara dengan 1 – 1/R0 [159].
Maintenans virus AI di dalam populasi
Secara khusus, sebagian besar individu unggas mengeluarkan virus hanya dalam waktu 7 – 10 hari, dan virus AI tidak menetap atau memproduksi infeksi laten pada individu unggas, seperti yang sudah diperlihatkan terjadi pada beberapa virus avian, seperti herpesvirus atau infectious laryngotracheitis. Kasus yang sesekali terjadi dimana virus dapat dikeluarkan dalam waktu yang lebih lama pada individu unggas telah dilaporkan [88]. Akan tetapi virus AI dapat dipertahankan dalam waktu yang jauh lebih lamam dalam populasi unggas yang besar, seperti yang biasa ditemukan pada produksi perunggasan di pedesaan, pasar unggas hidup, ataupun operasi perunggasan komersialm karena paparan awal dan fase akut tidak menyebabkan tingkat infeksi langsung 100%. Seiring berkurangnya jumlah unggas yang rentan dalam populasi tertutup, tingkat transmisi melambat. Hanya ada sedikit informasi tentang jalannya sirkulasi virus AI dalam populasi unggasm dan hal ini juga dapat tergantung dari lingkunan dimana unggas dibesarkan, yang berdampak pada stabilitas virus diluar hospes.7
Virus AI telah muncul kembali dari flok yang sebelumnya telah terinfeksi setelah persitiwa yang sangat berat, akan tetapi tidak ada status karier jangka panjang yang telah didefinisikan, atau virus telah muncul mengikuti masuknya unggas baru yang masih rentan kedalam populasi terdampak. Virus LPAI telah ditemukan sampai 36 hari kemudian setelah waktu terpapar pada ayam (sampel trakea) [7] dan 22 hari pada kalkun [106], akan tetapi pada kalkun dimana waktu terpapar tidak pasti, virus ditemukan sampai 72 hari kemudian dihitung dari awal eksperimen lantai kandang [83]. Dalam satu kasus di lapangan, virus LPAI H7N2 di Pennsylvania selama tahun 1997-1998 ditemukan kembali dari kasus kematian harian pada flok ayam petelur berumur 6 bulan yang secara klinis normal yang sebelumnya sembuh dari penyakit LPAI akut, dan ditemukan juga dari flok ayam petelur lain 8 minggu setelah terkena LPAI akut setelah mengalami molting/gugur bulu [238]. Karena itu, setelah satu flok didiagnosa terinfeksi virus AI, harus dipikirkan adanya kemungkinan flok tersebut sebagai sumber virus terhadap unggas yang ada di dalam flok, sampai seluruh unggas itu dieliminasi dan peternakan tersebut dibersihkan dan didisfeksi dengan baik, dan akhirnya dimungkinkan masuknya unggas baru yang bebas AI. Vaksinasi telah terbukti efektif dalam mengurangi jumlah virus yang dikeluarkan ke lapangan dan menghentikan transmisi virus [220, 221]. Terdapat contoh capaian kesuksesan eliminasi virus melalui implementasi selective culling flok yang terinfeksi (termasuk pemasaran yang terkendali) dan/atau vaksinasi darurat [47, 73].
Respons imun terhadap virus LPAI pada itik berbedan dengan pada ayam, dan hal ini dapat memainkan peranan dalam maintenans virus dalam populasi itik. Saat itik dipaparkan virus LPAI secara eksperimental, itik tersebut memunculkan respons imun, akan tetapi jika itik tersebut diekspos kembali dengan virus yang sampai 21 hari kemudian itik tersebut masih dapat terinfeksi kembali dan mengeluarkan virus, terutama melalui kloaka. Ayam yang telah terpapar sebelumnya tidak mengeluarkan virus sama sekali ketika terekspos kembali dengan virus yang homolog [29].
Shedding virus ke dalam lingkungan dan ketahanannya di lingkungan
Dalam tubuh hewan yang terinfeksi, virus AI diekskresikan dari hidung dan mulut (sekresi respiratorik), konjungtiva, dan kloaka (feses) ke lingkungan sekitar. Virus HPAI juga dapat dideteksi pada bulu keras dan bulu halus, yang memiliki potensi transmisi penyakit melalui perilaku saling membersihkan bulu masing-masing (allopreening) atau melalui bulu yang tercabut. Sampai hasil pencabutan bulu di rumah pemotongan unggas merepresentasikan sumber potensial penyebaran virus. Sumber virus di lingkungan bertanggung jawab terhadap sebagian besar peristiwa paparan, akan tetapi unggas juga dapat terpapar virus AI melalui predasi atau kanibalisasi karkas unggas mati karena terinfeksi. Studi eksperimental pada ayam menunjukkan bahwa virus HPAI dikeluarkan dalam jumlah paling besar dari orofaring (104.4-7.7 dosis infeksius rata-rata pada embrio ayam [EID50]/ml dari sekresi respiratorik), dan dalam jumlah yang lebih sedikit dari kloaka (102.5-4.5 EID50/g feses) [200, 201]. Hal ini bervariasi tergantung pada strain virus, dan untuk beberapa virus HPAI H5N1, bahkan hanya ada sedikit atau tidak ada sama sekali virus yang dikeluarkan melalui kloaka. Untuk LPAI pada ayam, pengeluaran virus ke lingkungan lebih kecil melalui sampel orofaring (swab, 101.1-5.5 EID50/ml) dan kloaka (swab 101.0-4.3 EID50/ml) [201], meskipun tidak begitu untuk subtipe H7N9 yang muncul di China sebagai penyakit zoonosis serius [135], dan untuk beberapa virus H9N2. Dalam studi eksperimental, pengeluaran virus HPAI dalam titer yang besar ke lingkungan ini menandakan kontaminasi virus yang lebih besar dan memiliki kemampuan transmisi yang lebih besar jika dibandingkan dengan LPAI [219]. Titer virus dalam karkas (daging) bervariasi tergantung strain virus, tipe jaringan, spesies unggas dan stadium klinis penyakit:
- Ayam yang mati terinfeksi oleh virus HPAI H5N2 dari Pennsylvania tahun 1983 memiliki titer virus 102.2-3.2 EID50 per gram daging, sedangkan virus HPAI H5N1 dari Korea Selatatan tahun 2003 memiliki titer virus 105.5-8.0 EID50 per gram daging, akan tetapi kuantitas
- Titer virus HPAI H5N1 dalam hati ayam dilaporkan setinggi 1010.6 EID50 per gramnya.
- Virus HPAI H5N1 memproduksi virus dengan jumlah titer yang berbeda pada itik domestik yang secara klinis tampak normal (102.0-3.4 EID50/gram) dan itik domestik yang tampak sakit (104.0-6.0 EID50/gram) [201, 203, 209].
Virus AI yang dikeluarkan ke lingkungan dilindungi oleh material organik dimana mereka berada yang memberi perlindungan agar partikel virus tidak mengalami inaktivasi fisik maupun kimia [45]. Ditambah lagi, kondisi lingkungan spesifik seperti kondisi lembab dan dingin, meningkatkan kemampuan bertahan hidup virus dan memiliki dampak mendalam terhadap transmisi. Sebagai contoh, virus HPAI H5N1 dan H5N2 mampu bertahan dalam kondisi kotoran kandang cair selama 150 hari di musim dingin ketika kondisi beku, 30-35 hari pada suhu 4o C, 7 hari pada suhu 20o C, dan 4 hari pada suhu 25-32oC dalam kondisi tidak terkena sinar matahari [10, 56, 180, 225]. Dalam studi eksperimental dimana virus HPAI H5N1 yang ditambahkan pada kotoran kandang, tidak ada virus yang ditemukan setelah 24 jam di suhu 25oC dan setelah 15 menit jika dipertahankan pada suhu 40oC. Upaya memaparkan kotoran kadang dengan sinar ultravioler (UV) tidak efektif untuk membunuh virus AI, mungkin karena penetrasi sinar UV yang tidak mencukupi kedalam kotoran kandang [36]. Untuk virus AI di air, dua virus HPAI H5N1 mengalamai penurunan titer infeksisu sebesar 101 EID50 setelah 4-5 hari pada suhu 28oC (pH 7.2 dan salinitas 0 ppm), dan tidak ada virus terdeteksi setelah 30 hari, akan tetapi pada suhu 17oC dengan kondisi pH dan salinitas yang sama, dua virus tersebut bertahan masing-masing sampai 94 dan 150 hari [20]. Virus-virus HPAI H5N1 ini mampu bertahan dalam waktu yang lebih pendek di lingkungan dibandingkan dengan virus LPAI H5 dari burung air liar. Sebagai contoh, virus LPAI dari burung air liar tetap infektif pada suhu 17oC sampai 207 hari, dan pada suhu 28oC sampai 102 hari. Meningkatkan salinitas air atau pH mengurangi waktu virus dapat bertahan hidup di kedua suhu tersebut [185, 186]. Penelitian-penelitian ini dan juga pengamatan lapangan menunjukkan bahwa virus AI tetap infektif di air atau dalam material organik basah yang dipertahankan dalam kondisi temperatur dingin, seperti kondisi musim dingin, untuk kemudian tetap dapat infektif terhadap burung atau unggas liar dalam waktu yang lama. Namun sampai saat ini hal ini tidak terbukti terjadi [232]. Bahkan jika virus HPAI H5N1 dapat bertahan hidup dalam es, mereka tidak menyebabkan perpanjangan siklus infeksi, mengingat bahwa virus yang identik secara geentik tidak terdeteksi secara berturut-turut per tahunnya pada burung migrasi dari 2005 sampai 2009. Yang mungkin terjadi malah virus-virus yang terisolasi telah berevolusi menunjukkan bahwa virus bertahan hidup dalam populasi burung liar.
Kondisi tanah juga mempengaruhi kemampuan virus bertahan hidup, seperti yang ditunjukkan virus HPAI H5N1 di Kamboja [66].
Inaktivasi
Mengikuti depopulasi peternakan terinfeksi dan perlakuan pembuangan unggas, virus AI yang telah mengkontaminasi lingkungan harus dieliminasi dan/atau diinaktivasi dengan semestinya untuk mencegah tranmisi dan mengendalikan infeksi di lapangan. Virus AI sangat labil dan karena itu rentan terhadap panas dan berbagai desinfektan, termasuk deterjen. Untuk kandang unggas yang bersifat tertutup, telah disarankan langkah dibawah ini sebagai program eliminasi virus AI yang efektif dari tempat yang terinfeksi: pemanasan 32,2o – 37,oC selama satu minggu, diikuti dengan pemindahan dan pembuangan alas kandang dan kotoran kandang secara semestinya, diikuti dengan pembersihan dan dinsinfeksi kandang dan alat kandang, dan kemudian 2-3 minggu periode kosong sebelum restocking [69]. Jika pembersihan dan disinfeksi telah dilakukan secara menyeluruh, virus seharusnya tidak mampu bertahan kali ini, dan periode waktu kering kandang selama 2-3 minggu mampu memberikan margin keamanan yang cukup besar. Pada situasi dimana unggas dijual melalui pasar unggas, waktu penyelesaian suatu proses (turnaround time) untuk kandang transport diukur dalam hitungan hari. Akibatnya, kandang transport ni memiliki resiko cukup signifikan terhadap transmisi virus, terutama jika kandang tersebut telah sangat terkontaminasi dari unggas yang terinfeksi. Meskipun kandang dicuci dan didisinfeksi, masih terdapat resiko kontaminasi residu virus meskipun dengan kadar yang sedikit, jika kandang tersebut sebelumnya membawa unggas terinfeksi AI, karena sangat sulit untuk membersihkan seluruh material kotoran pada saat pembersihan. Virus AI dalam karkas unggas, alas kandang, maupun pupuk kandang dapat dibunuh dengan efektif dalam waktu kurang dari 10 hari jika telah dilakukan pembusukan/ proses kompos yang seharusnya, atau jika dikubur atau dibakar [163]. Pada permukaan yang bersir, berbagai desinfektan (termasuk juga deterjen) efektif untuk menginaktivasi vurus AI, seperti misalnya sodium hypochlorite (pemutih), senyawa ammonium kuartener, sodium hydroxide (lye), senyawa phenol, senyawa ionofor acid, disinfektan chlorine dioksida, agen oksidasi kuat, dan kombinasi sodium karbonat/sodium silikat [37]. Akan tetapi, seluruh material organic harus dihilangkan dengan cuci kering atau basah dengan deterjen sebelum desinfektan dapat bekerja dengan baik. Petunjuk pembersihan dan desinfeksi untuk avian influenza tersedia pada sumber lain [14].
Virulensi dan pathogenisitas
Telah muncul kebingungan dari penggunaan istilah ‘virulensi’ dan ‘patogenisitas’ yang bertentanga, yang berhubungan dengan kapasitas virus AI dalam menuimbulkan penyakit diukur dari kemunculan gejala klinis, atau lesi-lesi makroskpis, mikroskopis dan atau ultrastruktural [22]. Pelaporan resmi virus AI sebagai LP atau HP adalah berdasarkan berkemangnya penyakit dan kematian setelah eksperimen inokulasi virus pada ayam, pada sepses target, atau pada sekuens situs pembelahan proteolitik hemagglutinin (lihat Bab 1). Klasifikasi patotipe resmi ini hanya spesifik untuk ayam, akan tetapi memiliki aplikasi patobiologi pada spesies gallinaseus yang berhubungan. Akan tetapi, patotipe ayam tidak bersifat prediktif terhadap potensi patogenisitas virus AI kepada spesies avian yang tidak berhubungan, atau kepada manusia atau spesies mammalia lainnya.
Infeksi di dalam sistem pertanian dan sistem buatan manusia lainnya
Aktivitas manusia telah merubah ekosistem alami unggas melalui penangkaran, domestikasi, pertanian dan perdagangan, yang telah dimulai ribuan tahun yang lalu [198]. Karena itulah niche-niche baru telah terbentuk untuk virus AI, yang telah merubah insidensi dan distribusi virus-virus ini dan infeksi yang mampu ditimbulkannya. Berbagai sistem buatan manusia telah dikembangkan, dan skema klasifikasinya bervariasi tergantung perspektif penulisnya. Sebagai contoh, dalam satu skema jlasifikasi, lima kategori luas sistem buatan manusia diidentifikasi yang dapat memberi dampak terhadap ekologi dan epidemiologi virus AI [198]:
- Koleksi unggas dan sistem perdagangan, termasuk burung liar dan koleksi zoologi
- Flok-flok unggas di pedesaan, unggas yang dipeliharan rumahan atau hobi, termasuk ayam aduan dan unggas untuk pameran
- Sistem pasar unggas hidup (LPM) dengan pergerakan ynggas dari pedesaan ke perkotaan untuk dijual dan disembelih
- Unggas komersial yang dibesarkan di luar kandang/outdoor atau diumbar, termasuk unggas organic, kalkun yang diumbar, itik yang diumbar, dan unggas untuk perburuan
- Unggas komersial yang dipelihara dalam sistem terintegrasi dalam ruangan/indoor
Pada tahun 2004, Food and Agriculture Organization (FAO) telah mendefinisikan empat sektor produksi secara luas dalam rangka mendesain program surveilans [52]:
Sektor 1 – sistem industri terintegrasi dengan biosekuriti tingkat tinggi, unggas dan produk hasil peternakan dipasarkan secara komersial (contoh: peternakan yang merupakan bagian dari perusaahan produsen ayam broiler terintegrasi dengan prosedur standar biosekuriti yang telah ditetapkan dan diimplementasikan).
Sektor 2 – sistem produksi perunggasan komersial dengan biosekuriti tingkat menengah sampai tinggi, unggas dan produk hasil peternakan biasanya dijual secara komersial namun dapat dijual melalui pasar unggas hidup (LPM) (contoh: peetrnakan dengan unggas yang dipelihara di kandang/indoor secara terus menerus, yang mencegah kontak dengan unggas lain maupun hewan liar).
Sektor 3 – sistem produksi perunggasan komersial dengan biosekuriti rendah sampai minimal, dan unggas atau produknya memasuki sistem pasar unggas hidup (LPM) (contoh: peternakan ayam petelur kandang baterai dengan kandang setengah terbuka (open shed), peternakan dengan unggas yang sengaja dilepas diluar kandang, atau peternakan yang memelihara ayam dan unggas air yang bebas berkeliaran).
Sektor 4 – produksi unggas di pedesaan dengan biosekuriti minimal, dan unggas atau produknya yang dikonsumsi di skala lokal.
Akan tetapi, kategorisasi produksi perunggasan secara konsisten kedalam satu skema tunggal tidak mungkin dilakukan, karena terdapat banyaknya variasi antara negara atau bahkan dalam satu negara sendiri dalam level biosekuriti, variasi dalam skema marketing, tingkat modernisasi sistem produksi, dan sumber pembiayaan finansial. Bagaimanapun juga, saat memperhitungkan resiko yang berhubungan dengan peternakan secara individu ataupun sekumpulan peternakan, banyaknya kontak dari hulu ke hilir juga perlu diperhitungkan. Sebagai contoh, peternakan yang menjual unggas ke pasar unggas mungkin terpapar virus dari kandang-kandang pembawa ternak dari pasar yang belum dibersihkan dan didisinfeksi dengan baik, atau kepada pengumpul unggas yang datang dari pasar yang terkontaminasi.
Dari perspektif sejarah, definisi peternakan komersial telah berubah setiap abadnya. Seperti misalnya, dari era Romawi sampai pertengahan 1800-an, kebanyakan peternakan unggas memiliki sekitar 50-100 ekor ayam. Sebuah peternakan ‘komersial’ besar di Italia Utara di akhir tahun 1800-an memiliki sekitar 1000 ekor ayam, yang digunakan terutama sebagai penghasil telur [93]. Pada saat ini, di negara-negara maju, peternakan ayam dengan 1000 ekor ayam akan dianggap sebagai peternakan kecil atau peternakan sebagai hobi, sementara peternakan komersial besar di Amerika Serikat atau China dapat memiliki beberapa juta ekor ayam petelur sekaligus. Di banyak negara, terutama negara berkembang, terdapat percampuran tipe peternakan unggas yang kompleks yang berbagi satu tempat yang sama. Bahkan produsen unggas rumahan menjual beberapa unggas mereka kepada penjual unggas, dan pekerja peternakan mungkin memelihara unggas juga di rumah, sehingga terdapat hubungan spasial antar berbagai sektor produksi.
Struktur dalam sektor perunggasan memainkan peranan besar dalam diseminasi dan persistensi virus AI, dan tampaknya merupakan faktor besar dalam menjadikan virus HPAI H5 keturunan Gs/GD menjadi endemik [54]. Di beberapa wilayah hal ini berhubungan dengan persistensi virus di itik domestik, sementara di wilayah lain perdagangan unggas hidup yang tidak terkontrol, termasuk juga perdagangan unggas melewati batas antar negara, tampaknya lebih penting.
Untuk virus dapat bertahan di sebuah wilayah, harus ada kantong-kantong unggas rentan yang memungkinan transmisi dan propagasi virus, dan atau virus yang bertahan hidup dalam jumlah cukup banyak di lingkungan sampai unggas yang rentan ada di wilayah itu. Di beberapa bagian Asia, perbatasan darat nasional melintasi apa yang disebut sebagai zona lingkungan, mengakibatkan reintroduksi virus secara regular dalam satu zona lingkungan yang sama, atau dari luar negeri. Contoh hal ini seperti perbatasan darat antara China dan Vietnam, dan antara Vietnam dan Kamboja. Di banyak tempat di Asia Tenggara dimana virus HPAI H5 keturunan Gs/GD bersirkulasi, kondisi cuaca dan tanah tidak berpihak pada bertahannya virus. Akan tetapi di Delta Mekong, virus dari clade 1 dan keturunannya tetap bertahan dari tahun 2003 sampai 2014 [177, 230]. Hal ini mengindikasikan bahwa sejumlah burung yang rentan harus ada untuk mempertahankan siklus infeksi. Perbatasan darat yang panjang dan berlubang memungkinkan pergerakan unggas secara illegal, dan hal ini telah dikenali sebagai salah satu faktor yang menyebabkan masuknya virus baru dari clade HPAI H5 keturunan Gs/GD secara berulang-ulang ke Vietnam. Juga telah diusulkan bahwa ‘pelepas liaran’ burung gereja yang termasuk sebagai salah satu ritual keagamaan agama Buddha merupakan penyebab potensial diseminasi virus. Virus HPAI H5N8 diperkenalkan di Eropa pada saat musim gugur tahun 2014 dan musim dingin tahun 2015 (kemungkinan besar oleh burung liar, meskipun masih belum jelas bagaimana mereka bisa berpindah dari Asia ke Eropa tanpa terdeteksi), dan berhasil menembus pertahanan biosekuriti pada sejumlah peternakan komersial di Inggris, Jerman, Italia, dan Belanda, hal ini juga terjadi untuk virus H5N8 dan H5N2 yang terdeteksi di Amerika Utara dalam periode yang sama.
Sumber masuknya virus AI kedalam peternkan unggas bervariasi tergantung pada spesies hospesnya, strain virus, sistem pemeliharaan, dan kualitas biosekuriti yang diberlakukan. Sebagai contoh virus AI telah masuk kepada flok kalkun di Amerika Serikat selama lebih dari empat dekade terakhir melalui berbagai sumber (Gambar 12.3), meliputi:
- Burung akuatik liar kepada kalkun domestik yang dipelihara diluar kandang
- Air minum yang terkontaminasi yang menularkan virus kepada kalkun yang dipelihara di dalam kandang, dimana air tersebut diambil dari kolam maupun danau yang mengandung virus AI dari burung akuatik yang terinfeksi AI
- Terpapar fomit terkontaminasi AI yang berasal dari pasar unggas
- Infeksi virus AI flu babi H1 dan H3 saat babi dipelihara di tempat yang sama atau di peternakan yang terletak berdekatan dengan kandang kalkun
Serupa dengan itu, infeksi AI pada kalkun selama musim dingin di Italia bagian utara bersamaan dengan periode staging burung air liar sebelum bermigrasi musim dingin [144]. Virus HPAI H52 menginfeksi kalkun yang dibesarkan dalam kandang di Amerika Utara pada akhir tahun 2014 dan awal 2015. Virus-virus ini telah terdeteksi pada burung liar, akan tetapi mode tepatnya bagaimana virus bisa masuk ke dalam setiap peternakan bervariasi, dan tidak selalu dapat ditentukan dengan tepat. Sebagai contoh, infeksi HPAI H35N8 pertama adalah pada flok unggas beragam spesies yang dibesarkan secara rumahan di barat laut Amerika Serikat yang berkontak langsung dengan burung liar terinfeksi atau burung pemangsa dalam penangkaran yang telah berburu burung air liar yang telah terinfeksi. Infeksi pertama kali pada peternakan kalkun komersial dan peternakan ayam adalah titik pemasukan virus dari burung air liar, akan tetapi mode tepatnya bagaimana virus dapat masuk ke dalam setiap peternakan dan kandang masih tidak dapat ditentukan. Akan tetapi, dari kolam-kolam penyimpan limpahan air dimana unggas air liar hidup memang berlokasi dekat dengan kandang kalkun yang terdampak. Kasus-kasus virus reasortan HPAI H5N2 di Amerika Serikat bagian tengah barat yang muncul kemudian memiliki bukti-bukti titik pemasukan virus dari burung air liar yang terinfeksi, akan tetapi kasus-kasus yang lain mmerupakan akibat tersebarnya secara sekunder virus antar peternakan. Faktor resiko pemasukan virus AI, meliputi, diantara yang lainnya, penggunaan air permukaan laguna atau kolam yang didiami burung liar untuk mencuci tempat kotoran unggas, penyimpanan beih biji-bijian untuk pakan di luar ruangan tanpa dilindungi dari kontak dengan burung liar, peralatan yang dipakai bersama dalam banyak proses pekerjaaan dalam peternakan, dan sistem pengambilan unggas mati yang dipakai secara bersama-sama.
Introduksi pada unggas domestik, dan adaptasi virus AI yang berasal dari unggas yang hidup bebas
Virus LPAI dari burung liar akuatik telah menetap pada unggas galinaseus domestik (terutama ayam dan kalkun, akan tetapi termasuk juga burung puyuh Jepang, ayam guinea, burung pegar, ayam hutan, dan spesies lainnya), dan unggas air domestik (terutama itik dan angsa) melalui proses dua Langkah, yaitu paparan hospes yang terinfeksi yang diikuti dengan adaptasi pada hospes yang baru (Gambar 12.4) [203]. Biasanya, paparan virus LPAI pada burung liar merupakan akibat dari kontak langsung dengan burung yang telah terinfeksi atau dengan kontak langsung melalui fomite. Paparan semacam itu telah berhasil membawa virus AI dari burung liar akuatik yang hidup bebas kepada unggas komersial yang dibesarkan di luar kandang. Aktivitas beresiko tinggi yang membawa kepada paparan yang mengakibatkan infeksi ini telah terjadi melalui kontak langsung dengan burung liar akuatik (Gambar 12.5), yang dapat dicegah dengan memelihara unggas di dalam kandang, pemeliharaan dengan mengandangkan ternak/tidak membiarkan ternak berkeliaran selama beberapa waktu saat kemungkinan persinggungan ternak peliharaan dengan unggas liar masih sangat tinggi, atau menyediakan akses untuk keluar ruangan kandang hanya di fasilitas peternakan yang telah dibuat sedemikian rupa untuk menghindarkan burung liar masuk ke fasilitas tersebut dengan menggunakan jaring pembatas. Terdapat resiko paparan yang mengakibatkan infeksi melalui pemakaian air permukaan yang terkontaminasi virus AI dari kolam-kolam atau danau yang didiami burung air yang terinfeksi AI, atau dapat melalui angin ketika kolam atau danau tersebut berlokasi sangat dekat dengan kandang unggas. Resiko yang pertama dapat dicegah dengan memberi perlakuan terhadap air tersebut untuk membunuh kuman di dalamnya, atau dengan menggunakan air murni yang berasal dari sumur dalam. Pembangunan peternakan yang jauh dari habitat burung air dapat mengurangi resiko penularan melalui angin. Baju dan sepatu yang terkontaminasi umumnya hanya memiliki resiko penularan rendah, karena baju atau sepatu yang dipakai untuk berburu unggas liar ataupun saat berjalan-jalan melihat burung liar biasanya tidak dipakai lagi untuk masuk ke dalam kandang, kecuali di tempat-tempat terpencil misalnya di Siberia, dimana kasus-kasus HPAI H5N1 telah terjadi pada unggas di pedesaan setelah penduduknya melakukan perburuan unggas liar (untuk beberapa kasus hal ini terjadi karena burung liar hasil buruan dibawa masuk ke desa). Tidak ada peralatan kandang yang boleh dipakai untuk berburu burung liar, untuk dibawa jalan-jalan, ataupun untuk melakukan pekerjaan di dalam flok unggas.
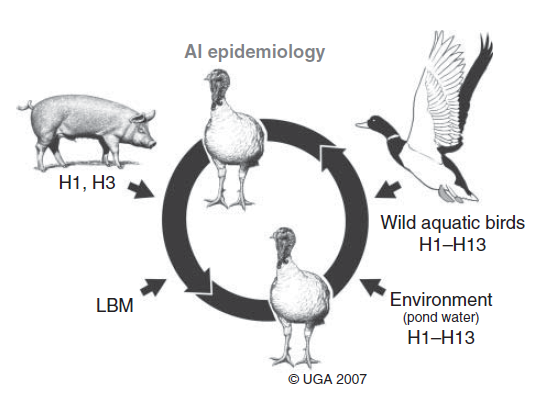
Gambar 12.3 Empat sumber penularan yang bertanggungjawab dalam masuknya virus LPAI ke dalam peternakan kalkun komersian di Amerika Serikat dari tahun 1960 s/d 2000. Sumber: K. Carter, University of Georgia, and D. Swayne, U.S. Department of Agriculture/Agricultural Research Service.
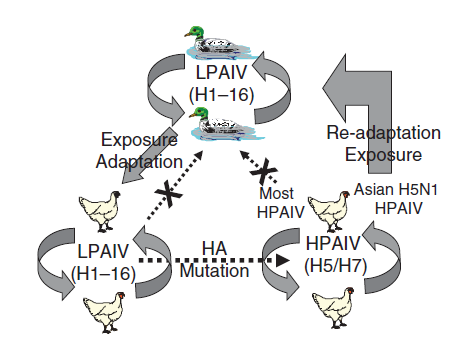
Gambar 12.4 Epidemiologi virus LPAI dan HPAI antara burung akuatik yang hidup bebas dan unggas domestik. Sumber D. Swayne, U.S. Department of Agriculture Research Service.
Paparan terhadap virus AI dari burung liar yang berakhir menjadi transmisi berkesinambungan dan replikasi yang efisien hanya bisa terjadi jika virus LPAI telah beradaptasi dengan baik pada hospes unggasnya, dan jika flok unggas yang ada bersifat rentan. Adaptasi virus yang buruk terhadap hospes biasanya akan mengakibatkan tidak berhasilnya virus dalam berpropagasi dan bertransmisi antar hospes burung, yang pada akhirnya akan menyebabkan virus itu mati. Pada beberapa kejadian, transmisi yang sporadis dan tidak efisien ajan terjadi sampai adaptasi virus secara progresif terhadap hospes baru berhasil memunculkan virus yang mampu bertahan melakukan transmisi dari unggas yang satu ke unggas lain. Ketika virus LPAI telah beradaptasi pada hospes unggas yang baru, maka virus AI ini sangat jarang bertransmisi kembali dan bertahan dalam populasi burung liar akuatik karena sekarang mereka harus kembali melakukan adaptasi pada hospes burung liar yang dulunya adalah hospes asal virus tersebut (Gambar 12.4). Akibatnya, burung liar akuatik hanya memiliki peranan sangat terbatas, itupun jika ada, terhadap diseminasi sekunder atau persebaran virus LPAI yang telah beradaptasi dengan unggas dari satu peternakan ke peternakan lain [80, 127].
Saat bersirkulasi pada unggas gallinaseus, beberapa virus LPAI H5 dan H7 secara tiba-tiba berubah menjadi virus HPAI melalui perubahan pada tempat pembelahan protein hemagglutinin [140]. Beberapa diantaranya telah bersirkulasi pada unggas dalam waktu cukup lama tanpa berubah menjadi HPAI (misalnya virus LPAI H7N9 yang muncul di China tahun 2013). Dalam sejarahnya, virus HPAI baru yang berasal dari LPAI telah beradaptasi sebelumnya pada unggas gallinaseus, dan umumnya tidak kembali menginfeksi hospes asalnya yakni burung liar, meskipun hal ini mungkin saja disebabkan karena akhir-akhir ini wabah HPAI telah dengan cepat dieliminasi, sehingga mengurangi kesempatan bagi virus-virus ini untuk melakukan adaptasi kembali pada burung liar akuatik. Serupa dengan itu, virus-virus HPAI ini dalam sejarahnya hanya memiliki sedikit kemampuan atau bahkan tidak mampu menimbulkan infeksi pada itik domestik [5, 203]. Salah satu pengecualiannya adalah terdeteksinya virus H5N8 pada itik di peternakan yang berdekatan dengan peternakan kalkun yang telah terinfeksi di Irlandia pada tahun 1984. Selain kasus HPAI H5N3 pada burung common tern (Sterna hirundo) di Afrika Selatan tahun 1961, hanya sedikit kasus infeksi HPAI terisolasi yang telah terdeteksi pada burung liar sebelum tahun 2002, yang mengindikasikan bahwa virus HPAI sebelumnya tidak menetap pada burung liar [154, 194, 195]. Situasi ekologi telah berubah setelah kemunculan virus HPAI H5N1 keturunan Gs/GD. Infeksi dan angka kematian yang signifikan pada spesies non-unggas pertama kali dilaporkan pada burung air dalam penangkaran, dan secara spasial berhubungan dengan burung air akuatik liar, di du ataman di Hong Kong tahun 2002. Wabah-wabah ini kemudian diikuti dengan laporan-laporan individual adanya kematian burung liar di Kamboja dan Thailand, dan laporan kematian yang cukup signifikan pada populasi burung air liar di Qinghai, China dan Danau Erhel, Mongolia tahun 2005 (Gambar 12.4) [32, 48, 110]. Percobaan infeksi eksperimental mencerminkan perubahan terhadap infektivitas virus HPAI H5N1 pada burung liar dibawah perubahan alami di alam: virus HPAI H5N1 stain 1997 dari Hong Kong memiliki infektivitas yang sangat rendah terhadap itik domestik [143], dan banyak dari virus yang terdeteksi di Hong Kong tahun 1999-2000 sangat infeksius akan tetapi hanya memproduksi infeksi asimptomatik pada itik domestik [31]. Di tahun 2002-2004, virus-virus itu menyebabkan penyakit parah dengan beberapa kematian. beberapa strain baru telah mengakibatkan angka kematian yang tinggi pada anak itik muda dan pada beberapa khusus juga pada itik dewasa [92, 203]. Data lapangan dan eksperimental ini menunjukkan bahwa virus HPAI H5N1 telah melakukan readaptasi kepada beberapa spesies burung air liar. Terjadi pada waktu yang bersamaan, atau mungkin sebelum readaptasi kepada burung air liar adalah pemasukan dan adaptasi virus HPAI H5N1 keturunan Gs/GD kepada itik domestik, menyebabkan infeksi, penyakit, dan akhirnya kematian. Kedua peristiea ini berakibat pada perubahan terhadap ekologi dan epidemiologi virus-virus ini jika dibandingkan dengan virus HPAI yang sebelumnya. Akan ettapi, penetapan burung air liar sebagai reservoir virus HPAI H5N1 keturunan Gs/GD, tidak untuk jangka waktu lama seperti yang terjadi pada LPAI, belum didemonstrasikan.
Infeksi HPAI H5 keturunan Gs/GD pada burung liar telah dilaporkan, dan burung liar itu telah memperkenalkan virus kepada wilayah yang sebelumnya bebas infeksi. Burung liar juga dicurigai memainkan peranan dalam persebaran dari flok satu ke flok lainnya dalam sistem perunggasan di pedesaan, baik sebagai vektor biologik maupun mekanik. Sebagai contoh, infeksi virus HPAI H5N1 keturunan Gs/GD pada burung pipit pohon (Passer montana) – burung yang terkait erat dengan tempat tinggal manusia dan bangunan pertanian – telah dilaporkan di China. Temuan ini telah menimbulkan kekhawatiran bahwa spesies ini dapat menjadi vektor penyebaran virus, dan kemudian mengharuskan perlunya dibangun kandang unggas yang bebas dari burung [102]. Penelitian secara eksperimental telah mendemonstrasikan bahwa burung pipit yang terinfeksi dapat membawa virus kepada ayam domestik [235]. Akan tetapi, lebih penting lagi, populasi itik domestik telah menjadi penampung utama virus HPAI H5 keturunan Gs/GD di sebagian Asia dan juga di Mesir [87, 175].
Dalam sejarahnya beberapa sistem produksi unggas air domestik telah memiliki tingkat infeksi virus AI yang tinggi yang diakibatkan dari interaksi dekat dan kohabitasi (berbagi habitat) dengan burung liar akuatik. Sebagai contoh, China bagian selatan memiliki banyak kolam itik dan itik dibesarkan di danau dimana terdapat percampuran sejumlah besar itik domestik dan burung liar akuatik [24, 170]. Lingkungan semacam ini memungkinkan transmisi fecal-oral melalui ingesti air yang terkontaminasi virus oleh unggas-unggas domestik yang dibesarkan dengan diumbar di wilayah itu, terutama unggas air domestik [169]. Di akhir tahun 1970-an dan awal tahun 1980-an, virus AI terdeteksi di pasar-pasar di Hong Kong, terutama pada itik domestik (6,5 % sampel terdeteksi positif), akan tetapi hanya sedikit positif pada ayam (0,4% positif) dan burung galinaseus lainnya [168, 169]. Tidak ada satupun dari virus ini merupakan virus HPAI. Serupa dengan itu pula di Amerika Serikat, sistem produksi unggas umbaran di Long Island, New York selama tahun 1979-1980 memiliki tingkat positivity isolasi virus AI sebesar 23% pada anak itik berumur 2 sampai 5 minggu, akan tetapi tidak menunjukkan gejala penyakit [156].
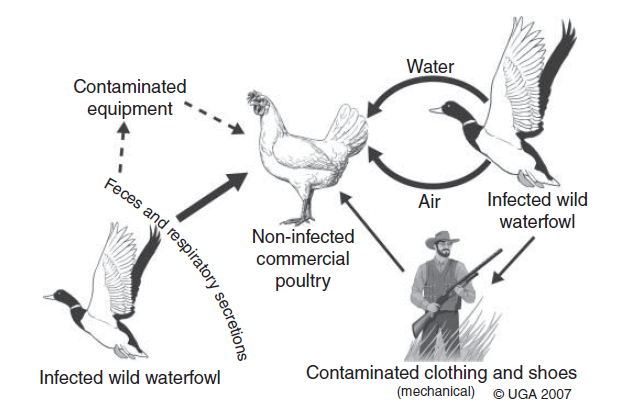
Gambar 12.5 Kepentingan relatif dari berbagai sarana pengenalan awal virus AI dari burung akuatik yang hidup bebas kepada unggas domestik. Sumber: K. Carter, University of Georgia, dan D. Swayne, U.S. Department of Agriculture Research Service.
Transmisi virus AI di dalam fasilitas/perusahaan perunggasan atau antar fasilitas dan perusahaan perunggasan yang berbeda
Saat virus HPAI H5 keturunan Gs/GD muncul di banyak negara di Asia di tahun 2003-2004, pertanyaan kemudian muncul tentang relatif pentingnya unggas di pedesaan dan peternakan komersial dalam transmisi dan mempertahankan virus ini. Telah disimpulkan bahwa resiko yang tertinggi muncul dari produksi unggas dan praktek penjualan dimana biosekuriti yang dilakukan tidak sepadan dengan resiko masuknya virus [176]. Meskipun dari segi jumlah banyak kasus terdeteksi pada unggas di pedesaan, jika berdasarkan hitungan ‘per flok’ hanya ada sedikit kasus daripada sektor komersial (yang bahkan menyebabkan bias dalam pelaporan). Banyak jalur transmisi dalam persebaran virus keluar dan masuk kedua sistem tersebut. Yang memiliki peranan penting adalah hubungan antara pedagang ternak unggas dan LPM, yang keduanya sendiri diakui sebagai tempat-tempat beresiko tinggi. LPM telah memainkan peranan penting dalam diseminasi virus AI. Sebagai salah satu contohnya di Amerika Serikat, virus LPAI H7N2 yang endemik pada LPM di timur laut Amerika Serikat dari tahun 1994-2006 masuk kedalam peternakan indeks komersial dan kemudian menyebar dan menyebabkan kasus pada unggas komersial sebagai berikut: ayam petelur di Pennsylvania di tahun 1996-1998, breeder ayam pedaging di Pennsylvania tahun 2001-2002, unggas komersial di Virginia, West Virginia, dan North Carolina tahun 2002, perusahaan ayam petelur besar di Connecticut tahun 2003, peternakan ayam petelur berukuran kecil di Rhode Island tahun 2003, dan tiga peternakan ayam pedaging di Delmarva tahun 2004 [1, 44, 49, 165, 182, 193, 202, 238]. LPM juga sudah terimplikasi dalam infeksi unggas komersial di Daerah Administrasi Khusus Hong Kong tahun 2002 [105]. Level resiko yang dimiliki LPM tergantung pada upaya manajemen yang telah diterapkan dalam rangka mencegah unggas yang ada di pasar agar tidak tertular atau tetap terinfeksi setelah tertular. Hong Kong telah memberlakukan serangkaian upaya pencegahan dalam LPM, dan upaya-upaya ini telah cukup berhasil dalam mengurangi resiko yang dimiliki oleh pasar-pasar ini terhadap peternakan unggas. Akan tetapi upaya pencegahan ini memerlukan ketaatan yang sangat ketat terhadap protokol biosekuriti dan manajemen. Jika unggas dalam flok komersial skala kecil dan unggas di pedesaan terinfeksi, mereka dapat memainkan peranan dalam dalam transmisi virus ke dalam peternakan komersial skala besar, akan tetapi ini akan bergantung kepada hubungan langsung dan tidak langsung antara dua tipe produksi tersebut. Transmisi virus juga dapat terjadi dari arah yang berlawanan, terutama jika unggas dijual melalui LPM yang manajemennya buruk atau jika terdapat tingginya konsentrasi pembesaran unggas dengan tipe yang berbeda-beda di satu wilayah yang sama, dan ketika infeksi berhasil masuk ke satu peternakan atau lebih.
Aktivitas resiko tinggi paling utama dalam masuknya virus AI ke dalam perunggasan komersial adalah kontak langsung dengan unggas terinfeksi atau kontak tidak langsung dengan fomite terkontaminasi, seperti kandang pembawa ternak, baju dan sepatu pegawai peternakan. Sebagai contoh, kasus LPAI H7N2 pertama di Pennsylvania (pada Desember 1996) terjadi di tempat penjual/pengumpul unggas untuk LPM yang memiliki 50 ekor unggas pada saat itu, dan pengumpul ini telah melakukan 405 kali pengambilan unggas dari peternakan-peternakan terdekat selama 3 bulan sebelumnya [75]. Kasus kedua terjadi pada flok ayam petelur komersial yang terletak sejauh 1,5 mil dari tempat kasus pertama, dan kasus ketiga terjadi pada peternakan ayam petelur skala kecil. Empat pengumpul ternak untuk LPM dari Pennsylvania dan New York telah melakukan pengambilan berkali-kali dari setiap flok. Resiko semacam ini dapat dimitigasi dengan memberikan pendidikan terhadap pegawai tentang resiko penularan virus AI dan melarang memasukkan unggas lain ataupun peralatan dari luar ke dalam peternakan, dan agar pegawai tidak memelihara unggas atau berkontak dengan unggas yang dipelihara di pedesaan atau unggas hidup di pasar unggas atau pegawai peternakan/pasar unggas. Jika unggas komersial ingin dijual di pasar/LPM, maka protokol beosekuriti yang ekstra harus dilakukan untuk menghindari masuknya patogen kedalam flok dengan hanya mengizinkan masuknya kandang yang sudah dibersihkan dan didisinfeksi ke dalam peternakan, dan mengharuskan pegawai/pengunjung untuk memakai pakaian pelindung luar sekali pakai dan sepatu boot yang bersih. Upaya pencegahan lain yang dapat dilakukan untuk lebih mengurangi resiko seperti vaksinasi seluruh unggas yang akan dijual di pasar LPM dengan strain virus yang diperkirakan menjadi ancaman (misalnya HPAI H5N1, seperti yang dilakukan di Hong Kong), dan juga pengendalian secara ketat pada sumber-sumber pensuplai unggas.
Perpindahan virus AI melalui udara atau angin dalam jarak dekat dapat terjadi antar tempat, terutama persebaran virus melalui angin selama aktivitas depopulasi seperti misalnya debu-debu yang muncul pada saat proses pembuangan alas kandang yang terkontaminasi atau penggilingan karkas sebelum dibusukkan/proses kompos [18, 130]. Air juga dapat menjadi jalan pemasukan virus jika terkontaminasi kotoran dari unggas yang terinfeksi, terutama dari itik domestik yang terinfeksi, atau dari unggas liar terinfeksi. Material feses dan alas kandang dari peternakan dan pasar yang disebarkan di padang juga dapat menjadi sumber transmisi antara tipe produksi unggas yang berbeda.
Perlakuan praktek biosekuriti tingkat tinggi pada peternakan akan memitigasi resiko persebaran antar peternakan ke peternakan, seperti yang terbukti di Lembah Shenandoah di Virginia selama tahun 2002, dimana lebih dari 78% peternakan unggas (667 peternakan) tetap bebas dari LPAI H7N2 [164, 166]. Akan tetapi di wilayah dimana kepadatan peternakannya tinggi, transmisi lokal dapat terjadi meskipun upaya pencegahan yang memadai sudah dilakukan. Di beberapa wabah HPAI H5, virus telah diisolasi dari lalat langau (blow fly), lalat rumah (house fly), lalat sampah hitam (black garbage fly), dan lalat kotoran kecil (small dung fly), yang menunjukkan bahwa serang-serangga ini dapat berperan sebagai vektor mekanis persebaran virus AI antar peternakan [21, 157]. Transmisi mekanis virus AI dapat terjadi antar peternakan melalui hewan apa saja yang dapat berjalan, merangkak, ataupun terbang, termasuk serangga, manusia, dan mamalia lain, juga burung liar, akan tetapi konfirmasi tepat rute transmisi dan hubungan sebab akibatnya sangat sulit sekali untuk dibuktikan [21].
Frekuensi infeksi AI di dalam sistem buatan manusia yang berbeda bervariasi tergantung pada struktur sektor perunggasannya, termasuk kepadatan produksi unggas di wilayah itu, sektor produksi spesifik, kualitas sistem biosekuriti yang digunakan, sistem pemasaran dan transportasi, dan status infeksi negara terkait. Diantara 25-30 milyar ayam yang dipelihara per tahunnya didalan sistem perunggasan komersial terintegrasi di negara-negara maju, HPAI telah jarang ditemukan dan LPAI hanya bersifat sporadis. Hal ini menunjukkan bahwa resiko masuknya virus dan infeksi yang terjadi dapat diatasi. Di Amerika Serikat, infeksi AI telah lebih sering dilaporkan pada unggas dalam sistem LPM [205, 216]. Dalam sektor industri negara maju, wabah LPAU telah dilaporkan paling sering pada kalkun, lebih sedikit dilaporkan pada ayam petelur, dan lebih sedikit lagi pada unggas domestik lainnya [21, 107]. Sebaliknya berbagai infeksi HPAI dan LPAI sudah umum dilaporkan baik pada unggas di pedesaan maupun unggas komersial di banyak negara berkembang. Sebagai contoh, virus LPAI H9N2 telah menjadi endemik pada ayam komersial di negara-negara Asia dan Timur Tengah mulai pertengahan sampai akhir tahun 1990-an [33, 34, 109, 111, 123, 128, 142]. Serupa dengan itu, sejak tahun 2003, HPAI H5 keturunan Gs/GD telah menjadi endemik di sejumlah negara Asia, dipertahankan di dalam LPM, dan kemungkinan di beberapa wilayah dengan konsentrasi unggas yang tinggi yang dibesarkan dan dijual menggunakan upaya biosekuriti yang tidak memadai, dan juga terjadi pada itik domestik. Ketika infeksi virus AI terjadi di sektor industri atau sistem pasar unggas hidup, virus AI telah menyebar dengan cepat dalam keseluruhan sistem dari peternakan ke peternakan lain ketika praktek biosekuriti yang ada tidak memadai, mengakibatkan epidemi HPAI atau LPAI.
Unggas yang dibesarkan di lingkungan luar (outdoor)
Pemeliharaan unggas di luar ruangan atau di padang penggembalaan di wilayah tertentu yang memberikan akses kontak dengan unggas liar yang terinfeksi virus AI adalah salah satu faktor resiko transmisi dari burung liar kedalam sistem pertanian. Sebagai contoh di Minnesota antara tahun 1970 sampai 1990-an, sejumlah besar peternakan kalkun komersial membesarkan banyak kalkun di padang penggembalaan setiap tahunnya untuk memproduksi suplai kalkun untuk perayaan Thanksgiving dan hari libur Natal [205]. Praktek pembesaran ini dilakukan pada awal musim gugur, selama saat periode itik liar berdiam di danau-danau di Minnesota sebelum bermigrasi ke arah selatan untuk musim dingin. Hal ini menyebabkan terpaparnya kalkun dengan unggas air liar yang bermigrasi yang telah terinfeksi virus LPAI, yang berakibat terjadinya infeksi [68]. Jumlah flok yang kalkunnya tertular AI bervariasi dari tahun ke tahun, dengan jumlah miminum terdampak sebanyak dua flok pada tahun 1983, dan mencapai puncak-puncaknya dengan jumlah flok terdampak sebanyak 141 flok (1978), 258 flok (1988), dan 178 flok (1995) [71]. Pada tahun 1998, industri kalkun komersial di Minnesota mengeliminasi praktek pembesaran kalkun dengan penggembalaan, dan hasilnya telah dapat mengurangi jumlah flok yang terinfeksi. Hanya 33 flok kalkun saja yang terinfeksi dari tahun 1996 dan 2000, dan sebagian besar dari flok yang terinfeksi ini terinfeksi oleh virus H1N1 influenza babi [72]. Akses outdoor ini lebih dominan pada sistem produksi yang mensuplai sistem LPM. Biasanya penyuplai unggas semacam itu meliputi peternakan kecil dimana unggas dibesarkan di belakang rumah atau tempat-tempat terbuka lainnya, terutama pemeliharaan unggas air domestik [161, 212].
Sebelum berkembangnya produksi perunggasan komersial modern yang terintegrasi secara vertikal dan terbentuknya jaringan pemasaran melalui pengendalian temperature untuk produk yang mudah rusak pada tahun 1950-an, sebagian besar produksi daging dan telur dibesarkan di luar ruangan dan secara lokal di kandang belakang rumah dan flok-flok para hobiis unggas, atau pada peternakan komersial berskala kecil yang hasilnya langsung disembelih dan dimakan [64]. Produksi unggas lokal outdoor yang kecil dan operasi pemotongan unggas berskala kecil masih beroperasi sekarang di banyak negara berkembang. Unggas yang dibesarkan di luar ruangan dan di lingkungan pedesaan serta sistem pasar unggas hidup memiliki tingkat infeksi virus AI yang lebih tinggi dibandingkan dengan sistem produksi unggas industrial di negara maju [171].
Kerentanan dalam satu spesies
Virus LPAI dari burung liar akuatik berhubungan dekat secara adaptasi hospes dengan unggas air domestik, menyebabkan unggas air dapat menjadi hospes. Beberapa penelitian memberikan saran bahwa kalkun, burung pegar dan burung puyuh Jepang lebih rentan terhadap virus AI yang berasal dari unggas air domestik daripada ayam [89, 141, 204]. Bertemunya berbagai spesies dalam sistem pasar unggas hidup, terutama unggas air domestik, memudahkan transmisi virus AI antar spesies dan mengisiasi terjadinya infeksi [212]. Meskipun ayam umumnya tahan terhadap tranfer virus AI langsung dari unggas liar, setelah pasase melalui hospes intermediate/antara (seperti kalkun, burung puyuh Kalkun atau burung pegar) dan adaptasi selanjutnya pada ayam, virus AI kemudian lebih mudah menginfeksi ayam dan kemudian bertransmisi dengan lebih efisien. Namun demikian, terdapat laporan adanya infeksi virus AI yang langsung berasal dari burung liar ke ayam, termasuk kasus yang terjadi di Australia yang berhubungan dengan virus subtipe H10 [222]. Terdapat satu laporan lapangan tentang beberapa strain ayam lokal yang resisten terhadap virus HPAI H5N1 berdasarkan keberadaan haplotype B21 [16]. Akan tetapi, studi eksperimental yang menggunakan ayam white leghorn haplotype B12 tidak mencegah ayam menjadi sakit atau mati setelah ditantang dengan virus HPAI H5N1 asal Indonesia dengan dosis rendah yang diberikan secara intranasal [90]. Salah satu studi eksperimental telah melaporkan penyakit yang lebih parah pada ayam white leghorn komersial dibandingkan ayam broiler setelah diinokulasi dengan virus LPAI H4N8 [197].
Kurangnya pembatasan/pengaturan pergerakan unggas dan biosekuriti
Dalam sejarahnya, kurangnya pengendalian pergerakan, termasuk karantina, dan biosekuriti yang buruk dihubungkan dengan menyebarnya HPAI di Eropa antara tahun 1900 dan 1930, dan bertanggungjawab terhadap menetapnya infeksi endemik yang berkelanjutan di Eropa [191]. Kondisi yang serupa juga ditemukan pada saat ini di tempat-tempat dimanan virus H5 keturunan Gs/GD telah menjadi endemik [54]. Sejak tahun 1980, survei yang dijalankan pada LPM unggas di Hong Kong, New York, dan beberapa kota besar lainnya telah mengidentifikasi infeksi virus HPAI maupun LPAI [162, 169, 171, 212, 227]. Di beberapa kota dimana infeksi-infeksi tersebut telah dicegah dan dikendalikan melalui kombinasi sejumlah upaya pengendalian, meliputi biosekuriti yang upaya higienitas yang baik, implementasi manajemen perpindahan ternak (melalui kontrol ketat sumber-sumber perunggasan), segregasi/pemisahan antar spesies, protokol pembersihan dan desinfeksi, periode istirahat untuk pasar unggas, kewajiban vaksinasi terhadap seluruh unggas yang akan masuk kedalam sistem LPM, dan pelarangan untuk menginapkan unggas semalaman di pasar unggas. Upaya-upaya pencegahan ini telah diberlakukan untuk mencegah HPAI H5N1 di pasar-pasar di Hong Kong [173]. Upaya pencegahan serupa telah mampu untuk mengeliminasi virus LPAI H7N2 dari LPM-LMP di bagian timur laut Amerika Serikat [213, 214]. Di banyak negara, penjualan unggas hidup melalui LMP telah dilarang. Penutupan pasar sementara ataupun permanen telah berhasil dalam mengendalikan infeksi zoonosis virus LPAI H7N9 di China, setidaknya untuk sementara. Diperkenalkannya upaya pengendalian seperti waktu istirahat pasar dan upaya hygiene lainnya, atau pergantian menjadi sistem penyembelihan yang tersentralisasi, memerlukan Kerjasama dari peternak dan pedagang ternak yang pada banyak kasus tidak melihat adanya alasan yang kuat untuk melakukan perubahan praktek peternakan dan perdagangan yang telah mereka lakukan.
Pencegahan persebaran virus pada peternakan komersial memerlukan implementasi biosekuriti dengan level tinggi. Aktivitas beresiko tinggi harus diidentifikasi, dinilai, dan dimitigasi ataupun dieliminasi sesuai yang diperlukan. Misalnya, aktivitas beresiko tinggi yang menyebabkan transmisi virus LPAI H7N2 di Virginia tahun 2002 adalah perpindahan unggas terinfeksi yang mati dari peternakan melalui sistem rendering bersama (sistem penanganan produk akhir asal hewan yang bukan diperuntukkan untuk manusia), juga pengeluaran ternak dari peternakan untuk dikuburkan tanpa melalui penyegelan yang seharusnya dan tanpa dekontaminasi fasilitas transportasi [18, 166]. Resiko-resiko semacam ini harus dikendalikan melalui prosedur dan praktek biosekuriti yang sesuai. Ditambah lagi, untuk meminimalisir resiko masuk dan terdesiminasinya virus AI, produsen seharusnya hanya memelihara satu spesies unggas saja dalam satu fasilitas operasional, memiliki sistem produksi all-in-all-out, atau menambahkan/memasukkan unggas baru hanya setelah dilakukan pengajuan dan karantina, dan mempraktekkan biosekuriti tingkat tinggi. Sejumlah studi kontrol kasus tentang HPAI H5N1 keturunan Gs/GD juga telah menunjukkan pentingnya upaya-upaya biosekuriti yang teratur dengan baik [105, 133]. Upaya biosekuriti tingkat tinggi hanyalah mengurangi resiko. Beberapa peternakan yang tampaknya telah memiliki upaya pencegahan tersedia masih bisa terinfeksi influenza dan virus lainnya. Hal ini juga mencakup beberapa wabah HPAI H5 keturunan Gs/GD pada unggas yang dipelihara secara intensif (terutama kalkun) di sejumlah negara maju, termasuk Amerika Serikat pada tahun 2014-2015. Jelasnya, untuk virus dapat masuk ke dalam peternakan, harus terjadi pelanggaran biosekuriti yang telah ada, akan tetapi bahkan setelah melalui penyelidikan menyeluruh, mode pemasukan virus kepada beberapa peternakan masih belum dapat ditentukan.
Modelling faktor ekologikal
Sejumlah kelompok peneliti telah mengembangkan model untuk mengidentifikasi faktor-faktor ekologi yang dihubungkan dengan wabah HPAI H5N1. Model-model ini telah menitikberatkan pada pentingnya sejumlah faktor resiko yang telah diketahui, meliputi peranan itik domestik yang diumbar, hubungan dengan LPM, dan pentingnya meningkatkan biosekuriti dalam peternakan untuk pencegahan penyakit [43]. Beberapa model telah menggunakan teknik epidemiologi molekuler dan mendemonstrasikan korelasi dan pengelompokan strain virus, yang mengindikasikan adanya penyebrangan (crossover) infeksi antara unggas liar dan unggas domestik [61].
Model epidemiologi mencoba memadatkan interaksi kompleks kedalam model yang kurang lebih simple. Model-model ini kemudian terhambat dengan data yang tidak sempurna, dengan informasi surveilans dan investigasi penyakit yang terbatas dan bias, terutama di negara-negara berkembang dimana pelaporan penyakit tidak lengkap. Model dapat dengan cepat menjadi tertinggal ketika upaya pengendalian baru, seperti pengendalian pergerakan hewan, manajemen pasar, dan biosekuriti peternakan diimplementasikan untuk mencegah infeksi, karena itu memerlukan perubahan daam struktur dan parameter yang diperlukan untuk membangun model tersebut. Model dapat menjadi bernilai dalam perbaikan strategi pengendalian penyakit [190], yang didapat dengan melakukan verifikasi kondisi lapangan untuk meyakinkan bahwa keluarannya sesuai dengan pengalaman di lapangan.
Penelitian lainnya telah menggunakan analisa jaringan sosial untuk mengidentifikasi faktor resiko dalam jaringan pemasaran [59, 118]. Pada beberapa kasus studi tersebut telah mengidentifikasi pasar yang telah terindentifikasi pada penelitian lain sebagai salah satu resiko tinggi yang menyebabkan persistensi dan transmisi HPAI H5N1, dan intervensi telah diperkenalkan untuk mengurangi resiko tersebut [177].
Investigasi epidemiologis
Setiap kali wabah AI pada unggas dicurigai terjadi, penting untuk melakukan investigasi menyeluruh dalam rangka mendapatkan diagnosis spesifik. Juga penting untuk menentukan sumber infeksi yang paling mungkin dan kemungkinan penyebarannya ke depan dengan mengidentifikasi lokasi yang mungkin memiliki resiko melalui pelacakan (tracing). Standar data epidemiologi harus dicatat, meliputi lokasi tempat kejadian, lokasi kelompok-kelompok umur yang berbeda atau batch, ukuran populasi beresiko di setiap kandang, dan jumlan dan tipe unggas yang mati dan sakit. Garis waktu yang dibuat harus menunjukkan penanda kejadian-kejadian penting/kunci dalam suatu peternakan sebelum dan setelah wabah. Lokasi pasti terjadinya wabah dalam peternakan harus dicatat, termasuk titik-titik di peternakan dimana wabah dimulai. Dalam investigasi wabah HPAI (selain virus H5 keturunan Gs/GD), investigasi serologis flok-flok lain dalam peternakan yang sama harus dilakukan untuk menilai apakah LPAI telah menginfeksi flok-flok lain di tempat itu sebelum berubah menjadi HPAI.
Pada lokasi-lokasi dimana banyak kasus AI telah terjadi, studi kontrol kasus dan spatio-temporal telah dilakukan untuk menentukan resiko paling penting masuknya agen penyakit, dan faktor yang berhubungan dengan transmisi penyakit [74, 105, 120]. Penelitian-penelitian ini kadang kala dihalangi oleh kurangnya informasi (misalnya ketergantungan dengan ada atau tidaknya gejala klinis daripada pengujian untuk mendeteksi bukti adanya infeksi pada flok yang sudah divaksinasi). Jika informasi genetik tentang virus tersedia melalui sekuensi dalam (deep sequencing) dimungkinkan untuk mencari hubungan antar peternakan, seperti yang telah dilakukan pada wabah besar yang terjadi di Belanda [9, 237]. Pada banyak kasus rute pasti pemasukan virus dan/atau asal muasal virus pertama kali tidak dapat ditentukan meskipun telah melalui investigasi yang mendetail. Data molekuler dapat membantu dalam proses ini, akan tetapi pendekatan ini tergantung terdeteksinya jumlah yang mewakili tempat-tempat yang terinfeksi. Pada akhirnya melalui pemeriksaan yang menyeluruh terhadap kebiasaan pelaksanaan pekerjaan di peternakan dan tempat-tempat yang terlibat harusnya mampu membuahkan informasi yang setara tentang rute-rute infeksi.
Kesimpulan
Selama ribuan tahun aktivitas manusia telah merubah ekosistem alami burung melalui penangkaran, domestikasi, agrikultur, dan perdagangan, dan perubahan ini terus terjadi sampai hari ini. Sistem buatan manusia ini sangat beragam, meliputi unggas hobi, unggas pedesaan dan perkotaan, ayam aduan, burung liar yang ditangkarkan, unggas non-komersial dan komersial yang dibesarkan di luar ruangan, dan unggas industri yang dibesarkan di dalam ruangan. Ukuran peternakan komersial telah berubah secara dramatis sejak akhir tahun 1800-an, dan perkembangan produksi komersial perunggasan dalam ruangan telah mengalami akselerasi sejak tahun 1950-an.
Serupa dengan itu pula virus LPAI telah berubah dari sebelumnya merupakan sekelompok virus beragam yang bersirkulasi tanpa menimbulkan gejala pada burung akuatik tertentu yang hidup bebas menjadi sekelompok virus AI yang tidak begitu beragam, yang merupakan akibat dari reasortmen atau adaptasi seluruh virus, menyebabkan penyakit pernafasan endemik pada kuda, babi, manusia dan unggas domestik. Ditambah lagi, virus LPAI yang beragam pada burung liar yang hidup bebas telah menyebabkan infeksi sporadis pada berbagai mamalia dan unggas liar maupun domestik. Virus HPAI tidak menetap pada reservoir burung liar seperti virus LPAI, setidaknya tidak dalam jangka waktu yang lama. Virus HPAI telah muncul karena mutasi virus LAPI H5 dan H7, biasanya muncul setelah sirkulasi virus yang tidak terkontrol pada unggas galinaseus yang rentan. Secara historis, virus HPAI tidak begitu infeksius untuk burung air domestik maupun yang hidup bebas (angsa dan itik), akan tetapi selama dua dekade terakhir, virus HPAI H5 keturunan Gs/GD yang berasal dari China bagian selatan telah beradaptasi kepada burung air liar dan domestik, menyebabkan infeksi, morbiditas dan kematian.
Transfer virus LPAI dari burung akuatik yang hidup bebas memerlukan proses yang kompleks dan banyak Langkah yang harus ditempuh, meliputi paparan dan adaptasi virus kepada hospes yang baru. Kemunculan strain virus AI yang baru, seperti virus H10N8 yang pertama kalinya di Provinsi Jiangxi, China, memberikan contoh bagaimana proses ini dapat terjadi [115]. Transmisibilitas semacam itu memerlukan paparan, adaptasi hospes, dan replikasi virus yang efektif pada spesies hospes, dengan transmisi yang mudah antar individu. Pada kasus lainnya, transfer virus LPAI dari burung liar kepada unggas domestik terjadi dengan mudah, seperti yang terlihat pada banyak wabah pada kalkun di Amerika Serikat.
Unggas-unggas yang beresiko tinggi masuknya virus AI dari burung akuatik yang hidup bebas adalah unggas domestik yang dipelihara di luar rumah, terutama burung air domestik (itik dan angsa). Faktor resiko tambahan meliputi percampuran spesies unggas di tempat yang sama, dan kurangnya biosekuriti dan pengendalian pergerakan unggas. Terdapat enam enam jalur utama (satu jalur langsung dan lima jalur tidak langsung) pemasukan virus ke suatu tempat, yaitu:
- Kontak langsung dengan burung liar maupun unggas domestik yang terinfeksi.
- Paparan dengan peralatan peternakan/pertanian, kendaraan pengangkut, ataupun material.
- Melalui pergerakan manusia, virus menempel di sepatu, baju, rambut, tangan maupun kulit.
- Air dan pakan yang terkontaminasi.
- Melalui udara (airborne), debu ataupun tetesan air.
- Berpotensi dari serangga maupun tikus.
Pentingnya setiap jalur ini tergantung pada keadaan masing-masing individu. Pemahaman yang didapat tentang bagaimana salah satu dari jalur ini yang terlibat dalam wabah penyakit yang didapat melalui investigasi epidemiologi yang terstrukturisasi dengan baik, merupakan sesuatu yang krusial dalam pengembangan program pengendalian dan pencegahan penyakit.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

