Oleh: Mary J. Pantin-Jackwood
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Perkenalan
Itik domestik adalah sumber makanan dan pendapatan penting di banyak belahan dunia. Kerentanan itik domestik terhadap infeksi virus AI dan kemunculan gejala klinjs dapat bervariasi tergantung pada banyak faktor, termasuk spesies dan umur itik, strain virus, dan manajemen pemeliharaan. Meskipun burung air domestik merupakan reservoir alami virus AI, itik domestik juga memainkan peranan penting dalam epidemiologi AI, berlaku sebagai penghubung transmisi antara unggas air liar dan spesies unggas lainnya [46, 49, 67, 123]. Itik yang secara alami tertular atau diinfeksi secara eksperimental dengan sebagian besar virus AI, termasuk strain HPAI, hanya mrnimbulkan gejala klinis ringan atau subklinis. Akan tetapi, banyak virus HPAI H5N1 keturunan Gs/GD Asian goose/Guangdong telah diperlihatkan mampu bereplikasi secara sistemik dan menyebabkan penyakit parah pada itik dan bahkan kematian (di review di sumber lain) [104]. Virus HPAI H5 yang baru yang berhubungan dengan HPAI keturunan Gs/GD juga dapat menyebabkan penyakit dan di beberapa diantaranya menyebabkan kasus kematian pada itik [63, 69].
Itik dibesarkan untuk mendapatkan daging, telur dan bulunya, dan itik mampu berkembang sampai dewasa dengan hanya diberi pakan sederhana dari bahan-bahan yang tersedia secara lokal [40]. Itik domestik merupakan anggota Ordo Anseriformes, keluarga Anatidae, dan meliputi dua spesies berbeda dengan banyak ras, yang terbagi kedalam dua klasifikasi besar yaitu itik biasa dan Entok/Muscovy. Kebanyakan itik domestik adalah itik biasa (Anas platyrhynchos var. domestica) dan dipercaya sebagai keturunan itik mallard (Anas platyrhynchos). Itik Mallard didomestikasi melalui dua peristiwa terpisah, yang pertama di Asia Tenggara dan kemudian di Eropa selama abad pertengahan [137]. Sebagian dari ras itik yang terkenal antara lain Meliputi Pekin, Aylesbury, Rouen, Call, Indian Runner, Khaki Campbell, Cayuga, Alabio, Maya dan Tsaiya. Ras dan varietas itik yang berbeda dapat dibiakkan dan menghasilkan keturunan yang fertil [40]. Itik domestik merupakan spesies unggas dominan di sebagian besar Asia Selatan, dimana mereka dibesarkan untuk pedaging dan petelur. Kebanyakan adalah produksi unggas semi komersial, akan tetapi juga terdapat produksi komersial sebagai pedaging khusus, utamanya di Eropa dan Amerika Utara [137]. Selama berabad-abad, itik yang dipelihara dengan cara tradisional di wilayah produksi bebas, sementara itik lokal dipilih dari generasi ke generasi karena kemampuannya untuk memakan semua bahan makanan dari sawah yang sudah di panen, padang, rawa dan kali kecil. Contoh ras itik yang dipilih untuk diumbar adalah Itik Alabio dan Bali dari Indonesia dan itik lokal Maya di China. Selain itik Maya, terdapat juga sejumlah garis keturunan atau ras berbeda di China, seperti Shao, Gaoyou, Jinding, Baisha, Yellow Colophony, dan Peking [40].
Itik Muscovy/Entok (Cairina moschata) sangat berbeda secara genetik dari itik biasa, dan berasal dari Amerika Selatan [36]. Dari Amerika, Entok dibawa ke Eropa (terutama Perancis) dan ke Afrika oleh para petualan samudera dari Spanyol dan Portugism akan tetapi juga dibawa ke Asia, dimana ia beradaptasi dengan baik pada iklim yang panas [36]. Meskipun Entok dapat dikawinsilangkan dengan itik biasa, keturunannya steril. Hybrid steril ini disebut ‘mule’ dalam Bahasa Inggris dan ‘itik Balagung” dalam Bahasa Indonesia (Entok jantan x itik betina) dan disebut ‘hinny’ dalam Bahasa Inggris dan ‘itik Serati’ dalam Bahasa Indonesia (Itik jantan x Entok betina). Pada beberapa kasus, pengusaha pembibitan unggas komersial memberi nama sendiri untuk komoditas hibridnya. Sebagai contoh, hibrida yang diproduksi dengan menyilangkan Entok jantan dengan itik Peking betina disebut sebagai itik ‘Moulard’. Di Taiwan, hibrida yang didapat dari persilangan Entok Putih jantan dengan itik betina Kaiya (hasil persilangan itik Peking dan Itik Tsaiya) disebut sebagai ‘Itik Entok’ [40]. Entok masih tetapi menjadi spesies unggas yang kurang disukai. Pusat produksi komersialnya berada di Perancis, negara Eropa Timur, dan Asia Tenggara sebagai penghasil daging. Peranan Entok di belahan bumi lainnya adalah sebagai unggas di pedesaan dan peternakan berkelanjutan sebagai penghasil telur dan daging [137].
Pada kebanyakan kasus, itik domestik yang terinfeksi virus AI tidak menunjukkan gejala klinis. Akan tetapi, banyak virus HPAI H5N1 keturunan Gs/GD, dan virus H5 baru yang merupakan keturunan dari H5N1, termasuk virus HPAI H5N8, telah menyebabkan penyakit pada itik yang mempengaruhi proses produksi. Itik domestik memainkan peranan penting dalam epidemiologi virus HPAI H5N1. Virus-virus ini sangat mematikan untuk ayam. Akan tetapi pada itik domestik, virus-virus ini dapat menghasilkan gejala klinis yang sangat bervariasi, mulai dari infeksi asimptomatik sampai penyakit berat dengan kematian [12, 63, 80, 94, 103, 104, 109, 135, 145]. Baik itik yang sakit maupun yang tidak bergejala dapat mendeahkan virus dalam jumlah yang signifikan ke lingkungan sekitar, berakibat pada meningkatnya resiko transmisi dan potensi terjadinya wabah pada itik komersial. Burung liar yang bermigrasi berkontribusi terhadap persebaran virus HPAI H5N1 dan H5N8 dari Asia ke belahan bumi lainnya [25, 66, 67]. Akan tetapi sirkulasi virus HPAI H5N1 pada populasi itik domestik dianggap sebagai salah satu sumber utama infeksi, yang memungkinkan terjadinya siklus enzootik virus HPAI H5N1 di beberapa negara yang mempraktekkan peternakan gaya umbaran, juga unggas yang dipelihara di belakang rumah maupun unggas yang dipelihara di pedesaan [46, 49, 67, 123]. Pemeliharaan itik domestik di lapangan terbuka, sawah yang berair, atau kolam atau penampungan air lainnya memungkinkan kontak langsung dengan unggas air liar dan itik domestik dari peternak lain, memberikan kesempatan banyak mekanisme penularan maupun persebaran virus antar peternakan [10]. Selain kontak langsung dengan unggas terinfeksi, kontaminasi lingkungan oleh virus yang didedahkan oleh itik terinfeksi memainkan peranana penting dalam transmisi virus AI secara tidak langsung kepada unggas yang rentan [77, 129, 130].
Dalam rangka untuk mengendalikan AI dengan lebih baik, perlu dipahami tentang patobiologi virus AI pada itik domestik. Beberapa pembahasan mengenai patobiologi virus AI pada unggas telah dipublikasikan [104, 138, 140, 142]. Bagian seterusnya dari Bab ini akan merangkum penelitian eksperimental yang telah dilakukan untuk mengetahui tentang infeksi virus AI pada itik.
Konsep umum patobiologi avian influenza
Virus AI adalah virus Influenza A yang menginfeksi beragam unggas domestik, unggas dalam penangkaran, dan spesies burung liar yang hidup bebas dalam kondisi alami maupun eksperimental [142]. Burung liar akuatik, terutama yang termasuk ke dalam Ordo Anseriformes (itik dan angsa) dan Charadriiformes (burung pesisir, burung camar, tern dan auk), adalah reservoir alami virus ini [128, 138, 156]. Virus-virus AI ini sangat beradaptasi dengan baik pada hospesnya, terutama bereplikasi pada sel epitelium saluran gastrointestinal dan menyebabkan infeksi subklinis pada spesies-spesies hospes tersebut. Secara berkala, virus-virus ini ditransmisikan dari unggas air liar ke unggas domestik (ayam dan kalkun), menyebabkan infeksi subklikins, atau kadang-kadang menimbulkan penyakit pernafasan dan penurunan produksi telur. Fenotipe virus ini biasanya disebut berpatogenitas rendah (low pathogenic) LPAI dan mungkin saja merupakan salah satu subtipe yang berasal dari kombinasi 16 hemaglutinin (HA) dan 9 neuraminidase (NA) [141]. Akan tetapi beberapa virus LPAI H5 dan H7 setelah bersirkulasi pada unggas domestik, telah bermutasi menyebabkan virus berpatogenitas tinggi (highly pathogenic) HPAI. Virus-virus HPAI ini menyebabkan penyakit sistemik berat dengan lesi-lesi nekrosis dan inflamasi pada kulit, organ dalam, dan otak unggas gallinaseus [142]. Dalam sejarahnya, virus HPAI belum pernah menginfeksi unggas iar, dengan pengecualian adanya kematian diantara populasi burung common tern (Sterna hirundo) di Afrika Selatan pada tahun 1961 [11], akan tetapi sejak tahun 2002 virus HPAI keturunan Gs/GD telah menyebabkan infeksi, penyakit dan kematian pada berbagai spesiies burung baik dalam penangkaran, kebun binatang dan unggas liar, termasuk burung-burung air.
Beberapa faktor mempengaruhi biologi virus AI yang kompleks, meliputi infektifitas, adaptasi hospes, virulensi dan tropisme jaringan [104]. Meskipun patotipe LP maupun HP untuk virus AI didefinisikan dalam lingkungan laboratorium, infeksi alami virus AI mengakibatkan beragam gejala klinis yang tergantung pada banyak faktor, meliputi strain virus, spesies hospes, umur hospes, jenis kelamin hospes, infeksi yang terjadi bersamaan dengan infeksi AI, imunitas perolehan, dan faktor lingkungan [138]. Terdapat empat kemungkinan hasil akhir setelah terpapar virus AI, yaitu tidak terjadi infeksi, infeksi asimptomatik, penyakit ringan, atau penyakit berat dengan kematian [104]. Paparan, atau akses terhadap virus, sangat kritikal dalam memulai proses infeksi. Namun, untuk beberapa virus Ai dan beberapa hospes, paparan terhadap virus mungkin saja tidak menyebabkan infeksi, terutama jika rute paparannya tidak cocok, dosis virus berada dibawah ambang batas yang diperlukan untuk menginisiasi infeksi, terdapat kekebalan terhadap strain virus tersebut, atau strain virus itu tidak beradaptasi terhadap spesies hospes secara spesifik [104]. Doses infeksius rata-rata untuk beberapa virus AI yang telah didapatkan untuk beberapa spesies unggas domestik dibawah kondisi percobaan. Dosis ini terbukti tergantung baik kepada strain virus maupun hospesnya, dan dapat dianggap sebagai salah satu parameter dalam mengukur infektivitas dan adaptabilitas virus terhadap spesies hospes tertentu (Table 13.1) [139].
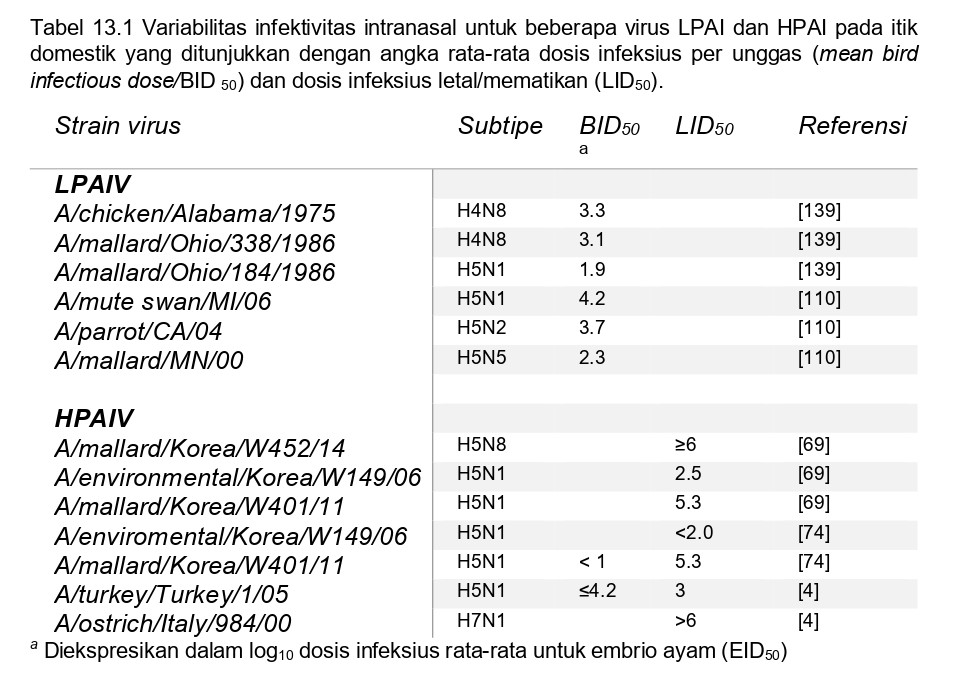
Patogenitas infeksi virus AI pada itik tergantung kepada strain virusnya. Virus LPAI endemik yang terdapat secara alami di alam biasana enterotropik, dengan pendedahan virus terutama melalui feses [45]. Akan tetapi, ketika virus dari burung air liar melompat dan beradaptasi pada spesies unggas gallinaseus, virus biasanya berubah menjadi lebih respiratori-tropik, dengan hanya sedikit virus yang terdeteksi dalam feses. Saat virus-virus yang telah beradaptasi pada ayam ini menginfeksi itik, virus biasanya tetap mempertahankan pola replikasi respiratori-tropik [100, 125].
Penentu virulensi secara genetik
Virulensi atau patogenisitas adalah kemampuan virus untuk menyebabkan penyakit, dan ditentukan oleh kapasitas virus untuk berkembang, untuk menjadi invasive, menginfeksi sel rentan, menghindari sistem imun, dan menyebabkan kerusakan sel [152]. Kapasitan-kapasitas ini terkode dalam genome virus melalui gen virulensi individual, dan ciri spesifik yang berhubungan dengan virulensi disebut sebagai penentu/determinan virulensi. Patogenisitas virus AI adalah sifat poligenik yang mempengaruhi tropisme hospes dan jaringan, efektivitas replikasi, dan makanisme penghindaran sistem imun, dan lainnya. Hemaglutinin (HA) adalah penentu dominan dalam virulensi, akan tetapi ekspresi virulensi maksimum memerlukan kombinasi optimal gen-gen internal [14]. Dalam rangka menginisiasi proses infeksi pada unggas, HA pada awalnya harus berikatan dengan sel reseptor yang terhubung dengan galaktosa α2,3 untuk menginisiasi endositosis yang dimediasi reseptor. Fenomena ini belum dimengerti sepenuhnya, akan tetapi memiliki dampak baik pada spesifisitas hospes dan sel serta tropisme jaringan [138]. Selain itu, fusi amplop virus dengan dinding endosome memerlukan pembelahan protein HA menjadi protein HA1 dan HA2, yang penting bagi virus untuk menjadi infeksius dan memproduksi banyak siklus replikasi. Virus LPAI dilepaskan dari sel hospes dengan protein HA yang tidak terbelah, dan karena itu bersisifat non-infeksius. Protein dapat dibelah oleh protease mirip tripsin yang terdapat pada situs-situs anatomi terbatas, seperti sel epitel pernafasan dan pencernaan, yang menyebabkan terbatasnya replkasi dan virulensi yang rendah. Perbedaan antara situs pembelahan virus LPAI dan HPAI adalah jumlah asam amino dasar dalam HA1 dekat situs pembelahan, atau inserti asam amino dekat situs pembelahan yang menentukan apakan protease mirip tripsin atau proteasi mirip furin dapat membelah protein tersebut. Virus LPAI umumnya memiliki dua asam amino yang tidak berurutan pada ujung karbon protein HA1, yang hanya bisa dibelah oleh protease mirip tripsin. Sebaliknya, virus HPAI H5 dan H7 memiliki banyak asam amino dasar atau memiliki insersi asam amino pada ujung karbon protein HA1, yang memungkinkan pembelahan proteolitik oleh protease furin yang tersedia pada banyak sel di seluruh tubuh [133]. Hal ini meningkatkan tropisme sel untuk virus tersebut, membawa kepada replikasi virus dalam banyak organ dalam, sistem syarafm dan sistem kardiovaksular, yang mengakibatkan penyakit sistemik disertai kematian yang tinggi. Satu faktor tambahan, yaitu ada tidaknya situs glikosilase pada ujung terminal amino pada protein HA1, telah ditunjukkan dapat mempengaruhi pembelahan HA. Perubahan pada situs glikosilasi Neuraminidase (NA) juga memainkan peranan dalam patogenisitas virus HPAI pada ayam [55], juga delesi cabang NA, yang dianggap sebagai ciri adaptasi virus burung liar kepada ayam [8, 23, 92].
Penelitian tentang teknik genetika terbalik (reverse genetic) dan reasortansi klasik telah menunjukkan bahwa gen-gen lain dan mutasi spesifik juga merupakan kontributor penting dalam patogenitas virus AI. Perubahan pada polimerasi PB2 dan PB1-F2, nucleoprotein (NP), dan protein non-struktural dalam situasi eksperimental dapat merubah patogenitas virus HPAI pada ayam [2, 26, 81, 143, 144, 171]. Selain mutasi pada gen-gen ini, kombinasi berbeda dari komponen ribonucleoprotein (RNP) (NP dan polymerase PB1, PB2, dan PA), yang berfungsi sebagai satu unit, dapat melemahkan dan meningkatkan secara efektif virulensi virus pada ayam [55, 116, 144, 154, 155].
Penentu molekuler pathogenesis virus AI pada itik masih belum dapat dimengerti sepenuhnya, dan masih belum jelas mengapa virus HPAI tidak menginduksi penyakit yang sama pada itik seperti yang terjadi pada ayam. Patogenisitas virus HPAI H5N1 keturunan Gs/GD bersifat unik bahwa ia dapat menyebabkan penyakit ringan dan berat pada itik. Untuk ayam, penelitian genetika terbalik dan studi reasortan virus telah membantu untuk mengidektifikasi faktor genetik yang merubah virus H5N1 non-virulen menjadi virus yang virulen. Meningkatnya virulensi virus HPAI HN51 pada itik tampaknya disebabkan sebab banyak gen (multigenetic), dan telah dihubungkan dengan perubahan pada gen HA, NS, NS, NP, PA, PB1, dan PB2 [51, 53, 61, 62, 88, 118, 122, 145]. Sebagai contoh, substitusi tertentu (Q/L pada posisi 9) dan delesi (pada posisi 2) di dalam situs pembelahan HA tampaknya penting dalam patogenisitas virus H5N1 pada itik [145], demikian juga delesi K pada posisi 2 [62]. Akan tetapi, clade HA virus tersebut tidak berkorelasi dengan virulensi yang dimunculkan virus-virus pada itik, karena pada hampir semua clade HA virus AI H5N1 dapat ditemukan perwakilan virus-virus yang virulen dan avirulen (Table 13. 2) [99, 153]. Mutasi pada gen-gen PA (T515A) dan PB1 (Y436H) menghapuskan patogenisitas virus yang virulen pada itik, akan tetapi perubahan pada HA tidak memberikan dampak [53]. Situs-situs lain pada gen PA, seperti PA 224P dan PA 383D, juga berhubungan dengan tingginya virulensi virus HPAI H5N1 pada itik [122], dan tiga perubahan asam amino pada PB1-F2 (T51M, V56A, dan E87G) menurunkan patogenisitas virus HPAI H5N1 [88]. Lebih-lebih lagi, gen yang sama juga berkontribusi kepada replikasi sistemik yang efisien pada virus H5N1 yang lainnya [118]. Banyak gen, meliputi PB2, PA, NP, HA, dan NS, telah ditunjukkan bertanggung jawab terhadap efisiensi replikasi dan virulensi penuh virus HPAI H5N1 pada anak itik domestik berumur 2 minggu [61]. Akan tetapi, pertukaran gen NS dari virus HPAI H5N1 atau patogenisitas yang berbeda tidak merubah virulensi virus [117]. Dalam sebuah penelitian dimana gen-gen PA dan HA dihubungkan dengan replikasi yang efisien virus HPAI H5N1 yang virulen pada itik dengan membandingkan respons imun hospes dengan virus rekombinan H5N1 yang berbeda, ditemukan bahwa meningkatnya virulensi berhubungan dengan respons imun bawaan yang kuat pada itik, terutama pada otak [51]. Kesimpulannya, peningkatakn virulensi yang teramati pada beberapa virus HPAI H5N1 keturunan Gs/GD tampaknya terjadi melalui banyak mekanisme berbeda yang melibatkan banyak gen yang berbeda pula.
Imunologi dan immunopatologi
Patogenisitas virus AI juga dipengaruhi oleh respons imun hospes terhadap virus, yang dapat merubah arah infeksi dan hasil akhir penyakit. Infeksi virus AI pada hospes rentan memicu serangkaian perlindungan tubuh hospes yang bertanggung jawab dalam pengendalian dan penghilangan virus, dan meliputi respons imun bawaan dan respons imun yang muncul kemudian. Review komprehensif tentang imunologi pada itik telah dipublikasikan [87, 119], meskipun peranan elemen respons imun hospes dalam pengendalian virus AI pada itik masih belum dimengerti sepenuhnya. Beberapa penelitian telah membahas tentang ekspresi gen imunitas bawaan pada sel asal itik yang terinfeksi virus AI [1, 9, 34, 37, 60, 70, 72, 82, 89, 124], dan yang lainnya telah mempelajari tentang ekpresi gen hospes pada itik yang terinfeksi virusAI [9, 21, 22, 33, 43, 90, 101, 117, 150]. Beberapa penelitian telah secara khusus membahas tentang imunitas humoral dan seluler terhadap virus AI pada itik, dengan sebagian besar informasi yang didapat dari penelitian tentang patogenesis dan vaksinasi saat meneliti tentang produksi antibodi melawan virus AI setelah vaksinasi ataupun uji tantang terhadap virus.
Studi komparatif mengindikasikan bahwa itik dan ayam merespons secara berbeda terhadap infeksi virus LPAI dan HPAI [33, 34, 92]. Saat virus masuk ke dalam tubuh hospes, sistem imun bawaan menjadi aktif, berakibat induksi sitokin pro-inflamasi. Aktivasi sistem imun bawaan hospes oleh virus dimediasi, selain berbagai faktor lain, oleh reseptor pengenal antigen (PRRs), termasuk reseptor mirip Toll (TLRs), dan reseptor gen-I yang diinduksi oleh asam retinoid (RIG-I) [30, 65]. Sel penyaji antigen yang memproduksi level interferon (IFN)-α yang tinggi dan IFN-β sebagai respons terhadap infeksi virus, karena aktivasi PRRs seperti TLR3, TLR7, RIG1, dan gen 5 yang berhubungan dengan differensiasi melanoma (MDA-5). Ayam, tidak seperti itik, tidak memiliki RIG-I, akan tetapi ayam mengekspresikan MDA-5, yang secara fungsional mengkompensasi tidak adanya RIG-I. RIG-I itik adalah elemen pengenalan sitosolik untuk mengenalii virus AI, sementara sel ayam mengenali virus AI melalui MDA-5 [30].
Selain perbedaan ekpresi PRRs antara itik dan ayam, respons sitokin dan IFN setelah aktivasi PRRs dapat berbeda, dan dapat memainkan peranan dalam hasil akhir infeksi virus AI. Penelitian ekspresi sitokin dan PRR mRNA proinflamasi dalam jaringan tubuh itik dan ayam setelah infeksi virus LPAI menemukan adanya perbedaan dalam korelasi antara MDA-5, TLR-7 dan IFN alfa antara ayam dan itik, yang dapat menentukan perbedaan antara dua spesies ini dalam regulasi jalur IFN alfa dalam infeksi AI [33]. Respons imunologis juga teramati pada paruparu, otak, dan limpa itik dan ayam setelah infeksi dengan virus HPAI [34]. Virus ini menyebabkan angka morbiditas dan mortalitas yang signifikan pada ayam, sementara pada itik infeksinya bersifat asimptomatik. Jumlah virus mRNA HPAI lebih tinggi dalam jaringan ayam jika dibandingkan dengan jaringan itik. Respons inflamasi sitokin sangat lambat dan respons imun selular yang tidak mencukupi tampaknya berkontribusi terhadap pathogenesis pada ayam, sementara itik menginisiasi respons sitokin yang cepat diikuti dengan aktivasi PRR utama dan respons seluler yang persisten [34]. Proses immunologi dimana infeksi HPAI dihilangkan dari organ itik merupakan proses yang kompleks, akan tetapi tampaknya tubuh itik dengan cepat menginisiasi respons IL-1β, Il-6, iNOS mRNA, bersama apoptosis yang diinduksi secara cepat yang dapat mencegah replikasi awal virus, sementara repons imun seluler kuat yang terjadi beberapa waktu setelah infeksi berjalan membantu menghilangkan infeksi [34, 71]. Level ekspresi bentuk nitric oxide synthase (iNOS) yang dapat diinduksi yang teramati dalam tubuh itik selama infeksi HPAI H5N1 juga mungkin memainkan peranan penting dalam respons inflamasi yang berkontribusi terhadap patologinya [19].
Respons pro-infalamasi yang meingkat pada ayam yang tampaknya menjadi faktor patogenis besar dalam infeksi virus HPAI H5N1 sebagian dimediasi oleh inhibisi STAT-3 [72]. Studi uji tantang terhadap virus HPAI H5N1 pada ayam dan itik menemukan bahwa ekspresi STAT-3 mengalami proses down-regulated (proses dimana sel mengurangi komponen selulernya, seperti RNA ataupun protein sebagai respons terhadap stimulus eksternal) atau tidak terpengaruh pada itik secara in vitro dan in vivo mengikuti infeksi virus H5N1. Pada penelitian yang lain, virus H5N1 menyebabkan infeksi fatal pada ayam, disertai juga dengan jumlah virus yang banyak dalam tubuh, dan peningkatan produksi molekul pro-inflamasi, saat dibandingkan dengan itik [20]. Sitokin, termasuk IL-6 dan protein fase akut serum amyloid A (SAA), dengan cepat terinduksi dalam waktu 24 jam pasca infeksi H5N1 pada ayam. Sebaliknya, induksi sitokin-sitokin ini rendah pada itik, dan hanya terjadi beberapa waktu setelah infeksi telah berjalan. Observasi ini mendukung pandangan bahwa hipersitokinemua dapat berkontribusi terhadap pathogenesis pada ayam, sementara respons sitokin yang rendah pada itik mungkin merupakan faktor yang berkontribusi terhadap resistensi terhadap penyakit dan berkurangnya kematian. Ayam tidak mampu untuk mengatasi replikasi virus yang intens dan influx sitokin yang menyertai virus HPAI H5N1. Sebaliknya, itik bertahan hidup dan respons sitokin dalam tubuhnya relatif rendah, setara dengan ayam yang terinfeksi virus LPAI [20].
Penelitian lainnya telah membandingkan respons imun hospes itik yang diinfeksi dengan virus HPAI H5N1 dengan pathogenesis berbeda [101]. Entok mati lebih cepat dibandingkan dengan itik Peking dan mengalami gejala syaraf yang lebih berat. Akan tetapi itik Peking memiliki suhu tubuh yang lebih tinggi secara signifikasn dan memiliki level nitrit oksida yang lebih tinggi di dalam darahnya pada 2 hari pasca inokulasi dibandingkan dengan Entok. Hal ini mengindikasikan kemungkinan perbedaan respons imun bawaan masing-masing [21, 22]. Perbandingan ekspresi gen terkait imunitas bawaan dalam limpa itik yang tidak divaksin menunjukkan perbedaan, termasuk sedikit meningkatnya level ekspresi RIG-I pada itik Peking dan IL-6 pada Entok [21]. Pada penelitian lainnya telah ditemukan bahwa level ekspresi IL-6 dan IL-8 dalam otak itik setelah terinfeksi virus H5N1 yang lebih virulen lebih tinggi daripada itik yang terinfeksi dengan virus H5N1 yang kurang virulen [159].
Dalam rangka mencirikan respons imun itik terhadap virus LPAI dan HPAI, gen imun bawaan yang diekspresikan pada awal infeksi telah diidentifikasi [150]. Major histocompatibility complex class I (MHC I), interferon yang diiduksi protein dengan tetratricopeptide repeats 5 (IFIT5), dan 2’,5’-oligoadenylate synthetase-like gene (OASL) semuanya meninglat 1000 kali lipat dalam jumlah transkripsi yang relatif banyak pada paru-paru itik yang terinfeksi virus HPAI H5N1. Gen-gen ini kurang terinduksi pada paru-paru maupun usus pada infeksi virus LPAI. Ekspresi gen-gen ini setelah infeksi mengindikasikan bahwa itik menginisiasi respons langsung dan kuat terhadap strain influenza yang berpotensi letal, dan memberikan respons minimal terhadai strain berpatogenitas rendah [150]. Beberapa jalur kekebalan ditunjukkan teraktivasi sebagai respons terhadap infeksi virus LPAI pada itik. Itik menimbulkan respons imun bawaan yang unik terhadap isolat virus LPAI H7 yang berasal dari spesies-spesies berbeda. Akan tetapi, 12 gen yang telah teridentifikasi bersama jalur sinyal sel nya (RIG-I, nucleotide oligomerization domain-NOD, TLR) diekspresikan secara berbeda tanpa memperhatikan asal isolat, mengindikasikan bahwa kumpulan gen inti ini bersifat penting untuk respons imun itik terhadap virus AI [90]. Gen yang merespons terhadap virus AI juga telah diidentifikasi menggunakan transcriptome (jumlah total RNA messenger yang diekspresikan dari gen sebuah organisme) dari paru-paru dari itik kontrol dan itik yang diifeksikan baik dengan virus HPAI H5N1 maupun virus LPAI. Mekanisme pertahanan tubuh itik telah dioptimalisasi melalui diversifikasi β-defensin dan butyrophilin-like yang terus secara regular dilakukannya [52].
Hanya terdapat sedikit informasi tentang respons imun perolehan terhadap infeksi virus AH (seluler dan humoral) pada itik. Respons sel-T lebih kuat pada itik dibandingkan dengan ayam setelah infeksi virus LPAI H9N2, dan kinetic level transkiripsi interleukin dan interferons yang berbeda juga telah ditemukan, yaitu itik menunjukkan respons imun selular yang lebih aktif dan lebih kuat dibandingkan ayam [52]. Perbedaan respons imun humoral pada itik dan ayam terhadap infeksi AI juga telah dilaporkan [28]. Mengikuti re-infeksi terhadap virus LPAI homolog, itik hanya sebagian saja terindungi terhadap pendedahan virus dalam usus bagian bawah yang setara dengan respons antibodi sedang, sementara ayam terproteksi secara penuh melawan pendedahan virus dalam saluran pernafasn atas dan mengembangkan respons antibodi yang lebih kuat. Sebaliknya, ireonfeksi heterolog tidak diikuti dengan berkurangnya ekskresi virus dalam saluran pernafasan atas ayam, sedangkan itik masih sebagian terlindungi dari ekskresi virus dari pencernaan, dengan tidak ada korelasi dengan respons antibodi [28]. Immunoglobulin itik telah menunjukkan memiliki versi IgY yang lebih kecil, tidak memiliki bagian Fc, yang akan mempengaruhi fungsi immunoglobulin seperti fiksasi komplemen, opsonisasi, dan penghilangan virus melalui makrofagi yang dimediasi Fc [87, 119]. Masih belum jelas bagaimana tepatnya hal ini mempengaruhi respons imun humoral terhadap infeksi virus AI.
Influenza A pada itik domestik
Avian Influenza berpatogenitas rendah (LPAI)
Itik yang telah diinfeksi secara eksperimental dengan virus LPAI dari subtipe berbeda jarang menunjukkan gejala klinis [5-7, 28, 32, 35, 39, 44, 45, 64, 92, 95, 96, 100, 110, 111, 125, 160, 164]. Saat terdapat gejala klinis, yang ditemukan terdiri dari gejala pernafasan ringan [95] atau menurunnya berat badan [38, 39]. Jumlah itik yang mendedahkan virus, rute pendedahan virus (orofaring vs kloaka), dan jumlah virus yang didedahkan bervariasi tergantung strain dan asal virus (virus asal unggas gallinaseus vs asal burung liar). Dalam kondisi di lapangan, infeksi virus LPAI sering terjadi bersamaan dengan infeksi bakteri, dan biasanya menyebabkan gejala klinis yang lebih besart, terutama lesi berupa airsacculitism pneumonia, dan sinusitis [7, 142].
Trakeitis, laryngitis, dan bronchitis adalah lesi mikroskopis paling umum yang teramati pada itik yang diinfeksi secara eksperientla dengan virus LPAI [45, 92]. Lesi pada trakea dan bronkus mulai dari ringan sampai berat, dan terdiri dari kongesti dan edema, pengelupasan sel epitelm dan peningkatan jumlah mucin dalam lumen trakea. Juga umum ditemukan terjadinya desiliasi, hyperplasia, dan metaplasia epitelium, degenerasi epitel, dan inflitrasi limfoplasmasitik. Jika terdapat lesi pada paru-paru, maka dicirikan oleh pneumonia limfositik, histiositik, dan heterofilik [32, 39, 92]. Tidak ada lesi yang dihubungkan dengan infeksi apda saluran pencernaan dan bursa kloaka pada itik yang terinfeksi LPAI, meskipun terdapat relatif banyak sel yang terinfeksi, terutama pada vili epitel usus. Tidak ada lesi histopatologis yang dilaporkan pada jaringan lainnya [32]. Sel yang positif antigen terbatas pada trakea, paru-paru, kantong udara, saluran pencernaan dan bursa kloaka pada unggas terinfekso [32, 39, 45, 110, 111, 121].
Pada itik yang diinokulasi melalui rute intranasalm virus dapat terdeteksi pada swab orofaring (OP) dan swab kloaka dari 1 hari pasca inokulasi (DPI). Titer virus mencapai puncak pada hari ke 2 – 3 DPI, dan merendah di hari ke-10 DPI, meskipun virus masuk dapat terdeteksi pada beberapa itik sampai hari ke-14 DPI [38]. Jumlah virus LPAI yang lebih tinggi biasanya terdeteksi pada swab kloaka dibandingkan swab OP [15, 38, 39, 44, 45, 126, 127]. Virus LPAI telah diisolasi dari trakea dan usus, akan tetapi tidak diisolasi dari otak, ginjal, hati maupun limpa [164].
Avian Influenza berpatogenitas tinggi (HPAI)
Angka kematian yang disebabkan oleh HPAI pada itik domestik telah dilaporkan walaupun jarang sebelum terjadinya wabah HPAI di Asia. Kematian pada itik terjadi sebagai akibat infeksi eksperimental dengan virus HPAI H7N1 [5], dan gejala neurologis dan kematian dilaporkan pada Entok setelah terinfeksi virus HPAI H7N1 di Italia [24]. Pada sebagian besar studi eksperimental, itik yang telah diinokulasi virus HPAI melalui intranasal tidak menunjukkan gejala klinis [6, 120, 160, 164, 165]. Akan tetapi, virus telah diisolasi dari swab trakea dan kloaka [160], dan telah didapatkan dari trakea, perut, hati, jantung, otak dan limpa [164]. Untuk lesi mikroskopis pada jaringan, pneumonia ringan yang dicirikan dengan inflitrasi limfosit dan makrofag telah dilaporkan, begitu juga pada kantong udara disertai edema dan inflitrasi seluler serupa. Ditemukan pewarnaan antigen terus menerus pada sel epitel yang membatasi saluran udara, akan tetapi tidak ada pewarnaan ditemukan pada paru-paru [32].
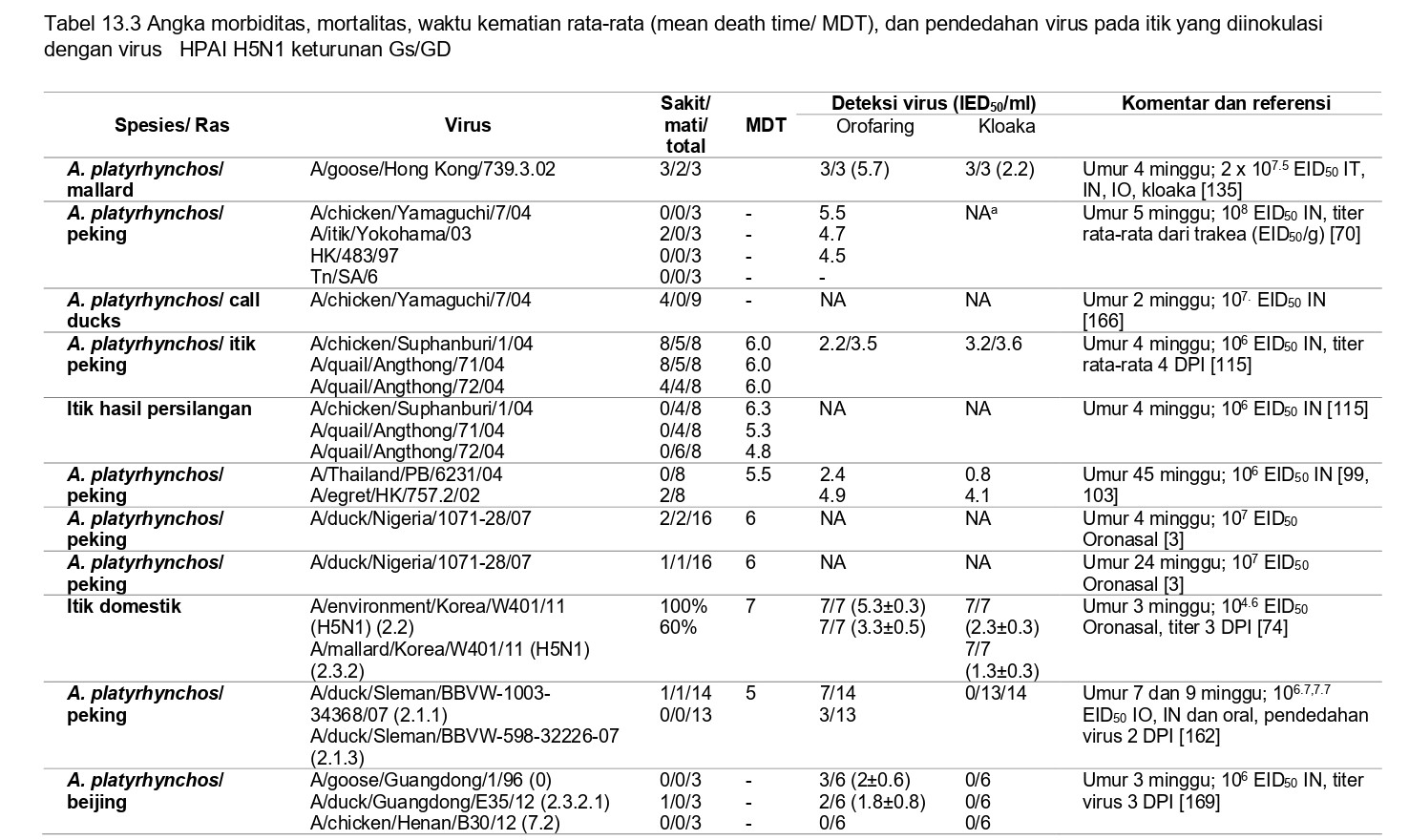
Patobiologi virus HPAI H5N1 dari jalur keturunan Gs/GD
Virus HPAI H5N1 keturunan Gs/GD telah mengembangkan kapasitas unik diantara virus HPAI lain untuk menginfeksi dan menyebabkan penyakit pada itik domestik dan burung liarm memproduksi sindrom gejala yang bervariasi mulai dari infeksi saluran pernafasan dan pencernaan asimptomatik, penyakit sistemik (terbatas hanya pada beberapa organ penting, biasanya otak, jantung, kelenjar adrenal, dan pakreas), dan infeksi sistemik berat dan kematian (seperti yang terlihat pada unggas gallinaseus) [104]. Virus HPAI H51N terus berevolusim dan strain antigenik dan genetik berbeda telah muncul, banyak diantaranya menunjukkan fitur patobiologi yang sangat berbeda dan memingkatnya virulensi untuk itik (Tabel 13.2 dan 13.3). Isolat awal asal Hong Kong (1997-2000) bereplikasi hanya pada saluran respirisasi itik domestik, dan menyebabkan lesi respirasi ringan tanpa adanya sakit ataupun kematian [106]. Serupa dengan itu, inokulasi intranasal itik domestik dengan strai HPAI H5N1 yang diisolasi dari itik di China (1999-2000) menyebabkan infeksi saluran respirasi dan pencernaan, akan tetapi tidak ada sakit maupun kematian [29]. Akan tetapi pada tahun 2001, virus HPAI H5N1 yang diisolasi dari daging itik beku yang telah diimpor dari China ke Korea Selatan, bereplikasi dan menyebar secara sistemik pada itik, dan telah diisolasi dan terlihat pada otot, jantung dan otak, akan tetapi tidak menyebabkan gejala klinis ataupun kematian [147]. Strain yang diisolasi dari burung air dalam penangkaran di Hong Kong selama tahun 2002 menyebabkan kematian tinggi pada itik domestik muda yang diinokulasi virus secara eksperimental, menunjukkan infeksi sistemik dan titer virus yang tinggi dalam saluran respirasi, jantung dan otak, sedangkan strain lain dari Asia Tenggara menyebabkan kematian yang rendak dengan lesi neurologis dan memproduksi gejala sakit [54, 78, 103, 135, 136]. Itik domestik yang diinokulasi secara eksperimental dengan tiga isolat virus HPAI H5N1 dari Thailand yang diisolasi tahun 2004 menginduksi 50-75% mortalitas, disertai gejala neurologik yang terobsarvasi pada hampir semua itik domestik, akan tetapi penyakit yang tidak begitu parah teramati pada itik hasil persilangan [115]. Lesi pada bulu telah dilaporkan pada itik domestik yang terinfeksi dengan virus HPAI H5N1 [166]. Banyak virus HPAI H5N1 lainnya yang diisolasi di negara-negara berbeda telah menunjukkan peningkatan virulensi pada itik, akan tetapi banyak diantaranya yang masih memiliki virulensi rendah, tidak memproduksi penyakit klinis pada itik (Tabel 13.2 dan 13.3).
Selain strain virus, kerentanan itik domestik terhadap infeksi HPAI H5N1 dan kemunculan gejala klinis dapat bervariasi tergantung faktor lainnya, meliputi umur dan spesies itik itik, serta manajemen pemeliharaan [101, 103, 123]. Meskipun beberapa virus H5N1 dapat menyebabkan penyakit berat dan kematian serupa dengan yang teamati pada infeksi pada ayam, mekanisme patofisiologinya berbedam dengan virus terutama menyebabkan kerusakan vaskuler berat pada ayam, yang menyebabkan edema polmuner berat, kongesti, hemoragi, dan mikrotrombosis dalam kapiler [105], sementara pada itik domestik virus bereplikasi dan menyebabkan kerusakan pada banyak organ dan jaringan, meliouti saluran respirasi, pankreas, sistem syaraf pusat, kelenjar adrenal, dan miokardium [98, 142]. Patogenitas virus H5N1 pada itik berhubungan langsung dengan efisiensi replikasi virus [51, 103, 153]. Itik yang diifeksi dengan virus HPAI H5N1 yang lebih virulen menunjukkan jumlah virus yang lebih tinggi dalam otak, yang menyebabkan gejala neurologis berat, meliputi goyang kepala, ataksia, tremor dan torticolis yang diikuti dengan kematian. Diseminasi virus menuju otak menyebabkan disfungsi neurologik mungkin menjadi penyebab virulensi virus H5N1 yang tinggi pada itik [12, 54, 61, 68], akan tetapi lesi pada organ penting lainnya, termasuk jantung, dapat menyebabkan kegagalan banyak organ dan kematian [99]. Akan tetapi perbedaan hanya pada replikasi virus saja mungkin tidak cukup dalam perbedaan patogenitas yang terlihat pada virus HPAI H5N1, dan ekspresi gen imunitas bawaan pada hospes mungkin juga memiliki peranan dalam hal itu [101].
Terus berlangsungnya sirkulasi virus HPAI H5N1 di negara dimana virus ini endemik telah membawa perubahan pada virus HPAI H5N1 menjadi virus yang lebih patogentik. Sebagai contoh, di Mesir virus HPAI H5N1 clade 2.2 telah berevolusi sedemikian rupa sehingga beberapa diantaranya menjadi virulen pada itik [153]. Hal ini juga telah teramati pada virus yang berasal dari Vietnam [27, 107], akan tetapi tidak dengan virus-virus HA clade 2.1 yang bersirkulasi di Indonesia dalam waktu yang lama, yang tetap bervirulensi rendah untuk itik [162].
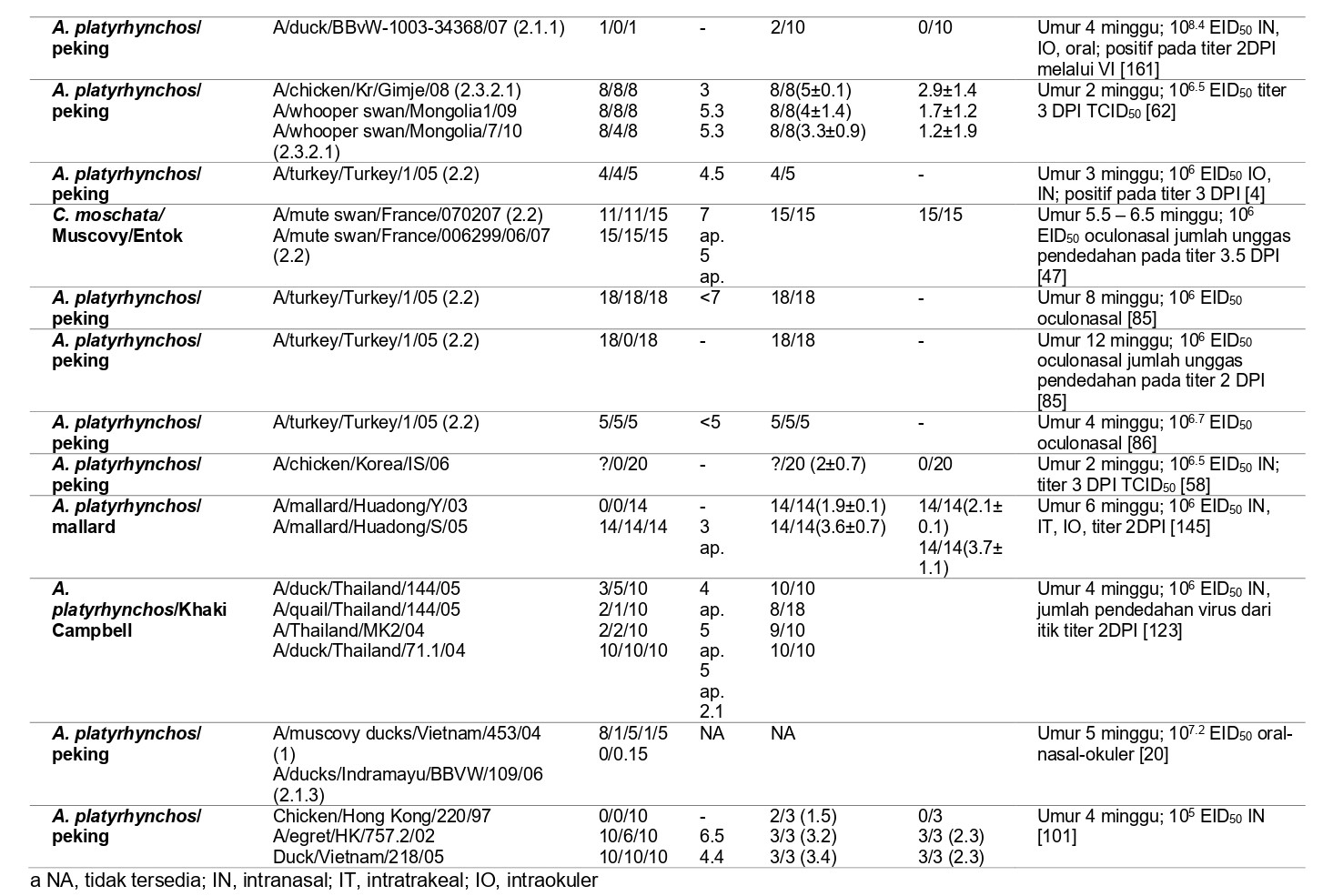
Sebuah studi perbandingan yang telah meneliti tentang pathogenesis virus HPAI H5N1 pada itik domestik dapat ditemukan pada Table 13.1 dan 13.3. Tabel 13.2 membandingkan patogenisitas virus HPAI H5N1 pada anak itik peking berumur 2 minggu yang diberi perlakukan dan kondisi percobaan yang sama. Tabel 13.3 membandingkan penelitian yang telah dilakukan oleh beberapa kelompok peneliti. Uji tantang terhadap virus ini maupun virus H5N1 lainnya juga telah dilakukan pada penelitian tentang vaksinasi [10, 13, 21, 22, 31, 41, 68, 83, 91, 108, 112, 114, 131, 132, 146, 148, 149, 158, 168], yang telah dibahas oleh Pantin-Jackwood dan Suarez [102].
Gejala klinis dan lesi-lesi makroskopis
Gejala klinis penyakit dan lesi-lesi yang berhubungan bervariasi tergantung virulensi strain virus HPAI H5N1. Pada virus yang kurang virulen, gejala klinis bersifat ringan atau bahkan tidak ada. Untuk virus yang lebih virulen, gejala klinis yang umumnya teramati meliputi gelisah, anoreksia, diare berair kehijauan, konjungtivitis, kornea menjadi semakin tebal/berwana putih, penurunan berat badan, meningkatnya suhu badan dan gejala neurologis (tergantung tremor seluruh tubuh, tubuh bergetar tak terkontrol, kehilangan keseimbangan, kepala miring/terpuntir, kejang, hilangnya penghilahatan, dan paralisis) (Gambar 13.1-13.3) [21, 22, 85, 86, 97, 103, 145, 153, 167]. Lesi makroskopis pada itik yang terpaparah penyakit parah diantaranya dehidrasi, usus kosong, splenomegaly, atropi timus, jantung yang membesar dan lembek dengan meningkatnya cairan pericardial, nekrosis pankreas, airsacculitis, dan otak yang melembek dan mengalami kongesti. Meningkatnya produksi telur telah dilaporkan pada itik domestik komersial [113].

Gambar 13.1 Anak Itik Peking berumur dua minggu menunjukkan gejala neurologis berat pada hari ke-3 setelah inokulasi IN (intranasal) dengan virus HPAI H5N1 A/egret/HK/757.2/02. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].

Gambar 13.2 Anak Itik Peking berumur dua minggu menunjukkan gejala neurologis berat pada hari ke-3 setelah inokulasi IN dengan virus HPAI H5N1 A/egret/HK/757.2/02. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].

Gambar 13.3 Anak Itik Peking berumur dua minggu menunjukkan feses dengan kotoran berwarna empedu (bile-stained) pada hari ke-3 setelah inokulasi IN dengan virus HPAI H5N1 A/egret/HK/757.2/02. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
Lesi-lesi mikroskopis
Lesi mikroskopis yang pada umumnya terobservasi pada itik yang terinfeksi dengan virus HPAI H5N1 meliputi [58, 85, 86, 97, 101, 123, 153, 162, 163]:
- Inflamasi sel submucosa mononuclear terlokasisasi baik ringan maupun berat pada saluran pernafasan, termasuk turbinate, sinus infraorbital, trakea, bronkus, kantong udara, dan paru
- Foci-foci malacia yang tersebar secara acak dengan gliosis, perivascular cuffs limpoplasmasitik ringan, dan edema perivascular ringan pada otak
- Pembengkakan dan nekrosis sel multifokal berat pada epitel acinar pankreas
- Area-area yang mengalami degenerasi vakuoler multifokal atau mengumpul bersama sampai nekrosis sel adrenal kortikotropin dan sel epitel kelenjar Harderian
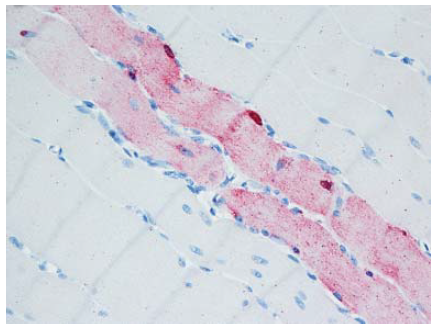
- Degenerasi sampai nekrosis serabut otot/myofiber individual pada otot skeletal dan jantung
- Proventrikulitis moderat sampai berat dengan infiltrasi limfoid diffuse
- Berkurangnya limfoid moderat sampai berat pada bursa kloaka dan timus
- Perubahan inflamasi ringan pada lamina propria mukosa usus
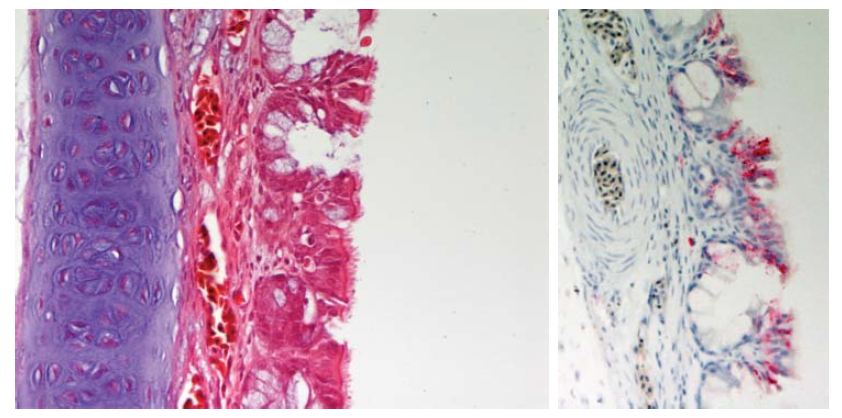
Gambar 13.4 Rhinitis nekrotik moderat, dengan kongesti submokosa dan edema, dan hyperplasia glandula pada epitel hidung dari anak itik berumur 2 minggu yang mati 3 hari setelah diinokulasi dengan virus HPAI H5N1 A/crow/Thailand/04. Pewarnaan HE. Inset. Demonstrasi antigen viral dalam sel epitel (ditunjukkan dengan warna merah). Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
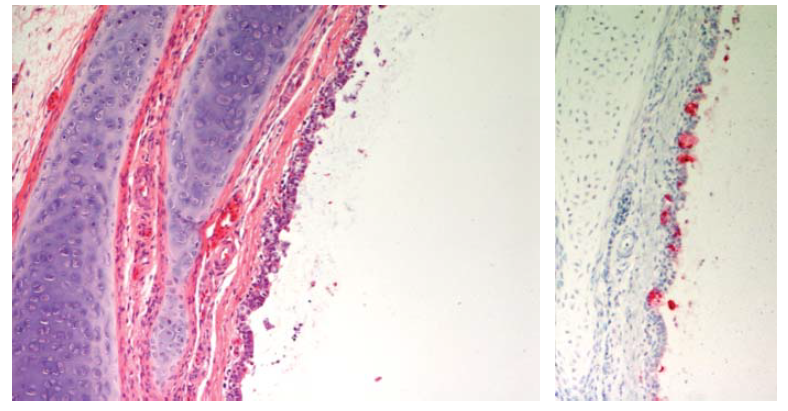
Gambar 13.5 Degenerasi dan nekrosis epitel trakea dengan eksudat mukoseluler yang mengandung sel epitel yang terkelupas pada trakea dari anak itik berumur 2 minggu yang ditemukan mati 4 hari setelah diinokulasi dengan virus HPAI H5N1 A/crow/Thailand/04. Inset. Pewarnaan antigen virus (warna merah) menunjukkan antigen virus terdapat pada sel epitel. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
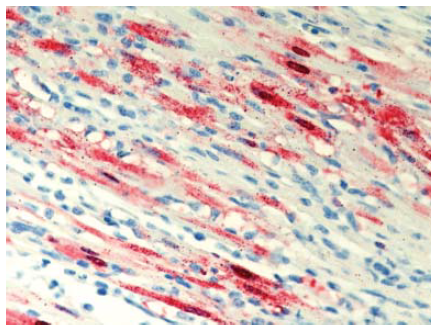
Gambar 13.6 Antigen virus yang sangat ekstensif/tersebar luas pada intranukleus dan intrasitoplasma (warna merah) pada sel-sel miosit yang berdegenerasi dan nekrotik pada jantung anak itik berumur 2 mingguyang diinokulasi dengan virus HPAI H5N1 A/Thailand PB/6231/04 yang ditemukan mati 5 hari setelah inokulasi. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
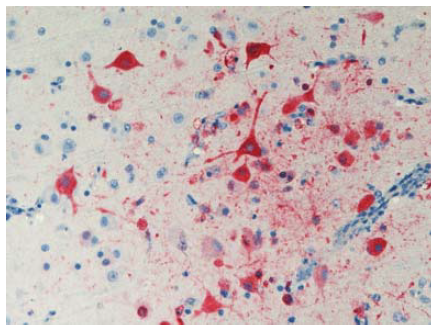
Gambar 13.7 Pewarnaan virus dengan nilai positif sangat kuat (warna merah) terdapat dalam sel neuron dalam cerebrum anak itik berumur 2 minggu yang diinokulasi dengan virus HPAI H5N1 A/Vietnam/1203/04 yang ditemukan mati 4 hari setelah inokulasi. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
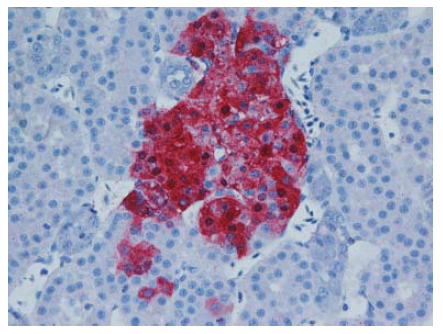
Gambar 13.8 Pewarnaan virus AI (warna merah) terdapat dalam sel kortikotropik dalam kelenjar adrenal anak itik berumur 2 minggu yang diinokulasi dengan virus HPAI H5N1 A/Vietnam/218/05, dua hari setelah inokulasi. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103].
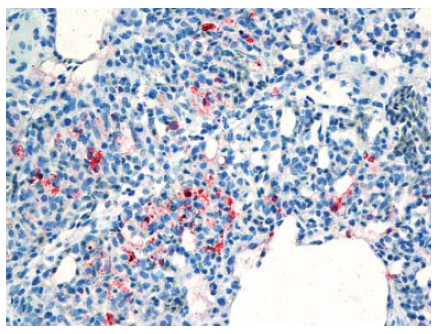
Gambar 13.9 Pewarnaan virus AI (warna merah) terdapat dalam sel miosit pada otot rangka anak itik berumur 2 minggu yang diinokulasi dengan virus HPAI H5N1 A/Crow/Thailand/04, yang dieuthanasi 4 hari setelah inokulasi. Foto diterbitkan dengan izin dari buku Avian Diseases. Hak cipta dipegang oleh American Association of Avian Pathologist, Athens, Georgia, USA. Sumber: USDA – M. Pantin-Jackwood [103]
Gambar 13.10 Pewarnaan virus AI (warna merah) terdapat dalam sel fagosit dan epitel kapiler udara pada paru-paru anak itik berumur 2 minggu yang diinokulasi dengan virus A/chicken/Egypt/08124S-NLQP/2008.
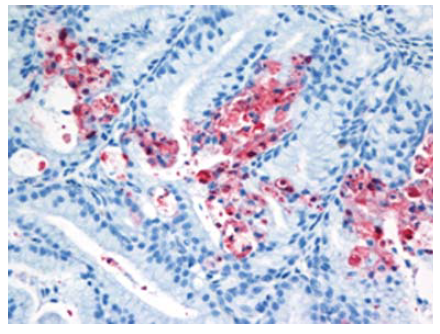
Gambar 13.11 Degenerasi vakuoler dan pewarnaan virus AI (warna merah) pada sel epitel kelenjar Harderian anak itik berumur 2 minggu yang diinokulasi dengan virus A/chicken/Egypt/08124S-NLQP/2008.
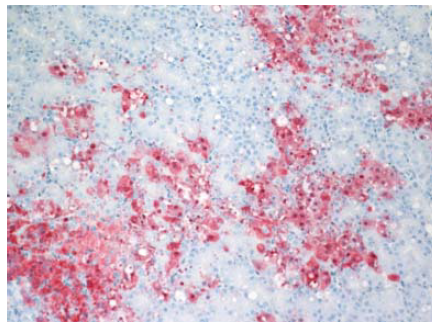
Gambar 13.12 Pembengkakan sel berat dan nekrosis sel secara multifokal pada sel epitel acinar pankreas dengan pewarnaan virus (warna merah) pada anak itik berumur 2 minggu yang diinokulasi dengan virus A/chicken/Egypt/08124S-NLQP/2008.
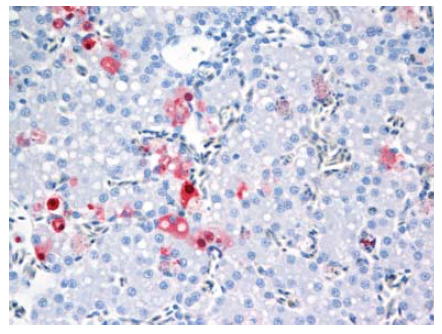
Gambar 13.13 Pewarnaan virus (warna merah) pada sel hepatosit dan sel Kupffer pada hati anak itik berumur 2 minggu yang diinokulasi dengan virus A/chicken/Egypt/08124S-NLQP/2008.
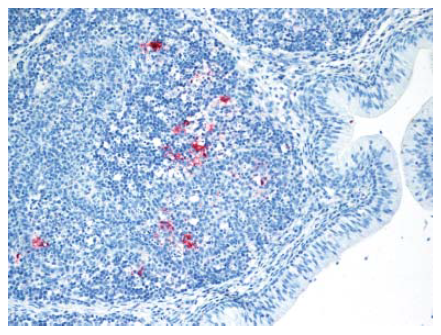
Gambar 13.14 Antigen virus AI (warna merah) pada sel fagosit lokal maupun sel fagosit yang melakukan inflitrasi jaringan dalam folikel bursa pada anak itik berumur 2 minggu yang diinokulasi dengan virus A/chicken/Egypt/08124S-NLQP/2008.
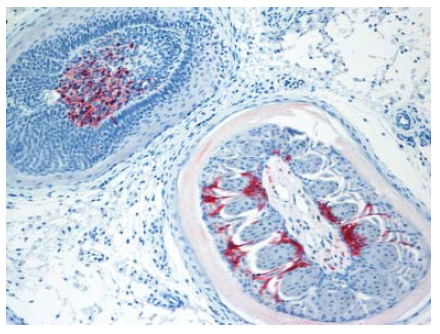
Gambar 13.15 Antigen virus AI (warna merah) pada sel epitelium dan pangkal bulu (pulp of feather) pada anak itik berumur 2 minggu yang diinokulasi dengan virus A/duck/Vietnamt/218/2005.
Pewarnaan antigen virus telah menemukan keberadaan virus HPAI H5H1 dalam berbagai jaringan di tubuh itik, mengindikasikan adanya infeksi sistemik (Gambar 13.4 sampai 13.15). antigen virus telah teramati dalam sel epitel sistem respirasi (Gambar 13.4 dan 13.5), dalam kantong udara dan sinus infraorbital, dengan foci kecil yang kadang muncul pada dinding kapiler paru-paru (Gambar 13.10), dalam epitelium acinar pankreas (Gambar 13.13), dalam neuron dan sel glia pada otak (Gambar 13.7), dalam epitel trakea, epitelium kapiler udara, bagian janutng (Gambar 13.6) dan serabut otot sekeletal (Gambar 13.9), epitel kelenjar Harderian (Gambar 13.11) dan epitel lidar. Dalam organ limfoid, antigen virus telah diidentifikasi dalam fagosit lokal maupun fagosit yang melakukan infiltrasi (Gambar 13.14), akan tetapi tidak dalam limfosit apoptotic. Antigen virus juga telah teridentifikasi dalam epitel gandula di proventrikulus, dalam hepatosit dan sel Kuffer di hati (Gambar 13.12), dalam otot polos di ventriculus, periosteum, sumsum tulang, dan endosteum tengkorak kepala, ganglia autonomic ganglia pada saluran pencernaan, sel endothelial kornea, dan sel epidermis bulu (Gambar 13.15) [58, 85, 86, 97, 101, 103, 153, 162, 163, 167]. Perbedaan penting dalam pathogenesis dibandingkan dengan yang terjadi pada ayam adalah kurangnya replikasi virus dalam endothelium dan tidak adanya kerusakan vaskuler yang berhubungan dengan itu [73, 101].
Pendedahan virus HPAI H5N1 terjadi utamanya melalui rute orofaring [48, 54, 58, 99, 104, 135, 136]. Jumlah virus yang didedahkan dan isolasi virus dari jaringan internal akan bervariasi tergantung virulensi virus HPAI H5N1.
Efek spesies terhadap patogenitas virus HPAI H5N1 pada itik
Baik pada itik domestik dan pada itik liar, spesies itik telah terbukti berpengaruh dalam menentukan hasil akhir infeksi virus HPAI H5N1, beberapa spesies itik tampaknya lebih mungkin menunjukkan gejala klinis dan angka kematian yang lebih tinggi [16, 21, 22, 42, 47, 66, 76, 86, 97, 109, 131, 132]. Perbandingan tiga penelitian yang menggunakan hewan model itik Peking, Entik, maupun itik Mallard, semuanya menggunakan dosis virus HPAI H5N1 dan metode inokulasi yang sama, mengungkapkan adanya perbedaan dalam gejala awal yang muncul dan waktu yang diperlukan untuk mencapai angka kematian 100% [47, 66, 86]. Itik Mallard dan Entok yang diinfeksi dengan virus HPAI H5N1 yang berbeda menunjukkan perbedaan yang jelas dalam respons terhadap infeksi, yaitu Entok menunjukkan angka kematian yang tinggi tidak perduli jenis virus apa yang diinokulasikan, berbanding terbalik dengan angka kematian pada itik Mallard yang berkisar antar 0 sampai 100%. Hal ini menunjukkan bawa Entok lebih rentan terhadap infeksi HPAI H5N1 [109]. Serupa dengan itu pula, ditemukan perbedaan petogenitas antara itik Peking dan Entok yang diinfeksi dengan virus HPAI H5N1 dengan clade yang sama, dengan hanya 20% itik Peking menunjukkan gejala klinis, dibandingkan dengan 100% pada Entok [131, 132].
Selain itu, terlihat perbedaan yang jelas pada respons terhadap vaksinasi antara Entok dan Itik Peking [21, 22]. Entok mengembangkan titer antibodi yang rendah dibandingkan itik Peking ketika divaksin dengan vaksin yang sama, dan mengalami angka kesakitan dan kematian yang lebih tinggi ketika ditantang dengan virus HPAI H5N1 [21]. Saat membandingkan respons terhadap infeksi pada itik yang tidak divaksin, perbedaan juga teramati, Entok yang terinfeksi menunjukkan waktu rata-rata lebih rendah menuju kematian dan menunjukkan gejala neurologis yang lebih berat dibandingkan itik Peking [22]. Akan tetapi, itik Peking menunjukkan suhu tubuh yang lebih tinggi dan kadar nitrat oksida yang di dalam darah yang lebih tinggi pada 2 DPI dibandingkan Entok, yang mengindikasikan kemungkinan perbedaan dalam respons imun bawaanya [21, 22].
Pada penelitian yang lain yang mengamati patogenitas virus HPAI H5N1 pada spesies dan ras itik domestik yang berbeda dengan memperhatikan hasil akhir infeksi, terlihat bahwa patogenitas virus HPAI H5N1 bervariasi antara dua spesies itik domestik yang umum diternakkan, yaitu Entok (Cairina moschata) menunjukkan penyakit yang lebih berat daripada berbagai ras itik domestik Anas platyrhynchos var. domestica, termasuk itik Peking, tipe Mallard, Black Runners, Rouen, dan Khaki Campbell [97]. Perbedaan yang teramati dalam patogenitas antara dua spesies tersebut dapat dijelaskan sebagian dengan perbedaan resopons imun antar keduanya. Itik Anas platyrhynchos var. domestica mungkin lebih efisien dalam mengendalikan replikasi virus dan penyebarannya setelah terinfeksi dibandingkan Entok, dan setelahnya mampu untuk menghilangkan virus dan bertahan hidup dari infeksi, atau setidaknya dapat bertahan hidup lebih lama setelah terinfeksi [22].
Efek umur terhadap patogenitas virus HPAI H5N1 pada itik
Umur itik juga mempengaruhi hasil akhir infeksi HPAI dan replikasi virus dalam jaringan [3, 85, 99, 101, 103]. Anak itik Peking umur 2 dan 5 minggu yang diifeksikan dengan tiga virus HPAI H5N1 berbeda, menunjukkan patologi terinduksi virus yang berbeda bervariasi mulai dari tidak ada gejala klinis sampai gejala penyakit berat dan kematian. Anak itik berumur 2 minggu yang diinfeksikan virus lebih virulen mengalami gejala yang lebih berat [101]. Virus-virus ini menginduksi suhu badan tinggi pada anak itik berumur 5 minggu dibandingkan dengan anak itik umur 2 minggu, yang mengindikasikan kemungkinan perbedaan respons imun bawaan. Level RNA IFN-α, RIG-I, IL-6, dan IL-2 meningkat di dalam limpa tidak perduli tipe virus dan umur itiknya. Akan tetapi perbedaan dalam level regulasi yang meningkat terobservasi antara anak itik umur 2 minggu dan anak itik umur 5 minggu [101].
Saat itik muda (tipe pedaging) dan itik dewasa (tipe bibit) diinfeksi secara alami dengan virus HPAI H5N1 dibandingkan, ditemukan bahwa itik tipe pedaging mengalami angka kematian yang lebih tinggi (30%) dan menunjukkan gejala syaraf yang lebih tinggi [133]. Sebaliknya, itik bibit yang terinfeksi HPAI menunjukkan gejala klinis minimal akan tetapi mengalami produksi telur yang menurun. Itik yang lebih muda menunjukkan titer virus yang tinggi pada organ, level pendedahan virus yang tinggi, dan angka kematian tinggi setelah diinfeksi virus HPAI secara eksperimental. Dibandingkan dengan itik bibit, itik tipe pedaging dibesarkan dalam peternakan yang berskala lebih kecil dengan fasilitas karantina dan pembibitan yang buruk. Karena itulah mungkin biosekuriti yang lebih baik pada peternakan itik tipe bibit telah dapat mengurangi dosis infeksi dan kemudian mengurangi keparahan penyakit. Karena itu manajemen mungkin merupakan faktor yang berkontribusi terhadap kerentanan terhadap HPAI pada itik [113].
Efek rute infeksi virus
Itik domestik mungkin terinfeksi virus HPAI H5N1 melalui rute berbeda. Berbanding terbalik dengan virus LPAI, virus HPAI lebih memilih untuk bereplikasi pada saluran respirasi itik, meskipun virus masih bereplikasi juga pada saluran pencernaan, dan virus diekskresikan melalui feses dan sekresi respirasi maupun oral [104]. Sebagian besar penelitian yang telah memeriksa patogenitas virus HPAI H5N1 pada itik telah menggunakan rute inokulasi intranasal (IN) untuk menginokulasi virus [17, 21, 70, 76, 99, 10, 106, 107, 109, 115, 166]. Akan tetapi, rute paparan yang lainnya juga telah digunakan untuk menginfeksi itik secara eskperimental. Dalam upaya untuk meniru paparan secara alami, itik diinfeksi dengan melakukan inokulasi virus secara bersamaan melalui kloaka, trakea, kerongkongan, nares dan mata [54, 135, 136]. Inokulasi yang bersamaan melalui rute IN dan introkular (IO), atau melalui IN, IO dan rute oral, juga telag digunakan untuk menginfeksi itik dengan virus HPAI H5N1 [12, 85, 86]. Infeksi dengan virus HPAI H51 menyebabkan morbiditas dan mortalitas pada itik domestik setelah ingesti daging yang terinfeksi dan inokulasi melalui rute intragastik dan IN [75]. Itik juga telah menjadi terinfeksi setelah ingesti bulu yang terkontaminasi virus HPAI H5N1 [166].
Itik Mallard telah terinfeksi dengan virus LPAI melalui berbagai rute inokulasi melalui pola pendedahan virus yang sangat serupa satu sama lain [44]. Entok dan Itik Peking juga telah teinfeksi dengan dua virus HPAI H5N1 yang memiliki virulensi berbeda saat diberikan melalui tiga rute – IN, intrakloka (IC), atau IO [97]. Tidak perduli lewat mana saja rute inokulasinya, hasil akhir infeksinya serupa untuk setiap spesies, dan tergantung kepada virus yang digunakan. Infeksi kedua jenis virus bersifat letal untuk Entok, akan tetapi hanya satu virus yang menyebabkan kematian tinggi pada itik Peking, yang sekali lagi menunjukkan adanya perbedaan yang jelas dalam patogenitas virus HPAI H5N1 untuk kedua spesies itik ini. Tidak perduli dimana tempat virus pertama kali bereplikasi, virus dengan cepat menjadi sistemik, dan memproduksi lesi dan perkembangan penyakit sampai titer virus yang tinggi pada jaringan [97].
Transmisi virus LPAI pada populasi unggas akuatik diperkirakan terjadi melalui rute tidak langsung fekal-oral yang melibatkan air yang terkontaminasi [50, 156, 157]. Dalam percobaan telah didemonstrasikan bahwa tidak seperti virus LPAI tipe liar, replikasi virus HPAI H5N1 terutama berhubungan dengan saluran pernafasan. Pada itik yang terinfeksi dengan virus H5N1, pendedahan virus melalui rute oral lebih jelas dibandingkan rute kloaka, dengan puncak pendedahan virus terjadi antara 2 sampai 4 hari setelah infeksi [99]. Itik yang terinfeksi dengan virus HPAI H5N1 non-letahal dapat mendedahkan virus infeksius sampai 10 hari setelah infeksi, dan pada beberapa kasus dapat mendedahkan virus lebih lama dari itu [161].
Itik terinfeksi dapat mengkontaminasi kolam, tanah lapang, ataupun lahan basah yang mereka diami dengan virus HPAI H5N1, yang dapat bertahan dalam lingkungan ini dengan ketahanan waktu yang berbeda-beda [18, 93, 123]. Kebanyakan itik domestik adalah tipe unggas air yang mencari makan di permukaan air (dabblers), cenderung untuk mencari makan di permukaan air (dengan menyusuri permukaan air untuk makan), akan tetapi mereka juga bisa mencari makan di wilayah berlumpur pada kali-kali yang dangkal [134]. Itik yang berenang di air juga sering melakukan “cloacal sipping” atau air yang disedot ke dalam kloaka, yang berpotensi meningkatkan persebaran infeksi jika air terkontaminasi oleh virus [134]. Nasib virus yang disebarkan melalui saluran pernafasan (respiratory borne) dari itik di air tidak diketahui. Karena itik adalah hewan yang suka berinteraksi dengan yang lain, perubahan menuju meningkatnya pengeluaran virus HPAI H5N1 melalui jalur pernafasan dapat berpotensi memfasilitasi penularan dari itik ke itik lain saat berkontak satu sama lain [134]. Akan tetapi, studi tingkat transmisi antar itik untuk virus yang dikeluarkan terutama melalui jalur kloaka atau orofaring masih belum dilakukan. Sangat penting untuk meningkatkan pemahaman tentang paparan virus akan memberikan pemahaman yang lebih baik terhadap pathogenesis virus influenza dan kemudian akan memungkinkan optimisasi pemeliharaan unggas untuk mencegah wabah penyakit.
Virus H5 baru hasil reassortan
Meskipun telah dilakukan upaya yang amat besar dalam mengendalikan persebaran virus HPAI H5N1, virus-virus ini terus bertahan hidup dan berevolusi di Asia, dan hal ini telah menimbulkan kemunculan banyak genotipe atau sub-keturunan baru. HPAI H5N1 yang telah menjadi endemik di Asia juga telah memunculkan generasi strain H5 reasortan dengan konstelasi gen baru. Baru-baru ini, subtipe baru virus HPAI H5 (H5N8, H5N5, dan H5N2) dengan backbone genetik virus clade 2.3.4.4 telah terdeteksi pada burung liar, itik, angsa, burung puyuh dan ayam [57, 84, 170]. Diantara virus reasortan, virus HPAI H5N8 telah diisolasi pada itik di China pada tahun 2010, akan tetapi tidak dilaporkan di negara lain sebelum bulan Januari 2014 [170], saat dua tipe virus HPAI H5N8 diisolasi pada peternakan unggas di Korea Selatan [80]. Gejala klinis HPAI, seperti penurunan produksi telur (60%) dan angka kematian yang sedikit meningkat, terdeteksi pada itik di peternakan pembibitan itik yang diikuti dengan laporan munculnya gejala klinis HPAI pada itik pedaging [80]. Pada November dan Desember 2014, virus HPAI dari subtipe H5 yang berasal dari China terdeteksi pada unggas dan burung liar di berbagai negara Asia dan Eropa, dan untuk pertama kalinya di Amerika Utara [56, 59, 79, 151]. Dari Desember 2012, virus H5N8, H5N2 dan H5N1 dideteksi pada burung liar, unggas belakang rumah, dan operasi petenakan unggas komersial di Amerika Utara wilayah barat. Virus HPAI H5N2 terus menyebar ke arah timur, memberikan dampak terhadap operasonal peternakan unggas komersial pada banyak negara bagian Amerika Serikat.
Studi eksperimental dengan virus H5N8 telah menunjukkan bahwa virus tersebut bereplikasi secara sistemik dan bersifat lethal pada ayam, akan tetapi tampaknya telah dilemahkan, meskipun telah ditransmisikan dengan efektif, pada itik. Gejala klinis ringan sampai berat teramati pada itik yang diinokulasi virus H5N8 secara intra nasal, dan angka mortalitas berkisar antara 0 – 20% [63, 69, 170]. Angka pendedahan dan replikasi virus dalam jaringan terbaca tinggi dan durasi pendedahan virus juga panjang [63]. Kemampuan virus H5N8 hasil reasortan baru ini untuk bereplikasi secara efisien dalam saluran pernafasan dan pencernaan tanpa membunuh itik hospes yang terinfeksi memungkinkan mereka untuk bersirkulasi dalam populasi itik, dan meningkatkan resiko transmisi dalam peternakan unggas.
Kesimpulan
Peningkatan patogenitas yang teramati pada itik yang terinfeksi dengan virus HPAI H5N1 tertentu dan virus H5 reasortan yang muncul baru-baru ini memiliki implikasi terhadap pengendalian flu burung. Itik yang terinfeksi dengan virus yang lebih virulen mendedahkan virus dalam jumlah lebih banyak, yang berkontribusi pada beredarnya virus di lingkungan dan meningkatkan resiko tranmisi kepada unggas yang rentan dan spesies mamalia, termasuk manusia. Di sisi lain, itik yang terinfeksi dengan virus yang tidak begitu virulen tidak menunjukkan gejala klinis, akan tetapi masih dapat menyebarkan virus. Penyebab meningkatnya patogenisitas virus HPAI H5N1 pada itik masih belum diketahui. Karena banyaknya perbedaan genetik yang terobservasi antar virus, sangat sulit untuk menentukan secara spesifik perubahan kausatif yang terjadi untuk perbedaan yang teramati dalam patogenisitas. Ditambah lagi, perbedaan dalam respons terhadap infeksi dan vaksinasi yang teramati antara dua spesies itik domestik harus diberikan perhatian saat mengembangkan program vaksinasi yang efektif untuk mengendalikan HPAI pada spesies itik yang berbeda.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

