Oleh David E. Swayne
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Perkenalan
Virus Avian Influenza adalah virus global yang tidak mengenal batas geografi, tidak memiliki agenda politis dan dapat menginfeksi unggas baik komersial maupun non-komersial, yang dipelihara indoor maupun outdoor, burung peliharaan, burung liar dalam penangkaran maupun yang hidup bebas, burung yang menjadi koleksi zoologi dan hutan lindung, dan beragam spesies unggas dan non-unggas lainnya. Virus AI telah diisolasi dari unggas domestic, burung dalam penangkaran, dan burung liar di Afrika, Asia, Australia, Eropa, Amerika Utara dan Selatan, dan baru-baru ini pada penguin Adele di Antartika [70], 94, 185]. Akan tetapi, laporan infeksi virus AI dan penyakit yang ditimbulkannya pada unggas domestic dan burung lainnya bervariasi antar negara, wilayah regional, dan benua. Frekuensi virus AI yang dilaporkan sangat dipengaruhi oleh ketersediaan pengujian yang akurat dan kapasitas diagnostic, kesempurnaan program surveilans, tipe unggas dan sector produksi yang disampel, waktu pengambilan sampel di tahun itu, lokasi geografis, kondisi iklim, dan faktor lain yang belum didefinisikan. Akan tetapi, kegagalan untuk melakukan surveilans yang tepat dan diagnosa pada unggas dan burung lain tidak boleh ditafsirkan sebagai bukti untuk mendukung pernyataan ketiadaan virus AI atau infeksi terkait dalam suatu negara.
Sebagai contoh, sebelum wabah HPAI H5N2 tahun 1983-1984, diagnostic dan surveilans di Amerika Serikat dilakukan utamanya pada unggas komersial dan kadang apda unggas belakang rumah (backyard poultry) menggunakan isolasi virus dalam telur ayam berembrio dan tes serologi dengan tes agar gel immunodiffusion (AGID) untuk penyakit yang dimasukkan untuk diagnose (sebagai contoh untuk surveilans pasif). Karena itulah selama tahun 1964 sampai 1985 isolat yang terdaftar (semuanya adalah virus LPAI, kecuali virus HPAI dari tahun 1983-1984) atau antibodi anti-influenza A utamanya berasal dari kalkun yang dipelihara dengan di umbar dan jumlahnya juga terbatas [193]. Akan tetapi, dengan identifikasi LPAI di dalam sistem pasar unggas hidup (live poultry market/LPM) di Amerika Serikat wilayah timur laut selama tahun 1986, dan laporan di tahun-tahun setelahnya dari spesies-spesies unggas non-tradisional, seperti burung-burung ratites (burung tak dapat terbang, seperti emu, burung unta, kasuari, rhea, dst) dan game birds (burung yang dipergunakan untuk olahraga berburu dan menembak, seperti misalnya itik), dan eliminasi sistem umbaran untuk ternak kalkun, surveilans aktif rutin telah meningkat dan jumlah insolasi virus AI telah bertumbuh secara geometri, dengan unggas yang ada pada system LPM dan spesies unggas non-tradisional menjadi sumber utama virus LPAI [195]. Sistem LPM biasanya disuplai dari peternakan unggas kecil yang memelihara unggas yang tertentu dan bercampur, dan tidak dari system produksi unggas komersial yang terintegrasi, kecuali untuk ayam petelur afkir. Pergerakan personel dari LPM ke dan dari peternakan komersial untuk mengambil ayam afkiran telah menjadi titik transmisi utama penyebaran virus LPAI H7N2 dari LPM ke unggas komersial [211].
Surveilans serologi aktif (misalnya monitoring AI H5/H7) dilakukan setahun sekali kepada lebih dari 95% broiler, layer dan flok breeder kalkun di Amerika Serikat melalui rencana perbaikan unggas nasional (National Poultry Improvement Plan/ NPIP) (A. Rhorer, komunikasi personal, 2 Maret 2007). Program ini bermula di tahun 1988, saat itu masih terbatas pada flok breeder broiler dan layer komersial, dengan sedikit perluasan pada tahun 2000 dengan memasukkan breeder kalkun komersial, dan perluasan besar pada bulan September 2006 dengan memasukkan ayam pedaging dan kalkun pada tempat penyembelihan, mewakili cakupan sebesar 90% unggas pedaging di Amerika Serikat melalui program monitoring NPIP. Sejak tahun 2007, jumlah tes surveilans tetap berada di level tinggi (Gambar 8.1). ditambah lagi, Majelis Ayam Nasional (National Chicken Council) memiliki program pengujian sebelum sembelih yang mencakup sebagian besar flok broiler komersial.
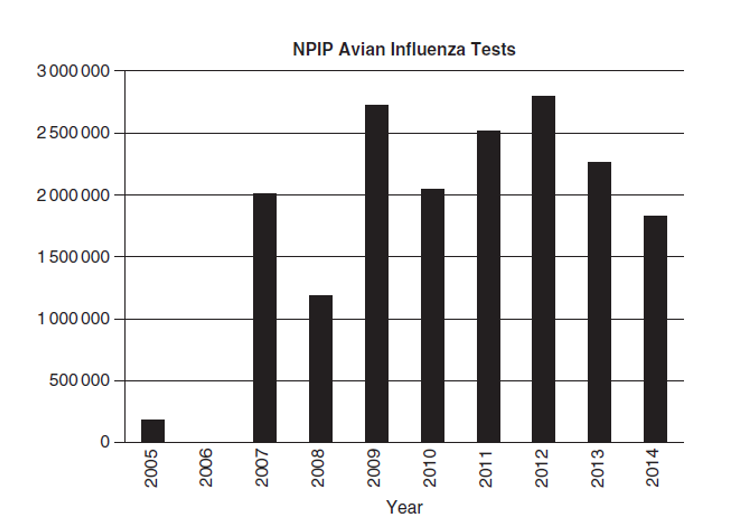
Gambar. 8.1 Jumlah pengujian surveilans avian influenza dalam Rencana Perbaikan Unggas Nasional di Amerika Serikat untuk tahun 2005 dan 2007-2014.
Sebuah contoh pengujian terbaru di Amerika Serikat adalah di tahun 2014, dimana sebanyak 1.397.400 tes serologi AGID telah dilakukan menggunakan referensi reagen dari Laboratorium Jasa Kesehatan Hewan Nasional (National Veterinary Services Laboratories). Pengujian ini menghasilkan 1578 serum positif, yang 97%-nya diambil dari kalkun untuk mendeteksi H1 atau H3 dengan menggunakan antibodi N1 atau N2, indikasi untuk vaksinasi melindungi terhadap virus influenza babi, dan 3% lainnya adalah antibody melawan H2 (NH: ayam, MN: kalkun), H4 (MN: kalkun), H5N2 (PA: kalkun komersial), H6 (PA: ayam; TX: campur), H6N8 (MN: kalkun), dan H& (NY: ayam peliharaan, NV: ayam padang rumput/Sage Grouse) [196]. Di dalam system LPM, sebanyak 658 sampel virologi yang diperiksa terhadap virus AI menghasilkan 11 virus LAPI [196]. Akan tetapi, hasil ini tidak mengindikasikan bahwa Amerika Serikat memiliki frekuensi virus LPAI yang lebih tinggi daripada negara lain, akan tetapi hanya pengujian sampelnya dalam jumlah besar yang berasl dari sector dengan resiko tinggi menghasilkan temuan virus AI dan atau antibodi anti-AI. Seiring meluasnya surveilans di negara-negara lain dan benua lainnya, dan seiring perkembangan diagnostic, sumber-sumber virus AI baru akan teridentifikasi.
Sejarah umum
Untuk mengerti tentang sifat avian influenza secara global, kita harus mengenali perubahan definisi infeksi avian influenza dan penyakit yang disebabkannya, berdasarkan perkembangan saintifik dalam bidang diagnostic dan peningkatan pengetahuan dan pemahaman tentang ekologi dan epidemiologinya selaman lebih dari 125 tahun ini. secara historis, lima kejadian/event besar utama telag mengubah definisi kita tentang avian influenza dan karena itu pula memiliki dampak terhadap frekuensi pelaporan avian influenza di seluruh dunia:
- Diagnosis awal sampar unggas pada unggas komersial didasarkan utamanya pada tanda-tanda klinis, lesi, dan studi hewan;
- Pengenalan virus LPAI dan infeksi yang ditimbulkannya pada unggas domestic berdasarkan pada serologi dan isolasi virus;
- Penemuan avian infuenza pada reservoir burung liar tanpa gejala (asimptomatik);
- Penemuan bahwa virus HPAI dapat berasal dari mutasi virus LPAI H5/H7;
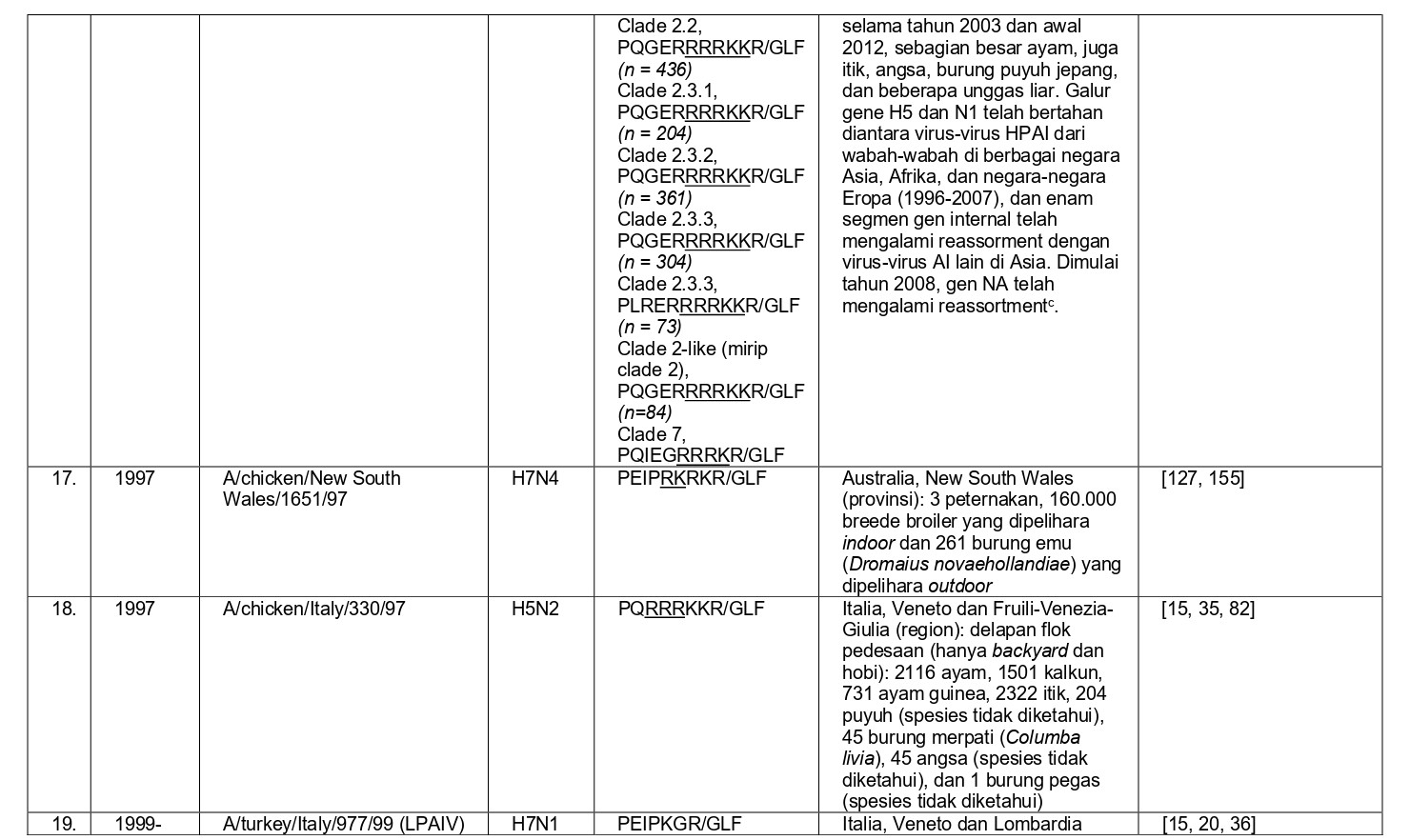
- Penyebaran virus HPAI dari garis keturunan H5N1 A/goose/Guangdong/1/1996 (Gs/GD) secara global yang tidak pernah diprediksi sebelumnya, termasuk diantaranya reassortment berbagai gen dan periode-periode episodic transmisi burung liar.
Sampar unggas pada unggas domestic
Dalam istilah historisnya, avian influenza hanya baru-baru ini saja dideskripsikan dalam literatur kesehatan unggas, dengan catatan historis melaporkan kasus pertama sebagai penyakit sistemik pada unggas yang sangat letal (sebagai contoh: HPAI) di Italia selama tahun 1878 [133]. Penyakit sistemik yang parah ini telah diberi nama ‘sampar unggas’ atau ‘hama unggas/fowl pest’, tetapi nama lain juga telah juga telah digunakan, seperti peste aviaire, Geflugelpest, typhus exudatious gallinarium, Brunswick bird plague, Brunswick disease, fowl disease, dan fowl atau bird grippe, diantara banyak sebutan lainnya [75, 163, 164]. Terminologi resmi yang dipergunakan sekarang yaitu ‘highly pathogenic avian influenza (HPAI)’, diadopsi pada tahun 1981 [17], dan ‘patogenitas tinggi/ high pathogenicity’ adalah varian gramatikal yang setara dengan istilah ‘sangat patogenik/ highly pathogenic’ (kedua istilah ini dapat digunakan secara bergantian) [185].
Dari tahun 1970an sampai awal tahun 1900an, sampar unggas menyebar dari Italia bagian Utara ke Eropa, dimulai dari laporan dari Austria, Belgia, Perancis, Jerman, Inggris, Hungaria, Belanda, Rumania, Rusia dan Swiss [46, 80, 89, 92, 163, 164]. Sampai pertengahan abad ke-20, sampar unggas telah terdiagnosa di Afrika Utara (Mesir), Timur Tengah, Asia (China dan Jepang), Amerika Selatan (Argentina dan Brazil), Amrika Utara (Amerika Serikat), dan sebagian besar Eropa. Sampar unggas telah endemik pada beberapa bagian Eropa dan Afrika pada tahun 1930-an [9]. Menariknya, pada banyak situasi sampar unggas menghilang pada saat Newcastle Disease dikenali sebagai penyakit unggas. Sebagai contoh, sampar unggas dilaporkan di Italia mulai dari awal 1930-an akan tetapi telah menghilang pada tahun 1937, saat epidemi Newcastle Disease dimulai [134]. Penemuan Newcastle Disease (yang juga dikenal sebagai “pseudofowl pest”), dan kesamaannya dengan sampar unggas dari segi lesi yang ditimbulkannya, presentasi gejala, morbiditas yang tinggi dan tingkat mortalitasnya, mengakibatkan adanya kebingungan diagnosis kasus-kasus lapangan dan virus penyebab. Pada beberapa kasus, istilah HPAI “fowl pest” digunakan secara bergantian bersama “Newcastle Disease”.
Telah pertama kali dipastikan bahwa sampar unggas disebabkan oleh virus yang dapat disaring/difilter pada tahun 1901, akan tetapi virus yang telah ditemukan ini belum diklasifikasikan sampai tahun 1955, saat virus ini ditentukan sebagai virus Influenza A [38, 141]. Wabah-wabah yang terjadi sebelum 1959 disebabkan oleh virus yang sekarang telah diklasifikasikan sebagai virus HPAI H7N1 dan H7N7 [49]. Akan tetapi pada saat itu virus-virus penyebab sampar unggas pada umumnya dianggap sama, karena perbedaan-perbedaan antigenic dan genetic antara “strain individu” belum diketahui (D. Alexander, komunikasi personal, 27 Februari, 2007). Sebagai hasilnya, virus-virus yang ditukarkan antar laboratorium bisa saja tidak mempertahankan nama aslinya, atau diganti namanya untuk keperluan pengiriman antar laboratorium, dan tidak dipertahankan sebagai kultur pasase original dari material asalnya. Pada saat ini, semua kesimpulan mengenai sumber dan tanggal terkait isolat-isolat sampar unggas secara historis harus diinterpretasikan dengan hati-hati. Sebagai contoh, Petek mengatakan bahwa virus FPV-(fowl plague virus)-Brescia telah diisolasi pada tahun 1935 dan telah disebut secara keliru sebagai Brescia/02, sedangkan seharusnya diperbaiki pelabelannya menjadi A/chicken/Brescia/35 (H7N1) [134]. Akan tetapi, terdapat referensi tentang FPV-Brescia yang berasal dari sebelum tahun 1935 [33], dan beberapa sampel yang diambil sebelum tahun 1935 mungkin saja telah dipertahankan dengan baik sebagai A/chicken/Brescia/02 [134] (D. Alexander, komunikasi personal, 27 Februari, 2007).
Kasus awal sampar unggas pada ayam dan unggas galinaseus lainnya telah didiagnosa utamanya berdasar pada adanya mortalitas tinggi yang mendadak, keberadaan lesi spesifik (misalnya jengger yang sianotik, hemorragi pada ventrikulus dan proventrikulus, dan petekie pada jantung), dan identifikasi virus yang dapat difiltrasi [75, 183]. Isolat-isolat virus itu bereaksi silang terhadap uji inhibisi hemagglutinin (HI) yang menggunakan antisera dari unggas yang sembuh. Hal ini melanjut pada sebuah kesimpulan bahwa hasil uji positif ‘H7’ pada HI mengindikasikan adanya virus sampar unggas (HPAI) atau adanya infeksi agen-agen serupa. Akan tetapi pada tahun 1959, 1961, dan 1966, penyakit klinis yang tidak dapat dibedakan dengan sampar unggas klasik (misalnya H7) telah diidentifikasi pada ayam, burung common tern, dan kalkun, tetapi virus-virus ini tidak dihambat oleh antisera yang didapat dari unggas yang sembuh dari wabah pada uji standar HI yang dilakukan (misalnya virus-virsnya bukan H7, tetapi H5). Karena itulah infeksi virus original penyebab sampar unggas pad aunggas dideteksi melalui keparahan gejala klinis dan dihubungkan secara serologis dengan dua subtipe, yaitu virus HPAI H5 dan H7.
Wabah-wabah virus HPAI awal (sampar unggas) ini telah dijelaskan secara detail pada Bab 7 dan 8 [75, 183] pada edisi pertama buku ini [188].
Pengakuan keberadaan LPAIV pada unggas domestic dan sistem buatan manusia
Bentuk klinis avian influenza ringan (contohnya pada kasus yang menimbulkan penyakit pernafasan dan penurunan produksi telur) pertama kali dikenali pada berbagai spesies unggas domestik pada tahun 1949, dengan laporan yang beberapa kali dilaporkan sampai pertengahan 1960an [46]. Bentuk-bentuk ini telah diberi nama avian influenza patogenik rendah, patogenik, patogenik ringan, dan tidak sangat pathogen. Pada tahun 2002, pada Simposium Internasional Avian Influenza ke-5, istilah ‘low pathogenicity (LP)’ diadopsi sebagai istilah resmi untuk menyebut avian influenza bervirulensi rendah (termasuk virus AI yang tidak memenuhi kriteria biologi dan molekuler untuk disebut sebagai HPAI) [56].
Virus LPAI yang pertama kali diketahui adalah strain “Dinter” atau “N”, diisolasi pada tahun 1949 dari ayam di Jerman (salah satunya A/Chicken/Germany/49 [H10N7]). Akan tetapi, virus ini belum diketahui sebagai LPAI sebelum tahun 1960 (untuk membaca review, lihat referensi [46]). Antara tahun 1953 dan 1963, virus LPAI diisolasi dari serangkaian kasus penyakit pernafasan pada itik domestik di Kanada, Cekoslovakia, Inggris dan Ukraina. Penelitian ini kemudian diikuti dengan pemberian deskripsi mengenai infeksi virus LPAI pada kalkun dari tahun 1963 sampai 1965 yang menjadi penyebab penyakit pernafasan dan penurunan produksi telur di Kanada dan Amerika Serikat. Akan tetapi, kasus-kasus tambahan virus LPAI tidak dideskripsikan lagi pada ayam sampai tahun 1966 di Italia, bersama kasus pertama pada burung pegar dan burung puyuh. Sepanjang pertengahan sampai akhirt ahun 1960-an, laporan-laporan penyakit pernafasan dan isolasi virus LPAI umum ditemukan pada anak kalkun dan anak itik domestik. Virus-virs LPAI awal ini terdiri dari beragam subtipe hemagglutinin (HA) dan neuraminidase (HA).
Pada awalnya, subtipe avian influenza H5 dan H7 hanya diasosiakan dengan virus-virus sampar unggas, tetapi pada tahun 1966 dan 1968, virus LPAI diisolasi dari kalkun yang mengalami mortalitas rendah atau syndrome penyakit yang belum pernah didefinisikan yang ditipekan sebagai subtipe H5, dan pada tahun 1971 virus LPAI yang disebut sebagai subtipe H7 diisolasi dari flok kalkun di Oregon yang mengalami penyakit respiratori ringan dengan diare [8, 25, 46, 158]. Sejak tahun 1971, banyak virus LPAI H5 dan H7 yang telah diisolasi dan dikarakterisasikan, yang akhirnya menghilangkan mitos bahwa subtipe H5 dan H7 itu selalu merupakan HPAI. Faktanya hanya sedikit saja dari virus H5 dan H7 yang sangat beragam yang bersifat sangat patogenik, sebagian besarnya adalah LPAI [8, 49, 65]. Lebih jauh lagi, perkembangan uji serologis AGID pada tahun 1970, dan pengadopsiannya sebagai pengujian internasional utama untuk mengindentifikasi flok ayam dan kalkun yang terinfeksi avian influenza telah memperluas cakupan identifikasi virus LPAI di tahun 1970an dan 1980an [23, 24].
Virus avian influenza dengan patogenitas rendah (low) dan patogenitas tinggi (high) pada unggas liar
Meskipun laporan-laporan awal tentang sampar unggas mencurigai bahwa ada keterlibatan burung liar dalam transmisi penyakit, bukti definitif pertama adanya infeksi virus AI pada burung liar adalah pada burung common tern yang mengalami mortalitas tinggi di Afrika Selatan selama tahun 1961 [26]. Pada akhir tahun 1960an, survei unggas air yang bermigrasi menunjukkan bukti serologis adanya infeksi virus AI [45]. Akan tetapi, isolat virus LPAI pertama belum diambil sampai tahun 1972, untuk itik yang bermigrasi melalui surveilans virus Newcastle Disease di California [156] dan dari pelagic seabird (shearwater) di Australia [43]. Sejak saat itu, banyak survey telah dilakukan, sebagian besarnya pada burung-burung di Amerika Utara, dan telah mendemonstrasikan adanya infeksi virus AI tanpa gejala (asimptomatik) pada unggas akuatik liar yang kelihatan sehat, utamanya pada Ordo Anseriformes dan Charadriiformes [65, 66, 79, 160-162]. Sejak laporan awal, survey-survei ekstensif telah dilakukan di Rusia, Israel, China, Eropa, dan negara-negara lain [83, 85, 122, 150]. Survei-survei ini telah menghasilkan puluhan ribu virus LPAI dari kesemua subtipe (16 HA dan 9 NA) dari unggas liar yang asimptomatik (Bab 7, tabel 7.2). Akan tetapi beberapa virus HPAI telah diisolasi dari unggas liar, yaitu: (i) selama epidemi dengan mortalitas tinggi pada burung common terns, A/tern/South Africa/61 (H5N3); (ii) isolasi tunggas A/finch/Germany/72 (H7N1), A/gull/Germany/79 (H7N7), dan A/peregrine falcon/UAE/2384/98 (H7N3); (iii) selama infeksi HPAI H5N1 yang baru-baru ini (ditambah reassortant H5N8 dan H5N2) panzootic di Asia, Eropa, Afrika, dan Amerika Utara, dengan banyak isolat yang berasal dari 50 lebih spesies burung liar; dan (iv) great-tailed grackle (Quiscalus mexicanus) dan barn swallow (Hirundo rustica) dengan H7N3 di Meksiko selama 2012 [10, 26, 39, 72, 84, 86, 110, 198]. Ekologi virus AI pada unggas liar telah dijabarkan di Bab 7 dalam buku ini, dan tidak akan didiskusikan lebih jauh di sini ataupun di Bab-Bab berikutnya. Unggas dari apesies gallinaseus, baik domestik maupun liar, bukanlah reservoir alami virus AI [127, 166].
Virus-virus avian influenza berpatogenitas tinggi yang berasal dari mutasi virus LPAI H5 dan H7
Virus HPAI tidak bersirkulasi pada reservoir primordial (contoh: burung air yang bermigrasi) atau pada unggas sebagai garis keturunan yang telah dibangun lama, akan tetapi kesemua virus HPAI telah timbul dari mutasi virus LPAI berdasarkan perubahan spesifik pada lokasi pembelahan proteolitik dari H5 dan H7 dimana saat virus LPAI ini dibiarkan untuk bersirkulasi tanpa diperiksa pada populasi unggas [116, 136]. Pada umumnya, virus LPAI H5 dan H7 hanya mempunyai dua asam amino dasar tidak berturutan pada ujung karboksi akhir dari HA1, sementara virus HPAI memiliki perubahan spesifik pada lokasi ini yang dapat meliputi substitusi asam amino non-dasar menjadi asam amino dasar, insersi beberapa asam aminos dasar dari kodon yang diduplikasi pada lokasi pembelahan HA, insersi pendek asam amino dasar dan non-dasar dari asal yang tidak diketahui, rekombinasi non-homolog dengan insersi yang memperpanjang lokasi pembelahan HA, tetapi mungkin mengandung atau tidak mengandung asam amino dasar tambahan, ada atau tidak adanya lokasi glikosilasi spesifik pada ujung terminal amino pada protein HA1 yang dapat melindungi lokasi pembelahan [34, 57, 68, 76, 126-128]. Informasi detail tentang dampak lokasi pembelahan proteolitik terhadap biologi seluler virus HPAI dan LPAI telah dibahas dalam Bab 1 buku ini.
Penyebaran virus dari garis keturunan virus H5 HPAI asal Guangdong
Wabah pertama dari virus HPAI H5N1 dari garis keturunan Gs/GD adalah pada angsa domestik di China selam tahun 1996, dan dengan cepat diikuti oleh wabah pada system LPM di Hong Kong pada awal tahun 1997 [151, 210]. Pada awalnya, virus-virus ini sangat lemah infeksinya pada unggas air domestic, dan tidak mampu menimbulkan penyakit [131, 132]. Akan tetapi, pada tahun 2002, virus HPAI H5N1 muncul dan menginfeksi dan menyebabkan mortalitas tinggi pada berbagai spesies itik yang dipelihara di dalam kandang [52]. Dari akhir tahun 2003 dan seterusnya, virus HPAI H5N1 menyebar ke negara-negara Asia lain yang bertetangga, menginfeksi terutama unggas dan juga menginfeksi burung-burung liar dan beberapa mamalia [153]. Beberapa gelombang HPAI H5 dari garis keturunan Gs/GD menginfeksi dan menyebar melalui burung-burung liar pada tahun 2005, 2010, dan 2014 [3]. Hal ini menyebabkan dispersi virus ini sampai ke Eropa dan Afrika pada tahun 2005-2006, re-infeksi di Jepang selama tahun 2010, dan menyebar kembali di Eropa, dan untuk pertama kalinya menyebar ke Amerika Utara pada tahun 2014 [3, 72].
Penyebaran virus HPAI H5 dari garis keturunan Gs/GD secara global dijelaskan secara detail pada Bab 9 pada buku ini, dan juga pada Bab 11 pada buku edisi sebelumnya.
Aspek Pengaturan
Sejak deskripsi pertama sampar unggas, berbagai pihak termasuk pemerintah dan badan lainnya telah mencoba melakukan eradikasi sebagai cara utama dalam menangani HPAI dan melindungi sumber pangan [197]. Pada awalnya, program eradikasi berfokus pada identifikasi virus HPAI menggunakan tes patogenitas in vivo pada ayam (contoh: patotipe) dan differensiasi virus-virus ini dari virus LPAI. Meskipun begitu, pada tahun 1994, kriteria spesifik molekuler dan in-vitro ditambahkan sebagai alternatif terhadap pengujian in-vivo dalam mendefinisikan HPAI (194). Saat ini, World Organization for Animal Health (Office International des Epizooties [OIE]), organisasi internegara, membuat standar sanitasi dan kesehatan hewan internasional, meliputi diantaranya avian influenza, dan kode-kode semacam itu digunakan untuk mengamankan perdagangan unggas dan produk unggas internasional. Dengan menggunakan Kode OIE dan standar-standar lainnya, avian influenza dapat dibagi kedalam tiga kategori:
- HPAI (sebelumnya disebut AI notifiable (wajib dilaporkan) yang bersifat highly pathogenic, HPNAI), yang meliputi semua HPAI H5 dan H7
- Semua LPAI H5 dan H7 (sebelumnya disebut AI notifiable (wajib dilaporkan) yang bersifat low pathogenic, LPNAI)
- Semua LPAI lain yang tidak wajib dilaporkan ke OIE (H1-4, H6 dan H8-16), akan tetapi bisa saja dilaporkan kepada otoritas negara bagian/provinsi [12, 117].
Akan tetapi, berdasarkan pada karakteristik patobiologisnya (misalnya: penyakit, lesi, dan sinyalemen), semua LPAU dapat dibedakan, kecuali beberapa virus LPAI H5 dan H7 telah menunjukkan kemampuan untuk berubah menjadi HPAI, yang merupakan alasan mengapa mereka dimasukkan kedalam daftar virus yang harus dikendalikan di level internasional. Definisi virus HPAI dan LPAI H5/H7 adalah sebagai berikut:
- Virus HPAI memiliki indeks patogenisitas intravena (IVPI) pada ayam berumur 6 minggu lebih dari 1,2, atau menyebabkan setidaknya mortalitas 75% pada ayam berumur 4 sampai 8 minggu yang diinfeksikan secara intravena. Virus-virus H5 dan H7 yang tidak memiliki IVPI yang lebih besar dari 1,2 atau menyebabkan mortalitas kurang dari 75% pada uji letalitas intravena harus dilakukan sekuensi untuk menentukan apakah terdapat asam amino beragam yang terdapat pada tempat pembelahan molekul hemagglutinin (HA0). Jika motif asam amino serupa dengan yang terobservasi pada isolat avian influenza berpatogenisitas tinggi lainnya, maka isolat yang diuji itu harus dianggap sebagai virus HPAI.
- Virus LPAI adalah semua virus influenza A dari subtipe H5 dan H7 yang bukan HPAI.
Meskipun pengujian patotiping in-vivo didasarkan pada pengujian hanya ayam saja, beberapa virus AI memberikan hasil uji in-vivo yang serupa jika pengujian menggunakan spesies unggas gallinaseus yang berkerabat [4, 130]. Sebaliknya, sebagian besar virus AI yang sangat letal atau highly pathogenic pada ayam tidak menyebabkan infeksi atau hanya infeksi asimptomatik pada itik domestik, kecuali untuk beberapa strain virus HPAI H5N1 Eurasia yang juga sangat letal, tergantung pada strain virusnya, pada itik domestik muda ataupun dewasa [5, 73, 123, 131]. Hasil uji patogenisitas adalah spesifik untuk hospes yang digunakan pada pengujian [185].
Terminologi
Terminologi yang digunakan untuk menjelaskan tentang avian influenza bervariasi tergantung laporan individual, publikasi, kuliah dan bentuk media lainnya yang digunakan untuk mendesiminasikan informasi. Di dalam OIE Terrestrial Code, “LPAI” hanya merujuk kepada LPAI H5/H7. Akan tetapi, di seluruh buku ini, istilah “LPAI” akan digunakan untuk mengindikasikan semua subtipe HA (16 subtipe) dari virus LPAI. Istilah-istilah lain bisa saja bervariasi dalam berbagai publikasi dan Bab yang mengikuti. Sebagai contoh, istilah “wabah” dapat digunakan untuk menyebut satu peternakan tunggal, seperti pada bahasa Italia, atau dapat merujuk kepada epidemi lengkap yang melibatkan strain virus atau galur keturunan virus pada sebuah negara ataupun wilayah. Sebuah “kasus” umumnya berarti satu laporan diagnostik dari suatu peternakan atau wabah yang terjadi pada satu peternakan tunggal.
Avian Influenza berpatogenitas rendah pada unggas domestik dan burung liar dalam penangkaran
Tidak ada mandate internasional maupun standar yang seragam yang digunakan di seluruh dunia dalam melakukan surveilans LPAI, dan tidak ada persyaratan keharusan untuk melaporkan LPAI ke OIE kecuali LPAI H5/H7 pada unggas. Karena itulah laporan LPAI yang dipublikasikan bersifat sporadic dan jarang, sebagian besarnya dipoublikasikan dalam literaur saintifik peer-reviewed yang menyangkut kasus tunggal ataupun kumpulan kasus. Akan tetapi, beberapa organisasi national dan internasional telah berupaya untuk membuat laporan kompilasi tentang LPAI dan infeksi LPAI dari setiap negara, wilayah, dan benua, terutama yang terdapat dalam Intenational Symposia on Avian Influenza dari yang pertama sampai kesembilan (1981-2005) [18, 47, 48, 136, 169-171, 176, 179, 182]. Surveilans untuk flu burung dan pelaporan yang ada telah menjadi sangat umum berasal dari Amerika Serikat, Uni Eropa, Australia, dan Kanada, dengan laporan sporadis dari negara-negara lain. Beberapa negara memiliki infrastruktur diagnose veteriner yang kurang atau kekurangan dana untuk melakukan diagnostik dan surveilans yang tepat untuk LPAI, atau negara tersebut tidak memberikan prioritas yang tinggi kepada LPAI dibandingkan dengan penyakit hewan lainnya, sementara negara lainnya mengambil kebijakan “jangan dicari maka kita tidak punya HPAI”.
Manusia telah mengembangkan sistem antroposentrik unggas yang baru melalui penangkaran, domestikasi, pembesaran unggas pada persinggungan antara wilayah pertanian dan habitat unggas liar, agrikultur non-industrial dan industrial, perdagangan nasional dan internasional, dan praktek-praktek pembesaran non-tradisional [177, 184]. Virus AI dapat bertahan dan beredar pada beragam kategori berbeda dalam ekosistem buatan manusia [177, 185], termasuk:
- Sistem koleksi, perdagangan, maintenans, dan pameran unggas
- Unggas di pedesaan, belakang rumah (backyard), dan flok hobiis, terutama sistem pemeliharaan outdoor dan campur spesies unggas
- Sistem pasar unggas hidup (Live Bird Market – LBM)
- Unggas komersial yang dibesarkan dengan umbaran atau dibesarkan di outdoor
- Unggas komersial terintegrasi dilingkungan indoor
Frekuensi virus LPAI pada unggas domestik, burung dalam penangkaran, dan unggas liar masih sangat tidak diketahui, akan tetapi pada sebagian besar negara-negara berkembang, infeksi bersifat sporadis pada unggas, paling sering pada ayam, kalkun dan itik [8, 10]. Akan tetapi, di dalam sistem unggas komersial terintegrasi di negara-negara maju, avian influenza telah sangat jarang dilaporkan jika diproyeksikan kepada 25-30 juta ayam yang dipelihara setiap tahunnya [192]. Kasus telah dilaporkan pada unggas liar di penangkaran yang dipelihara sebagai hewan peliharaan dalam sangkar atau pada tempat-tempat karantina, koleksi pribadi atau tempat perlindungan (reserves) dan taman-taman zoologi [8, 10].
Untuk unggas, frekuensi paling tinggi yang dilaporkan adalah pada unggas yang dipelihara pada peternakan kecil yang memelihara banyak spesies unggas sekaligus dengan akses outdoor (unggas pedesaan dan rural), atau yang dipelihara untuk dijual ke pasar unggas hidup, yang umumnya hanya sedikit menggunakan jasa medik veteriner, memiliki kontrol yang sangat rendah terhadap pergerakan unggas, dan kurangnya biosekuriti. Akan tetapi insidensi dan distribusi sangat bervariasi dalam kisaran wilayah geografis, negara, spesies dan umur unggas, waktu dalam satu tahun, dan lingkungan atau sistem agrikultur yang ditempatinya [185]. Beberapa contoh LPAI pada sistem buatan manusia yang berbeda akan didiskusikan berikutnya.
Contoh avian influenza berpatogenitas rendah pada sistem buatan manusia
Dalam sejarahnya, virus LPAI telah dilaporkan menginfeksi kalkun yang dibesarkan secara umbaran di Minnesota, Amerika Serikat, mengikuti paparan melalui unggas air liar yang terinfeksi virus LPAI selama periode staging dan migrasi ke selatan untuk musim dingin [61]. Akan tetapi jumlah flok kalkun yang terinfeksi telah bervariasi dari satu tahun ke tahun berikutnya, berkisar dari hanya dua flok pada tahun 1983 menjadi 141 flok pada 1978, 178 flok pada 18995, dan 258 pada 1988 [62]. Untuk mengeliminasi permasalahan ini, industry kalkun Minnesota memutuskan pada tahun 1998 untuk mengeliminasi cara pemeliharaan kalkun secara outdoor, yang berakibat berkurangnya jumlah kasus yang muncul, dengan hanya 33 flok yang terinfeksi influenza-A antara tahun 1996 dan 2000; yang sebagian besar kasusnya dikarenakan interaksi dengan virus flu burung H1N1 dan bukan infeksi virus LPAI [63]. Tingkat infeksi virus Influenza A yang rendah pada kalkun komersial di Minnesota terus belanjut sampai 2016. Selain paparan langsung yang menaikkan tingkat infeksi, kalkun juga memiliki kerentanan yang lebih besar terhadap voris influenza A yang berasal dari unggas liar, yang telah berkontribusi kepada lebih banyak kasus pada kalkun daripada kasus pada ayam [185].
Berbagai variasi subtipe virus LPAI telah diisolasi dari unggas di dalam sistem LPM di Amerika Serikat bagian timur laut (dari tahun 1986 sampai saat ini), akan tetapi karena implementasi program pengendalian pada tahun 2002, tingkat infeksi telah menurun dari setinggi 60% dari keseluruhan pasar menjadi dibawah 20%, dengan kurang dari 1% sample saja yang diambil dari pasar yang menunjukkan hasil positif virus LPAI pada tahun 2008 [95, 190, 196]. Akan tetapi, pasar-pasar unggas hidup ini dan peternakan-peternakan kecil yang mensuplai unggas telah menjadi reservoir utama virus LPAI H5/H7 di Amerika Serikat, dan telah berlaku sebagai sumber virus LPAI yang kemudian berpindah menginfeksi flok-flok unggas komersial berskala kecil maupun besar [143, 144]:
- Virus LPAI H5N1 di Pennsylvania yang menginfeksi 100 flok komersial selama tahun 1983, dan bermutasi menjadi virus HPAI H5N2 [58, 204].
- Virus LPAI H5N2 yang menginfeksi 21 flok di New York, New Jersey, Massachusetts, dan Ohio selama tahun 1986 [58].
- Virus LPAI H7N2 yang menginfeksi flok unggas komersial di Pennsylvania selama tahun 1996 dan 1998 [41, 159, 181, 211]
- Virus LPAI H7N2 yang menginfeksi tujuh flok unggas di Pennsylvania selama 2011-2002 [44, 159, 181]
- Virus LPAI H7N2 yang menginfeksi 210 flok komersial di Virginia, West Virginia, dan North Carolina selama 2002 [143, 147, 159, 181]
- Virus LPAI H7N2 yang menginfeksi 3,9 juta ayam pada perusahaan layer besar (empat peternakan) di Connecticut selama 2003 [143, 181]
- Virus LPAI H7N2 yang menginfeksi 32.000 ayam layer dalam satu flok tunggal di Rhode Island selama 2003 [143, 181]
- Virus LPAI H7N2 yang menginfeksi tiga flok ayam broiler di Delaware dan Maryland selama 2004 [146].
Tidak ada infeksi pada unggas komersial terkait sistem pasar unggas hidup (LPM) yang terindentifikasi selama tahun 2005 dan 2012, akan tetapi infeksi sporadic pada unggas belakang rumah dan unggas komersial dilaporkan dari sumber unggas liar [124, 148, 149].
Contoh-contoh lain infeksi unggas (lebih dari 100 flok) karena LPAI meliputi:
- Virus LPAI H5N2, endemik pada ayam non-komersil dan komersial di Meksiko dimulai tahun 1993 dan masih berlanjut sampai 2016 [124, 127, 140, 200-202],
- Virus LPAI H9N2, endemik pada ayam non-komersial dan komersial pada banyak negara berkembang di Asia dan Timur Tengah, dimulai pada akhir tahun 1990-an dan terus berlanjut sampai sekarang [14, 30, 74, 87, 93],
- Epidemi virus LPAI H7N1 pada kalkun di Italia selama 1999 yang bermutasi menjadi virus HPAI,
- Epidemi virus LPAI H7N3 di Italia Utasa selama tahun 2022-2003 [87],
- Virus-virus flu babi H1N1, H1N2, dan H3N2 pada kalkun pedaging dan breeder di berbagai negara [28, 49, 167, 186, 189]
- Virus LPAI H7N9, menyebar pada pasar unggas hidup (LBM) di China selama 2013-2014 [77, 203].
Wabah-wabah tambahan pada unggas (baik komersial maupun non-komersial), ratites, burung peliharaan, ayam aduan, dan unggas-unggas lain telah dideskripsikan dalam proceedings International Symposia on Avian Influenza yang pertama sampai yang kesembilan [18, 47, 48, 77, 169-171, 176, 179, 182]. Kompilasi wabah-wabah ini diluar cakupan yang dibahas pada Bab ini.
Fitur-fitur virus avian influenza berpatogenesis rendah
Infeksi virus LPAI di lapangan umumnya menimbulkan penyakit pernafasan atau penurunan produksi telur, akan tetapi mortalitas biasanya rendah kecuali jika virus LPAI disertai dengan agen-agen sekunder, seperti misalnya bakteri atau virus, yang kemudian dapat berakibat kematian setinggi-tingginya 80% pada kalkun da 75% pada burung puyuh [134, 185]. Pada beberapa kasus, virus LPAI dapat menyebabkan penyakit yang parah dan penting secara ekonomi di lapangan ketika disertai oleh infeksi sekunder dan agen stressor lainnya. Reproduksi sindrom lapangan melalui inokulasi ayam dengan virus LPAI saja umumnya tidak menimbulkan kesakitan maupun kematian, yang kemudian menjelaskan perlunya infeksi bacterial dan viral lain secara bersamaan, atau adanya faktor lingkungan lain, dalam penyakit lapangan. Diskusi mendetail tentang LPAI, terutama H9N2 di Eurasia dan H5N2 di Meksiko dan Amerika Tengah, disajikan dalam Bab 11 dalam buku ini.
Avian influenza berpatogenitas tinggi (1959 – 2015)
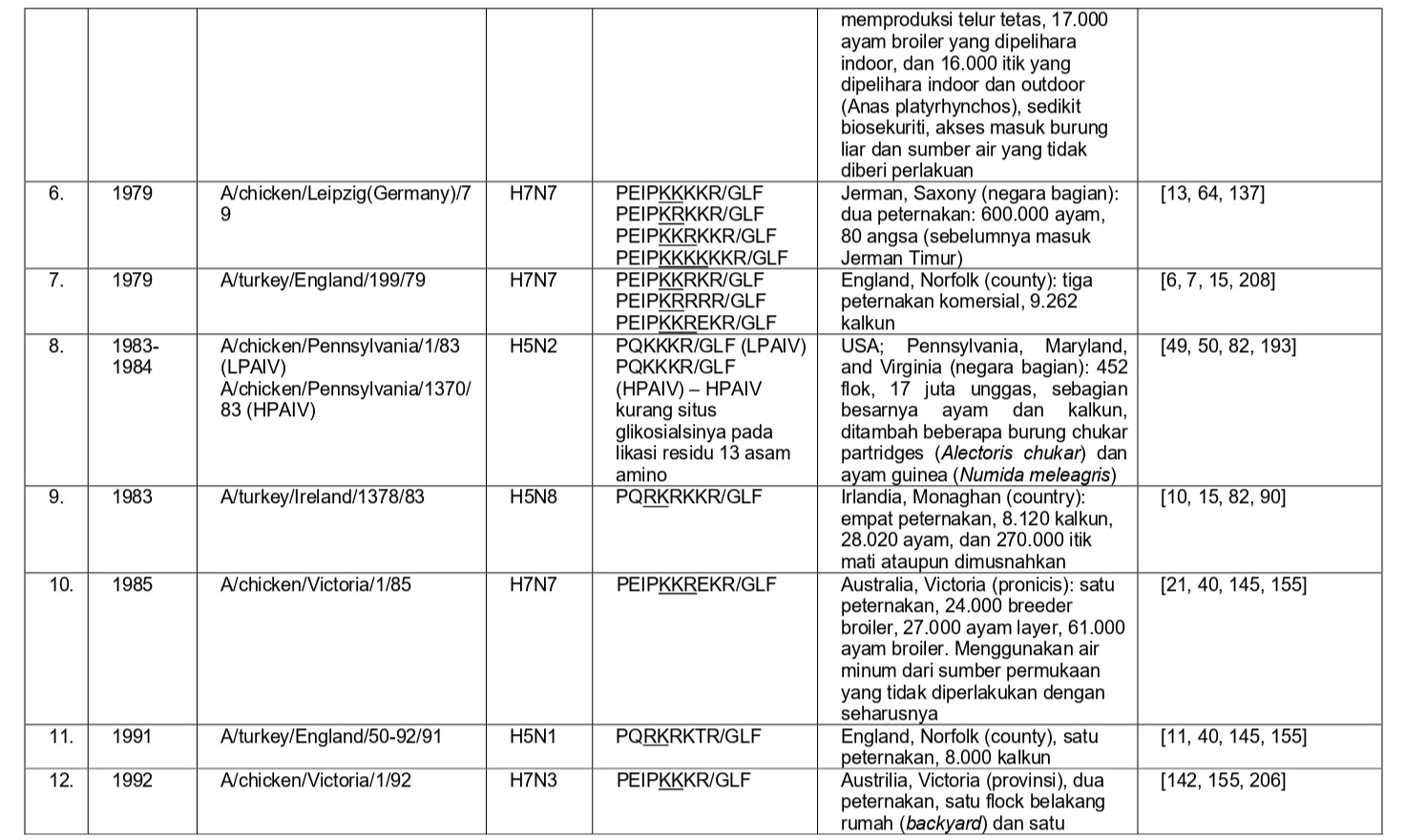
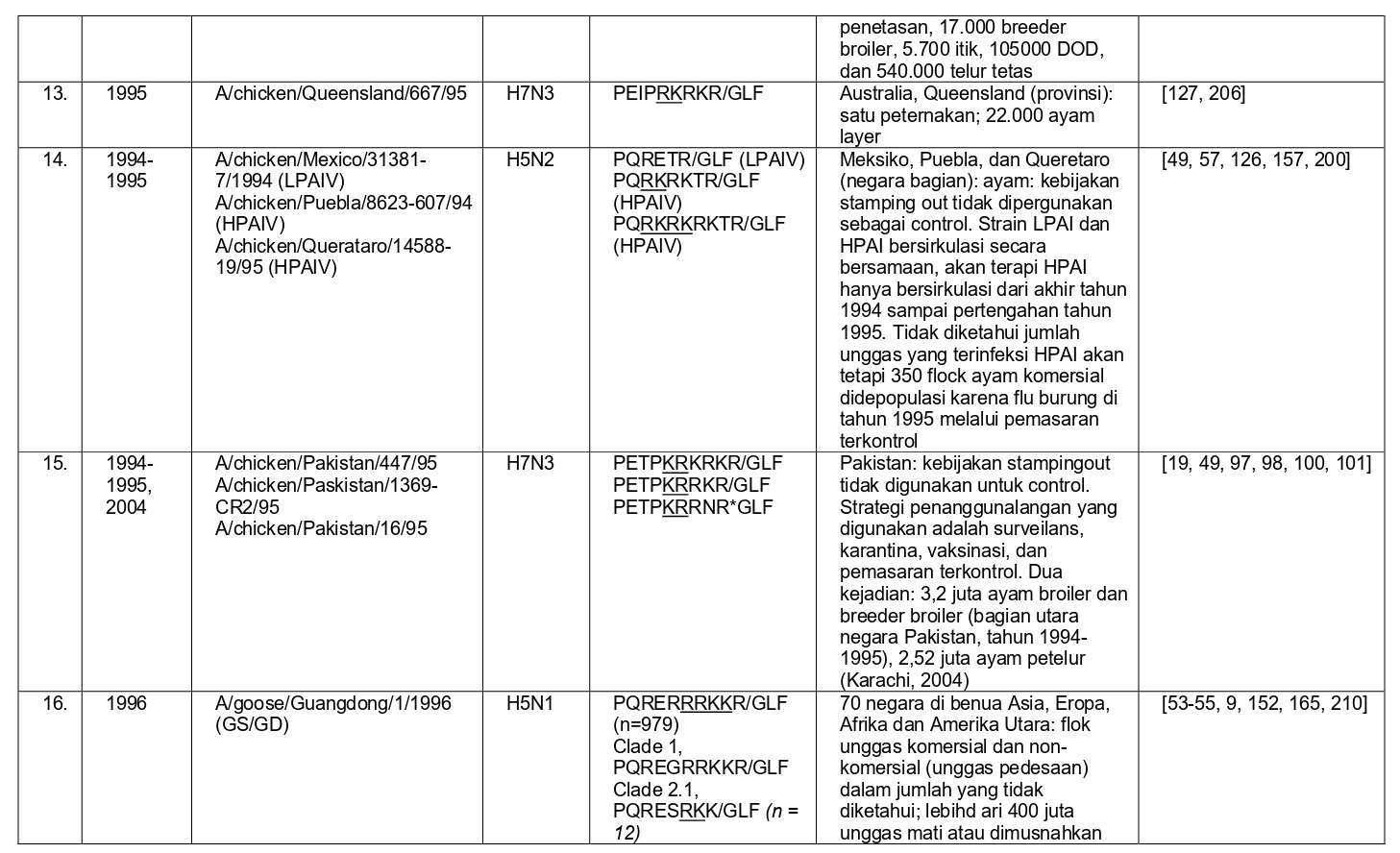
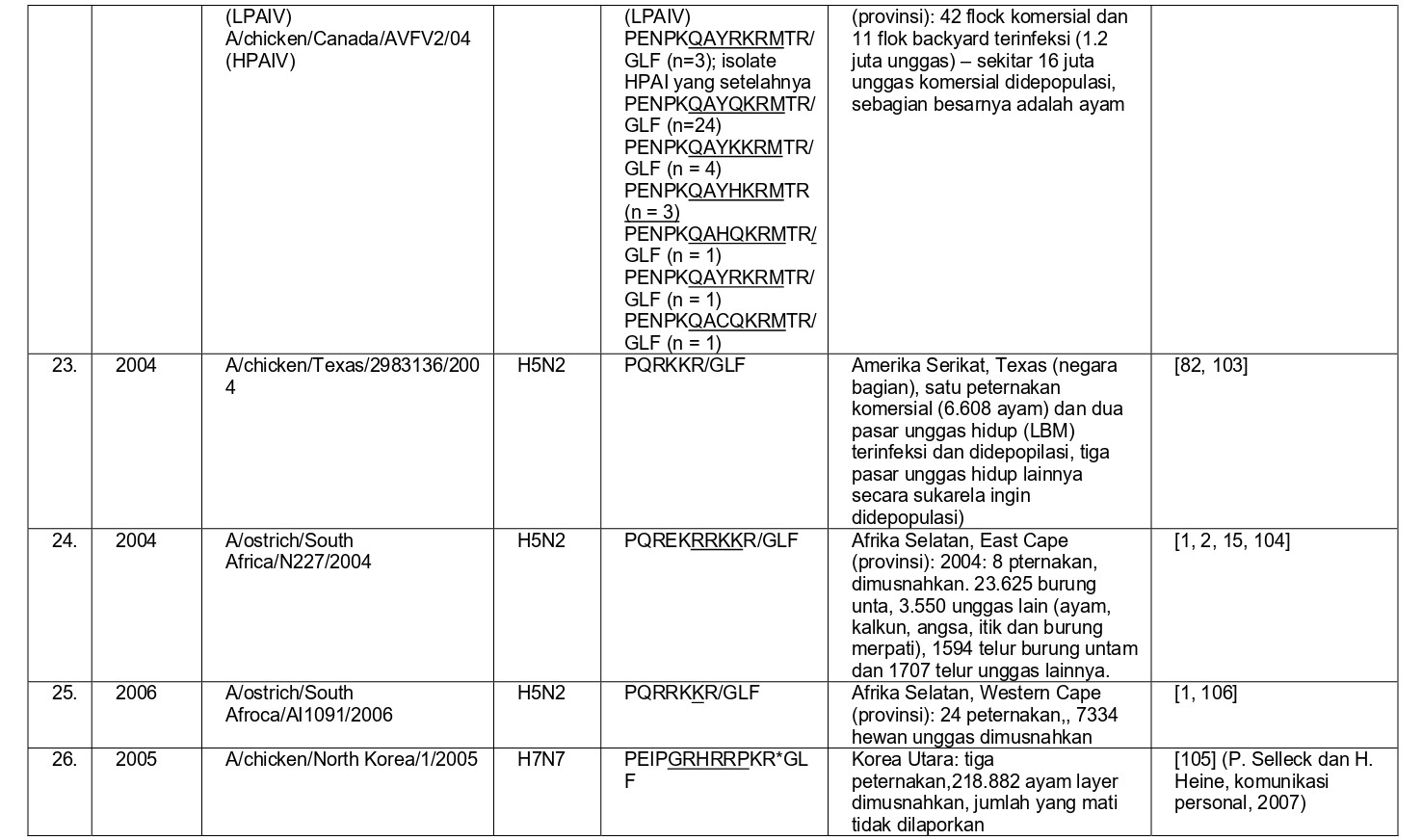
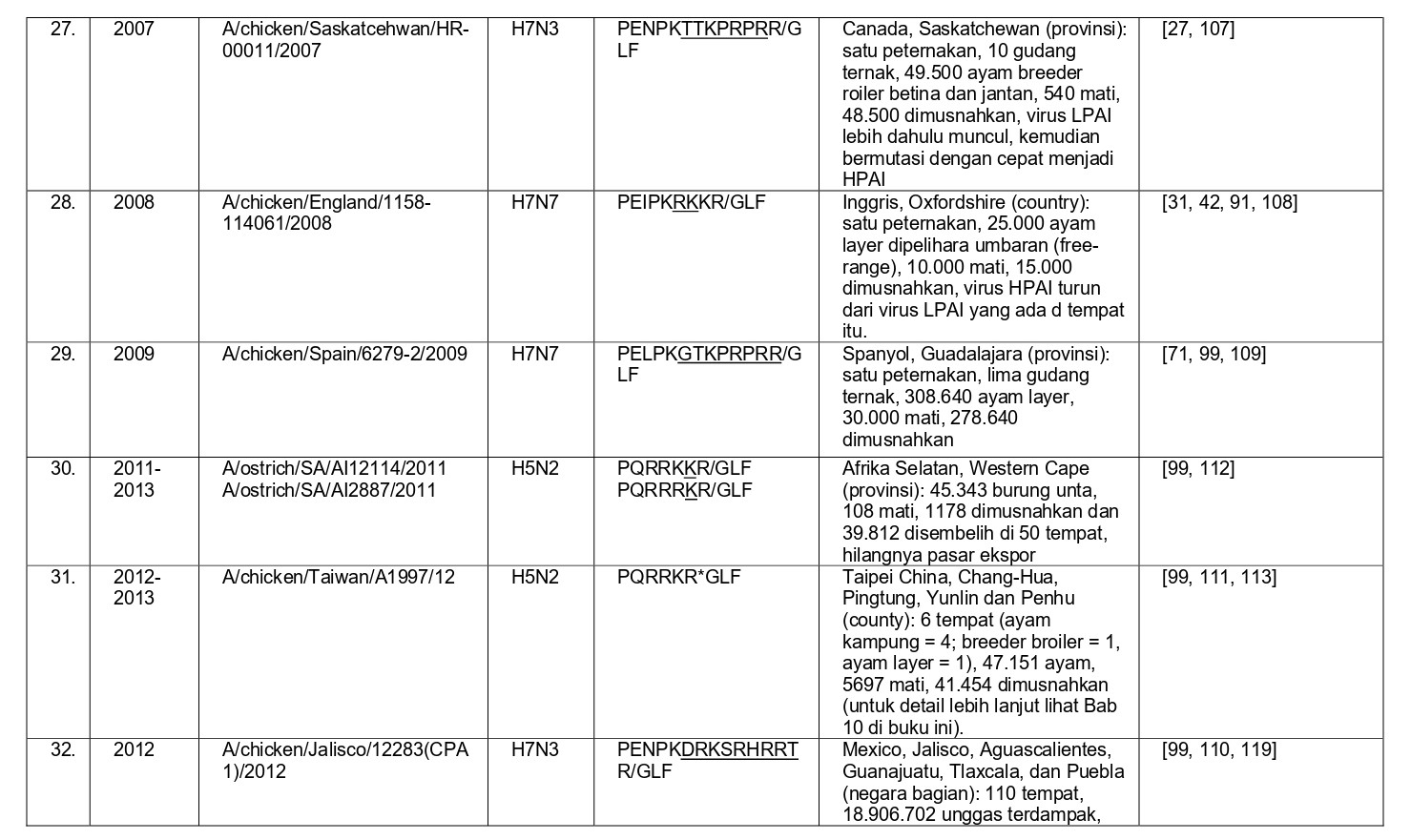
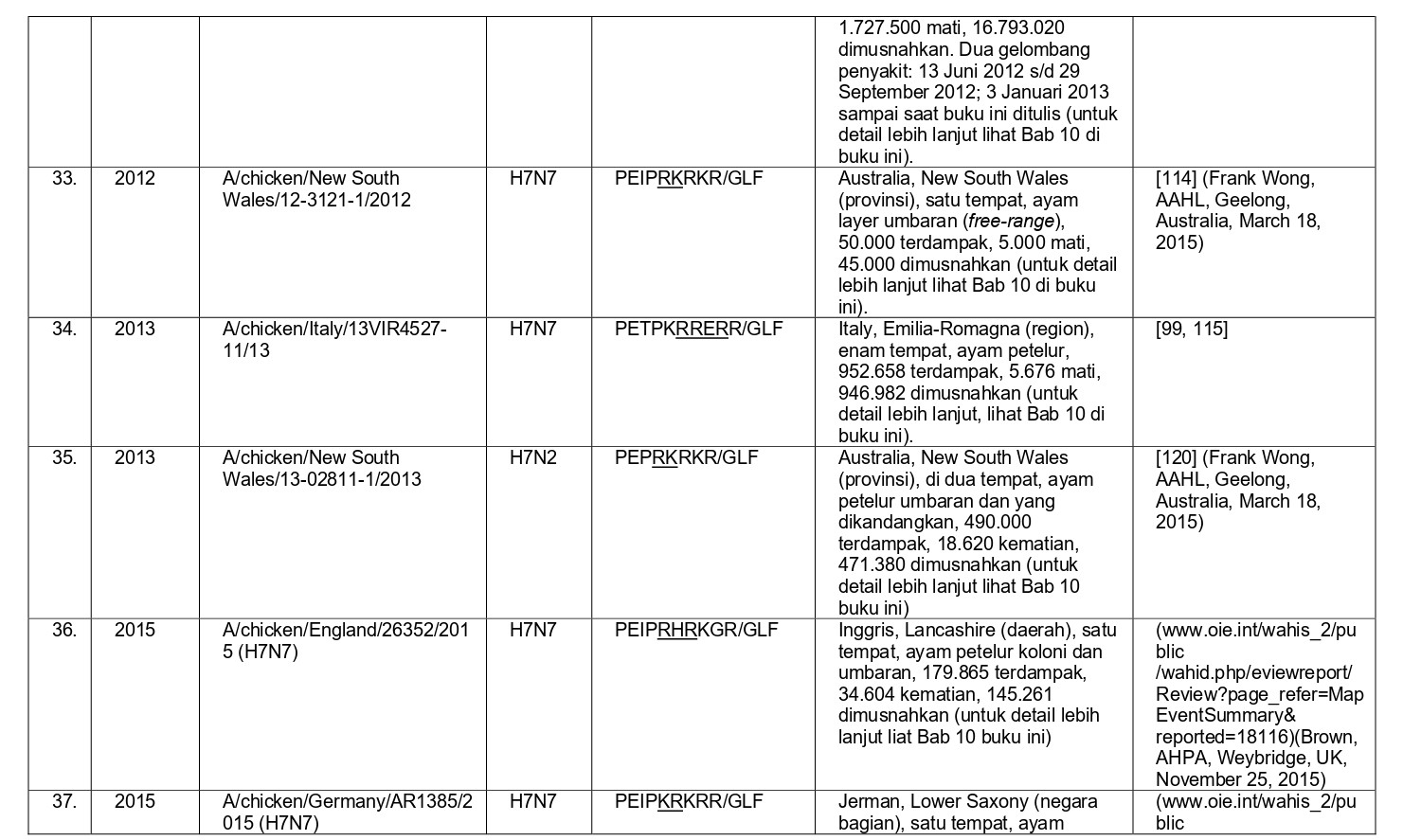
Selama 56 tahun terakhir, sejak perkembangan diagnostik dan strategi pengendalian yang konsisten, sebanyak 37 epidemi atau wabah terbatas HPAI telah didokumentasikan di seluruh dunia, dan kesemuanya dapat dilihat pada tabel 8.1. Semua virus HPAI ini berasal dari subtipe HA H5 dan H7. Belum pernah terjadi wabah HPAI dari 14 subtipe HA lainnya (H1-4, H6, H8-H16), akan tetapi terdapat virus-virus AI H2, H4, H6, H9 dan H14 yang diproduksi melalui sistem genetika terbalik dengan situs pembelahan HA HPAI, dan kesemuanya sangat mematikan bagi ayam [59, 60, 96]. Meskipun begitu, beberapa virus non-H5/H7 yang muncul secara alami juga telah menunjukkan tingkat mematikan yang tinggi pada ayam pada uji patogenisitas melalui intravena, seperti A/mandarin duck/Singapore/805/F-72/7/1993 (H10N5), A/turkey/England/384/79 (H10N4), dan turunan dari A/chicken/Alabama/1975 (H4N8), meskipun virus-virus ini tidak terlalu mematikan melalui okulasi intranasal, dan tidak memiliki sekuens situs pembelahan HA yang cocok dengan virus HPAI [32, 209]. Ditambah lagi, mekanisme yangbertanggungjawab erhadap tingginya tingkat letalitas adalah gagal ginjal yang dikarenakan replikasi virus yang ekstensif pada epitel tubulus ginjal, sebuah mekanisme yang sebelumnya dilaporkan pada ayam yang diinokulasi menlalui intavena menggunakan berbagai variasi virus LPAI [172-175, 209]. Karena itu tingginya letalitas yang terjadi pada tiga isolate virus flu burung ini adalah sebuah fenomena laboratorism dan ketiga virus ini bukanlah virus HPAI yang sebenarnya.
Secara klinis, keseluruhan 37 epidemi atau wabah terbatas HPAI ini awalnya dikenali melalui tiga penampakan penyakit yang sangat berbeda:
- Deteksi awalnya sebagai penyakit yang menyebabkan mortalitas yang tinggi pada ayam dan unggas galinaseus lainnya, yaitu deteksi HPAI pada kasus-kasus indeks dengan tingkat kematian yang tinggi (epidemi 1-3, 5-7, 9-13, 15, 17, 18, 21, 26, 31-35 dan 37),
- Deteksi HPAI pada unggas air domestik, ratites atau unggas gallinaseus sebagai kasus-kasus indeks, akan tetapi tanpa tingkat mortalitas yang tinggi (epidemi 16, 24, 25 dan 30),
- Penampakan LPAI H5 atau H7 didalam kasus indeks dengan perubahan yang cepat menjadi HPAI di dalam indeks atau kasus-kasus tambahan setelah periode beberapa minggu sampai satu tahun, sebelumnya dideteksi sebagai LPAI yang bermutasi menjadi HPAI (epidemi 4, 8, 14, 19-23, 27, 28 dan 36) (Tabel 8.1)
Pada Bab 1, mekanisme mutasi virus LPAI menjadi HPAI telah didiskusikan. Jumlah epozootik, jumlah kasus (misalnya per peternakan). Dan jumlah unggas yang terdampak wabah HPAI dari tahun 1959 sampai 1998 telah dikalkulasikan sebesar 23 juta, sementara antara tahun 1999 dan awal 2004 sebanyak lebih dari 200 juta unggas terlibat [37]. Dengan implementasi vaksinasi sebagai upaya pengendalian HPAI H5N1 di Asia dan HPAI H7N3 di Meksiko, jumlah unggas yang terdampak telah berkurang. Dalam waktu sepuluh tahun 2005 – 2014, seperti yang dilaporkan secara resmi ke OIE, 91 juta unggas mati atau telah dimusnahkan sehubungan dengan wabah HPAI [121].
Sejak tahun 1959, metode pengendalian utamanya lebih kepada stamping out, yang telah terdokumentasikan melalui catatan eradikasi virus pada 32 dari keseluruhan 37 epidemi (epidemi ke 1-13, 17-25, 27-31, dan 33-37). Pada lima wabah (epidemi ke-14, 15, 16, 26, dan 32), program vaksinasi dengan sedikit depopulasi telah mampu mengeliminasi penyakit HPAI klinis, namun demonstrasi eradikasi melalui program surveilans belumlah lengkap (Tabel 8.1). Galur keturunan HPAI H5 Gs/GD yang muncul di tahun 1996 sebagai H5N1 (epidemi ke-16) telah menjadi wabah HPAI terbesar dalam kurun waktu 50 tahun terakhir, dengan lebih dari 400 juta unggas terdampak (oleh kematian secara alami ataupun yang dimusnahkan), dan telah memberi dampak pada lebih banyak unggas jika dibandingkan dengan akumulasi jumlah unggas terdampak pada keseluruhan 36 epidemi lainnya [54, 187]. Epidemi ini telah menyebar dari kasus awalnya di China pada tahun 1996 dan menjangkiti unggas dan burung liar di lebih dari 70 negara yang tersebar di Afrika, Asia, Eropa, dan Amerika Utara [55]. Sebagian kecil dari negara-negara ini telah sukses mengimplementasikan upaya eradikasi, namun virus yang bersifat endemik pada unggas-unggas di pedesaan dan pada system pasar unggas hidup (LPM) di banyak negara (terutama itik domestik), kurangnya pengendalian pergerakan unggas-unggas di pedesaan dan system LPM, dan infeksi pada unggas air yang bermigrasi, telah menyebabkan wabah penyakit berulang dalam negara itu dan pada beberapa kasus, me-reintroduksikan virus ke dalam negara-negara yang sebelumnya telah dinyatakan bebas dari HPAI pada tahun 2004 dan 2005 (contoh: Jepang dan Korea Selatan), akhir tahun 2006 sampai awal 2007, 2010, dan 2014 [69, 78, 118, 121].


Unggas air akuatik adalah reservoir primordial untuk seluruh virus AI, dan virus-virus AI ini ataupun gen-gennya telah muncul pada virus-virus AI yang menginfeksi unggas domestik dan burung-burung dalam penangkaran (lihat Bab 7). Meskipun begitu, sumber langsung virus-virus LP dan HP penyebab epidemi tidak selalu dapat ditentukan, misal dari burung-burung liar, burung liar dalam penangkaran, unggas di pedesaan, unggas komersial, dan sebagiannya. Akan tetapi, beberapa dari virus LPAI maupun HPAI telah beradaptasi pada unggas dan telah bertahan di sistem perunggasan lingkungan pedesaan, peternakan halaman belakang, pehobi unggas, dan pasar unggas hidup (LPM) sebelum virus-virus itu masuk ke dalam industri unggas komersial. Sebagai contohnya, beberapa diantaranya mulai dari sistem LPM (misal: virus AI H5N2 di bagian timur laut Amerika Serikat, dan virus HPAI H5N1 di Hong Kong selama tahun 1997), atau bisa juga bermula pada peternakan unggas petelur yang dipelihara dengan diumbar (range-reared layers) (seperti pada wabah virus LPAI H7N7 di Belanda pada tahun 2003) sebelum kemudian menyebar kedalam sektor perunggasan komersial [82, 204, 207]. Beberapa lainnya terdeteksi di dalam sistem pasar unggas hidup (LPM) dan berhasil dieliminasi sebelum menyebar masuk ke perunggasan komersial (contoh: virus HPAI H5N2 di Italia selama tahun 1997, dan virus HPAI H5N1 di Texas selama tahun 2004) [35, 82]. Beberapa virus HPAI tampaknya muncul setelah masuknya virus LPAI pada perunggasan komersial (misal virus H7N3 di Chile selama tahun 2002 dan di Kanada selama tahun 2004) [29, 168]. Pada wabah lainnya, kurangnya surveilans yang benar berarti bahwa sumber infeksi awalnya tidak dapat ditentukan, akan tetapi kesalahan lebih mungkin dihubungkan dengan sektor komersial karena mereka adalah yang melaksanakan sebagian besar surveilans, sementara sekor rural atau pedesaan adalah yang paling sedikit melaksanakan surveilans. Akan tetapi, ketika infeksi virus AI juga terjadi pada industri komersial, kadang kala infeksi dapat menyebar dengan cepat melalui sistem yang terintegrasi dari satu peternakan ke peternakan lainnya, mengakibatkan munculnya epidemi HPAI atau LPAI, tergantung seberapa efektifnya upaya biosekuriti dapat menahan penyebarannya.
Informasi detail tentang wabah HPAI tahun 1878-2007 dapat ditemukan pada edisi pertama buku ini [188], pada Bab 7 [75], 8 [183], 9 [15], 10 [155], dan 11 [154]. Pada volume ini Bab 9 dan 10 memberikan informasi terbaru tentang epizotik dari tahun 2008 sampai 2015.
Kesimpulan
Virus AI adalah virus global yang tidak mengenal batasan geografis, tidak memiliki agenda politis, dan dapat menginfeksi semua unggas tanpa memandang sistem agricultural atau antropocentriknya. Virus AI ataupun bukti-bukti adanya infeksi virus-virus ini telah dideteksi pada unggas dan burung-burung liar pada keseluruhan tujuh benua yang ada di dunia. Akan tetapi, frekuensi laporan kasus AI dikacaukan oleh ketersediaan diagnostic, kuantitas dan kualitas surveilans yang dilakukan, tipe-tipe unggas dan sektor produksi yang di-tes, waktu-waktu dalam satu tahun, lokasi geografis, kondisi cuaca, dan faktor-faktor lain yang belum terdefinisikan. Surveilans yang paling menyeluruh dan intensif telah dilakukan di Amerika Utara dan Eropa, dikarenakan adanya kepentingan ilmiah, ketersediaan uji-uji serologis dan virologis, dan ketersediaan sumber-sumber pembiayaan. Karena influenza adalah permasalahan internasional, diperlukan solusi yang memerlukan upaya-upaya dan kerjasama dalam skala internasional pula.
Secara historis, ada lima perkembangan saintifik utama yang telah mengubah pemahaman kita terhadap avian influenza dan dengan demikian pula memberikan dampak terhadap frekuensi pelaporan penyakit ini di seluruh dunia:
- Diagnosis awal sampar unggas pada unggas domestik sebelumnya didasarkan gejala klinis, lesi dan studi pada hewan.
- Pengenalan virus LPAI dan infeksi yang ditimbulkannya pada unggas domestic didasarkan pada serologi dan isolasi virus.
- Penemuan virus avian influenza pada reservoir unggas liar yang tidak menunjukkan gejala.
- Penemuan bahwa virus HPAI dapat muncul dari mutasi virus LPAI H5/H7.
- Penyebaran secara global dari virus HPAI H5 dari galur keturunan Gs/GD yang tidak disangka-sangka, termasuk juga reassortment beragam gen dan periode-periode transmisi secara episodik.
Meskipun begitu, beberapa temuan yang sangat spesifik meningkatkan pemahaman kita terhadap patobiologi virus AI dan bagaimana caranya untuk mengendalikan penyakit ini dengan lebih baik dari sumbernya:
- Dari tahun 1978 sampai 1955, sampar unggas dideskripsikan sebagai penyakit unggas yang menyebabkan mortalitas tinggi di berbagai negara di Eropa, Asia, Amerika Utara dan Selatan, dan Afrika, dan etiologinya telah didemonstrasikan sebagai virus yang dapat difilter.
- Antara tahun 1930 sampai 1950-an, sampar unggas menghilang sebagai penyakit endemis pada sebagian wilayah dunia dan digantikan oleh penyakit Newcastle Disease (ND).
- Pada tahun 1949, kasus pertama penyakit ayam bervirulensi rendah yang disebabkan oleh virus AI dilaporkan (kasus LPAI pertama).
- Pada tahun 1955, etiologi sampar unggas ditetapkan sebagai virus AI, yang kemudian didentifikasi sebagai subtipe H7.
- Pada tahun 1959, wabah pertama sampar unggas yang disebabkan oleh virus AI subtipe H5 dideskripsikan pada ayam.
- Pada tahun 1961, infeksi virus AI dan kematian pertama yang disebabkannya di laporkan pada burung common tern di Afrika Selatan.
- Pada tahun 1966 dan 1871, subtipe virus LPAI H5 dan H7 pertama kali teridentifikasi. Sebelumnya, hanya HPAI yang memiliki subtipe H5 dan H7.
- Pada tahun 1970, tes serologis AGID pertama kali diperkenalkan, memungkinkan identifikasi secara cepat dan mudah terhadap adanya infeksi AI pada flok-flok unggas.
- Pada tahun 1972, virus LPAI pertama kali diisolasi dari burung liar tanpa gejala (itik di Amerika Serikat dan burung-burung pantai di Australia.
- Pada tahun 1981, istilah “highly pathogenic avian influenza” diterima sebagai nomenklatur standar untuk sampar unggas dan sinonim-sinonim terkait.
- Pada tahun 1983, virus LPAI terobservasi mengalami mutasi menjadi HPAI selama terjadinya wabah LPAI di lapangan, dan perubahan gen secara spesifik di lokasi pembelahan proteolitik dari hemagglutinin diidentifikasi sebagai yang bertanggung jawab terhadap perubahan virulensi ini.
- Pada akhir tahun 1980-an dan awal 1990-an, kriteria molekuler ditambahkan sebagai salah satu definisi dalam mengklasifikasikan satu virus AI sebagai HPAI.
- Pada tahun 2002, terjadinya infeksi dan kematian pada beragam spesies burung liar karena virus AI (missal karena virus HPAI H5N1) pertama kali dilaporkan.
- Galur keturunan Gs/GD virus HPAI H5 menyebar melalui unggas liar pada tahun 2005, 2010, dan 2014, dan menyebar dari Eurasia ke Amerika pada tahun 2014.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

