Oleh Leslie D. Sims and Ian H. Brown
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Perkenalan
Ketika virus avian influenza berpatogenitas tinggi (HPAI) dari subtipe H5N1 diisolasi di Provinsi Guangdong, China pada tahun 1996 [186] (yang setelah ini disebut sebagai virus H5 HPAI keturunan Gs/GD), hanya sedikit yang meramalkan bahwa ini menimbulkan ‘panzootik’1 besar HPAI, yang pertama dari penyakit ini yang berdampak pada unggas di empat benua. Panzootik ini penting untuk diperhatikan bukan hanya karena luasnya persebarannya, akan tetapi juga karena banyaknya spesies yang terdampak, yang meliputi bukan hanya ayam, akan tetapi itik domestic, unggas lainnya [140], beragam spesies avian bukan domestic [41, 43, 164], dan beberapa mamalia [161], termasuk anggota dari Felidae [59, 80, 151], Canidae [152], Viveridae (termasuk Owston Palm Civet) [132], dan Mustelidae (termasuk mink dan musang batu) [128, 165], dan manusia [7, 122]. Tidak semua strain dari virus H5 HPAI keturunan Gs/GD memiliki kapasitas yang sama dalam menyebabkan penyakit yang parah pada mamalia, termasuk beberapa strain virus terdeteksi di Eropa dan Amerika Utara pada tahun 2014-2015 (clade 2.3.4.4 dari subtipe H5N8, subtipe H5N1, dan subtipe H5N2) [76, 184].
Virus H5 HPAI keturunan Gs/GD dan keturunannya telah bersirkulasi sebagai virus berpatogenitas tinggi sejak muncul pada tahun 1996, menyebabkan panzootic dengan jumlah yang tidak bisa diprediksi. Prospek eradikasinya di tingkat global tetap terpisah, dan hal ini juga membedakannya dari wabah HPAI yang lainnya.
Pada tahun 1997, ketertarikan dunia internasional terhadap virus HPAI meningkat drastis mengikuti munculnya penyakit fatal pada unggas dan manusia di Hong Kong yang berhubungan dengan strain H5N1 dari virus HPAI [31]. Kasus-kasus pada manusia ini memberikan indikasi awal kepada komunitas internasional tentang adanya kemungkinan virus HPAI H5N1 sebagai prekursor pandemi virus pada manusia. Kekhawatiran-kekhawatiran ini meningkat dikarenakan tingginya tingkat kematian diantara manusia yang sakit, menjadi momok pandemi flu pada manusia seperti yang sebelumnya terlihat apda tahun 1918. Kekhawatiran ini tetap tinggi, meskipun belum ada bukti langsung yang mengindikasikan bahwa strain dari virus ini akan mampu untuk mengembangkan kapasitas untuk bertransmisi secara langsung antar manusia [122]. Beberapa penulis pernah menyatakan bahwa mungkin virus-virus ini tidak akan pernah menyebabkan pandemi hebat [103], dan respons terhadap meningkatnya kasus pada manusia di Mesir pada tahun 2014-2015 telah menjadi sedikit senyap, jika dibandingkan dengan respons yang muncul pada tahun 2004-2006, saat virus H5 HPAI keturunan Gs/GD menyebar ke tiga benua dan dengan semakin sedikitnya kasus pada manusia yang muncul di setiap negara.
Virus yang ditemukan di Wilayah Administrasi Khusus Hong Kong pada tahun 1997 (H5N1/97-like) [54] telah dieradikasi pada akhir tahun 1997, akan tetapi virus HPAI H5N1 lain di keturunan Gs/GD tetap ada di wilayah tersebut [142]. Virus yang diturunkan dari keturunan H5N1 ini menyebabkan wabah pada unggas dan burung liar yang timbul tenggelam di Wilayah Administrasi Khusus Hong Kong dari tahun 2001 sampai 2003 [41, 142]. Pada akhir 2003 dan awal tahun 2004, wabah HPAI yang disebabkan oleh H5N1 dilaporkan hampir bersamaan pada unggas di delapan negara Asia (China, Kamboja, Indonesia, Jepang, Korea, Laos, Thailand, dan Vietnam), diikuti kemudia pada tahun 2004 dengan adanya wabah di Malaysia [143].
1 Istilah ‘Panzootik’ digunakan untuk membedakan penyakit pada hewan dengan pandemi flu potensial pada manusia yang disebabkan oleh virus yang berasal dari unggas.
Dampak virus-virus ini lebih hebat di Thailand dan Vietnam, dimana terjadi persebaran wabah yang luas pada unggas, dan terdapat banyak kasus yang fatal pada manusia. Pada dua negara ini saja, sekitar 100 juta unggas dimusnahkan atau mati pada tahun 2004. Mulai dari Mei 2005, kasus yang berhubungan dengan virus H5N1 yang baru (novel) namun memiliki hubungan kekerabatan dekat dengan H5N1 (clade 2.2) terjadi pada burung migrasi di China Barat Laut, berpusat di Danau Qinghai [25, 27]. Strain dari virus ini kemudian terdeteksi di sepanjang Rusia utara, di Kazakhstan, dan di Mongolia utara, berdampak pada unggas dan atau burung-burung liar. Pada tahun 2006, virus-virus yang berhubungan dengan virus sebelumnya juga dilaporkan di Eropa, Timur Tengah, Pakistan dan India [153].
Bersamaan dengan itu, jumlah kasus pada manusia mulai meningkat di tempat-tempat dimana virus ini telah ada, seperti di Indonesia dan China, dan pada negara-negara yang baru saja tertular, seperti Turki, Mesir, Azerbaijan, dan Iran. Jumlah kasus pada manusia yang baru turun di Thailand dan Vietnam, bersamaan dengan membaiknya pengendalian infeksi pada unggas di negara-negara tersebut [182]. Wabah-wabah selanjutnya pada unggas mulai dari tahun 2007 ke depan, termasuk kasus yang dilaporkan sejak 2013, adalah akibat dari masuknya virus ke negara-negara yang sebelumnya telah berhasil memusnahkan virus tersebut (meliputi Korea Selatan, Jepang, Nigeria, Jerman, India dan Rusia), kemunculan penyakit pada negara-negara yang belum pernah melaporkan kasus pada unggas sebelumnya (meliputi Bangladesh, Nepal, Bhutan, Kuwait, Arab Saudi, Inggris, Belanda, Ghana, Togo, Amerika Serikat, dan Kanada), kasus-kasus di wilayah dalam negara yang telah terinfeksi namun yang sebelumnya belum pernah melaporkan kasus (wilayah bebas kasus dalam negara terinfeksi) (misalnya di Rusia), dan kasus-kasus tambahan di negara-negara yang menjadi wilayah endemik virus atau yang telah mencatatkan kasus secara regular di wilayahnya sebelumnya (meliputi Indonesia, Vietnam, China, Kamboja, Myanmar, dan Mesir). Negara-negara ini, bersama dengan sebagian wilayah dataran sungai Gangga (Bangladesh dan India), dianggap memiliki infeksi enzootik dengan virus-virus tersebut, meskipun serangan dan deteksi strain virus (clade yang berbeda yang termasuk dalam keturunan Gs/GD) juga telah terjadi di seluruh wilayah ini kecuali di Mesir, dimana semua virus berasal dari clade awal yang terdeteksi pada tahun 2006 (clade 2.2).
Mulai dari tahun 2003 sampai akhir April 2015, infeksi yang berhubungan dengan virus H5 HPAI keturunan Gs/GD tercatat pada unggas dan atau unggas/burung non domestic di 66 negara, termasuk juga China Taipei, Wilayah Administrasi Khusus Hong Kong, dan Wilayah Otonomi Palestina, bersama dengan 840 kasus infeksi dan penyakit pada manusia yang telah terkonfirmasi hasil laboratoriumnya (yang diantaranya 447 kasus berakhir fatal) dari 16 negara, termasuk satu kasus impor pada pelancong yang kembali ke Kanada [182]. Dari tahun 2008 sampai Mei 2015, kasus pada manusia tercatat di Bangladesh, Mesir, Kamboja, Indonesia, China dan Vietnam. Satu-satunya negara yang memiliki 20 atau lebih kasus yang terlaporkan per tahunnya adalah Indonesia (2008 dan 2009), Mesir (2009, 2010, 2011, 2014 dan 2015), dan Kamboja (2013) [182].
Virus H5 HPAI keturunan Gs/GD telah berevolusi menjadi sejumlah clade dan genotype HA. Beberapa dari virus-virus ini mendapatkan protein neuraminidase (NA) dari subtipe-subtipe berbeda melalui reassortment, terutama virus dalam clade 2.3.4.4. selain itu, untuk pertama kalinya virus H5 HPAI keturunan Gs/GD menyebar ke Amerika Utara mengikuti persebaran transglobal dari clade 2.3.4.4. Setelah virus terdeteksi pada unggas dan burung liar, virus-virus itu mengalami reassortment genetik lebih jauh lagi, mendapatkan gen-gen dari virus avian influenza dari keturunan Amerika Utara [68, 120].
Epizootik ini adalah yang paling serius yang pernah terjadi jika ditilik dari jumlah flok yang terinfeksi dan luasnya persebaran geografis penyakit ini. Selain itu, persebaran yang tidak terkendali telah menyebabkan tumpahan ‘spill over’ virus kepada hewan-hewan lain dan juga manusia dalam skala yang belum pernah ditemukan di masa lalu.
Ancaman yang dimiliki oleh virus-virus ini terhadap kesehatan masyarakat dan mata pencaharian petani peternak dan komunitas desa telah memunculkan upaya bersama pihak-pihak berwenang pada negara-negara terinfeksi, dengan disokong oleh agensi-agensi internasional, untuk mengendalikan dan di banyak tempat untuk mengeliminasi infeksi, seperti di Jepang, Malaysia dan Korea Selatan, akan tetapi negara-negara ini tetap mengalami serangan ulang dari virus H5 HPAI keturunan Gs/GD. Penyakit dengan cepat tereliminasi di Eropa Barat segera setelah penyakit tersebut muncul di sana, dan dari beberapa negara Afrika yang yang melaporkan infeksi antara tahun 2006 dan 2008. Hal ini terjadi cukup cepat pada negara-negara dengan kepadatan populasi unggas yang rendah dan iklim yang panas dan kering (misalnya Nigeria) dan dalam jangka waktu yang lebih lama di tempat lain (misalnya 3 tahun di Nigeria). Negara-negara Afrika Barat kembali melaporkan wabah pada tahun 2014-2015, dan pihak berwenang pada negara-negara ini mungkin mengalami kesulitan untuk menanggulangi virus, dikarenakan meningkatnya besaran sektor perunggasan sejak wabah terakhir [45].
Wabah yang terjadi di Amerika Serikat pada tahun 2014-2015 terbukti sulit untuk dikendalikan, terutama di negara bagian Iowa dan Minnesota, akan tetapi virus telah berhasil dieliminasi pada unggas, dengan kasus terkahir yang dilaporkan pada tanggal 17 Juni 2015. Eliminasi virus dimungkinkan jika infrastruktur kesehatan hewannya kuat dan industri perunggasannya telah mampu untuk menguatkan kebiasaan baik dalam mengurangi resiko masuknya virus.
Saat ini telah diakui bahwa virus ini bersifat endemik di beberapa negara dan wilayah, dan akan sangat sulit, atau mungkin bisa dibilang tidak mungkin, untuk melakukan eradikasi virus ini secara global. Eliminasi di tingkat lokal dapat dilakukan di sebagian wilayah negara-negara ini, namun zona-zona atau kompartemen-kompartemen ini rentan terhadap serangan-seranan virus dari wilayah-wilayah sekitar yang masih belum bebas virus, seperti pengalaman yang telah dicatat selama 12 tahun ini.
Tulisan ini memberikan kronologis kejadian-kejadian besar dan beberapa fitur kunci panzootik H5 HPAI. Tulisan ini menelaah virus-virus yang telah muncul dan berdampak pada negara-negara dan wilayah-wilayah kunci. Tulisan ini memberikan tinjauan informasi dalam jalur penyebaran virus dan dan mendiskusikan upaya-upaya pengendalian yang diimplementasikan di negara-negara yang telah dipilih dalam tulisan ini, termasuk diantaranya perubahan dalam pemeliharaan unggas dan praktik-praktik pemasarannya (yang biasanya disebut sebagai restrukturisas dalam industri perunggasan) yang penting dalam penanggulangan jangka panjang penyakit ini. Tulisan ini juga mendiskusikan perkembangan panzootik ini.
Terdapat celah-celah dalam pengetahuan kita terkait virus H5 HPAI keturunan Gs/GD, setengahnya dikarenakan oleh terbatasnya penelitian epidemiologi banyak wabah yang telah terjadi, terutama yang terjadi pada fase awal panzootik. Bahkan pada tahun 2015, sumber wabah-wabah yang terjadi di negara-negara berkembang tidak dapat dilacak. Kasus infeksi pada unggas tidak terlaporkan, ditunjukkan dengan kemunculan kasus-kasus pada manusia di wilayah dimana tidak ada kasus unggas yang dilaporkan [144], meskipun perbaikan kapasitas di wilayah ini tercatat telah tercapai. Kegagalan mendeteksi atau melaporkan infeksi juga menghambat upaya penanggulangan penyakit, dan juga menghambat upaya untuk memahami evolusi virus-virus ini dan penyakit yang disebabkannya.
Studi genetika dan numenklatur dari keturunan GS/GD virus H5 HPAI
Meskipun terdapat banyak virus avian influenza yang ada di Eurasia, virus yang dijelaskan secara mendetail pada Bab ini adalah virus HPAI yang termasuk ke dalam subtipe H5 (misalnya yang memiliki protein hemagglutinin (HA) dari subtipe H5 yang dapat dihubungkan secara filogenetik dengan virus H5N1 yang pertama kali terdeteksi di Provinsi Guangdong, China, pada tahun 1996). Sampai belakangan ini, sebagian besar dari virus-virus ini memiliki protein neuraminidase (NA) dari subtipe N1. Akan tetapi sejak 2008 beberapa strain dari subtipe N yang lain telah terdeteksi. Pada beberapa hal, dapat dikatakan sangat luar biasa bahwa tidak ada subtipe N lain yang muncul, melihat tingginya ko-sirkulasi virus avian influenza pada unggas, termasuk virus-virus H5N1 dan H9N2. Subtipe-subtipe utama yang ditemukan pada keturunan ini, selain H5N1, adalah H5N2, H5N3, H5N5, H5N6, dan H5N8 [68, 183, 191]. Virus-virus reasortan lainnya juga telah terdeteksi baru-baru ini di Amerika Utara (H5N2 dan H5N1), dimana gen N1 dan N2 (dan dua atau tiga gen lain yang mengkode protein internal) diturunkan dari keturunan virus avian influenza Amerika Utara [68]. Kebanyakan virus reasortan ini termasuk ke dalam clade 2.3.4.4, akan tetapi beberapa virus di Asia termasuk dalam clade 7.2.
Hal yang konstan terkait virus influenza A adalah bahwa ia akan berubah seiring waktu. Hal ini terutama terlihat pada virus H5 HPAI keturunan Gs/GD yang diisolasi dalam wajtu 19 tahun terakhir ini. Virus-virus ini menunjukkan heterogenitas genetik dan antigenetik dalam jumlah yang cukup besar, dan juga menunjukkan variasi genotip melalui reassortment genetik. Fitur umum yang secara umum dimiliki virus-virus ini adalah gen HA yang dapat dilacak kembali dengan virus original pada keturunan ini yang pertama kali terdeteksi pada angsa pada tahun 1996. Studi molekuler telah menyediakan pandangan unik terhadap evolusi virus HPAI H5 seiring dengan kemunculannya, yang telah memungkinkan pelaakan pergerakannya di seluruh dunia. Nomenklatur untuk clade HA telah distandarisasi, akan tetapi terminology genotipe dan varian-varian antigenik dari virus-virus ini masih beluh diatur oleh ketentuan yang konsisten secara internasional. Berbagai sistem yang digunakan untuk mendeskripsikan virus ini dibuat oleh banyak tim riset telah membawa kebingungan yang cukup luas [24, 54, 105, 137, 149, 168, 173]. Pada tahun 2005, usaha pertama dalam mendefinisikan berbagai clade virus, berdasarkan hubungan genetik gen HA [173]. Sistem ini kemudian dimurnikan lagi pada tahun 2006 dan 2007 [176], dan clade-clade baru telah ditambahkan seiring kemunculannya melalui proses peninjauan yang berkelanjutan dibawah naungan kelompok kerja gabungan Organisasi Kesehatan Dunia (WHO), Organisasi Kesehatan Hewan Dunia (OIE), dan Organisasi Pangan Dunia (FAO) [37, 177].
Menurut sistem nomenklatur yang dikembangkan oleh kelompok kerja gabungan WHO/OIE/FAO untuk evolusi H5N1 [177], virus-virus yang ada dibagi kedalam 10 clade ordo pertama yang diberi nomor 0 sampai 9. Clades dibedakan dengan berbagi nodus clade umum pembeda di dalam pohon filogenetik dengan nilai bootstrap > 50 pada nodus pembeda clade, dan rata-rata jarak pasangan nukleotida antar dan dalam clade yaitu > 1.5% dan < 1.5%. Virus-virus yang termasuk ke dalam clade 3 pada skema klasifikasi yang dikembangkan pada tahun 2005 diganti Namanya menjadi clade 0 untuk merefleksikan fakta bahwa mereka adalah prekursor dari seluruh clade lainnya. Clade 2 pada awalnya dibagi menjadi lima clade ordo ke-dua (2.1 sampai 2.5). saat ini beberapa virus dalam Clade 2.3 telah berevolusi menjadi clade ordo ke-lima, dengan clade ordo ke-lima ini dispesifikasikan dengan angka daripada nomer (misalnya subclade 1.3.2.1c). Kesebelas clade H5 secara aktif bersirkulasi selama tahun 2011 dan 2012 [181]. Kemudian, ditentukan rekomendasi tiga clade yang berdasar pembagian clade 2.1.3.2a (Indonesia), 2.2.1 (Mesir), dan 2.3.4 (deteksi menyeluruh di Asia, Eropa dan Amerika Utara), yang meliputi subtipe-subtipe dari keturunan virus HPAI Gs/GD yang baru saja muncul yaitu H5N2, H5N3, H5N5, H5N6, dan H5N8 untuk diklasifikasikan sebagai clade 2.3.4.4 [37]. Sampai bulan Maret 2015, satu-satunya clade yang diketahui sebelumnya atau telah bersirkulasi baru-baru ini adalah turunan dari clade 2.1 (Indonesia), 2.2 (Mesir dengan tumpahan kepada negara-negara yang berdekatan), 2.3.2 (beberapa strain yang tersebar luas di Asia dan satu di Afrika Barat), dan 2.3.4 (Cina, Korea Selatan, Jepang, Korea, dan Amerika Utara). Yang lainnya seperti diantaranya turunan clade 1 dan 7, mungkin masih bersirkulasi di Mekong dan Cina, akan tetapi belum dilaporkan.
Studi genetika
Sebelum tahun 1996, hanya ada dua virus HPAI dari subtipe H5N1 yang telah diidentifikasi – satu dari unggas di Skotlandia pada tahun 1959 [123], dan satu lagi dari kalkun di Norflok, Inggris, selama tahun 1991 [5]. Meskipun virus-virus ini adalah subtipe yang sama dengan virus HPAI H5 keturunan Gs/GD, mereka tidak berhubungan dekat, membentuk bagian dari keturunan H5 Eurasia yang lebih luas. Demikian juga sejumlah virus-virus LPAI H5N1 yang diisolasi di Asia, Amerika, dan Eropa, akan tetapi tidak ada dari mereka yang berhubungan dengan strain H5 dari keturunan Gs/GD. Virus LPAI dari subtipe H5 belum menjadi tetap pada unggas darat di Asia [38], akan tetapi masih ditemukan pada unggas liar. Di Eropa, dikarenakan adanya surveilans aktif pada unggas komersial, maka virus-virus itu lebih sering terdeteksi.
Pada tahun 1996 virus HPAI H5N1 (A/Goose/Guangdong/1/96, yang setelah ini disebut sebagai Go/GD/96) berada pada, atau dekat dengan akar keturunan HPAI H5 Gs/GD, yang terdiri dari berbagai clade dan genotipe berbeda, seperti yang telah dideskripsikan sebelumnya, telah muncul dan pada banyak kasus, menghilang di tahun-tahun berikutnya [24, 54, 55, 91, 108]. Seluruh virus H5N1 dari keturunan HPAI H5 Gs/GD yang telah diisolasi sejak tahun 1996, tidak peduli berasal dari spesies mana saja, memenuhi kriteria virus HPAI yang ditetapkan OIE (indeks patogenitas intravena > 1.2) [110], meskipun terdapat beberapa variasi pada indeks patogenitas intravena yang telah dideskripsikan, terutama pada beberapa strain virus dari itik dan angsa [24, 189].
Terpisah dari fakta adanya laporan yang berasal sebagian awal abad ke-20 dan dari Pakistan pada tahun 1990 yang melaporkan virus-virus H7N3, ini adalah kali pertama bahwa virus HPAI yang dikenali telah berada pada unggas dan atau burung liar dalam jangka waktu yang lama, dan baru kali ini terjadi meliputi kisaran geografis yang sangat luas.
Bagaimana tepatnya sumber dan sejarah virus Go/GD/96 tidak diketahui [38]. Agaknya, seperti juga seluruh virus influenza lainnya, virus ini berasal dari virus prekursor LPAI yang bersirkulasi pada burung air liar yang kemudian menyeberang ke unggas domestik dimana terjadi mutasi menjadi virulen, seperti yang terjadi pada strain virus HPAI lainnya [6]. Akan tetapi, data surveilans sebelum tahun 1996 untuk unggas dan burung liar di Asia, terutama selama periode dari tahun 1980 sampai 1996 jumlahnya terbatas. Gen HA dari Go/GD/96 memiliki beberapa kesamaan dengan virus-virus Eurasia lainnya dari burung liar, termasuk virus yang ditemukan pada angsa di Hokkaido pada tahun 1996, akan tetapi virus-virus ini bukanlah sumber langsung gen HA nya [38]. Demikian juga sumber gen NA pada virus Go/GD/96 juga tidak diketahui. Virus Go/GD/96 berbagi kesamaan nukleotida sebesar 95% dengan virus A/Duck/Hokkaido55/96, merupakan virus LPAI H5N1, yang juga menunjukkan hubungan gen NA yang berjauhan diantara virus-virus ini. Faktanya bahkan virus ataupun virus-virus prekursor langsung dari virus H5N1 masih belum juga ditemukan. Virus HPAI H5N1 yang muncul pada tahun 1997 (virus yang mirip dengan H5N1/97) dan menyebabkan penyakit berat pada unggas dan manusia di Hong Kong berbeda dengan virus yang muncul pada tahun 1996, yaitu bahwa virus ini merupakan virus hasil reasortansi yang memiliki gen NA dan gen protein internal yang berbeda dengan virus HPAI H5N1 yang pertama kali diidentifikasi pada angsa pada tahun 1996, akan tetapi gen HA-nya lebih berhubungan dekat [53]. Virus-virus mirip H5N1/97 ini dianggap membentuk genotipe berbeda dalam subtipe H5N1. Kemudian, genotipe yang sangat beragam muncul melalui proses reassortment, kemungkinan melalui multiplikasi virus pada burung air. Genotipe-genotipe berbeda diberikan nama sesuai dengan alfabet (misalnya “V”, “X”, atau “Z”), terutama didasarkan pada konfigurasi gen yang dimilikinya yang mengkode protein internalnya, meskipun terdapat inkonsistensi pada nomenklatur dan interpretasi temuan genetik antar kelompok riset [24, 54]. Melihat dari cakupan reassortment yang terjadi selama 18 tahun terakhir, sistem sederhana untuk mendeskripsikan genotip tidak lagi mungkin dilakukan. Genotipe-genotipe yang berbeda ini tetap mempertahankan gen HA asalnya yang diturunkan dari virus mirip Go/GD/96, akan tetapi sesuai perkiraan, gen ini juga pada akhirnya bervariasi seiring waktu dikarenakan antigenic drift, yang menghasilkan pembentukan clade-clade yang berbeda seperti yang disebutkan di atas. Genetic drift ini dapat dibuktikan dengan pohon filogenetik yang menunjukkan variasi yang cukup besar dalam komposisi nukleotida gen-gen HA dimulai dari virus awal tahun 1996 sampai dengan isolat baru-baru ini. Pohon genetik yang dibuat berdasarkan penelitian-penelitian ini juga menunjukkan adanya hubungan epidemiologis antar isolat (Gambar 9.1
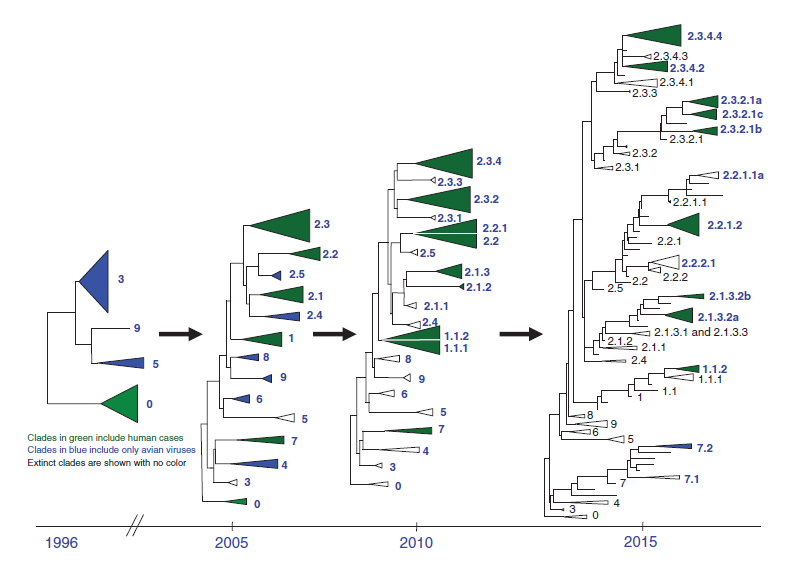
Gambar 9.1 Hubungan filogenetik gen HA dari keturunan virus HPAI H5N1 Gs/GD seiring waktu. Kelompok Kerja Evolusi H5 WHO/OFFLU telah meninjau secara terus menerus perkembangan nomenklatur keturunan virus HPAI H5N1 Gs/GD seiring evolusinya sejak pertama kali muncul dan terdeteksi pada tahun 1996. Kelompok monofiletik diskrit muncul dalam sebuah clade spesifik, dan saat kelompok-kelompok ini memenuhi kriteria pembeda nukleotida (yaitu: memiliki nilai bootstrap yang lebih dari 60, dan memiliki jarak rata-rata pasangan di dalam clade kurang dari 1.5%), mereka kemudian dibagi ke dalam clade ordo kedua (akan tetapi masih dianggap bagian dari clade ordo pertama). Ketika virus dalam ordo kedua terus berevolusi, mereka mungkin akan mencapai keragaman genetik yang serupa, yang pada suatu titik akan membelah lagi menjadi clade ordo ketiga, dan seterusnya. Kriteria penamaan clade yang sama diterapkan untuk menamai orde pertama, kedua, dan clade ordo tinggi lainnya. Clade yang telah punah yang dipercaya tidak lagi bersirkulasi ditunjukkan tanpa warna, clade yang hanya dilaporkan dari spesies avian dijunjukkan dengan warna biru, dan clade yang meliputi virus-virus yang telah terdeteksi baik pada manusia dan avian ditunjukkan dengan warna hijau. Hak Milik Todd Davis, CDC Atlanta.
Beberapa obervasi yang bermanfaat telah dilakukan terhadap karakteristik genetik virus-virus ini. Luasnya kisaran genotipe dan clade yang ditemukan di China, termasuk di wilayah administrative Hong Kong, dan di tempat lain mendemonstrasikan bahwa terdapat replikasi virus yang signifikan dalam waktu lebih dari 18 tahun terakhir, pada unggas dan burung liar [24, 55, 148]. Informasi genetik yang ada menunjukkan pemasukan pertama satu virus awal dari strain virus HPAI H5 keturunan Gs/GD yang berbeda ke Indonesia (clade 2.1) dan Thailand (clade 1) pada tahun 2003, dan ke Mesir pada tahun 2006 (clade 2.2), yang kemudian berevolusi di negara-negara tersebut. Di Indonesia, virus-virus ini menjadi endemik dan telah berevolusi menjadi clade ordo keempat. Dari semua itu, clade 2.1.3.2 menjadi strain yang dominan dan setelahnya terbelah dua menjadi dua clade ordo kelima yaitu 2.1.3.2a dan 2.1.3.2b [37]. Strain yang kedua (clade 2.3.2.1c) masuk ke Indonesia pada tahun 2012 [36]. Strain-strain tambahan juga masuk ke Thailand, akan tetapi tidak menetap [156]. Banyak strain virus telah masuk ke Korea Selatan dan Jepang (clade 2.5 pada tahun 2003-2004, clade 2.2 pada tahun 2006, clade 2.3.2.1 pada tahun 2008, clade 2.3.2.1c pada tahun 2010-2011, dan clade 2.3.4.4 pada tahun 2014-2015) [71]. Berdasarkan waktu pemasukannya, serta epidemiologi wabah, dan pada beberapa kasus dimana virus telah terdeteksi terlebih dahulu pada burung liar sebelum ditemukan pada unggas domestik, sangat mungkin bahwa burung-burung migrasi berperan sebagai sumber utama masuknya setiap strain virus ini ke Jepang dan Korea Selatan. Vietnam juga telah mengalami banyak pemasukan virus, akan tetapi sumber masuknya virus yang lebih mungkin adalah melalui perdagangan unggas illegal [84].
Dari tahun 2005 sampai 2009 hampir semua virus yang diisolasi daru Myanmar bagian utara dan selatan termasuk ke dalam clade 2.2 dan keturunannya. Virus-virus ini termasuk virus H5N1 yang terdeteksi apda burung liar dan unggas di Eropa, Timur Tengah, Asia Selatan dan Afrika. Virus-virus dari clade 2.2 ini dapat dibedakan dengan jelas dari clade-clade virus HPAI H5N1 lainnya yang pada saat itu terbatas penyebaraannya secara geografis di Asia Timur dan Asia Tenggara. Pengecualian yang ada diantaranya adalah virus-virus yang terdeteksi di Eropa pada burung-burung sitaan dari penyelundupan burung dari Asia [166].
Segera setelah masuknya clade 2.2 HPAI H5N1 ke Eropa, Asia Barat, Timur Tengah, dan Afrika, sejumlah sub keturunan mulai muncul. Hal ini mengindikasikan situasi yang dinamik dimana virus-virus ini terus berevolusi.
Analisis virus-virus yang terpilih, terutama dari Arika, tetapi juga memasukkan strain dari Eropa dan Timur Tengah, berhasil mengidentifikasi setidaknya tiga sub keturunan [137] dalam clade 2.2 (misalnya virus-virus yang berhubungan dengan yang teridentiffikasi pada burung liar di Provinsi Qinghai, China). Virus-virus ini pada saat itu tidak disebut sebagai clade yang terpisah, akan tetapi telah cukup berbeda untuk dapat disebut sebagai sub keturunan EMA1, EMA2, dan EMA3 [137]. Perbedaan yang tidak begitu kentara antar virus-virus ini menyediakan sokongan untuk penelitian epidemiologic. Sebagai contoh, keberadaan EMA1 dan EMA2 di Nigeria menunjukkan bahwa lebih dari satu virus telah masuk ke Nigeria selama 2005-2006. Virus yang dideteksi di India (EMA3) lebih berhubungan dekat dengan virus-virus di Mongolia, Azerbaijan, Italia dan Afganistan, dan pada tahun-tahun berikutnya tercatat di Rusia, Pakistan, Kuwait, Turki dan Republik Ceko. Sub keturunan EMA-3 tidak terdeteksi di Afrika. Kemunculan klaster-klaster baru virus HPAI H5N1 di Mesir telah dicatat pada beberapa kesempatan, kemungkinan sebagai hasil sirkulasi endemik virus. Pada tahun 2007, muncul satu subclade varian antigenic drift, yang sesudahnya disebut sebagai 2.2.1.1, yang berasal dari clade 2.2.1 dan meluas (clade 2.2.1.1a) pada populasi unggas komersial di Mesir. Sampai tahun 2010 virus ini menghilang [11]. Virus dari clade 2.2.1.1 yang muncul pada tahun 2007 sekarang telah digantikan oleh clade 2.2.1.2 [37], yang tampaknya telah menjadi dominan di seluruh sektor produksi perunggasan [12], dan lebih jauh lagi telah dihubungkan dengan peningkatan jumlah kasus infeksi pada manusia yang mungkin berhubungan dengan meningkatnya beban virus pada sektor perunggasan. Contoh ini mendemonstrasikan terjadinya evolusi dengan kecepatan lebih yang tejadi pada virus-virus ini dan pergantian satu clade dengan yang lainnya, yang sering menyebabkan clade yang telah tergantikan itu hilang sama sekali.
Beberapa perubahan yang menarik juga telah teramati saat mamalia terinfeksi. Meskipun sebagian besar kasus infeksi pada mamalia diturunkan secara langsung dari unggas, perbedaan gen-gen virus-virus ini pada hospes mamalia dan unggas telah terjadi, tampaknya mengikuti pasase tunggal atau pasase terbatas pada hospes mamalia. Mutasi gen PB2 pada posisi 627 (E627K) telah dilaporkan sebagai signifikan, akan tetapi sejumlah perubahan lainnya juga telah dihubungkan dengan pasase melalui mamalia [57]. Perubahan-perubahan ini kemungkinan disebabkan bahwa setiap populasi virus influenza pada suatu hospes tunggal adalah quasispesies/banyak spesies dan pada suatu hospes tunggal tersebut satu strain ‘dominan’ yang berbeda terpilih dari quasispesies ini, karena perbedaan lingkungan hospes.
Resistensi terhadap kimia antiviral amantadine telah diidentifikasi pada beberapa virus H5N1 (dan virus H9N2), menunjukkan adanya tekanan seleksi dari penggunaan obat ini di Asia, dan hal ini berkorelasi dengan laporan penggunaannya pada unggas komersial.
Studi eksperimental dimana virus H5N1 dimodifikasi oleh genetik terbalik/ reverse genetics atau dengan pasase berantai pada musang telah mendemonstrasikan perubahan yang terjadi pada virus-virus ini pada gen HA dan gen-gen lainnya yang telah memungkinkan virus untuk ditansmisikan melalui udara (aerogenic) antar musang (dengan patogenitas yang telah berkurang). Sejauh ini kombinasi mutasi ini belum dideteksi di alam [62, 67].
Situs pembelahan
Untuk seluruh virus influenza A, glikoprotein HA diproduksi sebagai prekursor, HA0, yang memerlukan pembelahan post-translational oleh protease hospes sebelum dapat berfungsi penuh dan sebelum partikel virus bersifat infeksius. Motif genetik pada tempat pembelahan HA0 pada virus HPAI biasanya mengandung beberapa asam amino dasar dan dapat ditemukan pada seluruh virus H5 dari keturunan Gs/GD. Virus original Go/GD/96 memiliki konfigurasi PQRERRRKKR*GLF, akan tetapi sejak itu terdapat variasi yang cukup besar pada tempat pembelahan, dan variasi juga tampak pada virus-virus yang berbeda clade (Table 9.1). Seluruh virus ini tetap bersifat patogenik tinggi untuk unggas galinaseus, dan banyak isolat memiliki nilai IVPI pada ayam sebesar 3.0.
Perubahan antigenic
Perubahan antigenik yang jelas terlihat pada protein HA virus HPAI H5 dari keturunan Hs/GD telah terjadi sejak virus ini pertama kali muncul. Studi dengan menggunakan baik antibodi monoklonal maupun poliklonal menunjukkan perbedaan yang signifikan antar strain-strain yang berbeda lokasi. Hal ini kemungkinan dimungkinkan oleh adanya kombinasi dari sirkulasi sistemik virus pada itik, yang kemudian mengembangkan respons imun terhadap virus-virus ini, kemudian transmisi antar spesies, yang menyebabkan tekanan imunitas yang selektif, dan mungkin juga beberapa adalah dampak dari vaksinasi. Penelitian yang saat ini masih berjalan dilakukan untuk memastikan antigen di dalam vaksin tetap dapat memberikan proteksi terhadap strain yang ada di lapangan, dan untuk mengevauasi dampak antigenic drift pada virus di lapangan, jika ada. China telah menjadi pemimpin dalam bidang ini, dan telah memperkenalkan sejumlah antigen vaksin batu semenjak strain varian antigen telah terdeteksi [89]. Kartografi antigenik juga telah digunakan sebagai sebuah cara untuk menunjukkan perbedaan antigenik [1, 65, 159], akan tetapi sistem yang ada secara global untuk mempergunakan informasi ini masih sangat kurang.

Penghapusan protein virus
Beberapa penghapusan protein virus telah berkembang seiring evolusi virus dari keturunan Gs/GD HPAI H5. Virus original berasal dari angsa (Go/GD/96) tidak memiliki penghapusan pada cabang NA, akan tetapi seluruh strain 1997 memilikinya. Perubahan ini umumnya dianggap sebagai adaptasi virus terhadap unggas galinaseus. Penghapusan 19 asam amino yang mirip akan tetapi tidak identik terjadi pada protein NA pada sebagian besar isolat dari tahun 2001 ke atas (dengan beberapa pengecualian pada beberapa virus yang berasal dari burung-burung liar di wilayah Administrasi Hong Kong pada tahun 2002, dan yang berasal dari manusia pada tahun 2003 [55]. Virus HPAI H5N2 dari Amerika Utara yang baru tidak mengalami penghapusan pada cabang NA, kemungkinan merefleksikan asal gen NA virus dari burung liar [120]. Penghapusan 5 asam amino juga telah diidentifikasi dalam protein NS pada banyak isolat [93]. Signifikansi kejadian ini tidak jelas, akan tetapi pemeliharaan perubahan ini pada populasi virus yang heterogen memberikan implikasi ketahanan virus pada spesies hospes kunci. Hal ini juga mungkin menjadi faktor yang berkontribusi dalam penentuan kisaran hospes. Hal ini juga telah dihubungkan dengan tingginya virulensi pada itik.
Sejarah Panzootik virus H5 keturunan GS/GD
Bagian berikut ini mendeskripsikan perkembangan panzootik dan berasal dari berbagai materi yang telah dipublikasikan, termasuk diantaranya database gen, dan ini berarti tulisan ini tidak hanya merefleksikan pemberitahuan resmi wabah yang telah terkonfirmasi kepada OIE. Beberapa data resmi yang ada menunjukkan data biologis yang tidak masuk akal, seperti diantaranya kurangnya laporan resmi terjadinya penyakit unggas pada tempat-tempat selain wilayah admministrasi khusus Hong Kong dari tahun 2001 sampai awal tahun 2003, meskipun terdeteksi keberadaan virus HPAI H5N1 di wilayah yang terbentang dari Hanoi ke Jilin [143, 178].
Ketidakadaan data dari negara-negara yang memiliki infrastruktur veterinaria dan sistem surveilans yang belum berkembang seringkali diinterpretasikan sebagai tidak adanya infeksi [144]. Selama lebih dari 10 tahun belakangan ini, sebagian besar negara-negara di dunia telah mengembangkan kapabilitas diagnostik dan surveilansnya, dan juga meningkatkan transparansinya sebagai hasil dari investasi pemerintah nasional dan subnasional yang disokong oleh pendanaan Lembaga donor dan institusi pembiayaan internasional. Dampak dari hal ini adalah semakin jelasnya luasan infeksi yang ada, meskipun tidak semua studi surveilans telah dilaporkan, terutama yang menunjukkan hasil negatif. Pertimbangan politis masih memiliki potensi dalam upaya menahan informasi terkait wabah penyakit. Peternak tidak selalu bisa mengenali atau melaporkan seluruh kasus penyakit [144], dan pada beberapa negara mereka tidak memiliki insentif untuk melakukan itu.
1996-1997: Kemunculan virus-virus H5N1 di China dan di Wilayah Administrasi Khusus Hong Kong (Hong Kong Special Administrative Region)
Kasus penyakit serius yang berhubungan dengan virus HPAI H5 keturunan Gs/GD di Asia yang secara resmi pertama kali dilaporkan adalah yang melibatkan kasus fatal pada unggas dan manusia di wilayah administrasi khusus Hong Kong pada tahun 1997 [31, 142]. Akan tetapi kasus-kasus ini sebelumnya telah didahului oleh infeksi HPAI H5N1 pada angsa di Provinsi Guangdong pada tahun 1996. Kasus pada unggas pertama di wilayah administrative Hong Kong didiagnosa pada sebuah peternakan pada bulan Maret 1997. Kasus pada manusia untuk pertama kalinya (pada anak berumur 3 tahun) telah dideteksi pada bulan Mei pada tahun yang sama, meskipun identitas virus pada manusia ini baru terdeteksi tiga bulan kemudian. Tidak ada hubungan langsung antara peternakan yang terinfeksi dan anak yang terinfeksi, dan pengujian yang dilakukan terhadap pasar unggas hidup (LBM) pada saat itu. Tidak ada kasus lain yang dilaporkan lagi sebelum bulan November 1997. Ketika itu kasus pada manusia muncul kembali dan terindentifikasi, diikuti deteksi kasus pada unggas di pasar unggas hidup (LBM) dan pada satu peternakan. Pada akhir Desember 1997, sebanyak 18 kasus pada manusia telah terdeteksi, enam diantaranya fatal. Studi kontrol kasus menunjukkan hubungan kunjungan yang dilakukan pasien ke pasar-pasar yang menjual unggas yang terjadi seminggu sebelum onset penyakit [104].
Virus-virus penyebab infeksi H5N1 adalah reassortan yang gen HA-nya diturunkan dari virus dari keturunan virus mirip Go/GD/96 dan tujuh gen lainnya merupakan keturunan dari virus-virus avian influenza (non-H5) yang lain [171]. Genotipe mirip H5N1/97 belum pernah terdeteksi lagi di lapangan sejak berhasil dimusnahkan pada akhir tahun 1997 setelah seluruh unggas yang ada di pasar-pasar dan seluruh peternakan dimusnahkan [142]. Virus dengan genotipe yang sama tampaknya terdeteksi pada telur itik dan angsa yang diimportasi dari Vietnam ke China [92], akan tetapi analisa filogenetik dari 100 lebih virus H51 dari unggas yang berbeda lokasi di Vietnam dari tahun 2001 sampai 2006, dan dari ribuan virus yang diisolasi setelah tahun itu, belum pernah lagi mengkonfirmasi adanya sirkulasi clade dan genotipe ini.
Masih tidak diketahui apakah virus-virus H5N1/97 ini muncul di Hong Kong ataupun di tempat lain. Akan tetapi, mereka memiliki banyak kesempatan untuk berkembang biak, sebagian besarnya tidak diketahui, terutama pada pasar unggas hidup (LBM) yang menjual banyak spesies unggas, termasuk unggas darat dan spesies akuatik serta beberapa burung liar. Replikasi yang tidak terkontrol dan persistensi virus-virus ini pada pasar-pasar telah memberikan kesempatan yang besar untuk virus-virus ini melakukan perubahan genetik. Hal ini dapat terjadi melalui mutasi titik yang muncul dari kurang tetapnya polimerasi virus influenza A selama replikasi, melalui reassortment mengikuti ko-infeksi pada unggas bersama dengan virus-virus influenza lain yang diketahui beredar di pasar-pasar ini. Akan tetapi, situasi ini tidak hanya unik di Hong Kong saja, akan tetapi kondisi yang sama juga terdapat di di China daratan dan di tempat-tempat lain di Asia pada waktu itu.
Telah dilaporkan bahwa sekitar 20% ayam di seluruh pasar di wilayah administrasi khusus Hong Kong terdampak virus H51 tepat sebelum pemusnahan unggas pada tahun 1997 [141]. Angka yang sering dikutip ini berasal dari prevalensi pada suatu waktu yang diambil dibawah kondisi yang tidak boasa, dan mungkin tidak merefleksikan prevalensi yang sebenarnya (True Prevalence) di pasar-pasar di bulan-bulan sebelum munculnya wabah (saat surveilans serupa dilaksanakan). Sampel yang dikumpulkan saat permintaan terhadap unggas telah kolaps, dan karena itulah unggas dipelihara di pasar-pasar yang terinfeksi dalam jangka waktu yang lebih lama, memberikan banyak kesempatan terjadinya transmisi virus di kios-kios unggas.
Perubahan gen-gen HA dari virus-virus HPAI H5N1 yang diisolasi pada tahun 1997 menunjukkan adanya evolusi yang terjadi dalam waktu 9 bulan dari Maret sampai Desember saat kasus pada unggas dan manusia terdeteksi. Keberadaan dua virus dari keturunan berbeda mengindikasikan bahwa dua strain virus telah masuk ke Hong Kong [193]. Virus lainnya adalah virus H5N1 dari keturunan HPAI H5 Gs/GD, akan tetapi berbeda dengan virus yang diisolasi di wilayah administrasi khusus Hong Kong, juga telah diisolasi dari ayam di Provinsi Hubei, China, pada tahun 1997, menunjukkan bahwa kasus-kasus pada waktu itu tidak hanya terbatas di wilayah Hong Kong saja (sebagai contohnya, virus A/chicken/Hubei/wh/1997) [178].
1998-2000: Sirkulasi virus di China
Tidak ada laporan resmi HPAI H5N1 yang dilaporkan ke OIE selama tahun 1998 sampai 2000 sama sekali dari seluruh negara di dunia. Akan tetapi, virus HPAI H5N1 berhubungan dekat dengan virus genotipe original 1996 (mirip Go/GD/96) terus bersirkulasi pada angsa di wilayah China selatan pada akhir tahun 1990-an [21]. Sampai pada tahun 2000, berbagai genotipe juga telah dideteksi pada itik domestik [24, 54]. Studi molekuler menunjukkan bahwa virus-virus reassortan ini mendapatkan gen koding baru untuk protein internal dengan kombinasi yang bervariasi dari virus-virus avian influenza yang tidak terindentifikasi, yang mungkin bersirkulasi pada burung-burung air [54].
Perluasan kisaran hospes virus HPAI H5N1 dari angsa ke itik dianggap sebagai salah satu event penting dalam pembentukan panzootik berikutnya. Studi eksperimental menunjukkan bahwa virus mirip HK/97 tidak begitu baik berdaptasi dengan itik [125]. Saat ini telah diakui bahwa itik domestik memainkan peranan vital dalam mempertahankan virus ini di lapangan dan penyebarannya kepada unggas darat [51, 154, 155, 162]. Perluasan kisaran hospes kemungkinan memainkan peranan dalam penyebaran virus-virus ini kembali kepada populasi burung liar (dan transmisinya dari burung liar kepada itik), dikarenakan adanya hubungan filogenetik yang dekat antara itik domestik dan spesies burung air liar dalam genus Anatidae, dan lingkungan hidupnya yang saling bersinggungan di banyak tempat di Asia, termasuk China [20].
2001-2002: Wabah penyakit di Wilayah Administrasi Khusus Hong Kong, dan kelanjutan sirkulasi dan evolusinya di China Daratan
Deteksi infeksi pada itik dan angsa tetap berlanjut sampai tahun 2001, dengan meningkatnya jumlah unggas air domestik yang terinfeksi secara subklinis yang terdeteksi dari pengiriman-pengiriman unggas dari China daratan ke pasar-pasar dan tempat pemotongan itik dan angsa di wilayah Administratif Khusus Hong Kong [142]. Selama periode ini, virus-virus dari clade 0, 1, 2.1.1, 2.4, 3, 4, 5, 6, 8 dan 9 terdeteksi di wilayah Administratif Khusus Hong Kong dan China daratan, menunjukkan cepatnya evolusinya [178]. Sebuah penelitian kecil terhadap unggas di pasar-pasar di Vietnam bagian utara pada tahun 2001 berhasil mengisolasi dua virus H5N1 clade 3 dari 33 sampel yang dikumpulkan dari angsa [109]. Melihat dari jumlah sampel yang sedikit, sangat tidak mungkin bahwa jumlah ini dapat mewakili hanya angsa yang terinfeksi (atau unggas lainnya) di negara itu pada waktu itu. Akan tetapi, dua tahun kemudian barulah dilaporkan wabah penyakit di Vietnam (Gambar 9.2).
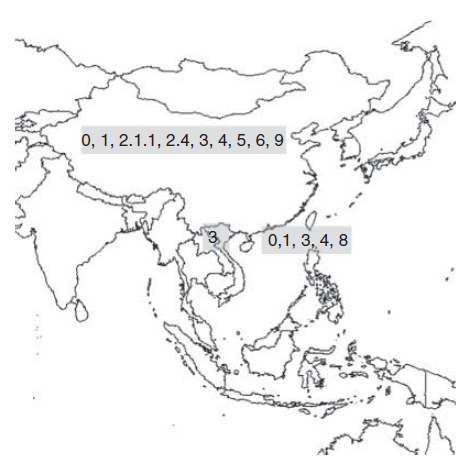
Gambar 9.2 Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode 1996-2002. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Kasus-kasus infeksi baru virus HPAI H5N1 pada unggas hidup dilaporkan di wilayah Administrasi Khusus Hong Kong dan China Daratan pada tahun 2001, yang pertama kali dilaporkan sejak tahun 1997 [142]. Berdasarkan kombinasi kode gen-gen protein internal, tujuh genotipe H5N1 yang sangat berbeda (salah satunya mirip Go/GD/6 dan yang lainnya virus hasil reasortan) telah teridentifikasi pada unggas hidup di wilayah Administrasi Khusus Hong Kong dan Provinsi Guangdong, China pada tahun itu, dan setidaknya lima genotipe lagi terindentifikasi pada unggas di wilayah Administrasi Khusus Hong Kong pada tahun 2002 [54, 142]. Virus-virus ini menyebabkan wabah penyakit di wilayah Administrasi Khusus Hong Kong untuk pertama kalinya sejak tahun 1997. Penyakit yang terjadi pada pasar unggas hidup (LBM) pada bulan Mei 2001 (utamanya disebabkan clade 3), dan pada peternakan dan pasar-pasar pada awal tahun 2002 (utamanya disebabkan clade 0, 4, dan 8).
Tidak ada laporan resmi penyakit ini di Cina Daratan pada tahun 2001 dan 2002. Akan tetapi, virus HPAI H5N1 telah diisolasi dari berbagai spesies, diantaranya ayam, itik, burung puyuh, dan burung pegar, dengan kasus yang membentang dari Provinsi Guangxi ke Provinsi Jilin [24, 178].
Diantara virus-virus yang diisolasi dari unggas darat di wilayah Administratif Khusus Hong Kong pada tahun 2002, terdapat salah satu yang disebut genotipe “Z”. Virus inilah yang kemudian menjadi genotipe dominan (akan tetapi bukan satu-satunya) yang berhubungan dengan panzootik yang terjadi di dekade awal abad dua puluh satu. Perwakilan genotipe “Z” yang pertama kali adalah virus yang diisolasi dari itik yang sehat di Provinsi Guangxi, Cina pada tahun 2001 [24].2 Virus-virus ini telah terus menerus berevolusi (melalui mutasi pada gen-gen individual), sedemikian rupa sehingga virus genotipe “Z” diisolasi dari satu lokasi di waktu-waktu yang berbeda, dan bahkan virus yang diisolasi dari negara-negara berbeda pada waktu yang sama memiliki perbedaan genetik dan antigenik yang signifikan berdasarkan sekuens gen dan profiling antibodi [55, 91]. Kombinasi gen protein internal yang membentuk genotipe “Z” dihubungkan dengan berbagai clade HA yang berbeda.
Tahun 2001 juga mencatat kasus pertama virus HPAI H5N1 yang dilaporkan yang menginfeksi mamalia selain manusia. Babi ditemukan terinfeksi di Provinsi Fujian, China pada tahun 2001. Tidak jelas apakah penyakit klinis yang dilaporkan pada beberapa dari babi-babi ini dikarenakan infeksi virus H5N1 [91]. Ditambah lagi, setidaknya satu ekor harimau ditemukan terinfeksi di Harbin pada tahun 2002 [23]. Berdasarkan pengalaman di Thailand pada tahun 2004, sumber infeksi yang paling mungkin adalah unggas yang telah terinfeksi.
Daging itik yang terifeksi diimpor dari Cina ke Korea Selatan pada tahun 2001 [163], meskipun tidak ada wabah penyakit yang terkairt dengan virus ini ataupun strain-strain virus yang terdeteksi di negara pengimpor. Temuan ini menunjukkan potensi persebaran infeksi melalui produk asal unggas yang terkontaminasi atau terinfeksi.
Temuan tambahan baru muncul pada tahun 2002, saat burung-burung liar pada dua tempat koleksi zoologi di Daerah Administratif Khusus Hong Kong menunjukkan penyakit fatal dan ditemukan terinfeksi virus dari keturunan virus HPAI H5N1 Gs/GD. Wabah yang pertama terjadi pada koleksi zoologi di Taman Penfold (Shating, New Territories) [41], dan virus yang menyebabkannya termasuk kedalam clade 1. Taman tersebut, yang terletak di tengah area pacuan, memiliki sebuah danau kecil yang merupakan rumah dari sejumlah burung air koleksi taman tersebut. Burung Little egrets (Egretta garzetta) dapat mengakses tempat itu, dan setidaknya satu dari burung-burung ini (yang ditemukan mati didekat Taman tersebut) terinfeksi virus ini [41,55]. Wabah kedua pada burung-burung pada tempat koleksi zoologi terjadi di Taman Kowloon pada akhir tahun 2002 dan awal tahun 2003, sekitar 13 km dari wabah yang pertama terjadi. Wabah ini dapat dikendalikan dengan kombinasi isolasi, depopulasi terbatas, dan vaksinasi, dan melibatkan berbagai spesies tangkaran yang sangat luas. Sumber dari virus masih belum ditentukan [41].
2003: Kemunculan virus H5N1 di wilayah-wilayah lain di Asia
Lebih banyak kasus infeksi yang lainnya bermunculan pada pasar unggas hidup (LBM) di Daerah Administrasi Khusus Hong Kong, dan wabah juga terjadi pada beberapa peternakan ayam dimana wabah dikendalikan dengan menggunakan kombinasi depopulasi terbatas dan vaksinasi [42]. Isolat HPAI H5N1 terakhir dari pasar unggas hidup di wiayah administrasi khusus Hong Kong, sampai Juni 2008, telah terdeteksi di bulan November 2003, tepat sebelum perkenalan vaksinasi untuk seluruh unggas dari China daratan yang diperuntukkan untuk wilayah administrasi Hong Kong, akan tetapi pada pasien-pasien kemudian muncul gejala klinis di Provinsi Fujian sebelum kembali ke wilayah administrasi khusus Hong Kong [55, 121]. Virus-virus ini memiliki hubungan dekat dengan virus yang terdeteksi pada burung liar di akhir tahun 2002 (misalnya: mereka memiliki konstelasi gen yang sama dan tidak ada penghapusan asam amino pada cabang NA). Gen HA virus-virus ini dikelompokkan dalam clade 1. Virus ini merupakan reasortan dengan gen PB2 yang tampaknya diturunkan dari keturunan virus Amerika Utara dan sebuah gen NA yang berbeda untuk isolat manusia. Diantara clade yang terdeteksi untuk pertama kalinya di China daratan selama tahun 2003 adalah virus-virus dari clade 2.3.2, 2.3.1, dan 2.5. Hal ini sekali lagi mendemonstrasikan sejauh mana sirkulasi virus dan evolusi yang ada [178].
Munculnya SARS (severe acute respiratory syndrome) pada tahun 2003 mungkin telah memicu kesalahan diagnose (misdiagnosis) pada beberapa kasus penyakit parah terkait H5N1 pada manusia. Kemungkinan ini didemonstrasikan dengan terdeteksinya kasus-kasus seperti itu di Beijing pada akhir tahun 2003. Kasus ini disebabkan oleh virus clade 7 dan belum terindenifikasi sebagai keturunan virus H5N1 Gs/GD kecuali sampai beberapa tahun setelah kejadian [194].
Laporan resmi pertama penyakit yang berhubungan dengan HPAI H5N1 di luar wilayah administratif khusus Hong Kong di tahun 2003 datang dari Korea Selatan. Hasil investigasi menunjukkan bahwa infeksi subklinis pada itik mendahului terdeteksinya penyakit pada ayam domestik [172]. Negara-negara lain dimana penyakit telah muncul pada unggas, hewan di penangkaran, maupun manusia pada akhir tahun 2003 meliputi Indonesia [34], Vietnam [84], Jepang [99], Thailand [72], dan Kamboja [35], meskipun penyakit belum dilaporkan sebelum 2004.
Pada tahun 2003, virus HPAI H5N1 keturunan Gs/GD dengan sub-keturunan baru telah terdeteksi pada angsa di wilayah otonomi khusus Xinjiang [32], yang merupakan laporan adanya infeksi untuk pertama kalinya dari wilayah barat laut China. Studi pasar dilakukan di wilayah provinsi-provinsi selatan berhasil mengindentifikasi infeksi di China baik pada unggas darat maupun air [91]. Bukti serologis adanya infeksi virus H5 pada babi juga dilaporkan dari Provinsi Fujian dan Guangdong. Di tambah lagi, satu virus H5N1 telah diisolasi dari babi di sebuah wilayah di Provinsi Fujian dimana infeksi pada babi telah terdeteksi sebelumnya.
2004: Respons terhadap wabah di Asia dan evolusi virus
Pada dua bulan awal tahun 2004, wabah HPAI H5N1 dilaporkan secara resmi dalam waktu singkat dan saling berturutan oleh sejumlah negara di Asia, meliputi negara-negara yang telah disebutkan sebelumnya, demikian juga Laos dan China. Pada bulan Agustus 2004, Malaysia juga melaporkan adanya infeksi. Penyakit dan upaya pengendalian yang diimplementasikan di wilayah itu (terutama sebagian bear didasarkan pada stamping out di dalam cincin besar yang melingkupi wilayah terinfeksi, bersama dengan pengendalian pergerakan hewan ternak) berakiba kehilangan unggas yang besar. Beberapa negara (misalnya Jepang, Korea Selatan, dan Malaysia), mengeliminasi virus, akan tetapi upaya pengendalian yang digunakan tidak berakibat eliminasi virus di wilayah itu. Sukses telah dicapai di negara-negara dimana infeksi terdeteksi lebih awal, virus tidak didesiminasikan secara luas, infrastruktur veteriner telah berkembang. Kurangnya kesuksesan eradikasi kasus di wilayah-wilayah lain dikarenakan beberapa factor, diantaranya terbatasnya kapasitas layanan veteriner, kegagalan peternak dalam melaporkan ataupun mengenali penyakit, infeksi yang tersebar luas di peternakan-peternakan yang tidak memiliki biosekuriti, rantai pemasaran yang kompleks yang sering melibatkan penjualan unggas melalui pasar unggas hidup (LBM) yang tidak memiliki aturan yang baik, terpeliharanya virus pada unggas air yang terinfeksi secara subklinis, dan sulitnya implementasi pengendalian pergerakan yang tepat [144].
Pada tahun 2004, tidak ada infeksi yang dilaporkan pada unggas komersial di wilayah administratif khusus Hong Kong, akan tetapi sampel dengan hasil positif didapatkan dari burung yang terbang bebas, meliputi peregrine falcon (Falco peregrinus) pada awal 2004 (clade 9), dan gray heron (Ardea cinerea) (clade 2.3.2) [178]. Virus-virus H5N1 juga telah diisolasi dari free-flying tree sparrow (Passer montanus) di Provnsi Henan, China. Virus-virus ini adalah reasortan yang membentuk genotipe baru di dalam clade 7 [79]. Temuan ini mendemonstrasikan adanya potensi penting dari berbagai burung liar dalam transmisi lokal virus HPAI H5N1 keturunan Gs/GD (Gambar 9.3).
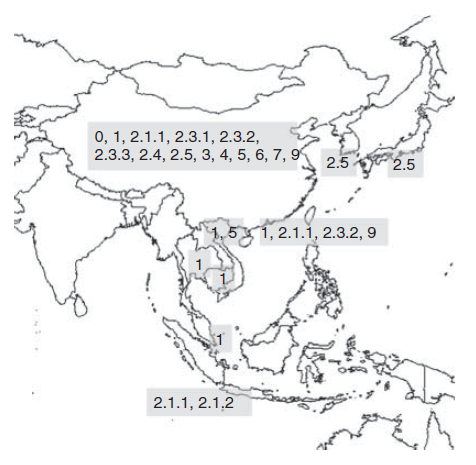
Gambar 9.3 Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode 2003-2004. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Selama tahun 2004, terdapat kenaikan jumlah kasus pada manusia yang cukup tinggi, terutama di Thailand dan Vietnam, demikian juga kasus-kasus tambahan pada mamalia [182]. Salah satu wabah yang penting pada harimau di suaka margasatwa di Thailand menyebabkan kematian lebih dari 45 ekor harimau, dan mungkin telah berakibat adanya transmisi antar harimau meskipun terbatas [160]. Sebagian besar kasus mungkin disebabkan pemberian karkas ayam yang terinfeksi sebagai makanan harimau, meskipun saat ini telah dikenali bahwa kontak dekat antara felid yang diinfeksi secara eksperimental dapat melanjut menjadi transmisi infeksi [130]. Kesimpulan ini juga didukung oleh kasus-kasus subklinis pada kucing domestik di Austria pada tahun 2006 yang terjadi di penampungan hewan sebagai akibat paparan dengan burung liar terinfeksi yang dipelihara di kandang terdekat. Penyebaran infeksi pada kasus di Austria ini dianggap melalui kontak dekat, daripada melalui ingesti burung yang terinfeksi [88].
Virus yang diisolasi dari kasus yang baru dilaporkan di tahun 2003-2004 menunjukkan keragaman genetik yang cukup besar, walaupun pada saat yang sama menunjukkan homogenitas genetik yang cukup signifikan antar isolat yang ditemukan di negara yang terinfeksi ataupun kelompok negara-negara, menunjukkan satu kejadian masuknya virus atau banyak kejadian masuknya virus yang identik. Virus-virus di Indonesia (clade 2.1) berbeda dengan yang ditemukan di Thailand, Vietnam, Laos, Kamboja, dan Malaysia (clade 1), dan dari yang diisolasi di Jepang dan Korea Selatan (clade 2.5). Satu-satunya pengecualian adalah negara China, dimana beragam genotipe virus dan sub-keturunan telah diidentifikasi dan dan beberapa clade baru telah diidentifikasi, termasuk clade 2.3.3. Bahkan dalam satu provinsi saja terdapat variasi virus-virus yang diisolasi tahun 2004 [189].
2005: Danau Qinghai dan pergerakan virus menuju arah barat
Kejadian-kejadian di tahun 2005 didominasi oleh deteksi dan kemunculan clade baru virus H5N2 yang teridentifikasi pada burung migrasi di Provinsi Qinghai di barat laut China (clade 2.2). Deteksi virus ini didahului oleh temuan virus HPAI H5N1 dengan gen yang serupa dengan yang ditemukan di Qinghai pada itik liar di Danau Poyang di Provinsi Jiangxi, China pada awal 2005 [26], meskipun hubungan migrasi antara dua tempat itu masih belum diketahui. Asal muasal dari clade ini masih tetap belum jelas [25, 27]. Virus-virus dalam clade ini berbeda dengan yang diisolasi sebelumnya dari burung liar atau unggas, yitu bahwa hampir semua virus dalam clade 2.2 yang diisolasi setelah deteksi di Qinghai memiliki mutasi E627K di protein PB2nya, sebuah ciri yang biasanya diasosiasikan dengan virus yang berasal dari mamalia. Masih belum jelas bagaimana ataupun dimana mutasi ini pertama kali terjadi, karena tidak ada satupun virus yang diisolasi dari Danau Qinghai ataupun Danau Poyang memiliki mutasi ini [25,27], berbanding terbalik dengan hampir seluruh virus dalam clade ini yang kemudian diisolasi. Kejadian ini memunculkan kekhawatiran bahwa virus H5N1 dengan ciri-ciri yang berpotensi untuk menginfeksi mamalia dan meningkatkan patogenitas pada manusia akan disebarkan oleh burung liar selama perjalanan migrasi ataupun pergerakan lokal mereka. Strain clade ini kemudian terdeteksi pada burung liar dan unggas di Rusia selatan dan Kazakhstan, dan pada burung liar di Mongolia [27]. Wabah di Rusia selatan dan Kazakhstan terutama melibatkan flok unggas kecil di tempat yang terisolasi dimana unggas dan burung liar berbagi lingkungan hidup yang sama. Kasus-kasus pada burung liar di Mongolia terjadi di wilayah-wilayah dimana tidak ada peternakan unggas.
Pada awal Oktober 2005, virus yang berhubungan dekat yang masuk ke dalam clade 2.2 dihubungkan dengan wabah penyakit unggas di Turki dan Rumania. Wabah di Turki berlanjut sampai tahun 2006, dan menyebar dari timur ke barat negara itu, dengan kasus-kasus terdeteksi pada unggas dan burung liar. Pengendaliannya dilakukan dengan stamping out, pembatasan pergerakan unggas dan karantina. Infeksi menyebar di Rumania dimana virus telah menetap sementara pada populasi unggas pedesaan di Danube Delta. Kasus-kasus yang dilaporkan pada unggas di Rumania terbatas terutama pada flok unggas kecil dan beberapa peternakan besar antara Oktober 2005 dan Juni 2006 [170]. Ditambah lagi, virus dilaporkan pada unggas dan burung liar di Ukraina. Mungkin, yang paling signifikan adalah ditemukannya virus pada burung mute swan (Cygnus olor) yang mati di Kroasia di bulan Oktober 2005, akantetapi tidak ada infeksi pada unggas di wilayah yang lebih luas. Temuan in kemudian diikuti dengan 16 kasus lain pada burung mute swan, itik mallard, dan burung black-headed gulss yang tampak sehat [138]. Lebih jauh lagi, virus H5N1 clade 2.2 terdeteksi pada burung wild teal hidup di Mesir pada akhir tahun 2005 [135], yang merupakan laporan pertama virus HPAI H5N1 di Afrika.
Negara-negara asia meliputi China, Thailand, Kamboja dan Indonesia terus mendeteksi dan melaporkan kasus infeksi dan penyakit pada unggas dan manusia yang disebabkan oleh strain virus selain yang berada dalam clade 2.2 (meskipun beberapa kasus di Provinsi Liaoning di China utara dihubungkan dengan virus dari clade 2.2 [178], demikian juga satu kasus pada Harimau di Shanghai [106]. Sampai tahun 2005 setidaknya ada tiga sub keturunan virus yang berbeda terdapat di Vietnam [84] (c;ade 1, 2.3.2, dan 8), yang mengindikasikan adanya pemasukan virus tambahan dari tempat lain [84, 149]. Virus dari clade 2.3.4 pertama kali terdeteksi di China pada tahun 2005 [174]. Clade ini telah menjadi penyebab penting dari penyakit yang terjadi selama beberapa tahun. Virus-virus yang diturunkan dari clade ini menyebar ke Amerika Utara dan Eropa pada tahun 2014-2015.
Seekor burung Chinese pond heron (Ardeola bachus) yang terinfeksi ditemukan di wilayah administrasi khusus Hong Kong melalui surveilans burung mati (clade 2.3.2), akan tetapi tidak ada kasus infeksi yang ditemukan pada unggas. Kasus pada mamalia tambahan lainnya terdeteksi pada tahun 2005 pada musang Owston’s banded palm civets (Chrotogale owstoni) di Vietnam utara [133].
2006-2007: Wabah di tiga benua
Pada tahun 2006, infeksi dengan virus H5N1 dari clade 2.2 melanjutkan sebarannya melalui Afrika Barat, Eropa Barat, Asia Barat, dan Timur Tengah, yang menimbulkan dampak pada burung liarm unggas, manusia, dan mamalia lainnya. Kasus-kasus infeksi dan penyakit tambahan terus ditemukan di Asia, termasuk kasus-kasus di negara-negara dimana penyakit tidak pernah dilaporkan dalam 3 tahun, dan pada negara-negara yang sebelumnya tidak pernah melaporkan penyakit. Banyak dari kasus-kasus ini yang disebabkan oleh virus yang termasuk kedalam clade 2.3.2 dan 2.3.4.
Di Afrika, infeksi dan penyakit yang dihubungkan dengan virus H5N1 dari clade 2.2 dilaporkan pada unggas, terutama di Nigeria [39], dan kemudian di negara-negara lain di Afrika Barat meliputi Nigeria, Burkina Faso, Kamerun, Pantai Gading, Ghana dan Togo. Deteksi di Nigeria kemudian diikuti oleh deteksi infeksi di Mesir, Sudan dan Djibouti. Penyakit di Mesir dan Nigeria ditemukan pada unggas di peternakan komersial dan unggas yang dipelihara di belakang rumah.
Penyakit yang utamanya pada unggas juga telah dilaporkan di Myanmar, Pakistan, India, Afganistan, Irak, Iran, Israel, Yordania, dan Palestina pada seperempat awal tahun 2006. Tingginya jumlah kasus yang terdeteksi di sepanjang Asia Barat dan Timur Tengah dalam waktu yang relatif bersamaan mengindikasikan bahwa virus tersebut telah menyebar luas di wilayah ini. Sumber infeksi dan rute pemasukan virus untuk sebagian besar negara ini belum ditentukan, akan tetapi seluruh virus yang terdeteksi dari 2006 sampai 2008 dari negara-negara ini, dengan pengecualian yang berasal dari Myanmar [176], tergolong kedalam clade 2.2 atau turunannya (Gambar 9.4). Kejadian virus ini yang terbatas pada unggas di Asia Timur, dan fakta bahwa virus ini terdeteksi pada burung liar tanpa terdeteksi juga pada unggas (demikian juga pemasukan berulang di tahun-tahun berikutnya) memberikan bukti tidak langsung yang kuat yang menunjukkan peranan burung liar dalam pemasukan virus ke wilayah-wilayah baru. Hal ini berlaku terutama untuk tempat-tempat yang tidak memiliki jalur perdagangan langsung unggas ataupun produk asal unggas dari negara-negara dimana terdapat virus ini. Akan tetapi, kemungkinan perdagangan unggas hidup dan/atau komoditas unggas illegal pada beberapa kasus tidak bisa dikecualikan.
Di negara-negara anggota Uni Eropa antara Januari dan Mei 2006, virus-virus H5N1 dideteksi ataupun diisolasi dari 748 ekor burung liar yang mati dari sekitar 60 spesies burung [127]. Puncak insidensi terjadi di pertengahan bulan Maret, yang bersamaan dengan kondisi cuaca buruk. Klaster burung yang positif H5N1 dideteksi di beberapa wilayah, seperti Laut Baltik dan Delta Danube, akan tetapi pemasukannya pada unggas bersifat terbatas, dengan hanya lima negara anggota (Denmark, Perancis, Jerman, Hungaria, dan Swedia) yang melaporkan terjadinya wabah. Wabah-wabah ini terutama terjadi pada sistem produksi luar ruangan yang melibatkan berbagai spesies unggas [127]. Sampai awal Juli, infeksi telah dilaporkan di 26 negara Eropa, dimana 25 negara melaporkan populasi burung liar terinfeksi dan 11 negara melaporkan wabah pada unggas. Dari 11 negara ini, 4 negara (Denmark, Perancis, Jerman, dan Swedia) sukses menahan satu wabah. Akan tetapi persebaran yang ekstensif pada unggas dilaporkan di Hungaria, Rumania, Federasi Rusia, Turki, dan Ukraina, terutama pada sistem produksi luar ruangan. Keberadaan virus ini pada burung liar di banyak negara sedangkan tidak ada laporan penyakit pada unggas memberikan bukti lebih lanjut tentang masuknya virus ke negara-negara ini melalui burung liar. Pada tahun 2007 (baik awal maupun akhir musim dingin) terdapat sejumlah wabah dengan jumlah terbatas yang dihubungkan dengan virus clade 2.2 pada unggas domestic di Republik Chechnya, Jerman, Hungaria, Polandia, Rumania dan Inggris, sementara pada tahun 2006 konsisten dengan temuan epidemiologi dimana terdapat kasus pada burung liar di Republik Chechnya, Perancis, Jerman, dan Polandia.
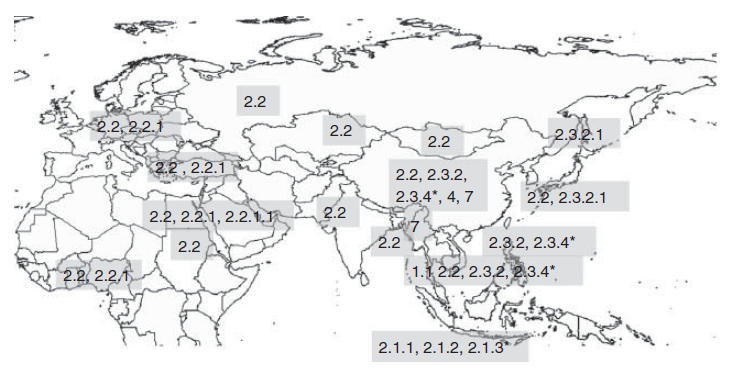
Gambar 9.4. Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode 2005-2008. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Selain wabah-wabah yang terjadi pada unggas dan burung liar, lima negara di Timur Tengah dan Afrika melaporkan infeksi/ kematian pada manusia pada tahun 2006 – 2007, meliputi Azerbaijan (8/5), Djibouti (1/0), Mesir (43/19), Irak (3/2), dan Turki (12/4) [182]. Seluruh kasus ini tampaknya terjadi di tempat-tempat dimana terdapat hubungan yang dekat antara unggas dan manusia. Beberapa kasus di Azerbaijan kemungkinan berhubungan dengan proses pencabutan bulu angsa liar mati [175], yang dicurigai terinfeksi virus HPAI H5N1. Kasus-kasus di Mesir sebagian besarnya dihubungkan dengan unggas yang dipelihara oleh rumah tangga.
Infeksi pada unggas di Indonesia tetap bersifat endemik. Analisa genetik virus dari isolat mengungkapkan bahwa semuanya termasuk kedalam kelompok clade 2.1 dan turunannya, akan tetapi cukup heterogen, yang mencerminkan evolusi seiring penyebarannya di seluruh negeri [149]. Sampai akhir tahun 2006, infeksi telah menyebar ke arah timur sampai Papua Barat, dan telah menyebar ke 29 Provinsi dari 33 Provinsi. Konsisten dengan menyebarnya infeksi secara luas pada unggas-unggas di Indonesia, meningkatnya kasus pada manusia juga terindentifikasi (97 kasus dengan 82 kematian di tahun 2006-2007). Sampai Agustus 2006, Indonesia telah mencatat kasus kematian karena virus HPAI H5N1 dalam jumlah yang lebih banyak dari negara lain. Kasus ini mencakup setidaknya satu klaster kasus yang besar di Sumatra dimana transmisi terbatas dari manusia ke manusia mungkin terjadi, meskipun sulit untuk membuktikan bahwa tidak ada sumber paparan pada kasus ini dan klaster-klaster lainnya [122]. Kasus-kasus pada manusia selanjutnya di Asia di tahun 2006 dan 2006 dilaporkan di China (18 kasus klinis/ 11 kasus kematian), Thailand (3/3), Laos (2/2), Pakistan (3/1), Vietnam (8/5), dan Kamboja (3/3) [182]. Tidak ada kasus pada manusia yang dilaporkan di Vietnam selama tahun 2006, yang mungkin berhubungan dengan banyaknya upaya pengendalian yang sudah dilakukan untuk mengendalikan penyakit pada unggas, termasuk pelaksanaan vaksinasi berskala besar. Tidak ada kasus pada manusia yang terdeteksi lagi di Thailand sejak 2006 dan di Laos sejak 2007.
Kasus penyakit baru pada unggas dilaporkan di Thailand (setelah periode lebih dari 6 bulan tanpa laporan kasus), Laos, dan Kamboja. Beberapa kasus di Thailand disebabkan oleh virus dari clade 1, mengindikasikan bahwa virus-virus ini masih bersirkulasi di wilayah itu. Akan tetapi, infeksi pada manusia dan infeksi pada unggas lainnya di Thailand dan Laos disebabkan oleh virus dari clade 2.3.4, yang mengindikasikan masuknya virus dari garis keturunan lain selain virus yang sudah diisolasi di tahun 2004 [30] (Gambar 9.4).
Vietnam mendeteksi virus melalui surveilans bertarget terhadap itik yang tidak divaksinasi, mengindikasikan bahwa resiko infeksi pada unggas darat tetap tinggi. Tidak ada wabah penyakit yang dilaporkan pada unggas di Vietnam pada tahun 2006 sampai Desember, dimana itik yang tidak terinfeksi di selatan Vietnam di Delta Mekong menunjukkan gejala klinis. Kasus penyakit sporadis terdeteksi pada tahun 2007, terutama pada itik Peking dan Entok. Virus di bagian selatan Vietnam termasuk ke dalam clade 1.1, sementara virus yang ada di bagian utara termasuk dalam kelompok clade 2.3.2 dan 2.3.4 dan turunannya [84]
Pada setengah tahun 2006, infeksi pada burung-burung liar dilaporkan kembali China Barat Laut, terutama di Xinjiang, Tibet dan Qinghai [179]. Virus juga dideteksi pada burung liar di Mongolia pada saat yang bersamaan [52]. Virus clade 2.2 tidak terdeteksi lagi di wilayah-wilayah ini pada tahun-tahun berikutnya. Wabah penyakit yang baru terjadi pada unggas di beberapa provinsi di wilayah utara, terutama pada peternakan ayam petelur. Salah satu dari wabah ini, yang terjadi di Provinsi Shanxi pada bulan Juni 2006, mengakibatkan pemusnahan lebih dari 1,7 juta ekor unggas. Wabah ini disebabkan oleh virus baru uang secara antigenik dan filogenetik berbeda dengan strain yang sebelumnya, yang termasuk ke dalam clade 7 [37]. Darimana tepatnya strain ini berasal masih tidak diketahui, meskipun masih termasuk juga kedalam virus HPAI H5N1 dari keturunan Gs/GD. Vaksin baru yang berdasarkan antigen virus ini telah diproduksi setelah wabah ini terjadi yang diperuntukkan untuk digunakan di China. Virus-virus dari clade 7 terus berevolusi di China sampai membentuk clade 7.2, yang juga terdeteksi di Vietnam.
Sampel pasar dari China bagian selatan juga ditemukan positif virus HPAI H5N1 pada tahun 2006 dan 2007 – yang utamanya didominasi clade 2.3.2 dan 2.3.4, akan tetapi tidak semuanya [148]. Tingkat pemulihan virus dari swab yang dikoleksi dari pasar menunjukkan pola yang mengikuti pola yang terlihat di tahun-tahun sebelumnya, dimana tingkat isolasi meningkat pada musim dingin.
Surveilans aktif di wilayah administratif Hong Kong akhirnya membuahkan isolasi virus dari burung yang mati dari 15 lokasi pada empat bulan pertama tahun 2006, dan 14 lokasi pada empat bulan pertama tahun 2007 dengan menggunakan strategi surveilans yang sama [43]. Dua ayam yang diselundupkan juga positif virus H5N1 di empat bulan pertama tahun 2006. Virus-virus yang diperiksa di tahun 2006 sebagian besar berasal dari clade 2.3.2, menunjukkan masuknya virus yang berbeda. Virus clade 2.3.4.3 pertama kali terdeteksi pada burung liat di wilayah administrasi khusus Hong Kong pada tahun 2007.
Virus telah diisolasi dari beberapa spesies burung passerine dan juga dari burung-burung pemangsa. Pada tahun 2007, tidak ada ditemukan hasil positif virus dari burung-burung air liar yang mati, hal ini berbanding terbalik dengan tahun sebelumnya, dimana burung-burung liar yang mati seperti bangau besar, burung camar dan bangau laut ditemukan terinfeksi. Pola musiman tampak disini, dengan seluruh kasus di tahun 2006 dan sebagian besar kasus di 2007 terdeteksi antara bulan Januari dan Maret, meskipun dilakukan surveilans intensif terhadap burung yang mati disepanjang tahun.
Kasus-kasus infeksi dan penyakit pada mamalia juga dilaporkan, meliputi kucing (di Jerman, Austria dan Indonesia), musang batu (Jerman)m dan mink (Swedia) [128]. Semua kejadian ini dipercaya sebagai hasil dari kontak dekat dengan unggas ataupun dari memakan burung yang mati. Juga terdapat beberapa laporan infeksi dan penyakit pada burung Plateau pikas di China bagian barat [192].
Pada Februari 2007, penyakit terjadi pada peternakan kalkun di Suffolk, Inggris [199]. Analisis gen virus-virus ini mendemonstrasikan hampir 100% kesamaan dengan virus-virus yang berasal dari wabah yang terjadi di saat bersamaan pada angsa di Hungaria. Investigasi lebih lanjut mengungkapkan bahwa daging yang belum diolah dari Hungaria telah dibawa ke fasilitas pengolahan daging yang berdekatan dengan peternakan kalkun. Akan tetapi, hubungan dengan daging ini dan peternakan yang terinfeksi di Hungaria masih belum dapat ditentukan. Pelanggaran biosekuriti terdeteksi terjadi pada peternakan kalkun tersebut [8]. Wabah-wabah lainnya terjadi pada November 2007 di flok-flok kalkun yang diumbar, sekali lagi di Suffolk. Kejadian ini tidak berhubungan secara langsung dengan wabah awal, dan virus penyebabnya hampir pasti masuk melalui burung-burung liat. Di tempat lain di Eropa, virus terdeteksi pada unggas di Jerman, Polandia, dan Rumania. Semua kasus ini disebabkan olelh virus-virus clade 2.2.
Pada tahun 2007, wabah penyakit juga dilaporkan secara luas di Bangladesh, negara yang belum pernah melaporkan adanya infeksi sebelumnya. Kemudian diikuti dengan laporan penyakit di West Bengal, India. Wabah-wabah ini disebakan oleh virus clade 2.2. penyakit juga melanda sejumlah peternakan ayam layer di Kuwait, dan kemudian dikendalikan dengan stamping out sebagian besar flok ayam layer di negara itu. Penyakit pertama kali terdeteksi pada Februari 2007 pada unggas belakang rumah, tetapi kemudian menginfeksi unggas komersial. Arab Saudi melaporkan wabah pertama kalinya pada bulan April 2007. Clade virus 2.3.4 terdeteksi di Malaysia pada tahun 2007.
Sampai tahun 2007 virus-virus clade 1.1 bersirkulasi di Vietnam selatan dan Kamboja. Virus-virus dalam clade 2.3.4.1 dan 2.3.4.3 juga telah diidentifikasi di Vietnam (Gambar 9.4).
2008-2010: Penyebaran clade 2.3.2.1 dan evolusi clade 2.3.4
Periode 2008-2010 melihat kejadian transisi virus yang sebelumnya dominan menjadi tidak dominan lagi. Virus-virus clade 2.2 yang telah terdeteksi di Eropa sejak tahun 2005 tidak terdeteksi lagi di sana sejak Januari 2009, dan kemudian diikuti dengan gelombang wabah penyakit virus H5N1 menuju ke arah barat pada tahun 2009 dan 2010, kali ini melibatkan virus yang berasal dari clade 2.3.2.1c. strain virus ini telah mencapai sejauh Bulgaria dan Rumania. Tampaknya pemasukan virus berasal dari burung liar. Clade ini telah menyebar dan sepertinya telah bertahan (setidaknya sementara) pada burung-burung liar, karena hasil surveilans dari wilayah menuju jauh ke timur telah mendeteksi strain-strain ini terutama pada burung-burung air akan tetapi juga pada burung pemangsa. Kasus terakhir pada burung liar di Eropa yang berhubungan dengann clade 2.2 terdeteksi pada itik mallard di Jerman pada bulan Januari 2009. Virus-virus clade 2.2 tetap bertahan selama tahun 2010 di Asia Selatan, dan merupakan penyebab wabah baru di Nepal dan Bhutan. Virus-virus ini serupa dengan yang ditemukan di India dan Bangladesh. Ko-sirkulasi clade virus 2.3.2.1 dan 2.2 terjadi di sub wilayah ini pada tahun 2011. Virus-virus dari clade 2.3.4 tetap melanjutkan evolusinya untuk membentuk clade ordo keempat, yang beberapa diantaranya telah menghilang sementara yang lainnya menetap.
Periode ini juga adalah masa dimana telah diakui bahwa virus-virus H5N1 telah menjadi menetap dengan kuat di sejumlah negara, dan bahwa eliminasi virus tampaknya tidak dapat dicapai di tempat-tempat itu setidaknya dalam 10 tahun kedepan [44]. Akan tetapi, beberapa kesuksesan besar juga telah dicapai. Sejak tahun 2009, Thailand [156] dan Nigeria [133] tidak lagi mendeteksi kasus HPAI H5N1, meskipun kemudian kembali mengalami wabah dikarenakan masuknya virus baru pada tahun 2015. Selama periode ini, kasus-kasus baru HPAI H5N1 tidak dilaporkan lagi di Pakistan.
Pada tahun 2008, wilayah administrasi khusus Hong Kong melaporkan kasus H5N1 yang pertama kali pada unggas komersial sejak tahun 2003, dimana virus baru dari clade 2.3.4 terdeteksi pada beberapa pasar eceran di bulan Juni dan kemudian pada peternakan komersial di bulan Desember [146]. Strain virus tertentu ini adalah sebuah varian antigenik yang membuat vaksin yang dipakai saat itu tidak mampu memberikan perlindungan optimal. Wabah pada bulan Desember hanya melibatkan satu peternakan, akan tetapi berdampak terganggunya perdagangan unggas. Rute masuknya virus belum dapat ditentukan, akan tetapi burung-burung liar dianggap sebagai sumber yang paling memungkinkan, karena burung-burung itu juga terdapat di peternakan, dan membangun sarang di dekat kandang-kandang ayam.
Virus yang serupa juga telah diisolasi dari burung peregrine falcon liar pada saat yang sama. Ditambah lagi clade 2.3.2.1 terdeteksi pada burung liar di wilayah administrasi khusus Hong Kong pada tahun 2008 dan 2009 [150].
Pada bulan Desember 2010, wilayah administrasi khusus Hong Kong mendeteksi kejadian untuk pertama kalinya sejumlah ayam dan itik yang mati yang terinfeksi virus HPAI H5N1 yang terdampar di pantai, terutama di pulau-pulau terluar [145]. Sumber unggas-unggas ini tidak dapat dintentukan, akan tetapi karkas-karkas unggas mati ini juga ditemukan di kepala delta sungai Pearl, yang menunjukkan bahwa karkas itu mungkin terbawa hanyut dari hulu atau mungkin dibuang dari kapal-kapal yang membawa unggas.
Kasus importasi pada manusia juga terdeteksi di wilayah administrasi khusus Hong Kong di tahun 2010 [19]. Virusnya berasal dari clade 2.3.2.1c. Kasusnya adalah pada penduduk Hong Kong yang memiliki sejarah perjalanan ke beberapa kota di China daratan di sekitar Jiangsu dan Shanghai.
Di sepanjang periode ini Kementerian Pertanian China terus melaporkan kasus-kasus infeksi pada unggas yang terdeteksi selama pelaksanaan surveilans rutin. Tingginya persentasi sampel positif dari itik lebih tinggi daripada ayam [101]. Kasus-kasus pada manusia di China selama periode sebagian besarnya disebabkan oleh clade virus 2.3.4 dan turunannya, dengan hanya tiga kasus yang disebabkan oleh virus-virus clade 2.3.2.1 (termasuk kasus importasi di wilayah administrasi khusus Hong Kong) [169].
Pada tahun 2008, Jepang dan Korea Selatan melaporkan terjadinya wabah penyakit yang berhubungan dengan virus clade 2.3.2.1. Akan tetapi, tidak seperti dua wabah sebelumnya, wabah ini terjadi di bulan April. Hanya kasus-kasus pada burung liar yang terdeteksi di Jepang. Virus yang sangat serupa kemudian ditemukan di Rusia timur jauh [150], akan tetapi tidak terdeteksi jauh ke barat, dan tidak nampak adanya invasi di jalur terbang (flayways) Amerika Utara, seperti yang terjadi pada akhir tahun 2014 dan awal 2015. Salah satu virus yang memiliki hubungan kekerabatan terdekat dengan virus dari Jepang ini terdeteksi di Provinsi Hunan, China di tahun 2007.
Baik Jepang maupun Korea Selatan sama-sama mengalami wabah penyakit unggas di tahun 2010-2011 sebagai akibat masuknya clade 2.3.2.1c yang ditemukan di kedua negara itu pada Desember 2010. Deteksi virus pada burung liar mendahului kasus pada unggas di Jepang, dan melibatkan angsa di penangkaran dalam koleksi zoologi dan burung liar lainnya di tempat lain. Kasus-kasus ini kemudian diikuti di tahun 2011 dengan wabah-wabah pada sejumlah kecil peternakan unggas. Wabah yang terjadi di Korea Selatan lebih besar, melibatkan 53 peternakan, akan tetapi mengakibatkan depopulasi 286 peternakan dan pemusnahan sekitar 6,4 juta ekor unggas [77].
Virus HPAI H5N1 terus berevolusi di China. Sampai tahun 2010, virus clade 2.3.2.1 yang sebelumnya muncul di tahun 2007 telah berevolusi menjadi tiga keturunan yang berbeda, yaitu virus-virus A/Hubei/1/2010-like virus (clade 2.3.2.1a), A/HK/Barn swallow 1161/10-like virus (clade 2.3.2.1b) dan A/HK/6841/2010-like virus (clade 2.3.2.1c). ketiga clade ini terdeteksi di China, termasuk juga di wilayah administrasi khusus Hong Kong, juga Vietnam. Akan tetapi terjadi ekspansi yang cepat dalam kisaran virus yang ada dengan perbedaan-perbedaan yang ditunjukkan antar clade ordo kelima yang juga berimbas pada beberapa perbedaan antigenik. Virus-virus clade 2.3.2.1a telah mendominasi di Bangladesh dan India terutama pada unggas sejak 2011, sementara clade 2.3.2.1b telah menyebar dari China ke Vietnam dan telah ditemukan utamanya pada unggas. Perlu dicatat bahwa meskippun virus ini adalah varian antigenik yang diharapkan akan memberikan keuntungan selektif bagi virus ini terhadap unggas yang telah divaksinasi, virus-virus dalam clade 2.3.2.1b belum pernah dilaporkan di Vietnam sejak 2012, dan terakhir kali dilaporkan di China sejak tahun 2014. Clade 2.3.2.1c menunjukkan kisaran hospes yang nampaknya lebih luas, meliputi berbagai macam hospes burung liar dan unggas. Agaknya sebagai hasil pemencaran melalui populasi burung liar, virus-virus ini telah terdeteksi melalui wilayah geografis yang sangat luas sejak tahun 2009 [180], meliputi sebagian Asia selain China dan Vietnam (yaitu Nepal, Mongolia, Japan, Korea Selatan, dan Iran), dan Eropa (Bulgaria dan Rumania). Pola geospasial dan temporal mengindikasikan bahwa clade ini dapat bertahan pada burung liar yang mungkin kadang-kadang berisifat independent terpisah dari unggas, meskipun tumpahan balik (spillback) strain-strain yang lebih kuat dari unggas juga mungkin terjadi kadang-kadang. Strain virus yang memiliki hubungan dengan virus clade 2.3.2.1c akan tetapi tidak identik ditemukan di Rusia, Bulgaria, Rumania dan Nigeria pada tahun 2014-2015.
Virus-virus dari clade 2.3.4 juga tetap melanjutkan evolusinya menjadi clade ordo keempat, meliputi deteksi pertama virus clade 2.3.4.4 (sebelumnya disebut clade 2.3.4.6) [95, 191] akhirnya masuk ke Eropa dan Amerika Utara pada tahun 2014-2015. Virus-virus clade terus berevolusi. Wabah terakhir pada unggas yang divaksinasi terakhir dilaporkan pada tahun 2014 [185].
Virus clade 2.3.4.1 teridentifikasi pada kasus pada manusia di Provinsi Hunan pada tahun 2009 dan juga pada unggas di Provinsi Guizhou dan di Vietnam dan Laos pada tahun 2009 dan 2010. Virus clade 2.3.4.2 terdeteksi di Provinsi Guizhou dan Vietnam, dan kemudian di Laos dan Myanmar. Clade 2.3.4.3 terus bersirkulasi di Vietnam sampai tahun 2009.
Virus-virus clade 2.3.4.4, termasuk sejumlah reasortan dengan gen N2, N5 atau N8, terdeteksi dari tahun 2008 dan seterusnya. Virus-virus ini merupakan precursor untuk strain virus yang menginfeksi unggas dan burung liar di Korea di tahun 2014-2015 dan kemudian menyebar ke Eropa dan Amerika Utara pada musim dingin tahun 2014-2015.
Virus-virus yang berhubungan dengan burung peregrine falcon di Hong Kong tahun 2009 terdeteksi pada banyak provinsi di China. Diantaranya meliputi virus subtiper H5N2 yang terdeteksi pada ayam di Tibet pada tahun 2010 (virus reasortan yang membawa gen yang berasal dari virus H9N2) [96]. Agak mengejutkan bahwa kasus pada unggas di Tibet dimana gen sekuens tersedia (selain yang berhasil diisolasi dari 2011) disebabkan oleh strain virus yang tidak ditemukan pada burung migrasi di Provinsi Qinghai atau pada unggas di Asia Selatan, meskipun terletak diantara dua populasi dalam jalur migrasi burung.
Pada bulan Mei 2009, kematian pada burung liar yang disebabkan oleh virus HPAI H5N1 dilaporkan di Pronvinsi Qinghai. Kejadian ini diikuti dengan laporan infeksi pada angsa liar di Mongolia, dan pada bulan Juni terdapat kasus di Republik Tuva yang merupakan bagian dari Rusia. Pada bulan November wabah kembali dilaporkan di Rusia barat disekitar Moskow. Semua wabah ini disebabkan oleh virus dari clade 2.3.2.1c.
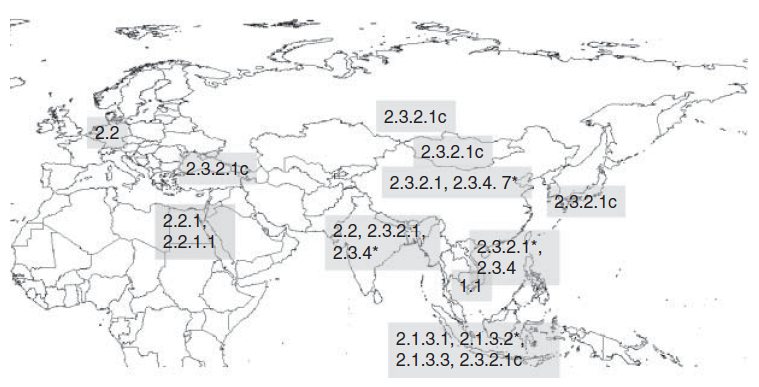
* Asia selatan meliputi calde 2.3.2.1a dan c, 2.2.2 dan 2.3.4.2
Indonesia meliputi clade 2.1.3.2a dan 2.1.3.2b
China meliputi clade 2.3.2.1a, b, dan c, 2.3.4.1, 2.3.4.2 dan 2.3.4.4.
Vietnam meliputi clade 2.3.2.1a, b, dan c, 2.3.4.1, 2.3.4.2
Gambar 9.5 Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode 2009-2012. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Myanmar melaporkan kasus HPAI H5N1 yang disebabkan virus yang berasal dari clade 2.3.4.2 disekitar Yangon di bulan Februari 2010. Virus-virus yang sama juga terdeteksi di tempat lain di Myanmar dan di Bangladesh, akan tetapi strain ini tidak menjadi menetap di wilayah itu [102].
Thailand melaporkan beberapa wabah penyakit unggas di bulan Januari 2008, yang berhubungan dengan clade 1 dan turunannya. Hal ini berbanding terbalik dengan wabah di tahun 2007 yang disebabkan oleh masuknya virus, dan diperkitakan bahwa virus clade 1 masih ada di negara itu. Beberapa perbedaan telah terdeteksi antar virus-virus dari wilayah yang berbeda di Thailand, meliputi beberapa reassortment antara strain dari clade 1 [9].
Di Asia Selatan, wabah terus terjadi di Bangladesh dan India. Nepal mengalami wabah untuk pertama kali di bulan Januari 2009. Penyakit pertama kali terdeteksi di sejumlah provinsi baru di India, termasuk Sikkim di bulan Januari 2009. Wabah pertama di Bhutan terjadi pada ayam umbaran pedesaan di dekat perbatasan dengan India pada tahun 2010. Virus penyebabnya berhubungan dekat dengan virus yang berada di Asia Selatan dalam clade 2.2 yang kemudian berevolusi menjadi clade 2.2.2. Masuknya virus clade 2.3.2.1 dikenali di Nepal pada bulan Februari 2010 [107].
Virus terus berevolusi di Indonesia, dengan beberapa strain varian antigenik teridentifikasi yang menimbulkan masalah pada sektor perunggasan yang menggunakan vaksinasi [34].
Ukraina dan Turki melaporkan wabah tambahan pada Januari 2008 pada unggas yang dipelihara di belakang rumah. Kasus-kasus di Ukraina terjadi di Crimea, sementara kasus-kasus di Turki terjadi di sepanjang garis pantai Laut Hitam pada unggas di belakang rumah dan dihubungkan dengan virus clade 2.2.1. Kasus-kasus burung liar terdeteksi pada angsa dalam jangka waktu yang lama disekitar tempat pembibitan angsa di Inggris selatan [8]. Kasus burung liar juga terdeteksi di Jerman dan Perancis.
Kasus HPAI H5N1 masih terjadi pada awal tahun 2008 di sejumlah negara Afrika Barat, termasuk Benin. Nigeria telah mengalami pemasukan virus baru dari clade 2.3 yang sangat berhubungan dekat dengan isolat burung liar dari Eropa di tahun 2008. Mesir terus mengalami wabah penyakit. Di tahun 2008 virus-virus di Mesir telah berevolusi untuk membentuk dua clade, 2.2.1 dan 2.2.1.1., dengan clade yang terakhir dominan ditemukan pada sektor komersial. Strain tertentu ini adalah sebuah varian antigenik, dengan perubahan genetik yang terjadi mungkin didorong setengahnya oleh program vaksinasi.
Israel mendeteksi virus clade 2.2.1 pada kebun binatang petting zoo di Haifa di bulan Januari 2008. Kejadian adalah yang pertama kalinya virus terdeteksi di Bulan Desember, sebuah pola yang kemudian berulang untuk semua wabah di wilayah sekitar Haifa, termasuk wabah yang terjadi di tahun 2014-2015.
Iran juga melaporkan wabah pada tahun 2008 yang berhubungan dengan virus clade 2.2 yang berhubungan dekat dengan virus yang terdeteksi di sana pada tahun 2006, menunjukkan bahwa virus mungkin menetap di wilayah itu selama beberapa tahun.
2011-2013: Virus utamanya hanya berdiam di wilayah-wilayah dimana infeksinya telah kuat berakar
Periode tahun 2011 sampai 2013 ditandai dengan kasus-kasus tambahan di Mesir, Vietnam, Kamboja, China, Indonesia, dan Asia Selatan – tempat-tempat dimana infeksi telah menyebar luas. Wabah-wabah yang terjadi di Jepang dan Korea Selatan di tahun 2010 berlanjut sampai 2011. Beberapa wabah di Israel dan wilayah otonomi Palestina dihubungkan dengan tumpahan (spillover) dari virus yang beredar Mesir.
Kamboja mengalami peningkatan kasus pada manusia yang cukup tinggi pada tahun 2011 (8 kasus, semuanya fatal) dan kemudian terjadi lagi di tahun 2013 (26 kasus, 14 fatal), yang terhitung sebagai 2/3 dari kasus yang terjadi secara global di tahun itu. Virus-virus yang menyebabkan kasus-kasus itu berasal dari clade 1.1.2, dengan beberapa strain reasortan yang membawa satu gen dari virus clade 2.3.2.1c. Alasan peningkatan kasus ini belum dapat diterntukan, meskipun beberapa diantaranya terkait dengan meningkatnya kapasitas pengujian dan program surveilans aktif. Perubahan pada karakteristik pengikatan reseptor ditemukan pada isolat manusia akan tetapi tidak pada isolat unggas, menunjukkan bahwa perubahan ini terjadi setelah infeksi pada manusia [131].
Periode dari tahun 2011 sampai 2013 patut diperhatikan karena tidak adanya wabah baru di Eropa meskipun surveilans pasif terus meningkat, terutama pada sektor perunggasan. Ketidaan kejadian kasus tampaknya juga berhubungann dengan resiko relatif dan level infeksi pada populasi burung liar. Terdapat beberapa bukti bahwa virus-virus ini menjadi sangat beradaptasi dengan unggas galinaseus dan telah mengurangi infektivitas pada burung air domestik (B. Z. Londt, komunikasi personal). Virus clade 2.3.2.1c terus bersirkulasi di Asia dan merupakan penyebab wabah di Iran pada tahun 2011 (wabah sebelumnya disebabkan oleh virus dari clade 2.2) [78].
Evolusi virus terus terjadi di China. Kasus pada manusia di Provinsi Guizhou dihubungkan dengan virus-virus dari clade 2.3.4.2 pada tahun 2012 dan 2013. Kasus pada manusia lainnya disebabkan oleh virus dari clade 2.3.2.1. Virus dari clade 2.3.4.4. terus mengalami reasortansi dan mendapatkan gen neuraminidase. Kasus pada manusia yang terdeteksi di Kanada pada bulan Desember 2013 terjadi pada seorang pelancong yang kembali dari China ditemukan terinfeksi dengan clade 2.3.2.1c. Tidak mungkin untuk menentukan bagaimana peristiwa paparan dapat terjadi, akan tetapi kasus tersebut telah ditetapkan sebagai kasus impor [115]. Kasus pada harimau di Provinsi Jiangsu telah dilaporkan pada tahun 2013. Virus ini merupakan reasortan yang memiliki gen PB2 baru [60].
Vietnam terus mengalami wabah yang terjadi sesekali pada unggas dan infeksi yang juga terjadi pada itik. Virus clade 2.1.3.2c menjadi strain dominan dan menyebar ke Vietnam selatan. Hal ini memperumit penggunaan vaksinasi karena dua virus yang berbeda bersirkulasi di sana dalam waktu yang sama. Hanya sesekali saja kasus pada manusia dilaporkan.
Tidak sampai tahun 2011 bahwa clade virus 2.3.2.1a tiba di India dan Bangladesh. Selama tahun 2011, tiga clade virus yang berbeda bersirkulasi di Bangladesh – clade 2.2, clade 2.3.4, dan clade 2.3.2.1a. kasus-kasus pada manusia tahun 2011 disebabkan oleh clade 2.2. Sejak tahun 2012 dan seterusnya, kecuali beberapa virus clade 2.3.2.1c di Bangladesh di tahun 2012, hanya clade 2.3.2.1a telah terdeteksi. Ditambah lagi, reassortment yang cukup besar pada virus-virus H5N1 telah terdeteksi di Bangladesh, antara isolat virus H5 dan virus H9N2 [49]. Wabah penyakit pada sapi menandai masuknya virus ini ke Bangladesh, meskipun mungkin unggas juga terdampak pada saat itu, karena jejak RNA virus terdeteksi di pasar unggas hidup (LBM) [73]. Di tahun 2013, variasi antigenik telah dideteksi pada virus-virus ini di Bangladesh.
Virus-virus clade 2.3.2.1a yang serupa juga terdeteksi di Nepal, India dan Bhutan pada tahun 2011, dan terus berevolusi [180]. Penyakit yang kadang dilaporkan di India terus berlangsung pada tahun 2011 di Tripura, Assam, dan West Bengal. Pada tahun 2012, tujuh wabah telah dilaporkan, dan lima diantaranya terjadi pada peternakan milik pemerintah (negara bagian Orissa, Tripura, dan Megalaya). Semua kasus ini terjadi dalam waktu empat bulan pertama tahun 2011. Pada tahun 2013, wabah dilaporkan di Bihar dan Chhattisgarh, dengan dua atau tiga wabah yang terjadi pada flok-flok yang dikelola universitas ataupun pemerintah. Representasi secara berlebihan dari kasus-kasus yang ada pada institusi pemerintah menunjukkan kurangnya pelaporan dari sektor swasta.
Bhutan dan Nepal melaporkan wabah tambahan pada tahun 2012 dan 2013 yang berhubungan dengan clade virus 2.3.2.1a yang telah bersirkulasi dan berevolusi di wilayah yang lebih luas.
Indonesia mengalami pemasukan virus clade 2.3.2.1c di tahun 2012 yang terdeteksi setelah penyidikan angka kematian yang tinggi pada itik [36]. Keberadaan virus ini menambah kompleksitas upaya pengendalian penyakit ini, terutama untuk peternakan-peternakan yang menggunakan vaksinasi. Virus dari clade 2.1 yang merupakan virus awal yang ada di Indonesia kini telah berevolusi menjadi clade ordo kelima yaitu clade 2.1.3.2a dan 2.1.3.2b [37]. Virus clade 2.3.2.1c yang terdeteksi di Austria adalah pada burung kicau (songbird) hasil selundupan yang berasal dari Indonesia [17].
Virus HPAI H5 keturunan Gs/GD juga telah berevolusi di Mesir. Varian antigenik clade 2.2.1.1 yang telah muncul dalam sektor perunggasan komersial telah menghilang pada tahun 2011 [11] (Gambar 9.6).
2014-2015: Gelombang ketiga penyebaran virus antar benua
Periode dari tahun 2014 sampai 2015 merupakan periode yang luar biasa karena untuk pertama kalinya dalam panzootik kali ini virus akhirnya menemukan jalannya untuk memasuki Amerika Utara, hampir pasti dibawa oleh burung liar [86. Periode ini juga penting karena dua clade virus yang berbeda (clade 2.3.2.1c dan 2.3.4.4) disebarkan melalui jarak yang sangat jauh dari Asia ke Timur Tengah dan sekitarnya.
Pada awal tahun 2014, Korea Selatan melaporkan wabah HPAI pada unggas, terutama pada itik yang meluas sampai sebagian besar negara itu. Wabah ini disebabkan oleh clade virus 2.3.4.4 dari subtipe H5N8. Kasus-kasus pada burung liar juga terdeteksi. Migrasi burung-burung air liar dan kepadatan itik domestik adalah faktor penting
Virus yang serupa juga terdapat di China pada saat yang sama, virus yang serupa diisolasi dari burung liar di Rusia bagian timur pada bulan September 2014, dan virus-virus yang berhubungan dengan virus itu kembali ditemukan di Korea pada musim dingin berikutnya.
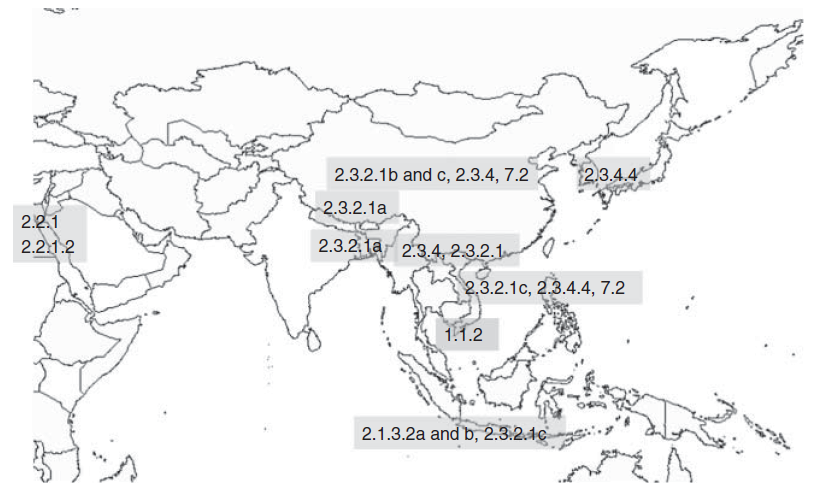
Gambar 9.6 Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode 2013- September 2014. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Virus ini juga masuk ke Jepang pada awal tahun 2014, dan telah menyebabkan penyakit pada satu peternakan. Virus ini juga terdeteksi pada burung liar. Banyak kasus pada burung liar kemudian terdeteksi di akhir tahun 2014, dengan strain yang diisolasi dari burung bangau di Kagoshima yang menunjukkan gejala akan berevolusi.
Virus-virus yang serupa dengan virus yang terdeteksi di Korea dan Rusia juga ditemukan di Eropa, dimulai dengan terjadinya wabah di peternakan kalkun di Jerman utara [58], dan diikuti dengan jeda yang sangat cepat munculnya wabah-wabah di Belanda [15], kasus-kasus tambahan di Jerman, dan wabah tunggal yang terjadi di Inggris utara [57]. Dua aspek yang tidak biasa dari kasus-kasus ini adalah bahwa peternakan-peternakan yang terdampak memelihara unggas terutama di dalam kandang, dan tidak ada virus-virus yang serupa yang telah terdeteksi antara Rusia Timur dan Eropa. Kasus-kasus lain kemudian terdeteksi pada kalkun di Italia dan itik domestic di Hungaria pada Februari 2015 (Gambar 9.7).
Semakin jauh virus masuk ke dalam industri unggas komersial, semakin meningkat pula kesadaran dan percepatan surveilans pada burung liar, dan sejumlah kasus kemudian terdeteksi, terutama pada burung-burung liar yang sehat di beberapa negara, termasuk Jerman dan Belanda. Virus-virus ini memiliki hubungan yang sangat dekat dengan virus yang terdeksi pada unggas. Lebih jauh lagi, seluruh virus-virus yang terdeteksi di Eropa berhubungan dekat dan membentuk klister monofiletik yang berbeda, akan tetapi mengandung beberapa strain dari akhir tahun 2014 yang ditemukan di Korea Selatan dan Jepang, dan terpisah dari clade virus 2.3.4.4 yang baru saja muncul di Amerika Utara.
Virus-virus yang serupa dengan virus yang diisolasi dari burung liar di Kagoshima ditemukan juga di Amerika Utara, dimulai dari Kanada barat, akan tetapi meliputi juga virus-virus reassortan yang telah mendapatkan gen dari virus influenza keturunan Amerika dari burung-burung liar. Virus-virus yang terdeteksi meliputi strain original H5N8 ditambah virus-virus hasil reasortansi subtipe H5N2 dan H5N1 [68, 120]. Seluruh gen HA nya termasuk kedalam clade 2.3.4.4. Ini adalah kali pertama tercatatnya pemasukan virus-virus H5 keturunan Gs/GD ke Amerika Utara meskipun telah dilakukan surveilans secara intensif di tahun-tahun sebelumnya, dan kasus-kasus ini juga menunjukkan bahwa virus dapat berpindah dari Eurasia ke Amerika Utara. Penyebaran virus ke Amerika Utara telah mengakibatkan epizootik terbesar pada unggas di benua itu, banyak sektor yang terlibat dan banyak pula pemasukan virus yang terjadi, terutama di peternakan kalkun dan ayam petelur. Epizootik ini menyebabkan setidaknya sekitar 49 juta unggas dibunuh atau dimusnahkan.
Pada saat yang sama satu clade virus baru 2.3.2.1c ditemukan di Rusia, Bulgaria, Rumania, Nigeria, Burkina Faso, Tanjung Harapan, Nigeria, Ghana, dan India. Virus-virus ini dapat dibedakan dengan jelas dengan virus-virus yang sebelumnya telah terdeteksi di Eropa, dan mereka menungjukkan kesamaan dengan derajat yang tinggi, yang memiliki indikasi potensial memiliki progenitor strain yang sama. Kemunculan kembali virus-virus ini, termasuk terdeteksinya virus-virus ini pada burung air liar seperti burung pelikan Dalmatian, dan juga pola persebarannya dengan kuat menunjukkan pemasukan awal dari burung liar. Deteksi virus di Afrika mewakiliki terdeteksinya virus clade 2.3.2.1c untuk pertama kalinya, dan menimbulkan pertanyaan tentang mode persebarannya.
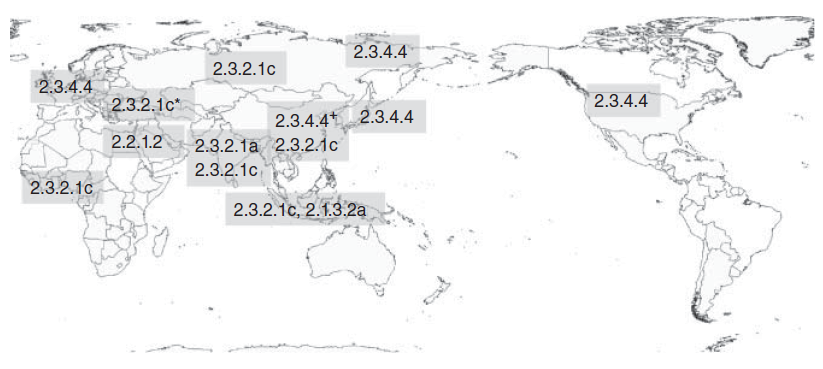
Gambar 9.7 Distribusi clade-clade dari dari keturunan virus HPAI H5N1 Gs/GD selama periode Oktober 2014- April 2015. Sumber: Diadaptasi dari Peta Dunia yang berpusat di Samudera Pasifik, $200inaiere, 4 Juli 2012. https://commons.wikimedia.org/wiki/Category:Blank_maps_of_world_without_Antartica#media/File:White_World_Map(Pacfic-centered)_Blank.png Used under CC BY-SA 3.0. http://creativecommons.org/licenses/by-sa/3.0/.
Mesir mengalami peningkatan kasus pada unggas dan manusia pada tahun 2014-2015. Peningkatan kasus pada manusia lebih mungkin dikarenakan paparan virus yang tinggi dari kasus pada unggas, daripada kemungkinan terjadinya mutasi virus. Virus ini kemudian disebut clade 2.2.1.2 dan telah menggantikan strain yang telah beredar selama beberapa tahun sebelumnya. Virus-virus yang serupa telah terdeteksi di Israel dan Teritori Otonomi Palestina.
Kasus pada unggas dan manusia yang dihubungkan dengan virus-virus dari clade 2.3.4.4 (H5N6) dilaporkan di China dan terdistribusi secara luas di negara itu. Kasus-kasus yang melibatkan burung liar dan seekor kucing juga terdeteksi [190]. Kasus infeksi virus H5N6 juga dideteksi pada unggas di Laos dan Vietnam. Taiwan mengalami wabah besar virus HPAI H5 keturunan Gs/GD yang tercatat untuk pertama kalinya, dengan berbagai virus dari clade 2.3.4.4. (H5N2, H5N3, dan H5N8) menyebabkan penyakit terutama pada flok-flok angsa dan itik. Sampai bulan Mei 2015, sebanyak lebih dari 800 tempat telah terdampak [112].
Sumber infeksi dan alasan-alasan penyebarannya
Penentuan secara tepat sumber timbulnya banyak wabah virus HPAI H5 keturunan Gs/GD telah terbukti sulit untuk dilakukan. Bagian ini akan mengulas beberapa faktor yang mungkin terlibat dalam persebaran dan persistensi virus-virus ini.
Faktor resiko tunggal yang terbesar dalam penyebaran virus HPAI H5 keturunan Gs/GD adalah transfer mekanik feses infektif dan atau sekresi oral yang mungkin mengandung virus dalam konsentrasi tinggi. Karena itulah setiap unggas yang terinfeksi atau setiap alat atupun komoditas yang terkontaminasi dengan feses infektif atau sekresi respiratori dapat menjadi sumber virus terhadap populasi rentan. Karena itulah, perdagangan unggas hidup dengan pengaturan yang buruk seperti yang terjadi di banyak negara mewakili resiko tertinggi, terutama jika hal ini terjadi antara wilayah dan atau populasi yang terinfeksi dan tidak terinfeksi.
Perdagangan unggas domestik dan burung-burung lain: faktor antropogenik
Secara historis dan secara konvensional, rute utama penyebaran HPAI adalah melalui perdagangan unggas hidup atau melalui peralatan yang terkait dengan industri perunggasan. Hal ini tentunya telah menjadi faktor besar dalam banyak wabah virus HPAI H5 keturunan Gs/GD, terutama di tempat-tempat dimana virus telah menjadi endemik. Sebagai contoh, di wilayah administrasi khusus Hong Kong perdagangan unggas hidup dengan level yang tinggi dianggap sebagai faktor utama yang berkontribusi dalam wabah berulang yang terjadi pada tahun 1997 dan antara tahun 2001 dan 2003. Pada beberapa kesempatan, masuknya virus terdeteksi melalui pengujian itik maupun angsa hidup dan sehat saat hewan datang di pasar grosir dan rumah potong hewan [142].
Perdagangan internasional ayam umur satu hari (DOC) telah disarankan sebagai sarana potensial penyebaran infeksi. DOC yang ditetaskan di inkubator mekanik yang diatur dengan baik sangat kecil kemungkinan terpapar virus saat mereka menetas, kecuali jika virus yang berasal dari ayam betina yang terinfeksi bertahan hidup di permukaan telur selama masa inkubasi. Akan tetapi, anak-anak ayam yang menetas secara alami (yang biasanya diinkubasi memakai ibu pengganti, seperti Entok di sebagian Asia) kemudian dapat terinfeksi melalui paparan dengan feses terinfeksi yang mengkontaminasi permukaan telur atau di lingkungan sekitar anak ayam yang baru menetas. Jika tempat untuk mengangkut DOC dipergunakan kembali dan terkontaminasi segera setelah meninggalkan tempat penetasan, paparan virus dan infeksi kepada anak ayam yang baru menetas bisa langsung terjadi. Di banyak tempat di Asia, perdagangan DOC tidak dikendalikan dengan baik, yang memungkinkan percampuran unggas dari berbagai sumber yang berbeda. Sebagian besar perdagangan global unggas hidup melibatkan pergerakan DOC. Jika perdagangan unggas-unggas itu dilakukan dan diatur sesuai dengan regulasi kesehatan hewan internasional [111], kegiatan perdagangan ini tampaknya tidak memiliki ancaman yang signifikan.
Dalam salah satu penelitian, besarnya perdagangan internasional unggas hidup digunakan sebagai indikator yang memungkinkan resiko masuknya virus dari negara terinfeksi ke negara yang belum terinfeksi [75]. Meskipun begitu, karena perdagangan ini sebagian besarnya melibatkan perdagangan DOC, indikator ini tidak begitu bisa diandalkan.
Perdagangan unggas illegal yang cukup besar juga terjadi, terutama di perbatasan antar negara dimana terdapat perbedaan harga unggas di pasaran yang signifikan. Sebagai contoh unggas hidup yang diimpor secara illegal diketahui berpindah melewati perbatasan antara negara China dan Vietnam, dan perdagangan ini dipicu oleh harga unggas yang lebih tinggi di Vietnam. Perdagangan illegal ini diketahui sangat sulit untuk dihilangkan, meskipun sejak kemunculan virus LPAI H7N9 di China telah dilakukan upaya mengurangi perdagangan illegal di Vietnam [19]. Volume perdagangan illegal sulit untuk diperikaran, akan tetapi masih menjadi faktor resiko yang signifikan dalam masuknya virus avian influenza.
Beberapa pihak telah menyatakan bahwa penyebaran virus HPAI H5N1 dari Asia ke Eropa selama tahun 2006 sebagiannya disebabkan karena kegiatan manusia (antropogenik), dengan rute-rute seperti Trans-Siberian Railway (dan lainnya) telah diajukan sebagai mode persebaran yang mungkin [48]. Akan tetapi, pergerakan yang berulang dari virus HPAI H5 keturunan Gs/GD melalui jarak yang jauh, termasuk pemasukannya ke Amerika Utara, memberikan bukti tidak langsung yang kuat adanya peranan burung liar dalam pemasukan virus pada awalnya. Juga perlu dicatat bahwa banyak kasus yang terjadi di Siberia terjadi di tempat-tempat yang terisolir yang terletak di antara danau-danau [94] yang tempatnya berjauhan dari rel kereta api dan tidak ada unggas baru yang masuk ke tempat itu.
Virus HPAI H5N1 terdeteksi pada daging itik yang diimpor secara illegal ke Korea Selatan [163] dan Jepang sebelum wabah dilaporkan di negara itu. Perdagangan daging yang terinfeksi dapat berkontribusi dalam persebaran infeksi jika bagian daging yang tidak dimasak diberikan kepada unggas. Akan tetapi tidak ada strain virus yang ditemukan sampai saat ini pada daging itik yang diimpor yang dihubungkan dengan kasus penyakit pada dua negara ini. Satu isolat virus HPAI H5N1 di tahun 2001 dari daging itik impor yang masuk ke Korea Selatan memiliki genetik yang serupa dengan virus yang ditemukan pada itik di dan sekitar Shanghai, yang merupakan tempat sumber dari daging tersebut [24].
Perdagangan burung kicauan dan unggas yang digunakan untuk tujuan keagamaan untuk dilepaskan ke alam liar di Asia telah diajukan sebagai rute potensial dalam persebaran infeksi [100]. Penelitian eksperimental terhadap dinamika infeksi virus HPAI H5N1 pada spesies burung passerine telah menunjukkan bahwa virus-virus ini dapat menyebar pada burung pipit, dan bahwa burung pipit yang telah terinfeksi dapat menginfeksi unggas [56, 188]. Burung yang ditemukan mati di wilayah administrasi khusus Hong Kong mewakili spesies yang umumnya digunakan dalam upacara keagamaan pelepasan hewan ke alam liar, akan tetapi masih belum jelas bagaimana infeksi bisa terjadi. Pengujian yang dilakukan secara ekstensif kepada burung kicau yang diimpor secara resmi tidak mendeteksi adanya virus, kecuali hanya satu kasus tunggal yang teridentifikasi di bulan Juni 2007. Kemungkinan bahwa impor illegal juga tidak dapat dikesampingkan. Peranan burung passerine diluar penyebarannya secara lokal masih sangat tidak pasti.
Ancaman masuknya virus H5 keturunan Gs/GD melalui perdagangan unggas di penangkaran didemonstrasikan melalui tiga kejadian di Eropa sebelumnya terdeteksinya virus pada burung liar yang hidup bebas atau unggas yang ada di benua tersebut. Kejadian pertama terjadi di bulan Oktober 2004, dimana virus HPAI H5N1 terdeteksi pada dua ekor burung crsted hawk-eagles (Spizaetus nipalensis) yang disita di bandara Brussels setelah diselundupkan dari Thailand. Virus yang didapat berhubungan dekat secara genetik dengan virus yang disolasi di Thailand (clade 1) [167]. Pemasukan yang kedua terjadi di bulan Oktober 2005 saat investigasi rutin terhadap kematian burung dalam penangkaran di karantina yang diimpor dari Taiwan ke Inggirs menunjukkan bahwa kematian itu disebabkan oleh infeksi virus HPAI H5N1 keturunan Gs/GD. Virus yang didapatkan sebagian besar berhubungan dengan virus dari China selatan (clade 2.3.) [8]. Kasus yang ketiga terjadi melalui barang kiriman burung tangkapan yang diselundupkan secara illegal ke Austria melalui Bandara Vienna di tahun 2013. Terdapat angka kematian yang tinggi pada banyak spesies burung, dan virus-virus yang menyebabkannya yaitu dari clade 2.3.2.1c menunjukkan kesamaan dengan strain yang dilaporkan di Indonesia pada saat itu [17]. Pada kasus-kasus ini, pemasukan melewati titik deteksi dapat dicegah, akan tetapi karena resiko yang disebabkan oleh kasus-kasus ini, importasi resmi burung tangkaran dari luar Uni Eropa tidak diizinkan lagi. Kemungkinan adanya peranan burung falcon atau burung yang merupakan mangsa untuk burung falcon yang diimpor secara illegal dalam penyebaran infeksi di Timur Tengah memerlukan studi lebih lanjut [97].
Pasar unggas hidup (Live Bird Market/LBM)
Pasar unggas hidup (LBM) dikenali sebagai tempat menetap dan pertukaran virus avian influenza [146], termasuk virus HPAI H5 keturunan Gs/GD yang ditemukan secara rutin di pasar-pasar besar. Deteksi virus HPAI H5 keturunan Gs/GD di pasar-pasar telah sering dilaporkan, akan tetapi hanya kadang-kadang dihubungkan dengan gejala klinis yang dapat dilihat atau meningkatnya pelaporan kematian [91, 142], membuatnya tampak seperti reservoir senyap dari virus-virus ini. Temuan ini sebagian besar dipertimbangkan dikarenakan kurangnya pelaporan penyakit dan cepatnya keluar-masuk unggas [81, 144]. Kemungkinan bahwa beberapa imunitas proteksi silang yang dimediasi sel yang disebabkan adanya infeksi sebelumnya dengan virus influenza dari subtipe yang lain juga tidak bisa dikesampingkan [66, 139]. Imunitas karena vaksinasi mungkin juga memainkan peranan dalam memungkinkan beberapa pengeluaran virus jika unggas yang hanya terlindungi seadanya kemudian terinfeksi. Banyak spesies unggas, baik liar ataupun domestik, disimpan di pasar-pasar unggas hidup (LBM) di banyak tempat di dunia, terutama (akan tetapi tidak hanya) di Asia, dan hanya jika pasar telah memiliki manajemen yang baik maka praktek-praktek ini dapat memfasilitasi pertukaran dan persebaran virus. Peralatan yang terkontaminasi dan unggas yang terinfeksi dipindahkan antara pasar yang satu ke pasar lain dan juga antar pasar-pasar mewakili adanya ancaman yang signifikan. Dengan sifat pasar inilah, banyak unggas dari spesies yang berbeda kemudian dibawa masuk untuk dijual dalam waktu yang bersamaan. Hal ini menciptakan suatu keadaan dimana spesies-spesies yang sebelumnya memiliki sedikit kesempatan untuk berkontak, akhirnya dapat berkontak secara langsung. Dengan demikian membantu transmisi virus antar spesies.
Pasar unggas hidup (LBM) memungkinkan untuk dioperasikan sedemikian rupa dalam rangka mencegah infeksi virus-virus tersebut, dan hal ini telah didemonstrasikan di wilayah administrasi khusus Hong Kong sejak tahun 2003. Akan tetapi, bahkan dengan pembatasan yang ketat terhadap sumber-sumber pasokan unggas untuk pasar-pasar ini, dan peningkatan higienitas pasar, infeksi virus HPAI H5N1 di wilayah administrasi khusus Hong Kong hanya dapat dicegah dengan memastikan bahwa seluruh unggas yang masuk ke pasar berasal dari flok yang sudah divaksinasi dan seluruh barang kiriman yang ada diperiksa untuk mencari bukti adanya antibodi protektif terhadap virus AI H5. Resiko yang berhubungan dengan pasar unggas hidup (LBM) diperparah di beberapa lokasi dimana sejumlah besar unggas dipelihara dalam sebuah fasilitas dengan biosekuriti yang buruk, seperti yang terjadi di banyak negara Asia dimana terdapat ketidakcocokan tinggi antara ancaman masuknya virus kedalam flok-flok unggas dengan level biosekuriti yang diterapkan pada peternakan.
Itik Domestik
Pada tahun 2000, perubahan genetika virus HPAI H5N1 berkorespondensi dengan perluasan kisaran hospes mencakup itik. Sebelum ini terjadi, virus H5N1 telah ditemukan pada itik di wilayah administrasi khusus Hong Kong pada tahun 1997, akan tetapi hanya pada saat dimana prevalensi infeksi sangat tinggi [141]. Studi eksperimental terhadap virus H5N1 Hong Kong/97 mendemonstrasikan bahwa virus ini tidak beradaptasi dengan baik pada itik, akan tetapi tetap bertumbuh dan dan mengeluarkan virus dalam level titer yang rendah dari saluran pernafasan dan pencernaan [125].
Sejak tahun 2002, virus HPAI H5 keturunan Gs/GD telah terus ditemukan pada unggas domestik di Asia dan sekitarnya [91], dengan beberapa virus yang ada diasosiasikan dengan terjadinya penyakit [4, 118, 154]. Alas an adanya variasi patogenitas dan tropisme preferensial yang tampak terhadap saluran pernafasan spesies avian masih belum dimengerti sepenuhnya. Perbedaan diantara mereka terkait dengan strainnya dan mortalitas tergantung pada usia (misalnya: angka kematian lebih tinggi pada itik yang lebih muda) [118]. Surveilans pada pasar unggas hidup (LBM) di China selatan pada awal tahun 2004 mengungkapkan angka infeksi yang tinggi pada itik domestik yang secara klinis nampak normal, dengan sekitar 25% sampel mengandung virus HPAI H5N1 [91]. Itik Mallar yang secara eksperimental diinfeksikan virus H5N1 melalui trakea mengeluarkan virus tanpa gejala sampai sekitar 17 hari [64], menunjukkan kapasitasnya dalam mengkontaminasi lingkungan dengan virus-virus ini. Mereka adalah sumber infeksi potensial terhadap ayam dan unggas lain, termasuk spesies burung liar. Ditambah lagi tampaknya virus-virus ini menjadi sangat beradaptasi terhadap spesies gallinaseus, kemampuannya untuk menginfeksi dan bertransmisi antar unggas air domestik, dan kemudian berpotensi menginfeksi unggas air liar, menjadi lebih lemah, karena spesies-spesies ini menjadi hampir resisten terhadap infeksi (B. Z. Londt, komunikasi personal).
Keberadaan infeksi dengan level yang tinggi pada itik domestik yang secara klinis tampak sehat dianggap sebagai faktor penting yang berkontribusi terhadap epidemi, terutama di negara-negara seperti Thailand dan Vietnam, dan di China selatan dimana itik umumnya dipelihara oleh setiap rumah tangga, dan itik tidak terlindungi dari burung liar dan diumbar bebas di kolam-kolam dan persawahan. Hanya China dan Vietnam saja, jumlah itik yang dibesarkan mencakup sekitar 65% dari keseluruhan jumlah itik yang dipelihara di seluruh dunia.
Burung-burung liar
Burung liar pada saat ini dikenali memainkan peranan dalam persebaran virus HPAI H5 keturunan Gs/GD melampaui jarak yang jauh, meskipun kontribusi relatif burung migrasi dan faktor antropogenik yang berhubungan dengan industri perunggasan masih belum jelas di beberapa tempat. Ketidakpastian ini ditambah lagi dengan pengetahuan yang terbatas tentang faktor hospes burung liar, meliputi kisaran spesies rentan, dinamika infeksi pada burung-burung ini, dan ketepatan detail yang mendeskripsikan pola migrasi dan pergerakan lainnya.
Peranan burung liar terhadap persebaran virus jarak menengah sampai jarak jauh sebelumnya didemonstrasikan dengan masuknya virus ke sebagian Eropa barat dan Mongolia dimana hanya ada sedikit unggas atau hanya tidak adanya kasus infeksi pada unggas. Masuknya virus ke Amerika Utara pada tahun 2014 memberikan bukti kuat tidak langsung adanya transmisi melalui burung migrasi. Masih belum jelas spesies manakah yang terlibat dalam penyebaran spesies, akan tetapi Anatidae tetap berada di peringkat tertinggi dalam daftar spesies yang dicurigai, karena virus HPAI H5 keturunan Gs/GD telah ditemukan pada beberapa spesies itik liar yang tampak normal/sehat [20, 28, 68], dan itik Mallard (Anas platyrhynchos) memiliki kapasitas untuk terinfeksi secara senyap, setidaknya dalam waktu yang pendek [71]. Hasil pendahuluan mengindikasikan bahwa virus clade 2.3.4.4 yang baru muncul ini bersifat lebih lemah pada itik Mallard yang tidak menunjukkan gejala klinis yang jelas akan tetapi mampu mengeluarkan virus dalam jumlah besar [71, 87].
Penyebaran HPAI H5N1 dari Rusia dan Kazakhstan ke sekitar lembah Laut Hitam di tahun 2005 bersifat konsisten dari segi waktu dan tempatnya dengan pergerakan migrasi itik [50]. Selain itu, karena program surveilans yang dilakukan di Eropa pada umumnya telah berkembang dengan baik, keberadaan virus HPAI H5N1 pada burung liar yang mati sementara tidak ada infeksi pada unggas domestik menjadi fakta yang signifikan. Karena hanya diperlukan sedikitnya satu ekor saja unggas terinfeksi untuk menjadi gerbang masuknya virus kedalam populasi yang rentan atau kepada lingkungan lokal, bahkan jika hanya ada prevalensi infeksi yang rendah pada burung liar yang sulit untuk terdeteksi melalui surveilans aktif, fakta ini menjadi cukup signifikan untuk diperhatikan.
Waktu migrasi burung tidak selalu sesuai waktunya dengan pelaporan penyakit pertama pada unggas [100]. Akan tetapi hal ini tidak mengesampingkan kemungkinan bahwa burung-burung ini berpotensi sebagai sumber infeksi, karena waktu pelaporan penyakit tidak selalu merefleksikan tanggal pemasukan virus awalnya [143]. Virus dapat menyebar dari burung liar kepada unggas air domestik (atau populasi itik liar yang berada di tempat yang sama), dengan amplifikasi virus yang terjadi kemudian yang bisa jadi senyap atau tidak terdeteksi, sebelum terjadinya infeksi unggas darat, berakibat adanya jeda waktu antara pergerakan burung liar yang terinfeksi dengan waktu dimana penyakit terdeteksi. Spesies-spesies yang berfungsi dalam menjembatani hubungan antara burung migrasi dengan populasi unggas juga dapat berperan dalam desiminasi virus. Clade virus yang baru 2.3.4.4. di Eropa dan Amerika Utara dari burung liar dan unggas telah menunjukkan adanya hubungan yang dekat, dan investigasi epidemiologi mengindikasikan transmisi fomite kepada flok-flok unggas, kemungkinan dipengaruhi oleh menetapnya virus yang berasal dari burung liar di lingkungan.
Meskipun masih belum dapat ditunjukkan apakah benar dapat terjadi atau tidak, transmisi relai pada virus mungkin saja bersifat signifikan. Dalam scenario ini, burung terinfeksi yang terbang bebas berpindah dalam jarak yang relatif pendek ke tempat-tempat persinggahan dimana mereka bercampur dan menginfeksi burung yang lain, dimana beberapa diantaranya kemudia memindahkan virus ke lokasi yang lain [46]. Hal ini dapat membantu dalam menjelaskan pola persebaran virus dari Asia ke Eropa, karena tidak ada burung yang diketahui bermigrasi secara langsung di sepanjang jalur ini, dan bahwa penyebaran virus yang terjadi kecepatan persebarannya relatif rendah, yang tidak konsisten dengan persebaran melalui migrasi [48]. Masih terdapat celah dalam pemahaman yang ada, seperti misalnya bagaimana clade 2.3.4.4 dari keturunan virus HPAI H5 Gs/GD mengalami perpindahan dari Rusia Timur dan Asia Timur ke beberapa tempat di Eropa barat di akhir tahun 2014 tanpa adanya kasus infeksi yang terdeteksi diantara tempat-tempat tersebut. Hal ini sangat berbanding terbalik dengan transmisi clade 2.2 selama tahun 2005-2006 dari China barat ke Eropa dan sekitarnya, dimana kemudian virus terdeteksi di beberapa lokasi diantaranya.
Seluruh pemasukan virus HPAI H5 keturunan Gs/GD ke Korea Selatan dan Jepang diperkirakan memalui burung liar, jika melihat dari lokasi peternakan yang terdampak, waktu terjadinya wabah dan karakteristik molekuler isolat. Kajian filogeografis telah mengungkapkan bahwa migrasi burung air liar dan kepadatan itik domestik penting dalam kemunculan dan menetapnya virus H5N8 di Korea Selatan [63]. Di Jepang, virus juga terdeteksi pada burung liar sebelum ditemukan pada unggas domestik, menunjukkan bahwa surveilans tertarget yang baik mengakibatkan terdeteksinya virus lebih awal pada burung liar dan dapat memberikan informasi kepada peternak untuk memperkuat biosekuriti [136].
Pada beberapa kasus, termasuk kasus pada burung gagak di Jepang [99] dan burung Magpie di Korea Selatan [82], burung liar yang terinfeksi terdeteksi pada saat pelaksanaan surveilans bertarget dipercaya telah terinfeksi karena terpapar dari unggas domestik yang sakit (atau dari material yang terkontaminasi oleh unggas yang sakit), daripada sendirinya menjadi sumber virus tersebut untuk unggas domestik. Tersebarnya virus ke dalam populasi burung bangkai memberikan bukti pertama adanya tumpahan/spillover dari unggas kepada populasi unggas liar lokal di Afrika [40]. Pada kasus lain, burung yang terbang bebas diperkirakan telah dinfeksi oleh burung yang ada dalam penangkaran yang dipelihara sebagai koleksi zoologi [41]. Namun demikian, bertemunya burung liar dengan burung liar domestik pada suatu lingkungan yang dibagi bersama terjadi secara luas di banyak tempat di Asia dan juga Eropa memberikan kesempatan yang signifikan untuk pertukaran virus (dalam dua arah bolak balik) antara burung liar dan unggas domestik, terutama dimana itik dipelihara secara ekstensif (umbaran) atau dibesarkan di kolam air yang terbuka. Di beberapa wilayah seperti Eropa Timur di tahun 2006, transmisi yang terjadi secara dua arah terlihat dari data genetik yang ada.
Juga perlu untuk dicatat bahwa tidak seluruh clade virus telah terdeteksi pada populasi burung liar. Akan tetapi, clade-clade tertentu seperti clade 2.2, 2.3.2.1c, dan baru-baru ini clade 2.3.4.4 telah terdeteksi pada banyak spesies dan lokasi seiring waktu yang mungkin mengindikasikan bahwa virus-virus ini memiliki kecenderungan yang lebih tinggi untuk menginfeksi dan menyebar pada populasi yang seperti itu. Hal ini mungkin menyebabkan virus dapat menetap secara bebas tanpa perlu terus melakukan infeksi berulang melalui paparan dengan unggas yang terinfeksi yang bertindak sebagai reservoir virus. Dinamika virus telah berubah seiring waktu, dengan menghilangnya clade 2.2 sejak tahun 2009 bertepatan dengan kemunculan clade 2.3.2.1c untuk pertama kalinya dan kemudian munculnya clade 2.3.4.4.
Masih belum cukup bukti untuk menentukan bagaimana tepatnya virus bisa memasuki Nigeria, negara di Afrika pertama yang melaporkan adanya infeksi dan penyakit. Pada awalnya burung liar diasumsikan sebagai sumber infeksi wabah yang terjadi di tahun 2006 [39]. Beberapa kali pemasukan virus yang serupa telah terjadi, dan sampai tahun 2009 virus-virus dari Eropa, Timur Tengah dan Afrika menunjukkan hubungan genetik yang dekat [137]. Semua virus itu termasuk kedalam clade 2.2, meskipun terdapat fakta bahwa virus-virus ini dikoleksi dari berbagai wilayah geografis yang luas yang mencakup tiga benua. Ditambah lagi, virus-virus dari clade ini tidak ditemukan secara luas pada unggas komersial di Asia pada waktu itu.
Ahli-ahli lainnya menyarankan bahwa virus masuk melalui perdagangan DOC illegal dan atau perdagangan DOC yang tidak dikendalikan dengan baik [166]. Akan tetapi, jika perdagangan unggas dari Asia adalah sumber infeksi, sulit untuk menjelaskan mengapa pemasukan virus tidak terjadi sebelum musim dingin tahun 2005-2006, dan mengapa hanya virus dari clade 2.2 yang muncul di saana (dan di Eropa dan di Timur Tengah), selain clade lain yang ditemukan secara luas diseluruh Asia selama beberapa tahun.
Pemetaan genetik strain virus di Nigeria menunjukkan bahwa terdapat setidaknya dua pemasukan virus secara independen di tahun 2006, dan pemasukan virus yang ketiga kalinya terjadi beberapa tahun kemudian [39, 47, 137]. Studi agro ekologi di Nigeria juga menunjukkan peranan burung liar dalam masuknya virus [22].
Masuknya virus ke Nigeria di tahun 2014 mengikuti pola yang serupa dengan yang terjadi di tahun 2005-2006, yaitu adanya virus yang serupa meskipun tidak identik yang berasal dari clade 2.3.2.1c terdeteksi pada burung liar pada tempat-tempat persinggahan burung di sepanjang jalur migrasi di Asia dan Eropa sebelum terdeteksi di Nigeria.
Di banyak negara yang terinfeksi, termasuk beberapa negara Afrika, penyidikan epidemiologi telah menjadi lebih kompleks dikarenakan deteksi infeksi pada unggas yang lambat (misalnya kasus yang pertama kali dilaporkan bisa jadi bukan kasus infeksi pertama) dan banyak jalur potensial masuknya virus, banyak diantaranya bersifat illegal dan sulit untuk dilacak [144, 166].
Efek musiman
Temperatur dan festival
Pola-pola penyakit bervariasi antar negara. Puncak laporan selama terjadinya epidemi H5N1 di Asia terjadi pada musimm dingin tahun 2003-2004. Kajian surveilans awal terhadap pasar-pasar di China, termasuk juga wilayah administrasi khusus Hong Kong, menunjukkan bahwa virus HPAI H5N1 lebih sering diisolasi pada bulan-bulan musim dingin [91]. Hal ini dapat dihubungkan dengan virus yang lebih mampu bertahan hidup pada suhu rendah, digabungkan dengan meningkatnya pergerakan dan perdagangan unggas yang dihubungkan dengan festival musim dingin. Akan tetapi, wabah penyakit telah terjadi di Asia di sepanjang musim. Wabah pertama HPAI H5N1 pada peternakan ayam di Hong Kong dilaporkan pada bulan Maret, April dan Mei tahun 1997 [142]. Wabah HPAI yang terjadi kembali untuk pertama kalinya sejak tahun 1997 pada unggas darat pada pasar unggas hidup/ LBM) di wilayah administrasi khusus Hong Kong terjadi di bulan Mei 2001, meskipun virus HPAI H5N1 telah terdeteksi di pasar untuk pertama kalinya di bulan Februari di tahun yang sama [142]. Temperature yang rendah tampaknya bukan merupakan faktor besar dalam munculnya penyakit di Thailand, dimana kasus telah terdeteksi sepanjang tahun, meskipun tampaknya terdapat kerentanan yang lebih besar di akhir musim panas dan awal musim gugur (mungkin dihubungkan dengan aktivitas badai).
Migrasi musiman burung liar
Kasus-kasus pada burung liar di China barat laut telah berhubungan dengan pergerakan migrasi burung-burung ini, dengan sebagian besar kasus terjadi pada burung-burung saat atau setelah mereka kembali dan berkumpul di wilayah berbiak setelah musim dingin (misalnya burung yang berada di Qinghai pada tahun 2005 dan 2009). Laporan pertama masuknya virus HPAI H5 keturunan Gs/GD ke negara Federasi Rusia pada musim panas pada tahun 2006, diikuti dengan penyebarannya ke Eropa pada musim gugur di tahun yang sama, bertepatan dengan pola migrasi musiman dan persebaran beberapa spesies burung liar. Hal ini saja tidak dapat menjadi bukti definitive persebaran virus melalui burung liar, meskipun pergerakan itik menuju lembah sungai Laut Hitam pada musim gugur konsisten dengan penyebaran HPAI H5N1 di wilayah itu pada waktu itu [50]. Pergerakan burung-burung ini akan juga dipengaruhi oleh pola-pola cuaca. Sebagai contoh, pergerakan Anatidae biasanya berbarengan atau mendahului musim gugur beku pertama di Palearktik Barat [50]. Penyebaran virus ke Eropa barat, utara dan selatan pada tahun 2006 dihubungkan dengan kondisi cuaca yang tidak biasanya menjadi buruk pada waktu itu, yang berakibat pergerakan tidak biasa dari burung-burung akuatik dari wilayah Laut Kaspia dan Laut Hitam (wilayah burung berdiam pada saat musim dingin/wintering) ke arah barat dan selatan [46, 114, 129]. Perpindahan burung dalam jumlah besar ini menyebabkan banyak spesies berkontak satu-sama lain dalam jumlah yang tidak biasa, yang mungkin meningkatkan besaran transmisi di dalam populasi-populasi tersebut. Ditambah lagi, beberapa populasi burung berpindah ke wilayah diluar wilayah berdiam pada saat musim dinginnya yang biasa. Wabah di Amerika Utara, Jepang dan Korea Selatan juga cocok dengan waktu terjadinya migrasi.
Patologi HPAI H5
Patologi HPAI yang disebabkan oleh virus H5 pada spesies avian dan beberapa spesies mamalia telah terdokumentasi dengan baik [41, 85, 120, 124, 125, 130, 157]. Penelitian eksperimental terhadap virus HPAI H5 keturunan Gs/GD pada ayam telah menunjukkan bahwa infeksi yang terjadi adalah sistemik dan menyebabkan kerusakan yang parah terhadap sel-sel endotel dan organ-organ parenkimal.
Akan tetapi, tidak seluruh ayam yang terinfeksi secara alami yang mati karena virus HPAI H5 keturunan GS/GD menunjukkan gejala klinis yang klasik, seperti diantaranya pembesaran bagian kepala, edema subkutis, dan hemoragi parah. Lesi-lesi ini ditemukan pada beberapa ayam yang mati, akan tetapi pada banyak kasus perubahan yang ada hanyalah kongesti dan sianosis jengger dan pial, dehidrasi, bebera[a hemoragi subcutan dan subserosa, leleran serous yang keluar dari lubang hidung, kongesti dan edema paru-paru, dan kongesti dan pembesaran limpa. Bintik-bintik pada pankreas menunjukkan bahwa nekrosis fokal bukanlah sebauah tanda yang konsisten pada ayam, akan tetapi telah dilaporkan pada spesies lain seperti pada burung Magpie di Korea Selatan [83]. Seka tonsil biasanya sedikit membesar dan hiperemi. Secara histologis, nekrosis multifokal dan inflamasi tampak pada limpa, otak, pankreas dan jantung. Antigen virus terdeteksi dari sebagian besar jaringan, dengan konsentrasi yang tinggi pada endothelium vaskuler dan sel miosit jantung [85].
Burung-burung air dan burung-burung liar lainnya yang mati karena HPAI H5N1 menunjukkan lesi makroskopis yang non-spesifik, meliputi bulu kusam acak-acakan (perubahan yang umum ditemukan pada unggas yang menunjukkan gejala syaraf yang tidak bisa merawat kebersihan dirinya sendiri), dehidrasi dan kongesti organ-organ visceral. Hemoragi ditemukan pada tulang-tulang kranial. Beberapa edema ringan pada paru dan meningkatnya cairan pada faring dan trakea telah terlihat pada burung air yang terinfeksi secara alami dan burung-burung liar lainnya di wilayah khusus administrasi Hong Kong. Kekeruhan/ opasitas kornea juga telah dilaporkan pada sejumlah kasus pada itik di Asia [187]. Infeksi eksperimental pada itik Peking menunjukkan sejumlah lesi, meliputi dehidrasi, splenomegaly, dan atropi timus. Usus unggas yang diinokulasi virus tidak ada isinya/kosong [116]. Leleran nasal berwarna kekuningan terdeteksi pada beberapa itik. Lesi-lesi histologis yang terindentifikasi meliputi ensefalitis non-suppuratif dan malasia, yang diikuti dengan sedikit inflamasi, rhinitis ulseratif, dan degenerasi, dan nekrosis pada sel epitel pankreas dan adrenokortis. Kongesti dan inflamasi interstitial terdeteksi pada paru-paru, serta berkurangnya limfoid dan nekrosis pada limpa, semua terdeteksi pada itik yang diinfeksi dalam percobaan.
Tidak ada satupun dari lesi makroskopis ataupun histologis ini yang bersifat patognomonis untuk infeksi virus HPAI H5 keturunan Gs/GD, karena itu diperlukan deteksi virus untuk mengkonfirmasi diagnosis.
Aspek Diagnostik
OIE Terrestrial Manual of Diagnostic Tests and Vaccines [110]. Memberikan rekomendasi pengujian yang tepat untuk penentuan diagnosis. Metode yang digunakan haruslah terstandarisasi dengan baik, tervalidasi dengan tepat, dan menunjukkan kesesuaian dengan tujuannya. Diagnosis dapat dibuat dengan pendeteksian virus infeksius, antigen virus, ataupun asam nukleat virus. Penggunaan serologis untuk virus HPAI H5 keturunan Gs/GD untuk unggas tertentu yang sangat rentan seperti misalnya ayam tidak direkomendasikan, karena sumber infeksinya biasanya sangat singkat, menyebabkan kematian sebelum respons imun yang terinduksi dapat dideteksi. Detesi antibodi adalah metode yang tepat untuk mendeteksi paparan yang sebelumnya terjadi pada burung air domestik, karena banyak kasus infeksi bersifat subklinis.
Sampel yang sesuai
Swab kloaka dan trakea telah digunakan sebagai sampel pilihan untuk sampel yang diambil di lapangan, karena karkas dari unggas yang terinfeksi tidak harus dinekropsi, mengurangi resiko infeksi untuk petugas yang menangani hewan yang sakit maupun mati. Strain virus HPAI H5 keturunan Gs/GD tampaknya dikeluarkan dalam level tinggi melalui rute respiratori/pernafasan dibandingkan melalui kloaka, dan karena itu disarankan untuk mengambil sampel dari kedua tempat itu. Di tempat-tempat dimana sampel jaringan dapat dikoleksi dengan aman, maka berbagai organ (termasuk otak) harus dikoleksi mengginakan media viral transport yang spesifik dan disimpan dingin (di suhu 4oC). Di lokasi-lokasi yang terpencil, koleksi sampel dilakukan deman memasukkannya pada buffer lisis atau kertas filter Flinders Technology Associates (FTA) [2] yang akan menyimpan RNA virus tanpa rantai dingin, memungkinkan deteksi virus dengan PCR akan tetapi membuat penggunaan kultur tidak dimungkinkan. Sampel jaringan harus dikoleksi di dalam larutan buffer netral formalin untuk pemeriksaan histologi dan immunohistokemikal.
Bulu dari unggas yang terinfeksi juga merupakan spesimen yang berharga untuk mendeteksi virus HPAI H5 keturunan Gs/GD [119]. Swab konjungtiva juga telah dilakukan untuk burung liar, dan pada salah satu penelitian ditemukan bahwa swab konjungtiva memiliki konsentrasi virus yang lebih besar daripada swab trakea [16].
Kulturisasi pada telur ayam berembrio berumur 9-11 hari adalah teknik standar emas untuk isolasi virus HPAI H5 keturunan Gs/GD yang kemudian diikuti oleh subtiping gen HA dan NA. Jika tersedia telur yang memadai, misalnya telur SPF atau telur yang beradal dari flok yang negatif antibodi influenza, isolasi virus dapat menjadi instrumen diagnostik yang cepat, dikarenakan sebagian besar embrio yang diinokulasi dengan sampel klinis yang positif akan mati dalam waktu 24-48 jam, yang mengurangi jeda waktu yang pada umumnya terjadi pada isolasi virus, setidaknya untuk kasus positif. Isolasi virus juga dapat menyediakan sumber virus untuk uji molekuler dan uji patogenisitas yang akan dilakukan kemudian.
Untuk mempercepat diagnosis, sejumlah teknis deteksi antigen AIV spesifik atau asam nukleat yang berbeda dilakukan secara rutin. Uji deteksi antigen cepat telah terbukti berguna sebagai uji penentu untuk kasus klinis pada burung galinaseus, terutama jika diaplikasikan pada banyak unggas yang berasal dari flok yang dicurigai [29, 134]. Beberapa hasil positif palsu telah dilaporkan, dan meskipun tidak lebih sensitive dari kultur ataupun PCR, metode ini mampu untuk mendeteksi infeksi jika terdapat tiga atau lebih ayam yang mati atau sakit dari peternakan atau pasar yang terinfeksi diambil sampelnya dan diperiksa dengan metode ini (melalui swab kloaka dan trakea). Akan tetapi, sampel negative masih harus dikirimkan untuk uji laboratorium. Selain itu, pengujian ini tidak cocok sebagai instrument screening unggas yang normal secara kliis, seperti misalnya sampel feses dari pasar, dan terbatas pemakaiannya untuk menguji swab kloaka dan trakea dari burung liar yang terinfeksi, karena rendahnya sensitivitasnya. Hal ini berhubungan dengan rendahnya konsentrasi virus pada sampel-sampel tersebut.
Berbagai teknologi molekuler juga telah digunakan untuk mendeteksi infeksi. Standard reverse transcriptase-polymerase chain reaction (RT-PCR) pada awalnya digunakan di banyak negara, namun saat ini telah banyak digantikan oleh real-time RT-PCR (rRT-PCR) yang memiliki target gen matriks yang tersimpan diantara seluruh virus influenza A, atau uji spesifik terhadap virus HPAI H5 keturunan Gs/GD. PCR memungkinkan deteksi virus influenza apapun, dan uji subtipe spesifik untuk untuk mendeteksi virus H5 dan N1 (ataupun subtipe N lainnya) juga digunakan secara rutin [3, 147]. Dikarenakan adanya perubahan pada gen HA dari virus HPAI H5, maka sangat penting untuk memperbaharui primer dan probe yang digunakan untuk memastikan seluruh isolat dapat terdeteksi. Pengujian-pengujian ini sangat sensitif, yaitu beberapa ordo lebih spesifik dibandingkan dengan isolasi virus, dan keuntungan lainnya adalah hasilnya dapat keluar dalam waktu 4 – 6 jam. Uji clade spesifik untuk virus HPAI H5 keturunan Gs/GD juga telah dikembangkan [61].
Untuk semua kasus dimana influenza tipe A terdeteksi idealnya seluruhnya harus dilakukan kultur virus untuk mengetahui apakah terdapat virus yang bersifat infeksius, dan kemudian kultur-kultur ini dapat digunakan untuk melakukan uji karakterisasi standar seperti yang dijelaskan dalam OIE Terrestrial Manual of Diagnostic Tests and Vaccines [110].
Pengendalian Penyakit
Strategi pengendalian yang digunakan untuk mengendalikan virus HPAI H5N1 sangat bervariasi, mendemonstrasikan bahwa tidak bisa digunakan hanya satu jenis pendekatan saja untuk pengendalian wabah dan ini berlaku untuk semua situasi. Seluruh upaya pengendalian akan didiskusikan di Bab 14. Rencana pengendalian individual harus sesuai dengan situasi penyakit secara lokal, resiko re-infeksi yang mungkin ada, dan sumber daya yang tersedia. Jika hanya dilakukan satu saja jenis upaya pengendalian maka tidak mungkin dapat mengeliminasi virus.
Pengendalian dan eliminasi virus HPAI H5 keturunan Gs/GD dari unggas juga tergantung pada system surveilans yang berfungsi secara penuh yang memungkinkan deteksi dini infeksi dan penyakit. System ini biasanya memerlukan insentif untuk pelaporan penyakit, sepertinya misalnya kompensasi dengan nilai yang pantas, dan system surveilans aktif yang sudah disiagakan untuk mendeteksi infeksi subklinis, seperti yang terjadi pada itik domestic dan pasar unggas hidup (LBM). Tipe surveilans ini tergantung pada pelayanan veteriner yang terlatih dan memiliki sumber daya yang cukup. Sebagian besar pelayanan veteriner di lokasi-lokasi dimana virus HPAI H5 keturunan Gs/GD masih kuat berakar masih dalam pengembangan. Upaya pengendalian juga harus disokong dengan Pendidikan masyarakat dan kampanye perubahan perilaku. Sangat penting bahwa program-program ini dapat secara menyeluruh melibatkan seluruh stakeholder terkait dalam rangka memastikan keberhasilannya. Juga penting untuk meneliti faktor-faktor yang memungkinan infeksi terjadi dan kemudian menetap, dan untuk membuat perubahan yang tepat dalam praktek-praktek produksi dan pemasaran untuk mengurangi resiko infeksi. Pertimbangan yang lebih besar terkait faktor sosio-ekonomi akan diperlukan di masa depan dalam rangka meningkatkan kemungkinan keluaran yang positif.
Bagian ini secara singkat akan mengulas upaya pengendalian dan pencegahan yang dilaksanakan di negara-negara yang sudah dipilih, dengan fokus utama di Asia, dimana upaya pengendalian dan pencegahan yang dilaksanakan adalah campuran dan bervariasi dan dimana penyakit ini (ataupun ancaman dan infeksinya) telah ada selama 18 tahun. Dalam mengulas efektivitas pengendalian dan pencegahan, tantangan terbesarnya adalah dalam menilau keuntungan setiap upaya pengendalian secara tepat, dikarenakan upaya-upaya tersebut tidak diupayakan secara sendiri-sendiri dan bahwa tidak ada populasi kontrol yang bisa menjadi pembanding yang setara.
Sebagai tambahan, saat membandingkan efektifitas upaya pengendalian yang Nampak, sifat sektor perunggasan di lokasi yang terdampak harus diperhatikan. Sebagai contoh, saat membandingkan antara Thailand dan Vietnam perlu untuk dicatat tentang sektor ekspor yang besar di Thailand, dan relatif kurangnya perdagangan unggas hidup di Thailand (diantara faktor-faktor lainnya), dimana kedua faktor ini membantu Thailand dalam upaya pengendalian penyakit yang dilakukannya.
Wilayah Administratif Khusus Hong Kong
Pada tahun 1997, wilayah administrasi khusus Hong Kong memiliki setidaknya 1000 lapak pasar eceran terpisah yang menjual unggas hidup, tersebar di seluruh wilayah di pasar basah dan toko-toko individu. Juga terdapat 200 peternakan unggas, utamanya terletak di bagian utara dan barat laut wilayah New Territories, yang mensuplai sekitar 20% unggas hidup yang dijual di pasaran. Sisa 80%-nya berasal dari China daratan. Terdapat dua pasar grosir besar dimana sebagian besar unggas dijual. Hanya ada sedikit upaya pengendalian pergerakan unggas antara peternakan dan pasar, atau bahkan dari pasar ke peternakan. Standar hygiene di pasar-pasar umumnya buruk, terutama pada pasar-pasar lama. Banyak jenis unggas hidup yang dijual di lapak-lapak individual, seperti ayam, itik, angsa, burung puyuh, ayam hutan chukar, ayam pegar, dan pada beberapa kasus juga menjual burung liar, seperti burung hantu dan itik liar [142].
Wabah penyakit di wilayah administrasi khusus Hong Kong mengakibatkan diperkenalkannya sejumlah upaya pengendalian dan pencegahan penyakit yang berbeda-beda dari wabah satu ke wabah lainnya. Wabah pada tahun 1997 berakibat dilakukannya depopulasi hampir semua ayam komersial di peternakan di Hong Kong dan di pasar-pasar unggas hidup (LBM), akan tetapi beberapa flok yang merupakan stok genetika yang berharga tidak ikut dimusnahkan. Upaya ini didukung juga dengan penutupan pasar unggas hidup (LBM) selama 7 minggu, dan pelarangan importasi unggas hidup selama periode tersebut. Seluruh peternakan dan pasar yang sudah dipopulasi dibersihkan dan didisinfeksi secara menyeluruh, dan tidak dibuka kembali kecuali telah memenuhi pemeriksaan veteriner yang ketat. Unggas peliharaan belakang rumah sebagian besar dikecualikan dari upaya pengendalian. Ketika perdagangan unggas kembali dilanjutkan di tahun 1998, hanya peternakan tertentu di China daratan yang diperkenankan menjadi supplier unggas hidup untuk pasar unggas. Unggas yang berasal dari tempat-tempat itu merupakan subjek pemeriksaan dan pengujian serologis di titik pemasukan di perbatasan. Uji deteksi cepat influenza A dilakukan pada swab kloaka dari unggas sakit maupun mati jika ditemukan saat pemeriksaan transportasi, dan seiring waktu pengujian ini digantikan oleh uji yang lebih sensitive yang berdasar pada amplifikasi asam nukleat. Kebijakan pemisahan yang diperkenalkan memisahkan unggas air domestic dengan unggas darat pada saat pemeliharaan, pengiriman, dan pemotongannya. Pasar grosir dan pemotongan khusus unggas air didirikan, dengan karkas yang sudah dikemas diperjualbelikan di pasar-pasar eceran.
Lapak-lapak pasar yang sebelumnya mendapat izin untuk menjual unggas liar dicabut perizinannya. Kandang-kandang kayu yang digunakan untuk membawa unggas diganti dengan kandang yang terbuat dari plastik yang lebih mudah dibersihkan dan didisinfeksi. Peralatan khusus pembersih kandang dipasang di pasar grosir utama. Peternak dan pedagang yang terdampak diberikan pembayaran kompensasi dan tunjangan ex gratia untuk menutupi kerugian akibat unggas yang dimusnahkan dan bisnis yang terhenti selama periode penutupan 7 minggu.
Upaya-upaya pengendalian ini tampaknya mencegah virus untuk masuk dan menetap lagi di pasar-pasar eceran sampai tahun 2001, dimana beberapa virus HPAI H5 keturunan Gs/GD terdeteksi. Sekali lagi dilakukan depopulasi pasar dan ditutup selama 1 bulan. Importasi unggas hidup dilarang. Karena tidak ada outlet untuk unggas hidup yang dibesarkan pada peternakan lokal (tidak ada tempat pemotongan pusat di wilayah administratif khusus Hong Kong untuk unggas darat), unggas yang telah memenuhi syarat untuk dijual pada peternakan-peternakan harus dimusnahkan. Sekali lagi, kompensasi dan tunjangan dibayarkan kepada pedagang dan peternak yang terdampak. Upaya-upaya pengendalian penyakit yang baru kemudian diperkenalkan untuk meningkatkan higienitas pasar, meliputi hari istirahat bulanan di pasar grosir yang memerlukan depopulasi total seluruh lapak-lapak pasar selama 24 jam pada satu hari setiap bulannya (dengan sinkronisasi untuk mencegah pergerakan unggas dari satu lapak ke lapak lainnya). Kebijakan pemisahan juga diperkenalkan untuk burung puyuh.
Wabah penyakit berikutnya yang terjadi pada tahun 2002 dan 2003 pada peternakan dan pasar berakibat diperkenalkannya vaksin sebagai upaya tambahan dalam pengendalian dan pencegahan, bersama dengan ditingkatkannya biosekuriti. Wabah-wabah ini dikendalikan dengan pemusnahan terbatas unggas di wilayah terdampak, dan penggunaan vaksinasi cincin. Setelah terjadinya wabah-wabah ini, upaya pengendalian tambahan juga diimplementasikan untuk meningkatkan higienitas pasar, meliputi hari istirahat tambahan dan membatasi dengan ketat jumlah unggas yang dapat dijual di lapak-lapak pasar. Pada akhirnya semua kebijakan ini berakhir dengan pelarangan memelihara unggas di belakang rumah. Antara bulan Desember 2003, saat vaksinasi diwajibkan untuk seluruh unggas yang akan dijual di pasar unggas hidup (LBM), dan bulan Februari 2015, selama periode ini hanya ada dua kejadian dimana virus telah berhasil masuk ke dalam system (pasar eceran ditemukan memiliki unggas yang terinfeksi pada bulan Juni 2008, san satu peternakan komersial ditemukan positif pada bulan Desember 2008), meskipun wabah tengah terjadi di Provinsi Guangdong (yang merupakan sumber unggas impor).
Pengalaman keberhasilan di wilayah administratif khusus Hong Kong memberikan beberapa pelajaran berharga bagi negara-negara lain, meskipun tidak semuanya bisa dilaksanakan, jika merujuk pada karakteristik khusus industri perunggasan Hong Kong yang kecil dan sumber daya keuangan yang tersedia. Pengalaman-pengalaman ini terutama sekali mempertunjukkan perlunya pemberlakuan beberapa jenis upaya pengendalian penyakit, mengadopsi pendekatan berulang dalam pengendalian, memodifikasi sistem produksi dan pemasaran, dan untuk meregulasi secara ketat sumber dan pergerakan unggas. Pengalaman-pengalaman ini juga mempertunjukkan bahwa pada wilayah-wilayah yang beresiko tinggi terhadap paparan virus, seperti misalnya perdagangan unggas hidup, peningkatan biosekuriti peternakan saja tidak cukup untuk mencegah infeksi berulang. Hal ini berakibat dengan diputuskannya penggunaan vaksinasi preventif [146]. Salah satu dari tantangan terbesar yang dihadapi oleh program pengendalian adalah bagaimana mempertahankan vaksin dengan antigen protektif yang cukup, dilihat dari tingkat evolusi viris di China Daratan. Selama periode ini burung-burung liar yang terinfeksi virus HPAI H5 keturunan Gs/GD terdeteksi decara reguler, akan tetapi tidak ada kasus pada peternakan yang dilaporkan. Kasus-kasus ini ditemukan sebagai hasil program surveilans yang intensif yang mencakup seluruh unggas di pasar-pasar dan peternakan. Program ini juga mencakup penempatan ayam-ayam sentinel yang tidak divaksinasi di antara kelompok-kelompok ayam yang sudah divaksinasi di peternakan-peternakan lokal, sebuah upaya uang tidak disukai oleh peternak. Pembatasan yang ketat juga telah ditempatkan dalam mengatur jumlah ayam yang dapat dipelihara dan dijual.
Konsekuensi ekonomi dari upaya pengendalian tertentu juga telah didemonstrasikan mengikuti implementasi kebijakan pemisahan itik dan angsa. Karkas dingin yang diproduksi di pasar-pasar dan rumah-rumah pemotongan itik dan angsa khusus yang didirikan pada tahun 1998 di wilayah administratif khusus Hong Kong tidak dapat berkompetisi dengan karkas dingin berharga lebih murah yang datang dari China daratan setelah perdagangan produk itu diperbolehkan. Pasar-pasar dan tempat pemotongan khusus ini sejak itu telah tutup bersma dengan seluruh peternakan itik lokal. Pelarangan menginapkan unggas di pasar grosir unggas dalam semalam juga mengakibatkan tingginya jumlah pedagang pasar yang menyerahkan kembali izin berdagangnya kepada pemerintah dan memilih menerima pembayaran ex gratia (terima kasih) dari pemerintah [146].
Thailand
Diantara negara-negara Asia Tenggara lainnya, Thailand adalah yang paling merugi dari dampak wabah HPAI H5N1 karena ketergantungannya dengan industri perunggasan dan ekonominya yang bergantung pada ekspor unggas. Meskipun begitu, kisahnya juga merupakan salah satu dari kisah sukses pengendalian wabah.
Sebelum wabah tahun 2004, industri perunggasan di Thailand telah berkembang dengan tingkat yang luar biasa. Sebagian industrinya terintegrasi secara vertikal, dengan sebagian besar unggas dibesarkan dalam sektor perunggasan. Namun demikian, ada beberapa peternak kecil dan sektor non industri, yang meliputi sejumlah besar itik umbaran yang diberikan makanan di padang persawahan yang baru saja dipanen dan dipindah-pindahkan antar padang ke padang lainnya dengan alat transportasi melalui jarak yang cukup jauh.
Wabah pada unggas karena HPAI di Thailand pertama kali dilaporkan pada tahun 2004, akan tetapi ini bukanlah kasus infeksi pertama karena kasus pada manusia dan kasus pada kucing sudah terjadi sebelumnya [72, 162]. Beberapa gelobang penyakit telah dilaporkan, dengan gelombang pertama yang pertama terjadi pada Oktober 2004 memiliki jumlah kasus terbanyak (akan tetapi juga karena surveilans yang dilakukan lebih intens dibandingkan dengan gelombang pertama). Pemerintah Thailand melaksanakan surveilans intensif dari pintu ke pintu (yang disebut surveilans “X-ray”) untuk mendeteksi kasus, dan hal ini memainkan peranan dalam mengurangi level infeksi dengan meningkatkan kualitas deteksi kasus [18]. Survei “X-ray) mendeteksi lebih dari 750 flok terinfeksi yang terpisah-pisah letaknya di 51 Provinsi antara tanggal 1 Oktober dan 9 Desember 2004. Jumlah yang besar ini mungkin mewakili diperkenalkannya surveilans intensif dan juga peningkatan wabah penyakit. Beberapa pembatasan pergerakan hewan diberlakukan. Pembatasan pergerakan hewan mencegah pengiriman ternak itik umbaran ke tempat-tempat dalam jarak yang jauh. Pengendalian terhadap ayam petarung/aduan juga diperkenalkan, meliputi pengembangan kartu tanda pengenal ayam aduan, meskipun upaya ini mungkin hanya sedikit memberikan manfaat dalam upaya pencegahan penyakit [10]. Penggunaan vaksinasi telah dilarang di Thailand, meskipun beberapa pengiriman vaksin illegal berhasil dicegat, dan pada masa lalu telah ada laporan penggunaan vaksin-vaksin ini, terutama pada peternakan ayam petelur [10].
Stamping out adalah metode utama yang digunakan, dan pada awalnya meliputi pemusnahan di zona luas disepanjang tempat-tempat terinfeksi, akan tetapi zona ini kemudian dikurangi menjadi hanya peternakan atau desa yang terinfeksi saja. Sekitar 62 juta ekor unggas dimusnahkan atau mati saat itu di Thailand [18]. Kompartementalisasi dipergunakan sebagai upaya pengendalian di unit-unit usaha besar yang terintegrasi. Industri ekspor Thailand saat ini bergantung pada produk yang telah dimasak, yang tidak begitu terpengaruh dengan keberadaan HPAI di negara itu jika dibandingkan dengan penjualan daging segar ataupun yang sudah didinginkan. Biosekuriti di peternakan-peternakan telah ditingkatkan, akan tetapi masih terdapat permasalahan yang signifikan pada standar-standar yang ditetapkan untuk upaya ini, terutama untuk peternakan yang berskala lebih kecil.
Kesuksesan upaya pengendalian yang dilakukan telah ditunjukkan dengan tidak adanya laporan kasus baru sejak tahun 2010, dimana bukti infeksi secara serologis terakhir kali dilaporkan [13], dan sekuens gen dari beberapa virus HPAI H5N1 keturunan Gs/GD dari ayam dan dari lingkungan pada tahun 2010 telah dimasukkan ke dalam GenBank.
Vietnam
Pada akhir tahun 2003, infeksi HPAI H5N1 telah menetap di Vietnam dengan disebabkan clade 1 dan virus lainnya. Sampai tahun 2004, penyakit ini telah berdampak pada 24% komunitas dan 60% dari kota-kota yang ada. Sampai Maret 2004, 17% dari populasi unggas telah dimusnahkan atau telah mati karena penyakit, yang setara dengan sekitar 45 juta ekor unggas. Gelombang awal infeksi dan penyakit diikuti dengan beberapa gelombang wabah yang tidak begitu parah pada tahun 2004 dan 2005. Stamping out mengurangi level infeksi, akan tetapi tidak mengeliminasi virusnya. Setelah gelombang pertama, kebijakan stamping out dirubah dari cincin luas yang berkisar di sekitar wilayah yang terinfeksi menjadi hanya untuk peternakan yang terdampak saja. Ho Chi Minh City melarang memelihara unggas dan memperjualbelikannya, dan menutup sejumlah besar rumah potong unggas berskala kecil. Hal ini telah menyebabkan pergeseran menuju penjualan karkas dingin di outlet-outlet eceran yang berada di dalam pasar yang bersumber dari sejumlah kecil pusat-pusat pemotongan yang berlokasi di luar kota. Hanoi menutup pasar grosir perkotaan besar dan mengupgrade salah satu pasar grosir besar yang menyuplai sebagian besar unggas untuk kota tersebut. Selama 9 tahun kemudian sejulah pasar kecil di seluruh negara juga ikut diupgrade. Penekanan khusus ditetapkan dalam rangka meyakinkan pekerja dan staf pasar mengerti tentang perlunya perubahan perilaku.
Pada tahun 2005, program vaksinasi unggas nasional dimulai untuk unggas di wilayah-wilayah beresiko tinggi. Putaran pertama dilakukan dari bulan Okrober 2005 sampai Januari 2006, dan telah berhasil memberikan 166.3 juta dosis untuk ayam dan 78.1 juta dosis vaksin untuk itik. Kemudian diikuti dengan putaran berikutnya di wilayah beresiko tinggi pada tahun 2006-2007. Tidak ada wabah HPAI yang dilaporkan antara bulan Desember 2005 dan akhir tahun 2006, saat penyakit kemudian terdeteksi pada itik yang tidak divaksinasi di bagian selatan negara itu. Kasus-kasus tambahan terdeteksi pada bulan Mei 2007, terutama mendominasi pada itik Peking dan Entok. Stamping out dilakukan pada peternakan yang terdampak. Kontribusi jelasnya dari vaksinasi yang dilakukan untuk mengendalikan penyakit tidak diketahui, karena implementasinya bersamaan dengan upaya pengendalian yang lain. Akan tetapi, semenjak dilakukan vaksinasi telah terlihat berkurangnya jumlah kasus pada unggas dan manusia yang cukup signifikan. Program vaksinasi telah dimodifikasi seiring waktu, seiring berkurangnya sokongan dana dari pusat, terutama setelah munculnya virus clade 2.3.2.1b, dimana vaksin yang tidak ada sangat tidak efektif dalam melindungi terhadap virus baru ini. Saat wabah penyakit terdeteksi, stamping out dilaksanakan dikombinasikan dengan vaksinasi cincin.
Upaya pengendalian lain yang telah diperkenalkan di Vietnam meliputi aktivitas penegakan hukum bagi penyelundupan unggas, dan beberapa perbaikan biosekuriti di peternakan. Pelayanan veteriner juga telah diperkuat, dengan menekankan pada laboratorium veteriner, pelayanan epidemiologi, dan pekerja kesehatan hewan berbasis komunitas. Upaya yang cukup telah dikerahkan untuk pelaksanaan surveilans pasar dan monitoring level antibodi pasca vaksinasi.
Virus HPAI H5 keturunan Gs/GD telah menjadi endemis di Vietnam, akan tetapi kemajuan telah dicapai dalam mengurangi dampaknya. Eliminasi virus masih menjadi tujuan jangka panjang, dan telah dianggap sebagai tujuan nasional, akan tetapi yang lebih mungkin dilakukan adalah pengembangan kompartemen atau wilayah bebas infeksi. Program yang dilakukan di Vietnam telah menjadi perhatian karena pengarahan dari pusat yang kuat yang dilakukan melalui komite bersama antar kementrian.
China Daratan
China telah mengunakan pendekatan multifaset untuk mengendalikan HPAI. Vaksinasi telah dipergunakan secara luas mekakui kampanye vaksinasi “selimut”, dan telah dapat mencapai level imunitas yang tinggi pada industri ayam petelur dan flok breeder. Vaksinasi tidak begitu efektif untuk itik dan ayam broiler yang berumur pendek [89]. Vaksin diproduksi secara lokal dari pabrik penghasil vaksin yang telah terdaftar dengan lebih dari 100 milyar dosis telah diberikan antara tahun 2006 sampai 2012 kepada sekitar 5 milyar ekor ayam dan kurang dari 1 milyar unggas air domestik, termasuk angsa. Kekhawatiran utama terkait vaksinasi adalah bahwa varian antigenik telah muncul dengan sangat cepat, dan meskipun sistem sudah disediakan untuk mendeteksi varian antigenik dan vaksin terus diupdate, terdapat jeda yang tidak dapat dihindari antara munculnya strain baru dan penggabungannya dengan antigen baru. China masih menjadi pelopor dalam perkembangan vaksin, dan beberapa produk baru telah memberikan harapan dalam membatasi infeksi pada itik domestik, terutama vaksin vektor virus duck enteritis yang dapat membantu meningkatkan level cakupan vaksinasi dan imunitas folk pada itik [89].
Pada saat kejadian wabah penyakit pada unggas, digunakan kombinasi stamping out dan vaksinasi cincin. Kemajuan telah dicapai dalam mempercepat kapasitas surveilans, dalam membangung laboratorium veteriner, dan meningkatkan kapasitas epidemiologi. Namun demikian, ukuran sektor perunggasan China yang besar, dengan sekitar 50% unggas dipelihara oleh petani kecil, hal ini memberikan tantangan yang sangat besar kepada otoritas veteriner.
Surveilans pasca vaksinasi dilakukan oleh otoritas veteriner nasional. Akan tetapi, seperti banyak negara Asia yang lain, sistem surveilans pasif perlu untuk diperkuat, seperti ditunjukkan oleh deteksi beberapa kasus penyakit zoonosis pada manusia sebelum terdeteksinya sumber infeksi dari unggas.
Kemunculan virus influenza A H7N9 sebagai agen zoonotik pada tahun 2013 telah berakibat banyak perubahan pada penjualan unggas hidup, terutama di lokasi yang telah mengalami kasus pada manusia. Pelarangan (jangka pendek ataupun permanen) terhadap penjualan unggas hidup telah diimplementasikan pada banyak kota besar di provinsi yang terdampak. Preferensi kultural yang kuat terhadap unggas hidup di Selatan China telah membatasi perubahan yang terjadi di wilayah-wilayah ini, dan perlu untuk dicatat bahwa pada tahun 2015 kasus H7N9 pada manusia sebagian besar terjadi provinsi-provinsi di wilayah selatan. Eliminasi Virus (baik HPAI H5 garis keturnan Gs/GD dan LPAI H7N9) masih menjadi tujuan jangka panjang.
Kamboja
Kamboja telah mengalami kasus yang timbul tenggelam baik pada manusia maupun unggas sejak tahun 2004. Secara umum negara ini memiliki kepadatan unggas yang rendah, sebagian besar unggas dipelihara di desa atau peternak kecil. Upaya pengendalian yang utama adalah stamping out, akan tetapi tidak ada kompensasi resmi yang ditawarkan untuk mendukung proses ini. Vaksinasi tidak diperbolehkan. Sumberdaya yang cukup banyak telah dikerahkan untuk meningkatkan kewaspadaan masyarakat dan meningkatkan surveilans penyakit. Upaya juga telah dilakukan, terutama di tingkat desa untuk memperkuat pelayanan veteriner dan memperkenalkan upaya pengendalian penyakit HPAI dan penyakit zoonosis lainnya. Beberapa perubahan dilakukan pada pasar unggas, akan tetapi hanya sedikit pengaturan pergerakan unggas ke pusat-pusat kota besar ataupun keluar perbatasan seperti perbatasan dengan Vietnam.
Korea Selatan
Mengikuti masuknya virus HPAI H5N1 keturunan Gs/GD pada tahun 2003-2004, virus telah berhasil dieliminasi dengan kombinasi program stamping out, pembatasan pergerakan hewan, dan penelitian pelacakan yang dilakukan setepat-tepatnya.
Wabah penyakit yang muncul kemudian telah ditangani dengan pendekatan yang sama seperti di tahun 2003-2004, akan tetapi telah berakibat pemusnahan sejumlah besar unggas. Surveilans aktif diperlukan untuk mendeteksi infeksi virus H5N8 2.3.4.4 pada flok itik, karena sebagian besar itik tidak menunjukkan gejala atau hanya menunjukkan gejala ringan (misalnya penurunan produksi telur). Perbaikan biosekuriti peternakan secara berangsur-angsur diimplementasikan. Vaksinasi tidak diperbolehkan.
Jepang
Jepang telah sangat efektif dalam mengendalikan wabah penyakit yang disebabkan virus HPAI H5 keturunan Gs/GD, dengan melakukan stamping out dan pembatasan pergerakan hewan yang ketat. Setelah setiap masuknya virus, perbaikan telah dilakukan terhadap biosekuriti peternakan, dan sistem peringatan dini telah dikembangkan melalui monitoring burung migrasi dan habitatnya. Perbaikan biosekuriti perternakan tampaknya berperan dalam membatasi munculnya kejadian wabah di tahun-tahun terakhir ini meskipun virus HPAI H5 keturunan Gs/GD masih ada pada populasi burung liar. Vaksinasi tidak diperbolehkan.
Indonesia
Infeksi di Indonesia muncul di tahun 2003, menetap sampai tahun 2004, dan pada saat tulisan ini ditulis masih endemik di sebagian wilayah negara ini, terutama Jawa dan sebagian Sumatera. Berbagai upaya pengendalian telah dilakukan, meliputi vaksinasi, stamping out, pendekatan partisipasi untuk deteksi dan pengendalian penyakit, dan upaya untuk meningkatkan sanitasi pasar. Vaksin digunakan secara luas pada sektor komersial, dan telah mengurangi dampak penyakit pada peternakan-peternakan tersebut. Pengendalian jangka panjang akan memerlukan restrukturisasi signifikan pada sistem produksi dan pemasaran unggas, terutama jika melihat pada besarnya skala produksi unggas di negara ini.
Rusia
Laporan pertama masuknya virus HPAI H5N1 ke Rusia terjadi di Juli 2005, pada awalnya di Siberia Barat, dan hampir eksklusif menginfeksi unggas di pedesaan. Banyak komunitas ini yang lokasinya terpencil, di tempat-tempat dimana burung liar dan unggas berbagi tempat hidup. Stamping out dilakukan bersama dengan pembatasan pergerakan hewan, upaya karantina, dan disinfeksi. Selama akhir tahun 2005 dan awal 2006 tejadi penyebaran penyakit ke wilayah selatan dan tengah di Federasi Rusia yang berada di benua Eropa. Pada awal bulan Maret 2006, lebih dari satu juta unggas telah mati atau dimusnahkan [69, 94]. Pada saat ini, vaksinasi target telag diperkenalkan untuk unggas yang diumbar dan burung dalam penangkaran uang ada pada wilayah-wilayah beresiko tinggi yang ditentukan berdasarkan lokasi wabah yang terjadi sebelumnya, dekatnya lokasi dengan jalur migrasi burung air, dan sifat perusahaan (belakang rumah versus komersial). Total sebanyak 425 juta dosis vaksin lokal telah diberikan kepada peternakan non-komersial dan unggas produksi yang dipelihara di belakang rumah antara tahun 2006 dan 2010 [158]. Jumlah kasus kemudian menurun, dan infeksi tampaknya hanya terjadi pada populasi yang tidak divaksin atau yang tidak divaksin lengkap. Saat infeksi kemudian dilaporkan, stamping out akan digunakan. Jumlah dosis vaksin yang diberikan telah menurun secara berangsur-angsur, sejumlah 16.7 juta dosis yang diberikan pada tahun 2014, karena resiko telah dipandang menurun. Wabah yang terjadi selanjutnya, termasuk yang terjadi pada tahun 2014-2015, telah dikendalikan dengan stamping out.
Mesir
Mesir telah menggunakan kombinasi beberapa upaya pengendalian, meliputi stamping out, penutupan beberapa pasar unggas hidup (LBM), dan vaksinasi, meskipun kemunculan varian antigenik virus telah mengurangi efektivitas vaksinasi. Vaksinasi untuk produsen kecil dilakukan dengan cara yang tampaknya sangat kecil kemungkinan akan berhasil [126], menggunakan berbagai jenis vaksin yang sudah terdaftar resmi. Vaksin vector berdasarkan virus herpes kalkun telah diberikan juga [74]. Kenaikan jumlah kasus pada manusia di Mesir pada tahun 2015 memunculkan pembahasan tentang upaya pengendalian yang telah dilakukan. Penyakit ini tetap endemik dan tidak bisa dikendalikan kecuali dilakukan restrukturisasi industri perunggasan, implementasi upaya yang lebih efektif untuk memutus rantai infeksi pada unggas belakang rumah, dan penguatan pelayanan veteriner.
Nigeria
Metode utama yang dipergunakan untuk pengendalian penyakit di Nigeria adalah pemusnahan populasi terdampak. Beberapa pihak telah menyarankan pembayaran tingginya kompensasi mungkin telah membantu dalam pengendalian penyakit yang mengikuti kenaikan pembayaran kompensasi di tahun 2007 [133], sementara yang lainnya telah menyarankan bahwa virus ini sepertinya tidak mungkin untuk tetap endemik di Niheria, dikarenakan rendahnya transmisi antar desa [14]. Apakah kesuksesan yang sama dapat dicapai setelah masuknya virus pada tahun 2014-2015 masih belum dapat ditentukan.
Negara-negara Uni Eropa (EU)
Upaya pengendalian komunitas meliputi stamping out, pembatasan pergerakan gewan, peningkatan surveilans, pemebrsihan dan desinfeksi, dan repopulasi terkontrol. Program pilot vaksinasi target dibawah kendali otoritas veteriner telah diberikan izin untuk dilakukan pada tiga negara anggota. Program-program ini dilaksanakan dibawah ketentuan yang ketat untuk surveilans yang berkelanjutan pada populasi yang divaksinasi, akan tetapi setelahnya ditinggalkan, karena telah berkurangnya resiko masuknya virus dan keengganan dari industri perunggasan. Seluruh wabah pada tahun 2014-2015 telah berhasil dikendalikan dengan stamping out.
Amerika Utara
Amerika Utara mengalami pemasukan virus HPAI H5 keturunan Gs/GD pada tahun 2014 – 2015. Wabah penyakit dikendalikan melalui stamping out dan pengendalian pergerakan hewan di sekitar tempat tertular yang terdapat kasus selama kurun waktu 6 bulan. Upaya biosekuriti pada peternakan juga telah ditingkatkan. Jika virus ini menetap atau re-infeksi pada populasi burung air migrasi, tantanganya adalah untuk mencegah virus untuk masuk kembali ke peternakan. Upaya biosecuriti yang telah dilakukan sampai tahun 2014 yang telah cukup baik dalam mencegah virus LPAI tidak dapat mencegah infeksi virus HPAI H5 keturunan Gs/GD pada 209 peternakan komersial dan 21 peternakan belakang rumah. Vaksin yang berasal dari virus H5 clade 2.3.4.4 dari Amerika Utara telah dikembangkan. Tidak jelas apakah vaksin ini akan digunakan untuk wabah di masa depan, terutama karena potensi pembatasan perdagangan yang dapat diberlakukan pada produk yang akan diekspor, bahkan dari wilayah dimana vaksin tidak digunakan.
Kesimpulan dan pandangan masa depan
Subtipe H5 dari virus HPAI keturunan Gs/GD telah bersirkulasi secara terus-menerus selama lebih dari 18 tahun sejak pertama kali dideteksi di China pada tahun 1996. Virus ini telah menyebar ke empat benua dan menetap di sejumlah negara dan sub-wilayah. Virus-virus ini telah menyebabkan kerugian yang besar pada industri perunggasan, demikian juga hilangnya nyawa manusia, dan terus meningkatkan keprihatinan potensi kemunculan strain virus yang dapat menimbulkan pandemi pada manusia.
Meskipun eliminasi lokal virus HPAI H5N1 telah dicapai di sejumlah negara, pada beberapa negara ini lebih dari sekali, prospek eradikasi penyakit secara global tetaplah kecil kecuali jika perubahan besar terjadi pada virus-virus ini atau dilakukan modifikasi yang signifikan terhadap metode pemeliharaan dan pemasaran unggas di negara-negara yang terinfeksi secara endemik dan tempat-tempat yang memiliki resiko tinggi infeksi. Karena industri perunggasan di tempat-tempat ini masih mempergunakan praktik-praktik beresiko tinggi, seperti penjualan ayam broiler melalui pasar unggas hidup (LBM) yang memiliki aturan yang buruk, dan juga menyokong sejumlah besar petani kecil dan pedagang-pedagang yang miskin, memelihara unggas dalam keadaan biosekuriti yang minimal, hal ini akan memerlukan waktu yang sangat lama. Permasalahan-permasalahan ini ditambah dengan pelayanan, administrasi, dan pemerintahan kesehatan hewan yang relatif lemah di sebagian besar negara-negara tersebut. Sebagai hasilnya, praktek kedokteran hewan preventif tidak dilaksanakan, meliputi pengecekan pre-market dan pengendalian pergerakan jutaan unggas di lokasi terinfeksi.
Panzootik ini telah sedikit demi sedikit merubah perilaku tentang cara-cara pengendalian penyakit. Respons kegawatdaruratan klasik yang digunakan untuk mengendalikan infeksi meliputi stamping out dan pengendalian pergerakan hewan, meskipun masih bernilai dalam mengurangi dampak penyakit dan masih merupakan pendekatan garis pertama pada negara-negara yang baru terinfeksi, kurang cocok diterapkan pada negara yang sudah terinfeksi secara endemik. Pengendalian penyakit pada negara-negara tersebut memerlukan upaya jangka panjang untuk merubah praktek-praktek industri yang beresiko tinggi, meliputi peningkatan biosekuriti peternakan, sanitasi peternakan, dan manajemen pergerakan unggas. Jika di wilayah tertentu hal ini tidak mungkin dilakukan, upaya pengendalian yang lain untuk memitigasi resiko ini harus dilakukan, seperti vaksinasi, akan tetapi di wilayah-wilayah ini vaksinasi hanya dapat, jika bisa, untuk membatasi penyakit untuk tetap berada di wilayah itu saja tanpa menyebar.
Dunia telah belajar untuk hidup bersama virus ini, dan diperkirakan dunia harus tetap seperti ini selama setidaknya 10-20 tahun kedepan, meskipun rencana-rencana ambisius dan tidak realistis tetapi dibuat untuk mengeradikasi virus ini. Hal ini akan memerlukan implementasi upaya-upaya pengendalian yang mengurangi resiko yang dimiliki oleh virus-virus itu kepada unggas dan kesehatan masyarakat, sementara dalam waktu yang sama menyeimbangkan dampak sosial, ekonomi, dan lingkungan dari program pengendalian yang dilaksanakan.
Wabah pada tahun 2014-2015 mendemonstrasikan bahwa selama suatu negara tetap terinfeksi secara endemik, virus HPAI H5 keturunan Gs/GD akan tetap bersikulasi, dan saat bersirkulasi juga bermutasi, membawa pada kemunculan strain atau genotipe H5 yang mungkin memiliki sifat biologis yang baru. Akan tetapi, himbauan yang ditunjukan kepada negara-negara ini untuk kembali memberlakukan stamping out tidak memandang sampai mana negara-negara ini telah berhasil di dalam jalur eradikasi penyakit. Sebelum perubahan penting dilakukan pada sektor perunggasan sebelum langkah pertama diambil sebagai dorongan terakhir menuju eradikasi, dan selama seluruh infeksi, termasuk kasus subklinis, dapat diidentifikasi seawal mungkin, negara-negara tersebut tidak akan berhasil dalam eradikasi penyakit. Pelayanan veteriner di tempat-tempat dimana infeksi virus telah kuat mengakar masih belum cukup kuat untuk mencapai tujuan ini.
Panzootik yang telah muncul ini tidak diprediksi sebelumnya, dan saat ini terdapat beberapa tempat di belahan bumi utara yang belum terpapar dengan virus keturunan ini. Selama lebih dari 18 tahun ini, virus HPAI H5 keturunan Gs/GD telah menunjukkan kapasitas yang besar dalam bertahan dan berevolusi. Keturunan virus ini muncul pada saat industri perunggasan sangat rentan terhadap patogen dari tipe yang sama. Percepatan ekspansi produksi perunggasan untuk memenuhi permintaan konsumen selama lebih dari 40 tahun telah berakibat kekurangan yang muncul antara metode yang digunakan untuk pemeliharaan, transportasi dan penjualan unggas dan upaya biosekuriti yang diperlukan dalam mencegah pemasukan dan penyebaran virus. Bahkan di beberapa negara yang kaya, sistem produksi perunggasan yang ada di sana masih kurang dari segi biosekuritinya sehingga tidak cukup untuk menghentikan pemasukan dan penyebaran virus. Pengalaman yang dialami Korea Selatan dan Jepang selama musim dingin 2006-2007 dan kemudian lagi di tahun 2013-2015 menunjukkan bahwa upaya biosekuriti pada peternakan unggas terindustrialisasi di dua negara ini, terutama di Korea Selatan, tidak dapat mencegah masuknya virus. Harus dicatat bahwa sebagian besar wabah di Amerika Serikat pada tahun 2014-2015 telah melibatkan peternakan yang memelihara kalkun dan ayam petelur, bukan pedaging/broiler, yang menunjukkan bahwa ada kemungkinan sistem biosekuriti di peternakan ayam pedaging mungkin telah mencegah masuknya virus. Banyak hal yang harus dipelajari tentang metode persebaran virus H5N2 di Amerika Serikat, dan informasi ini akan menjadi vital dalam pencegahan wabah skala besar di masa depan. Wabah di Amerika Serikat ini kemungkinan akan mengakibatkan penilaian kembali metode produksi unggas, terutama untuk kalkun dan ayam petelur.
Untuk negara-negara seperti Vietnam, China, Indonesia, dan Mesir, pada beberapa kasus, faktor-faktor yang telah memberikan virus ini kesempatan untuk menetap berubah-ubah, meskipun perubahan itu lambat. Kemunculan virus LPAI H7N9 di China telah menjadi katalis dalam pergeseran dari penjualan unggas hidup menjjadi penyembelihan terpusat atau pembentukan pasar yang diatur dengan lebih efisien (seperti yang digunakan di Amerika Serikat dan wilayah administrasi khusus Hong Kong). Perubahan ini akan membutuhkan banyak waktu, dan akan terjadi lebih lambat di negara-negara yang belum terpapar virus H7N9. Negara-negara ini menghadapi banyak rintangan dalam mengendalikan penyakit ini, meliputi terbatasnya sumber daya untuk membiayai pengendalian penyakit, ketidakstabilan politik, dan sistem otonomi provinsi dapat membatasi kapasitas implementasi program pengendalian penyakit secara nasional.
Sekarang ini kita telah memiliki bukti untuk mendapatkan kesimpulan bahwa baik pergerakan unggas secara illegal dan pergerakan burung liar telah berkontribusi terhadap penyebaran virus HPAI H5 keturunan Gs/GD. Kedua jalur ini haruslah dipertimbangkan saat mengembangkan dan mengimplimentasikan perencanaan nasional dan regional dalam pengendalian penyakit ini. Perdebatan tentang peranan burung liar dan perdagangan akan tetap menjadi kontroversi. Untuk transmisi virus jarak jauh, burung liar haruslah dipertimbangkan, terutama pada kasus-kasus dimana pola-polanya mengikuti pola yang muncul di masa lalu, dimana genetik virus menunjukkan masuknya strain yang berhubungan sangat dekat disepanjang wilayah geograsif yang luas, dan jika tidak ada penjelasan lain yang mungkin yang berhubungan dengan kontak dengan unggas ataupun produk unggas dari wilayah terinfeksi yang ditemukan.
Pada versi sebelumnya volume buku ini telah diketengahkan pendapat bahwa siklus infeksi terutama yang bersifat independent mungkin dapat menetap pada burung liar, dan bahwa masuknya virus secara berulang-ulang di sepanjang jalur migrasi ataupun rute pergerakan burung liar di Asia dan di tempat-tempat lain dapat terjadi. Hal ini telah terjadi, meskipun tampaknya siklus infeksi terjadi dengan clade virus yang berbeda setiap beberapa tahun. Akan tetapi dunia masih belum memiliki sistem yang siap untuk mencegah hal ini terjadi lagi. Infeksi akan tetap ada pada sektor perunggasan di negara-negara dengan populasi itik domestik umbaran yang besar, pengaturan pergerakan unggas yang buruk, tingginya konsentrasi peternakan dengan biosekuriti yang buruk, dan lokasi-lokasi dimana perdagangan unggas hidup yang tinggi melalui pasar-pasar unggas yang tidak diatur dengan baik, memberikan kesempatan terjadinya spillover/tumpahan virus.
Vaksinasi telah dipergunakan sebagai upaya pengendalian dan pencegahan tambahan di beberapa negara. Vaksinasi akan terus digunakan sebagai upaya jangka menengah dan jangka panjang dalam pengendalian virus HPAI H5 keturunan Gs/GD di tempat-tempat yang memerlukannya. Vaksin-vaksin baru yang menggunakan teknologi berbeda diharapkan dapat membantu mengendalikan penyakit, akan tetapi tidak berakibat eliminasi virus di tempat-dimana virus telah berurat berakar. Kemungkinan terbaiknya, vaksinasi akan mengurangi level shedding virus, yang merupakan tujuan yang penting. Akan tetapi, pengalaman selama sepuluh tahun terakhir juga menunjukkan bahwa varian antigenik virus memang muncul (karena vaksinasi ataupun faktor lainnya) dan jeda waktu yang tidak bisa dihindari antara kemunculan virus dan vaksin yang telah diupdate telah memunculkan kerentanan. Vaksinasi haruslah disokong oleh program yang memungkinkan identifikasi varian antigen dengan cepat dan dapat secepatnya merubah antigen vaksin jika diperlukan. Jika terdapat ketidakcocokan antara virus dan vaksin, spillover/tumpahan virus dari itik domestik yang divaksinasi secara buruk kepada burung liar yang berbagi habitat yang sama mungkin dapat terjadi. Hal ini mungkin adalah faktor dalam kemunculan virus dari clade 2.3.4.4. Akan tetapi, perlu untuk dikenali bahwa tanpa vaksinasi tumpahan ini juga diharapkan tetap terjadi karena adanya infeksi senyap pada itik domestik. Perubahan pada sistem produksi dan pemasaran akan diperlukan untuk mengurangi ketergantungan terhadap vaksinasi. Dalam mengimplimentasikan perubahan ini, pihak berwenang nasinal perlu untuk mempertimbangkan implikasi sosial, ekonomi, dan lingkungan dan kelayakan teknis dari setiap perubahan yang diusulkan oleh mereka, dikarenakan efek samping yang mungkin akan muncul, terutama pada peternak-peternak miskin dan rumah tangga rentan lainnya di wilayah kota dan pinggiran kota. Upaya pengendalian yang ada didesain untuk mengkonsentrasikan wilayah peternakan unggas harus dihadapi dengan pendekatan yang hati-hati, karena pengendalian dalam wilayah ini mungkin sekali sulit dan menantang, terutama di negara-negara berkembang yang lebih bergantung pada produksi perunggasan komersial yang terstrukturisasi.
Kemungkinan penggunaan vaksinasi darurat untuk menghadapi wabah besar haruslah diselidiki lebih jauh. Pembatasan perdagangan yang diberlakukan untuk negara-negara pengekspor yang melalukan vaksinasi darurat haruslah berdasarkan pada bukti saintifik dan konsisten dengan regulasi perdagangan internasional untuk hewan hidup dan produknya.
Sebelum tahun 2014 diharapkan bahwa upaya yang pengendalian telah diimplementasikan di seluruh dunia akan mengurangi level infeksi, meskipun puncak-puncak penyakit musiman dan variasi tahunan masih akan terjadi. Eradikasi secara global telah tertunda oleh terjadinya penyebaran virus yang ekstensif di seluruh dunia sejak 2014. Meskipun di lokasi-lokasi yang akhir-akhir ini terinfeksi virus telah berhasil dieliminasi, tempat-tempat ini tetaplah rentan terhadap pemasukan virus kembali, dikarenakan ketidakpastian menetapnya virus baik pada burung liar maupun lingkungan, bersama dengan arah revolusi virus kedepannya. Pengalaman dari wabah yang pertama kembali tahun 2005-2008 di Afrika Barat mendemonstrasikan bahwa virus dapat dieliminasi di wilayah tersebut, dan pelajaran yang telah dipetik dari wabah yang terjadi sebelumnya harus dapat diaplikasikan. Akan tetapi, sektor perunggasan di Afrika Barat telah berkembang sejak wabah terakhir, dan hal ini mungkin dapat mempersulit program eliminasi virus. Ditambah lagi, sumber pendanaan yang telah diberikan oleh donor antara tahun 2005 sampai 2011 mungkin tidak tersedia di masa depan.
Tampaknya virus clade 2.3.4.4 tidak menetap pada populasi burung liar di Amerika Utara, mengikuti pola yang terlihat pada virus-virus pada burung liar di Asia yang telah menghilang setelah satu tahun atau beberapa tahun kemudian, seperti yang terjadi pada virus clade 2.2. Sudah terdapat tanda-tanda evolusi divergen pada virus-virus ini pada jalur migrasi yang berbeda. Masih banyak yang perlu dipelajari tentang ekologi virus-virus ini pada populasi burung liar.
Satu pelajaran yang telah didapat dari panzootik ini adalah bahwa prediksi tingkah laku virus HPAI H5 sulit dilakukan. Namun demikian, pola-pola tertentu telah terindentifikasi. Sebelum tahun 2005, saat virus HPAI H5N1 pertama kali terdeteksi apda burung liar di barat laut China, beberapa pihak memprediksi pregerakan virus melalui Rusia ke Eropa dan Afrika. Sekarang hal ini hampir terjadi, dengan kejadian virus berpindah ke Eropa setidaknya tiga kali sejak 2005, meskipun jalur pemasukannya masih belum ditentukan.
Sebagian besar upaya dalam pengendalian virus HPAI H5 keturunan Gs/GD telah didasarkan pada keprihatinan bahwa virus-virus ini dapat menjadi strain pandemi virus pada manusia. Hal ini adalah pendorong besar dalam investasi penanggulangan penyakit pada tahun 2005, akan tetapi sudah berkurang saat sekarang ini. Mesir memiliki jumlah total kasus pada manusia per bulan yang tertinggi pada awal tahun 2015, akan tetapi tidak ada respons yang serupa dengan pada tahun 2005, dimana penyebaran antar benua pertama kali terjadi dan baru sedikit kasus pada manusia yang dilaporkan di setiap negara. Satu perbedaan penting antara strain awal virus H51 dan strain yang baru saat ini di Amerika Utara tampaknya mengurangi kapasitas strain Amerika Utara dalam menimbulkan penyakit pada mamalia, termasuk pada manusia. Jika di masa depan virus-virus ini tidak lagi memiliki ancaman signifikan terhadap kesehatan manusia, hanya akan sedikit sumber daya yang tersedia untuk mengupayakan pengendaliannya, karena faktor pendorong utama donasi pembiayaan yang ada selama ini adalah untuk mencegah kemungkinan pandemi influenza. Meskipun terdapat ketidakpastian apakah strain pandemi nantinya akan muncul, dampak yang tinggi dari kejadian itu nantinya memberikan justifikasi untuk mempersiapkan kemungkinan itu. Pengurangan resiko infeksi manusia memerlukan pengendalian infeksi pada sumbernya, yaitu apda reservoir hospes hewannya. Tindakan ini juga tetap diperlukan terlepas dari adanya implikasi kesehatan manusian atau tidak, karena penyakit ini tetaplah sebuah masalah kesehatan hewan serius yang akan menimbulkan dampak signifikan terhadap produsen unggas, terutama peternak-peternak miskin, dan untuk perdagangan unggas dan produk asal unggas dalam cakupan nasional maupun internasional. Potensi dampak jangka panjang terhadap ketahanan pangan global adalah sebuah ancaman yang nyata, terutama di wilayah-wilayah miskin dimana populasi manusia terus meningkat.
Berdasarkan ketahanannya dan evolusinya yang luar biasa selama lebih dari 18 tahun, kepunahan alami virus HPAI H5 dari keturunan Gs/ GD tampaknya sangat jauh kemungkinan terjadinya, meskipun hal ini telah terjadi pada virus-virus influenza yang lainnya. Kapasitasnya dalam menginfeksi baik itik domestik maupun itik liar meskipun belum tentu menimbulkan penyakit menyediakan tempat dimana virus berpatogenitas tinggi dapat bertahan. Sejumlah strain varian virus HPAI H5 telah muncul dan menghilang selama 17 tahun ini, kemungkinan telah digantikan oleh versi virus yang lebih baik, dan proses ini akan terus berlanjut.
Pada beberapa dekade terakhir telah terlihat kemunculan sejumlah penyakit hewan yang telah menyebar secara global. Kemunculan virus HPAI dari keturunan H5 Gs/GD telah memberikan informasi tentang beberapa faktor penggerak munculnya wabah-wabah terkait. Kebanyakan penggerak flu burung berhubungan dengan cara-cara bagaimana unggas dibesarkan dan dijual, dan juga berhubungan dengan luasnya industri perunggasan. Hal ini telah digerakkan oleh permintaan, dan proses berkembangnya telah dibiarkan bergantung pada kekuatan pasar, dengan hanya sedikit pengakuan terhadap adanya masalah dalam perkembangannya yang bisa saja akan atau telah ditimbulkannya. Mendesain dan merombak ulang sistem-sistem ini adalah sebuah tugas yang sangat sulit, akan tetapi tugas itu harus diambil jika keturunan virus ini ingin dapat segera dikontrol dan akhirnya dapat dimusnahkan.
Penghargaan
Informasi dalam Bab ini diambil dari berbagai sumber. Asistensi yang telah disediakan oleh banyak kolega dari Vietnam, China, Kamboja, Daerah Administratif Khusus Hong Kong, dan FAO dari PBB sangat dihargai. Kami juga berterimakasih kepada Todd Davis (CDC Atlanta) yang telah menyediakan gambar 9.1. Banyak sekuensing virus yang ada telah diadakan melalui pengiriman sampel kepada Laboratorium Referensi Weybridge. Kami juga sangat berterimakasih kepada negara-negara yang telah mengirimkan sampel.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

