Oleh: David E. Swayne dan Darrel R. Kapczynski
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.
Perkenalan
Vaksin Avian Influenza (AI) dan aplikasinya di lapangan dapat menjadi alat yang efektif dalam sebuah program pengendalian, yang harus memuat komponen tambahan berikut ini:
- Biosekuriti (bioeksklusi dan biokontainmen, meliputi karantina, membatasi akses manusia ke dalam fasilitas yang terdampak, pembersihan dan desinfeksi, dan pengendalian pergerakan unggas dan peralatannya)
- Edukasi tentang bagaimana mencegah virus AI, meliputi komunikasi risiko
- Diagnostik dan surveilans untuk deteksi virus AI, penyakit ataupun infeksinya dengan akurat dan cepat
- Eliminasi unggas terinfeksi AI melalui eutanasia humanis dan pembuangan karkas ramah lingkungan atau jika memungkinkan melakukan pemasaran yang terkendali dan tepat [330. 331].
Penggunaan semua komponen ini dengan berbagai kombinasinya dalam sebuah strategi pengendalian dapat mencegah, mengontrol ataupun mengeradikasi Avian Influenza. Akan tetapi, penggunaan vaksin AI saja dapat sangat membatasi efektivitas setiap program pengendalian, terutama jika ingin mencapai eradikasi penyakit, kecuali jika digunakan dengan tepat. Penggunaan vaksin AI dapat mengendalikan penyakit, akan tetapi jika ditambah dengan empat komponen lain dalam sebuah program pengendalian yang komprehensif, maka dapat mencegah atau mengeradikasi penyakit dan/atau infeksi yang ada.
Sejarah vaksin avian influenza
Pada awal tahun 1900-an, beberapa ayam yang terinfeksi virus sampar unggas (misalnya virus HPAI H7) telah diamati sembuh dari penyakit dan tahan terhadap penyakit setelah terkena wabah sampar unggas kedua (dua tinjauan memberikan informasi lebih lanjut) [24, 358]. Darah ayam tersebut yang mengandung substansi yang dapat menetralisasi virus (misalnya antibodi penetralisir). Usaha awal untuk memproduksi vaksin masih tidak konsisten dalam memproduksi imunitas [254, 358]. Vaksin pertama didapat dengan mengeringkan sumsum tulang belakang dari unggas yang terkena sampar unggas (sebuah percobaan untuk menggunakan teknologi yang telah berhasil menciptakan vaksin rabies Pasteur), atau diproduksi menggunakan panas, cahaya dan berbagai jenis kimiawi (misalnya formalin, fenol gliserin, tricresol gliserin, dst.) untuk menginaktivasi virus di dalam darah atau liver ayam yang telah mati karena sampar unggas. Kegagalan pembuatan vaksin umumnya merupakan akibat dari inaktivasi virus HPAI yang tidak lengkap sedemikian rupa sehingga pemberian vaksin malah berakibat timbulnya sampar unggas, atau vaksin tersebut tidak memproduksi perlindungan yang cukup karena tidak terdapat cukup virus inaktif yang dapat memproduksi respons imun, seperti misalnya pada unggas tervaksinasi yang tumbang setelah diberikan vaksin. Akan tetapi, jika vaksin berhasil diciptakan, ia dapat mempertahankan efektivitas sampai setidaknya 120 hari jika disimpan dalam suhu -3 derajat C. Imunisasi awal dan studi tantang mengindikasikan bahwa virus sampar unggas Eropa semuanya memiliki proteksi silang (misalnya memberikan proteksi sub tipe homogen untuk semua virus HPAI H7). Akan tetapi, karena kesuksesan program stamping-out dan inkonsistensi vaksin, vaksin tidak digunakan dalam program pengendalian HPAI sebelum tahun 1995, dimana vaksin digunakan untuk pertama kalinya di Meksiko dan Pakistan.
Pengembangan vaksin untuk mengendalikan virus LPAI muncul pada pertengahan tahun 1960-an, dan didasarkan pada kebutuhan secara ekonomi. Sebagai salah satu dari upaya awal pengamatan potensi kekebalan sebagai upaya pengendalian LPAI, beberapa flok kalkun pullet breeder yang dibesarkan dalam peternakan di California dibiarkan mengidap LPAI dan memproduksi gejala ringan, akan tetapi unggas yang sembuh kemudian dapat terlindungi dari gejala penurunan produksi telur yang disebabkan oleh LPAI setelah dipindahkan ke kandang khusus produksi breeder (R. McCapes, komunikasi personal, 23 Mei 2007). Terjadinya kerugian besar karena wabah LPAI yang menimpa breeder kalkun di Minnesota selama musim semi tahun 1978 berakibat disahkannya izin baru spesial dan kondisional untuk penggunaan vaksin AI inaktif komersial oleh Departemen Pertanian Amerika Serikat (USDA). Vaksin pertama ini diproduksi pada akhir tahun 1978, dan pada awalnya digunakan pada tahun 1979 untuk mengendalikan LPAI pada kalkun di Minnesota dan California [223, 253]. Beberapa vaksin AI digunakan pada kalkun pedaging di Minnesota, akan tetapi di California vaksin AI hanya digunakan pada kalkun breeder, setiap ekor unggas menerima dua dosis vaksin yang diberikan terpisah 4 – 6 minggu. Pada tahun 1980, vaksin AI inaktif polivalen H5N2, H6N2, dan H10N2 bersama virus Newcastle Disease (NDV) dilaporkan telah digunakan di Italia untuk mengendalikan banyak sub tipe virus LPAI bersama virus Newcastle Disease [402]. Di Amerika Serikat, perizinan kondisional diizinkan untuk penggunaan vaksin non-H5/H7 pada tahun 1985, akan tetapi vaksin H5/H7 memerlukan persetujuan pemerintah federal untuk distribusi dan penggunaannya dalam rangka mencegah mencampuri upaya eradikasi [107].
Fitur-fitur ideal vaksin avian influenza untuk hewan
Vaksin AI ideal adalah yang secara antigenik memiliki kedekatan dengan virus yang ada di lapangan untuk memberikan perlindungan terbaik, dapat digunakan untuk banyak spesies unggas, cocok dengan perlindungan dosis tunggal, dapat dengan mudah diberikan secara massal kepada populasi unggas yang besar, cocok dengan metode yang memudahkan identifikasi unggas terinfeksi dalam populasi yang sudah terinfeksi (misalnya strategi DIVA yang digunakan untuk membedakan hewan terinfeksi dengan yang divaksinasi), dapat mengatasi blokade antibodi maternal untuk menimbulkan respons imun aktif, mungkin dapat diberikan dalam penetasan pada umur satu hari atau in-ovo, dan juga tidak mahal (Tabel 15.1) 116, 117, 342]. Saat mengembangkan vaksin yang baru karakteristik ini harus dipertimbangkan, karena vaksin tampaknya tidak mungkin untuk dikembangkan dalam pemasaran kecuali jika mengandung karakteristik ‘ideal jika dibandingkan dengan vaksin AI yang telah diizinkan untuk unggas sebelumnya. Hal ini membutuhkan peneliti yang memiliki pengetahuan praktis tentang bagaimana produksi unggas di negara yang melisensi vaksin, dan bagaimana dilakukan manajemen permasalahan kesehatan unggas terkait di lapangan di negara-negara dan wilayah yang berbeda. Sebagai tambahan, pembaca harus menerima bahwa karakteristik ideal dari vaksin influenza manusia tidak akan menjadi ideal untuk vaksin AI unggas. Selain itu, pembaharuan teknologi vaksin yang baru masih belum cukup untuk dapat digunakan (misalnya teknologi baru yang ada harus dapat dipraktikkan). Tidak ada satu pun vaksin AI yang telah diberikan izin edar telah memenuhi seluruh kriteria vaksin ideal, karena itu masih banyak ruang untuk inovasi dan perbaikan.
Dasar perlindungan secara imunologi
Vaksin AI memberikan proteksi pada unggas, pada prinsipnya melalui imunitas humoral sistemik melawan protein hemaglutinin (HA), dan perlindungan semacam itu bersifat spesifik kepada sub tipe HA virusnya. Serupa dengan itu, infeksi virus LPAI juga menimbulkan proteksi terhadap paparan atau tantangan dari sub tipe HPAI HA yang sama, yang mengindikasikan terlibatnya kekebalan mukosa dan seluler dalam memberikan proteksi [376]. Antibodi humoral spesifik melawan protein neuraminidase (NA) dapat memberikan proteksi parsial sampai proteksi penuh. Laporan baru-baru ini telah menunjukkan bahwa kekebalan yang dimediasi oleh sel dapat berkontribusi memberikan proteksi melawan virus AI [161, 284].
Usaha teoritikal untuk mengembangkan vaksin universal untuk unggas adalah tujuan jangka panjang, dengan beberapa langkah kecil kesuksesan dalam mengurangi replikasi virus, terutama untuk LPAI, akan tetapi proteksi terhadap betapa mematikannya HPAI masih belum dapat dicapai. Sebagai contoh, imunisasi ayam dengan program prime-boost menggunakan rekombinan Adenovirus-NP/M dan rekombinan Vaccinia-NP/M mengurangi pendedahan melalui kloaka oleh virus LPAI A/Turkey/England/1977 (H7N7) [161]. Vaksinasi prime-boost dengan M2 dan M2e pada ayam memproduksi antibodi melawan protein tersebut, termasuk juga menetralisir protein, akan tetapi gagal untuk melindungi dari kematian pada uji tantang virus HPAI [35].
Kriteria laboratorium untuk menilai proteksi vaksin
Tujuan vaksinasi AI adalah memproduksi respons imun yang bersifat protektif melawan penyakit (morbiditas dan mortalitas), dan idealnya, mencegah infeksi. Penilaian proteksi yang ditimbulkan vaksin penting untuk otoritas pengatur kebijakan nasional, dimana hanya vaksin yang berizin yang memiliki efikasi dan bersifat poten, dan menilai apakah vaksin dapat digunakan dengan praktis di lapangan. Proteksi dapat diukur secara langsung dengan pengujian laboratorium secara in vivo menggunakan beragam variasi hewan unggas model dan berbagai ukuran kriteria atau metrik. Model laboratorium dapat berguna untuk mengukur proteksi secara langsung pada spesies target atau spesies pengganti sementara variabel lain seperti bibit strain vaksin, strain virus tantang, dosis virus tantang, dan isi antigen vaksinnya bersifat ter standarisasi. Ditambah lagi, berbagai variasi upaya tidak langsung dapat digunakan untuk menilai proteksi saat dibandingkan dengan data proteksi in-vivo. Pengukuran-pengukuran ini dapat meliputi uji-uji respons imunologi, seperti respons titer antibodi atau respons yang dimediasi sel, atau uji-uji untuk menguantifikasi jumlah protein yang akan memproduksi respons imunologis protektif yang muncul dari vaksin. Di bagian ini, istilah ‘efikasi’ akan digunakan untuk mengindikasikan bahwa vaksin bersifat protektif dalam penelitian yang telah terdefinisi dan ter standarisasi, dimana istilah ‘potensi’ mengindikasikan bahwa vaksin telah memenuhi uji kontrol kualitas yang meyakinkan adanya massa antigenik yang cukup dari protein immunogenik protektif untuk menimbulkan respons imunologis yang konsisten yang harus bersifat protektif dalam kondisi eksperimental demikian juga dalam kondisi lapangan yang bervariasi.
Penilaian proteksi secara langsung
‘Standar Emas’ untuk menilai kekebalan protektif dari vaksin AI adalah penggunaan model uji tantang virus LPAI dan HPAI pada spesies target atau spesies unggas pengganti lainnya. Dalam sejarahnya, sebagian besar penelitian vaksin AI dan penggunaan vaksin lapangan selanjutnya telah berfokus pada ayam, dan untuk sebagian kecilnya kalkun, karena spesies-spesies ini merupakan spesies yang dipelihara di negara-negara maju, dan mereka telah terdampak baik oleh infeksi dan penyakit yang disebabkan virus LPAI maupun HPAI. Ditambah lagi, spesies-spesies ini telah mengalami angka kematian tertinggi karena terpapar virus HPAI, dan ketika telah terinfeksi, spesies-spesies ini telah mengekresikan virus dalam konsentrasi tinggi ke lingkungan, berakibat terjadinya transmisi virus yang efisien antar individu dan terjadinya persebaran virus antar lokasi. Dengan berubahnya epidemiologi virus HPAI H5N1 A/goose/Guangdong/1996 (keturunan Gs/GD) di Asia, itik domestik dan angsa pun telah muncul sebagai kontributor yang teramat penting dalam maintenans dan penyebaran virus HPAI, dan telah berakibat meningkatnya kerugian ekonomi, dan karena itu memerlukan perhatian utama dalam penanganan AI melalui vaksin dan program vaksinasi. Karena itu, evaluasi proteksi pada spesies hospes tambahan, seperti itik, angsa, spesies unggas gallinaseus lainnya (misalnya burung puyuh jepang, burung pegar, burung ayam hutan, ayam Guinea, dll.), burung unta dan burung dalam taman zoologi mungkin saja diperlukan.
Seluruh studi in-vivo harus memasukkan sekelompok unggas yang divaksinasi dengan kontrol placebo (sham) untuk meyakinkan bahwa uji tantang yang baik dan tepat telah dicapai. Penelitian haruslah didesain dengan tepat dan dievaluasi menggunakan metode statistik untuk menetapkan efek perlakukan yang tidak bias untuk vaksin yang diuji. Perbedaan numerikal sederhana dalam bertahan hidup atau metrik ukur lain untuk sejumlah kecil unggas yang tidak diuji dengan statistik. Tidak boleh diinterpretasikan sebagai signifikan, dan dapat berakhir pada interpretasi yang bias. Meskipun penggunaan model tantang untuk virus AI adalah hal yang biasa untuk perizinan vaksin untuk ayam, kalkun dan baru-baru ini juga untuk itik, model tantang bisa jadi tidak memadai secara ekonomi di semua negara dalam rangka memberikan izin vaksin AI untuk angsa domestik, spesies unggas gallinaseus minor lainnya, burung unta dan burung-burung yang dipelihara di taman zoologi. Sebagai alternatif, demonstrasi dua antibodi HI yang bersifat sensitif terhadap sub tipe HA, terutama setelah dua kali vaksinasi, telah dihubungkan dengan proteksi, dan bisa jadi pengukuran proteksi yang cukup pada spesies unggas minoritas dan spesies non-unggas non-target untuk digunakan di lapangan [185, 345].
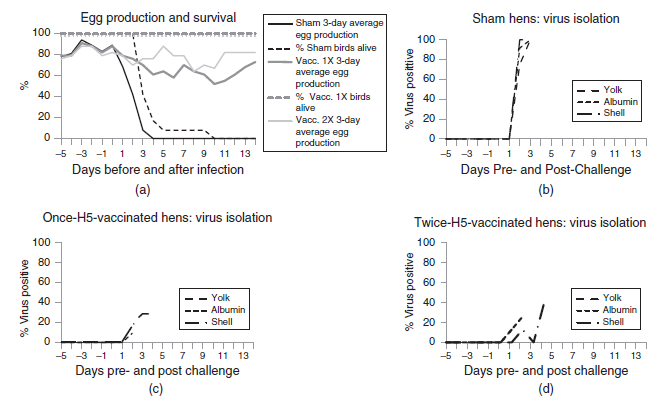
Kriteria yang digunakan untuk menilai proteksi dapat bervariasi tergantung pada apakah yang diuji adalah virus LPAI atau HPAI. Untuk tantang HPAI, pencegahan gejala klinis respiratori dan gejala klinis umum (morbiditas) dan kematian (mortalitas) adalah kriteria yang telah paling banyak dipergunakan untuk menilai proteksi (Tabel 15.2) [176]. Model uji tantang virus LPAI paling eksperimental tipikalnya tidak menimbulkan gejala klinis atau kematian, yang menyebabkan pengukuran morbiditas ataupun mortalitas menjadi tidak dapat diandalkan untuk mengukur proteksi vaksin LPAI. Akan tetapi baru-baru ini, proteksi terhadap konjungtivitis telah diajukan sebagai salah satu metrik pengukuran dalam penilaian vaksin pada model uji tantang virus LPAI H9N2 melalui paparan pada kantong konjungtiva [41, 145, 304, 305, 394, 398. Ditambah lagi, baik virus LPAI maupun virus HPAI dapat mempengaruhi kesehatan reproduksi ayam dan kalkun petelur, dan mencegah penurunan produksi telur atau berkurangnya jumlah telur yang positif virus (untuk kasus HPAI saja) dapat menjadi indikator kuantitatif adanya proteksi (Gambar 15.2) [[174].
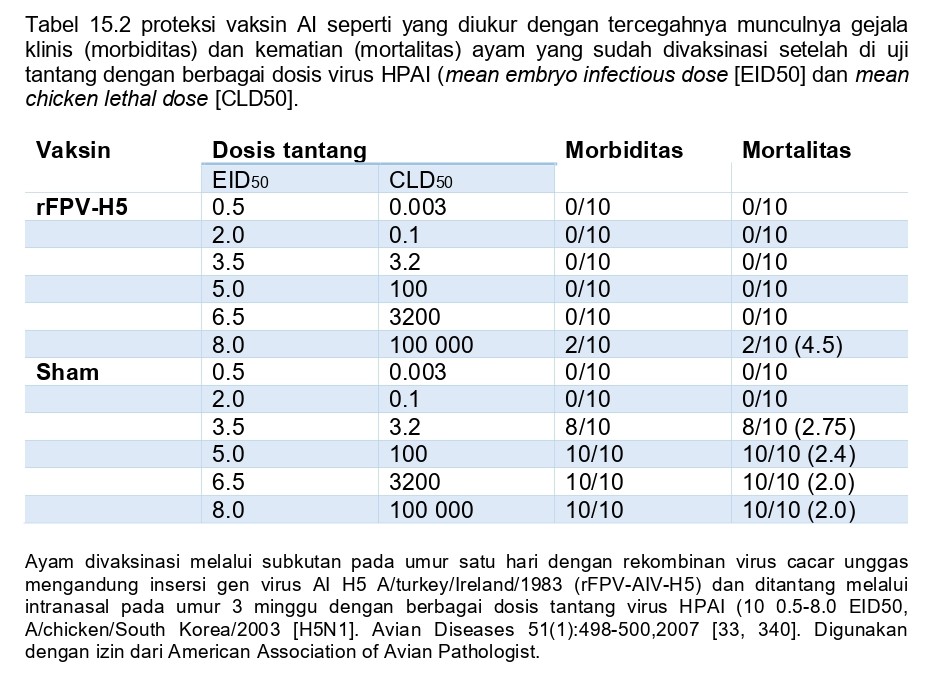
Baik untuk virus LPAI maupun HPAI, pencegahan infeksi atau reduksi replikasi virus secara kualitatif dan/atau kuantitatif dalam saluran respirasi dan digesti, adalah kriteria proteksi yang secara tidak langsung mengukur peranan vaksin dalam membatasi kontaminasi lingkungan dan persebaran virus di lapangan (Tabel 15.3 dan Gambar 15.2) [2, 29, 41, 165, 249, 304, 341]. Berkurangnya replikasi virus yang diuji tantang dapat dikuantifikasi menggunakan cara klasik isolasi virus dan metode titrasi dalam telur ayam berembrio (ECE) atau sistem kultur jaringan [18, 63, 52, 322, 23, 328], atau dengan pengujian asam amino spesifik secara kuantitatif ataupun kualitatif, seperti misalnya dengan. RRT-PCR [304, 322], atau dengan mendemonstrasikan protein virus AI, misalnya dengan uji ELISA [152, 189]. Demonstrasi berkurangnya replikasi dan titer pendedahan virus dari saluran pernafasan dan harus menunjukkan nilai minimum 10 2 EID (100 kali) lebih sedikit virus pada hewan tervaksinasi dibandingkan dengan unggas yang belum divaksinasi [177], atau perbedaan harus dianalisis untuk melihat signifikansinya secara statistik [314]. Badan perizinan terkait biologi veteriner nasional mungkin memerlukan demonstrasi bahwa berkurangnya jumlah virus terdedah relevan secara klinis (misalnya bahwa baik pendedahan virus maupun kontak transmisi dapat dikurangi dalam studi eksperimental). Selain itu, unggas yang sudah divaksinasi memiliki resistensi yang dapat diukur secara kuantitatif terhadap induksi infeksi yang terukur dengan angka dosis uji tantang sebesar lebih besar dari 10 32- 10 5 EID50 untuk dapat menimbulkan infeksi pada unggas yang sudah divaksinasi jika dibandingkan dengan unggas yang tidak divaksinasi, dan resistensi semacam itu dapat dipergunakan sebagai alat ukur proteksi. Akan tetapi, eksperimen yang harus dilakukan sangat besar dan memerlukan biaya mahal [322]. Di antara berbagai metrik proteksi yang teramati pada studi eksperimental, vaksin AI harus berulang kali dapat menunjukkan bukti dapat mencegah kematian, diikuti dengan mencegah munculnya gejala klinis, dan kemudian pecegahan atau pengurangan replikasi dan pendedahan virus dari saluran makanan, dan paling sulit untuk didemonstrasikan adalah pencegahan replikasi virus dan pendedahannya dari saluran pernafasan. Reduksi pendedahan semacam itu dicapai paling baik jika hemaglutinin virus dalam vaksin dan virus tantang secara genetik dan antigenik berhubungan dekat. [45, 63]. Penurunan produksi telur adalah yang paling sulit dicegah di antara metrik morbiditas lainnya. Baru-baru ini, saat menilai proteksi yang diberikan vaksin inaktif pada ayam setelah terkena virus LPAI, reduksi protein fase akut serum dihubungkan dengan berkurangnya pendedahan strain virus dari orofaring [152, 294, 295, 325].
Gambar 15.1. Contoh metrik produksi yang berhubungan dengan unggas petelur menggunakan produksi telur (persentase telur/ekor/hari dengan rata-rata pengukuran 3 hari), kematian ayam betina (%), dan terkontaminasinya telur/positif virus pada permukaan kerabang, kuning telur dan albumin dari sampel (% positif virus) untuk populasi kontrol (sham) yang tervaksinasi dan ayam yang telah divaksin dengan vaksin H5 satu atau dua kali yang diuji tantang dengan virus HPAI A/chicken/Pennsylvania/1370/83 (H5N2). Swayne dkk., Vaccine 30(33):4964-4970, 2012 [11]. Digunakan dengan izin dari Elsevier.
Tabel 15.3 Proteksi vaksin AI yang diukur dengan berkurangnya jumlah pendedahan virus HPAI oleh ayam yang sudah divaksinasi dari orofaring dan kloaka

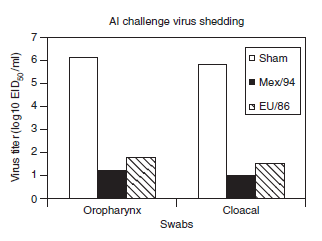
Gambar 15.2 Berkurangnya titer virus HPAI yang didedahkan dari orofaring dan kloaka dari ayam yang terinfeksi dua hari pasca uji tantang. Lihat detail di Tabel 15.3. Batas deteksi minimum adalah 101 ELD50/ml. Sumber: David E. Swayne.
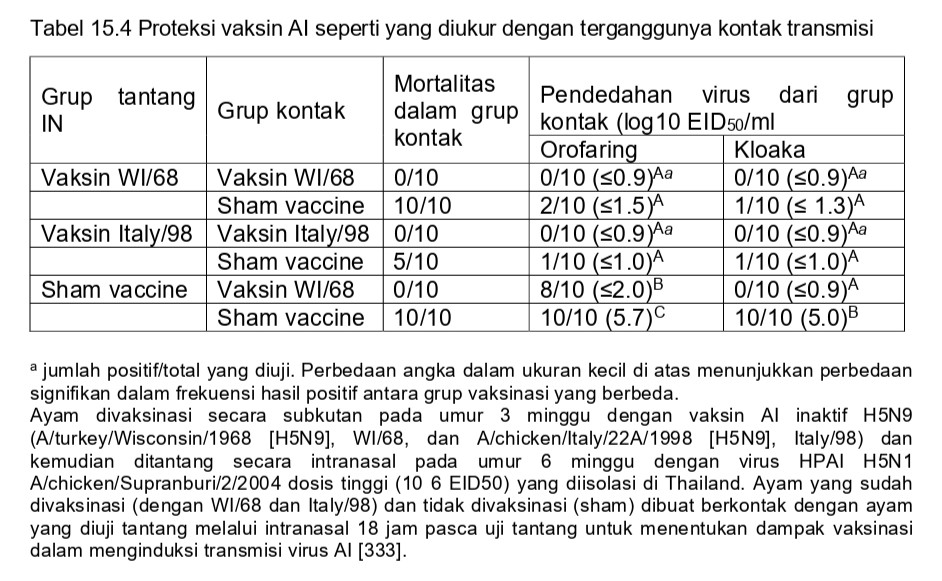
Pencegahan transmisi kontak adalah lebih menggunakan metode laboratorium langsung untuk mengukur kapasitas protektif vaksin untuk membatasi persebaran virus di lapangan (Tabel 15.4) [347]. Pencegahan transmisi kontak telah digunakan sebagai alat evaluasi epidemiologi untuk mendemonstrasikan bahwa vaksinasi yang baik harus dapat menghentikan epidemi HPAI dengan membatasi transmisi dan infeksi dari unggas ke unggas lain [322]. Sebagai contoh, salah satu dari model kuantitatif ter standarisasi menggunakan ayam dalam kandang menunjukkan bahwa dua vaksin H7 inaktif dapat memblokade secara penuh transmisi HPAI 2 minggu setelah vaksinasi, sementara 1 minggu setelah vaksinasi terlihat bahwa transmisinya hanya setengahnya saja terblok/tercegah [368]. Berdasarkan studi eksperimental, keberadaan unggas terimunisasi dalam jumlah presentasi yang tinggi dalam populasi sangat penting untuk mencegah transmisi kontak. Untuk mencegah wabah yang besar, 60% unggas dalam populasi harus diimunisasi, akan tetapi menggunakan batas atas confidence interval (CI), 90% (data eksperimental) dan 80% (data observasi) dari ayam dalam populasi harus divaksinasi untuk mencegah transmisi, dan reduksi transmisi kontak telah didemonstrasikan setidaknya paling awal 1 minggu setelah vaksinasi [367, 368]. Meskipun pencegahan transmisi kontak adalah tujuan akhirnya, pengujian laboratorium rutin untuk mengetahui transmisi kontak biasanya tidak ter standarisasi, sehingga tidak mungkin untuk membuat perbandingan antara data laboratorium dan data percobaan. Kebanyakan penelitian hanya mencakup penempatan unggas yang belum divaksinasi ke dalam kandang yang juga memuat unggas sudah divaksinasi yang diuji tantang dengan virus AI, akan tetapi pencegahan transmisi kontak dipengaruhi oleh banyak variabel, meliputi kepadatan unggas, tipe kandang, dan sanitasi dan ventilasi [33, 369, 370]. Sebagai contoh, mungkin lebih sulit untuk memblok transmisi pada unggas yang dibesarkan dalam kandang yang ada alas kandang, daripada yang dipelihara dalam kandang berlantai kawat/ada celah pembuangan kotoran di lantai kandang.
Dalam studi eksperimental, imunitas yang efektif untuk mencegah kematian mungkin dapat dicapai pada ayam dan unggas gallinaseus lainnya setelah satu kali vaksinasi, akan tetapi vaksinasi tunggal pada broiler komersial tidak efektif untuk mengurangi transmisi kontak [362]. Pada beberapa studi eksperimental pada itik dan angsa, diperlukan lebih dari satu kali vaksinasi untuk dapat menimbulkan imunitas protektif [250]. Kemudian, di lapangan, karena virus bersifat immunosupresif, antibodi maternal dan faktor lainnya, program vaksinasi dua kali biasanya diperlukan untuk memproduksi proteksi lapangan, terutama jika virus di lapangan beragam secara antigenik [102, 369]. Di lapangan, imunitas protektif lebih sulit untuk dicapai daripada yang telah didemonstrasikan dalam studi eksperimental menggunakan unggas bebas patogen spesifik (SPF).
Banyak faktor akan mempengaruhi proteksi vaksin AI dalam studi eksperimental, meliputi:
- Dosis virus di uji tantang. Vaksin kualitas tinggi memberikan proteksi melawan paparan berisiko tinggi, dimana vaksin kualitas inferior mungkin hanya dapat memberikan perlindungan dari virus dengan dosis rendah, dengan perubahan dosis tantang paling konsisten antara 106 mean embryo infectious doses (EID50) atau 103 mean chicken infectious doses (CID50) [34, 74, 246, 343].
- Kuantitas hemaglutinin dalam vaksin inaktif atau titer virus hidup dalam vaksin vektor rekombinan. Vaksin yang berisi hemaglutinin tinggi (inaktif) atau vaksin dengan titer virus tinggi (vaksin hidup/live) memberikan proteksi terbaik melawan replikasi virus AI dalam saluran respirasi dan digesti, dimana vaksin dengan antigen yang rendah atau kandungan virus yang rendah mungkin tidak dapat memproteksi sama sekali, atau mungkin melindungi dari morbiditas dan mortalitas akan tatapi tidak mengurangi replikasi dan pendedahan virus dari saluran respirasi dan digesti [322].
- Adjuvan. Penggunaan adjuvan minyak tambahan adalah hal yang umum dalam vaksin unggas inaktif, termasuk vaksin AI, dan memproduksi respons imun protektif jangka panjang yang lebih kuat dan luas daripada vaksin non-adjuvan [322, 323, 391].
- Kecocokan hemaglutinin. Makin besar kesamaan genetik dan antigenik antara HA dalam vaksin dan virus di lapangan, makin besar pula reduksi dalam replikasi dan pendedahan virus pasca tantang dari saluran respirasi. Penggunaan vaksin dalam jangka waktu lama (untuk lebih dari 3 tahun) dihubungkan dengan kemunculan varian virus AI dengan antigenik H5 di China, Meksiko, Hong Kong, Vietnam, Indonesia dan Mesir, dimana vaksin yang sudah terdaftar tidak mampu memberikan proteksi [99, 309]. Akan tetapi, di Pakistan, tidak muncul varian antigenik yang tidak dapat dilindungi oleh vaksin H7 yang tersedia [74, 77, 86, 172, 190, 325, 339, 344].
- Lama proteksi. Vaksin yang terbaik memproduksi proteksi paling awal 7 – 10 hari setelah vaksinasi, dengan puncak perlindungan pada minggu ke 3-4, dan proteksinya dapat bertahan dari 6 sampai 12 bulan, akan tetapi lama proteksi berhubungan dengan kuantitas antibodi protektif yang diproduksi (misalnya titer antibodi) setelah imunisasi. Akan tetapi, pada beberapa spesies, periode proteksi yang lama mungkin memerlukan beberapa vaksinasi tambahan [1].
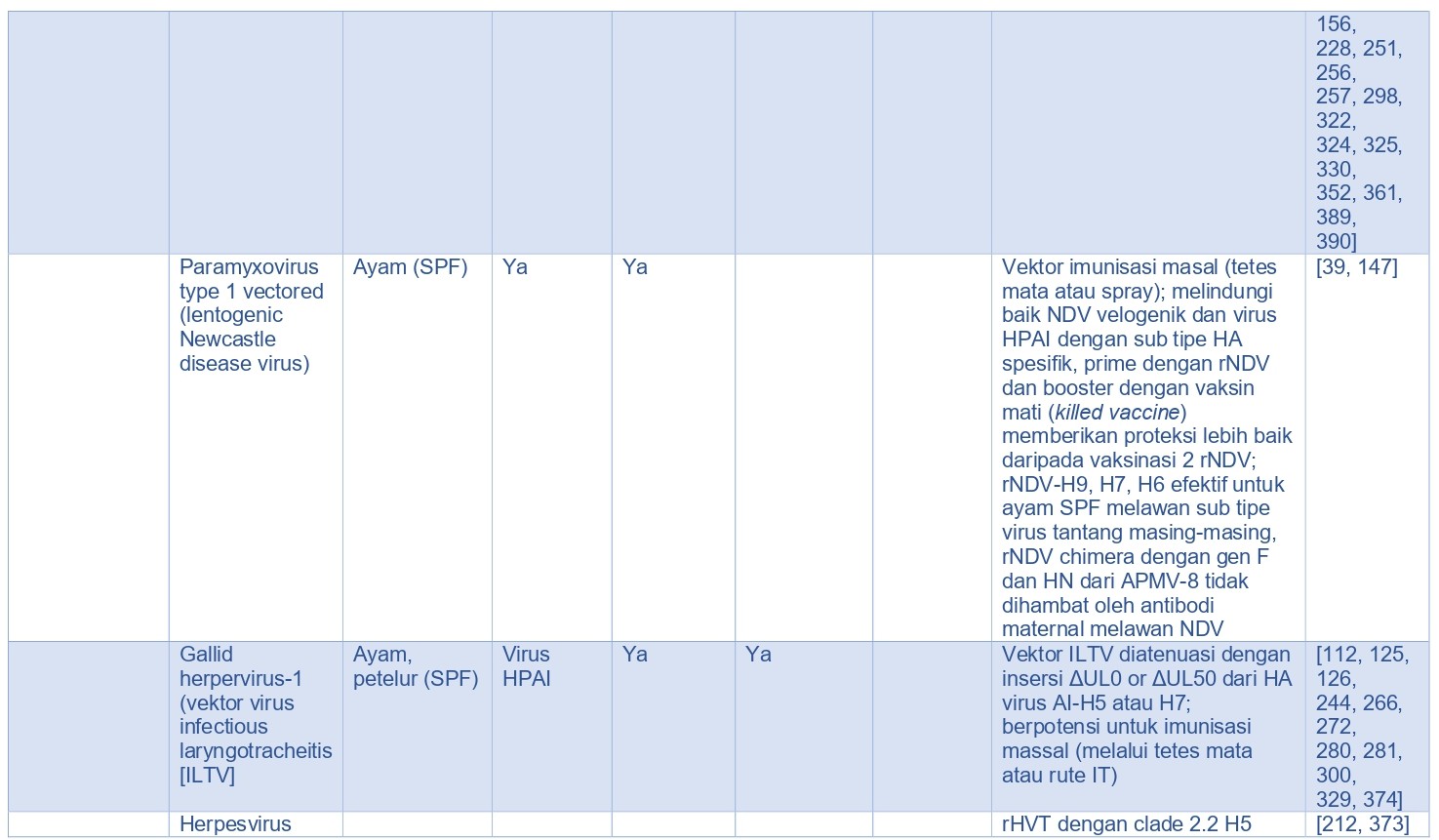
- Rute pemberian vaksin. Virus AI inaktif dan vaksin rekombinan cacar unggas (rFPV) dan vaksin rekombinan virus herpes kalkun (rHVT) dengan insersi gen H5 AI (rFPV-H5 dan rHVT-H5), memerlukan pemberian vaksin secara parenteral, sementara beberapa vaksin vektor yang hidup (live) seperti rekombinan virus Newcastle Disease (rNDV) dengan insersi gen virus AI H5 (rNDV-H5), dapat diberikan melalui rute topikal massal seperti melalui spray/semprot atau melalui air minum untuk memperoleh proteksi. rFPV-H5, rHVT-H5, dan vaksin lainnya memiliki potensi aplikasi melalui in-ovo [322].
- Spesies unggas dan jumlah vaksinasi. Ayam pedaging yang masa hidupnya pendek mungkin dapat diproteksi sepanjang hidupnya sebagai hewan produksi setelah divaksinasi satu kali saja sesuai dengan yang ditemukan dalam studi eksperimental, akan tetapi studi lapangan menunjukkan bahwa dua kali vaksinasi diperlukan untuk memberikan proteksi optimal, karena antibodi maternal terhadap HA dari virus AI atau vektornya. Beberapa spesies unggas pedaging (misalnya kalkun, itik dan angsa) dan unggas yang hidup lama (misalnya petelur dan breeder) mungkin memerlukan beberapa kali vaksinasi tambahan untuk mencapai proteksi yang akan bertahan sampai akhir berlangsungnya siklus produksinya [19, 164, 244, 322, 327].
- Umur vaksinasi. Respons imun optimal dengan vaksin AI dicapai setelah umur dua minggu dan sebelum pubertas untuk sebagian besar unggas, karena itulah proteksi sub optimal mungkin dapat terlihat pada unggas yang divaksinasi sebelum umur 2 minggu, dan pada unggas dewasa pada kejadian stres selama siklus petelur, akan tetapi timing vaksinasi sub optimal semacam itu mungkin penting untuk diperhatikan dalam merancang vaksinasi pertama atau booster dalam program vaksin multidosis dalam satu sistem produksi yang sama.
- Proteksi di lapangan vs proteksi di laboratorium. Proteksi di lapangan kurang tercapai dibandingkan dengan di studi efikasi di laboratorium karena adanya antibodi maternal, virus yang bersifat immunosupresif, penyimpanan vaksin dan permasalahan dalam pengiriman vaksin, vaksinasi yang tidak lengkap atau tidak dapat menepati jadwal vaksin yang sudah ditentukan di suatu peternakan atau dalam suatu wilayah, dan kegagalan mengikuti anjuran pakai dari perusahaan pembuat vaksin, seperti misalnya pemberian dosis vaksin yang kurang dari anjuran [16, 34, 322]. Dampak antibodi maternal melawan protein virus AI atau vektor vaksin terhadap proteksi dapat diukur melalui studi eksperimental menggunakan keturunan dari breeder yang sudah divaksin, atau dengan modeling menggunakan transfer antibodi anti-virus AI secara pasif kepada anak unggas SPF berumur satu hari [328, 330].
Sebelum tahun 2004, vaksin AI pada unggas memiliki waktu penggunaan di lapangan yang lebih lama tanpa harus mengubah strain vaksin jika dibandingkan dengan vaksin influenza musiman pada manusia, terutama karena terbatasnya penggunaan pada unggas, mengurangi kesempatan terjadinya antigenic drift pada hemaglutinin dan keberadaan kesamaan antigenik/reaktivitas silang luas dalam suatu sub tipe. Sebagai contoh, vaksin rFPV-H5 dengan insersi gen virus AI H5 tahun 1983 melindungi ayam dari berbagai virus uji tantang HPAI H5 yang berasal dari Amerika Utara dan Eurasia yang diisolasi dari tahun 1959 sampai 2004, sebelum vaksin akhirnya digunakan secara luas sebagai alat pengendalian virus HPAI atau LPAI H5/H7 [111]. Serupa dengan itu juga, vaksin AI H5 inaktif berdasarkan strain bibit vaksin virus LPAI klasik A/turkey/Wisconsin/68 (H5N9), A/turkey/3689-1551/Minnesota/81 (H5N2), A/duck/Potsdam/1402/86 (H5N2), dan A/duck/Singapore/F119/1997 menyediakan perlindungan melawan strain virus awal HPAI H5N1 keturunan Gs/GD A/Hong Kong/156/1997 dan A/chicken/Indonesia/7/2003 [43, 45, 325]. Akan tetapi, hilangnya proteksi yang disebabkan drift yang terjadi pada virus di lapangan telah diidentifikasi untuk strain virus vaksin AI H5N2 tahun 1994 yang digunakan untuk melawan munculnya strain virus LPAI Meksiko 1998 dan Guatemala 2003 [327, 333]. Kemudian, dengan pengembangan kampanye vaksinasi melawan virus HPAI H5 keturunan Gs/GD, telah teridentifikasi virus di lapangan yang resistan terhadap vaksin yang sudah berizin di China, Hong Kong, Mesir, Indonesia, dan Vietnam [190]. Sebagai respons terhadap hal itu China telah mengubah bibit strain vaksin setiap 4 – 5 tahun sekali ketika strain yang resistan terhadap vaksin muncul di lapangan [2, 86, 344]. Serupa dengan itu, di Korea dan China virus LPAI H9N2 di lapangan telah beralih dari bibit strain vaksin komersial [339]. Sebagai akibatnya, vaksin AI harus terus dievaluasi untuk memproteksi melawan strain virus drift di lapangan. Paling minimum, perlindungan in vivo melawan virus yang bersirkulasi di lapangan harus dinilai setiap dua tahun sekali, dan program berkelanjutan untuk menilai kartografi serologis virus terbaru di lapangan melawan antisera HI yang diproduksi dengan strain vaksin harus menjadi alat assesmen rutin.
Penilaian proteksi secara tidak langsung
Penilaian langsung dengan model tantang in-vivo untuk efikasi vaksin memerlukan banyak waktu dan memerlukan biaya mahal, akan tetapi penting untuk pendaftaran awal vaksin sebagai demonstrasi bahwa vaksin dapat melindungi terhadap virus spesifik di lapangan. Akan tetapi, penilaian tidak langsung dapat menjadi sebuah pilihan di beberapa situasi untuk menilai perlindungan yang diberikan, terutama saat menentukan konsistensi batch vaksin sebagai sebuah cara untuk memastikan level perlindungan minimal. Penilaian tidak langsung yang semacam itu dapat didasarkan pada respons serologis protektif, misalnya netralisasi titer antibodi HI pada unggas yang telah divaksin, atau melalui kuantifikasi HA (yang memicu respons imun protektif untuk vaksin AI inaktif) atau titer infeksius vaksin hidup (live) [242, 319]. Kuantifikasi HA dalam vaksin inaktif telah dicapai dengan uji radial immunodiffusion [214], titer infeksius sebelum inaktivasi [394], titer hemaglutinin [323], uji receptor-binding surface plasmon resonance (SPR) [32], dan metode imunologi untuk menguantifikasi protein HA, seperti ELISA atau uji imunitas lainnya [171]. Sebagai alternatif, kuantitas protein HA dapat dihitung menggunakan formula protein/asam nukleat dan kandungan asam nukleat yang didapat dari uji kuantitatif RRT-PCR [109, 131, 197]. Untuk vaksin vektor rekombinan atau virus hidup (live), titer virus dalam ECE atau sel kultur adalah alat pengukuran tidak langsung yang tepat. Kurangnya respons HI anamnestic setelah uji tantang pada unggas ter vaksin mengindikasikan level perlindungan yang tinggi, akan tetapi observasi yang seperti itu tidak dapat diandalkan sebagai cara mengukur efikasi vaksin secara tidak langsung.
Potensi
Pengukuran seberapa poten vaksin memerlukan pengujian kuantitatif yang dapat memastikan efikasi yang cukup di bawah kondisi lapangan yang bervariasi, dan tidak hanya mampu menciptakan level perlindungan minimal. Secara teoritis, pengujian potensi vaksin memastikan tercukupinya antigen atau titer virus secara konsisten agar menjadi efektif untuk penggunaan di lapangan. Potensi beberapa vaksin unggas, meliputi vaksin NDV dan AI, telah dikuantifikasi dalam mean protective dose (PD50)/ dosis protektif rata-rata di dalam kondisi laboratorium, dengan uji tantang dilakukan 21 hari setelah vaksinasi (misalnya PD50 adalah dosis vaksin yang memberikan perlindungan 50% dari unggas yang divaksin) [333]. Pada studi eksperimental, PD50 untuk vaksin AI telah mengukur pencegahan angka kematian dengan menggunakan serangkaian pengurangan dosis vaksin, misalnya 1X, 0,1X, 0,01X, dan 0,001X, diikuti dengan uji tantang melalui intranasal dengan dosis HPAI yang terukur [323, 355]. Menggunakan data ini, PD50 menjadi sebuah kalkulasi matematika sederhana. Ketika PD50 telah dihitung, jumlah PD50 minimal per dosis untuk satu vaksin poten harus mengandung rata-rata 50 PD50 per dosis dengan deviasi minimal tidak kurang dari 35 PD50 [84, 323]. Akan tetapi, potensi juga bisa diukur secara tidak langsung dengan mengukur respons serologi pada unggas terhadap dosis vaksin yang berbeda-beda, atau dengan kuantifikasi protein HA dalam vaksin. Pengurangan dosis vaksin di bawah angka 50 PD50 per dosis memiliki efek negatif terhadap perlindungan yang akan diberikan [355].
Dalam penelitian eksperimental sebelumnya terhadap vaksin AI inaktif pada ayam SPF yang diuji dengan virus HPAI, tingkat kemampuan bertahan hidup dihubungkan dengan titer geometrik rata-rata antibodi HI (HI antibody body geometric mean titer /GMT) sebanyak ≥ 8 [128] atau ≥ 10 [323], pencegahan pendedahan virus tantang melalui orofaring pada sebagian besar ayam ter vaksin dihubungkan dengan GMT ≥ 40 [182], dan perlindungan lengkap dari pendedahan virus sebanyak itu pada ayam ter vaksin dihubungkan dengan GMT ≥ 128 dalam vaksin yang mengandung virus yang dekat kekerabatannya dengan virus tantang [182]. Perkembangan dan implementasi standar potensi serologi minimum akan memastikan bahwa akan ada kandungan antigen yang cukup dalam vaksin AI inaktif komersial yang akan memproduksi respons imun protektif di lapangan untuk vaksin-vaksin yang dekat dengan virus yang ada di lapangan. Karena imunitas yang dimediasi oleh sel diinduksi oleh vaksin hidup rekombinan, standar HI serologi mungkin tidak dapat langsung diterapkan untuk menentukan potensi satu kali vaksinasi, akan tetapi penggunaan prime/vaksinasi awal dengan menggunakan rekombinan hidup dengan booster menggunakan vaksin inaktif atau vaksin berdasar protein HA lainnya dapat meningkatkan penentuan potensi HI di lapangan.
Pengujian potensi berdasarkan ≥ 90% angka bertahan hidup pada studi uji tantang virus HPAI dengan menggunakan dosis vaksin yang direkomendasikan telah digunakan, akan tetapi menggunakan pengukuran potensi yang kurang ketat, yaitu kurang dari standar 50 PD50 [333]. Potensi vaksin NDV hidup di Amerika Serikat didasarkan pada titer virus per dosis (9 CFR 113.329), yang berpotensi digunakan untuk menentukan potensi vaksin AI dengan vektor virus hidup.
Tipe vaksin-vaksin avian influenza
Kategori vaksin avian influenza
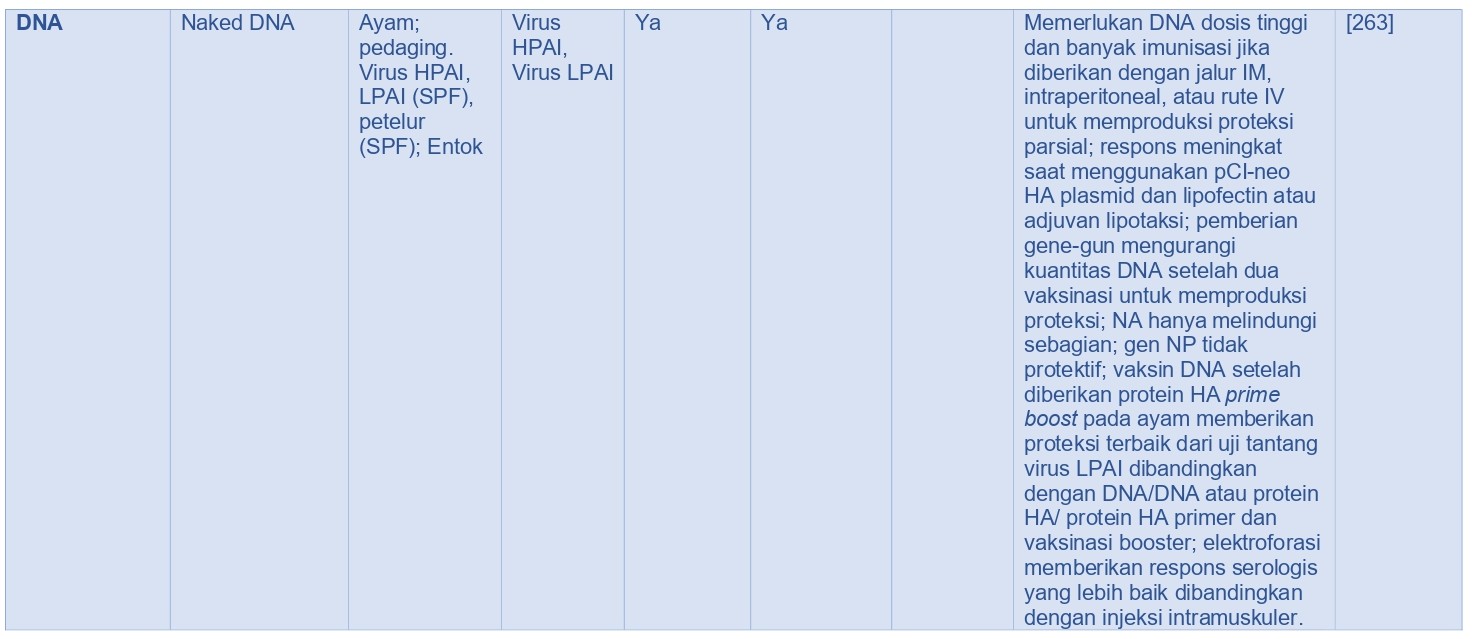
Selama 50 tahun terakhir, penggunaan vaksin di seluruh dunia telah dapat mengurangi penyakit infeksius pada unggas. Vaksin berkualitas tinggi dapat memicu elemen imun protektif seperti misalnya antibodi dalam sirkulasi, sitokin spesifik, sel efektor, dan berbagai limfosit dengan memori antigen spesifik. Vaksin AI terbagi ke dalam empat kategori luas [355], yaitu virus AI inaktif penuh, protein HA yang diekspresikan in-vivo (dan protein virus AI lainnya), protein HA yang diekspresikan in-vitro (dan protein virus lainnya), dan asam nukleat (Tabel 15.5). Vaksin dalam setiap kategori ini memiliki manfaat secara spesifik demikian juga kerugiannya.
Vaksin avian influenza yang diinaktivasi secara penuh
Kebanyakan vaksin AI yang diregistrasi dan digunakan di lapangan adalah vaksin AI inaktif penuh diberikan izin untuk diberikan secara parenteral (subkutan atau intramuskuler) (Tabel 15.5) [330]. Vaksin non-replikasi semacam itu dipilih karena faktor keamanan pada hospes konvensional maupun hospes dengan kondisi imun yang lemah. Akan tetapi, dalam rangka menginduksi kekebalan protektif, vaksin inaktif memerlukan injeksi antigen dalam jumlah banyak, dan penambahan adjuvan sangat memicu proses immunogenik [338]. Rute dan waktu vaksinasi akan mempengaruhi immunogenik dan efikasi respons imun terhadap vaksin. Sering kali vaksin AI dikombinasikan dengan vaksin virus lainnya maupun bakteri dan diberikan berturut-turut dalam waktu yang sudah di tentukan secara spesifik dalam masa hidup unggas, dan permasalahan logistik terkait hal itu haruslah dipertimbangkan saat mengembangkan program pengendalian AI. Banyak studi eksperimental telah menggambarkan efikasi vaksin AI inaktif pada spesies Avian (Tabel 15.5).
Vaksin AI inaktif biasanya menggunakan stok bibit virus LPAI yang diambil dari wabah, dan kadang-kadang juga menggunakan virus HPAI yang diolah dalam fasilitas pembuatan vaksin dengan keamanan terhadap bahaya kebocoran bahan biologis berbahaya [275 – 278]. Dimulai dari tahun 2006, strain vaksin yang telah memiliki izin telah dikembangkan dan digunakan di lapangan yang menggunakan teknologi pembalik genetik (rg) yang memakai HA dan NA yang berasal dari virus AI di lapangan dan enam segmen gen lainnya yang diambil dari virus influenza A dengan tingkat pertumbuhan tinggi seperti misalnya PR8 [330, 332]. Bibit strain yang dihasilkan dari teknologi pembalikan genetik (rg) biasanya memiliki tempat pembelahan proteolitik HA yang diubah dari HPAI menjadi LPAI. Dari 125 milyar dosis vaksin AI inaktif yang digunakan untuk mengendalikan HPAI antara tahun 2002 sampai 2010, sebanyak 71,9 milyar dosis menggunakan strain bibit rgLPAI dan 53,1 milyar dosis berdasarkan strain bibit virus LPAI maupun HPAI yang ada di alam [77, 152, 191, 205, 292, 344, 356, 392]. Tanpa memandang dari mana pun sumbernya, virus bibit ditumbuhkan dalam ECE, kemudian cairan alantois yang bersifat infektif dikumpulkan, diinaktivasi secara kimia, dan diemulsikan dalam sistem adjuvan mineral yang merupakan resep rahasia setiap perusahaan pembuatnya. Derajat kemurnian cairan alantois dapat mempengaruhi respons setelah vaksinasi, akan tetapi dalam rangka mengurangi biaya, kebanyakan vaksin AI pada unggas menggunakan cairan alantoin mentah tanpa pemurnian. Biasanya inaktivasi virus dicapai dengan formalin, yang mereaksikan protein virus sedemikian rupa sehingga replikasi virus tidak dapat terjadi. Beberapa zat kimia, seperti misalnya beta propiolakton atau etilenamin biner tidak digunakan sebagai zat inaktivan [78, 338].
Adjuvan
Vaksin AI inaktif penuh maupun vaksin virosom dibuat dengan adjuvan sebelum diaplikasikan. Adjuvan vaksin adalah zat kimia, komponen mikrobial ataupun protein mamalia yang dapat memacu respons imun terhadap antigen dalam vaksin [175]. Adjuvan itu penting untuk mengaktifkan dan mengarahkan respons imun bawaan maupun perolehan menuju antigen inaktif dalam vaksin yang sifat imunologinya sangat kurang. Pada umumnya, meskipun antigen tergantung kepada kemurnian dan kuantitasnya, antigen adalah elemen yang pasif dan adjuvan berfungsi sebagai aktivator dan modulator penghubung yang bekerja sebagai jembatan antara sistem imun hospes dengan inokulum vaksin. Adjuvan tunggal bisa saja memiliki lebih dari satu mekanisme aksi. Kepentingan dalam mengurangi efek samping terkait vaksin dan menginduksi tipe imunitas spesifik telah membawa pada pengembangan banyak adjuvan baru. Adjuvan dalam proses pengembangan atau dalam vaksin eksperimental atau komersial meliputi garam aluminium, minyak emulsi (termasuk adjuvan seperti Montanide, dst.), saponin, kompleks penstimulasi imun (immune stimulating complex/ ISCOMS), liposoma, mikro partikel, kopolimer penghambat non-ion, turunan polisakarida (misalnya beta-1,3/1.6 glucan [379]), CpG oligodeoksinukleotida [187], tool-like receptor (TLR) ligan [215, 216, 385, 396], peptida ukuran kecil (misal bursopentene [Cys-Lys-Asp-Val-Tyr] [200], agonis reseptor pengenal pola patogen (CVCVA) [198], sitokin [350], dan banyak macam turunan bakteria [396, 399, 400]. Vaksin inaktif yang tidak begitu murni terkadang mengandung komponen bakteria atau virus yang dapat berlaku sebagai adjuvan, sedangkan vaksin yang memiliki antigen lebih murni tidak selalu menstimulasi respons imun yang kuat dan bertahan lama [9, 92, 110, 116, 130, 141, 146, 169, 267, 271]. Garam aluminium dan kalsium adalah adjuvan relatif lemah yang umumnya menginduksi respons limfosit sel T-helper tipe 2 (Th2) dan sebagian kecil, jika ada, respons dari limfosit T-sitotoksik yang bersifat antigen spesifik (CTLs) [237].
Adjuvan Minyak
Adjuvan emulsi minyak mengandung campuran minyak dan fase akueus yang distabilkan oleh surfaktan, dan telah umum digunakan untuk vaksin AI inaktif baik eksperimental maupun komersial untuk unggas. Emulsi ini mengandung antigen baik dalam formulasi ‘minyak dalam air’ maupun ‘air dalam minyak dalam air’. Tanpa komponen lainnya, adjuvan berbasis minyak utamanya menstimulasi respons antibodi, meskipun pada kondisi tertentu emulsi air di dalam minyak mungkin dapat mengaktivasi CTLs [237]. Kebanyakan vaksin inaktif untuk unggas baik yang sudah berizin maupun masih dalam percobaan, termasuk vaksin AI, menggunakan dasar minyak mineral, akan tetapi minyak yang dapat dimetabolismekan telah terlihat efektif [9, 25, 114, 302, 304, 306-310, 398]. Keuntungan menggunakan emulsi meliputi terpicunya produksi antibodi, demikian juga pelepasan antigen dalam waktu lebih lama, yang berakibat respons imun yang lebih tinggi terhadap vaksin.
Dalam percobaan, formulasi nano-emulsi yang dibuat dari minyak kedelai, tributil fosfat dan Triton-X100 memberikan perlindungan awal pada mencit melawan kematian yang disebabkan virus influenza yang diberikan secara intranasal [310]. Nano-emulsi merupakan campuran dari detergen non ionik, pelarut yang termasuk dalam daftar aman (generally recognized as-safe (GRAS) list), dan minyak kedelai. Nano-emulsi tidak bersifat racun ketika diberikan pada mencit dengan jalur intranasal, dan juga melindungi mereka dari uji tantang virus influenza.
Liposoma
Berbagai jenis liposom telah digunakan sebagai adjuvan pada banyak studi vaksin pada mamalia maupun pada unggas, termasuk vaksin AI [100], akan tetapi sampai saat ini teknologi ini masih belum diaplikasikan untuk digunakan pada unggas di lapangan. Liposom adalah vesikel kolesterol dan fosfolipid yang mirip dengan sel membran mentah. Sebagai adjuvan, liposom dapat menempatkan antigen yang diinginkan baik di bagian tengah vesikel maupun dalam membran sel. Liposom dapat menginduksi imunitas humoral dan pada beberapa kasus mengaktivasi CTLs [110]. Nanopartikel dan mikro partikel adalah partikel solid kecil yang dibuat dari polimer yang biodegradable, sianoakrilik tertentu dan poli (lactid-ko-glikolida) kopolimer. Nanopartikel (berdiameter 10-1000 nm) berbeda dari mikro partikel (1-100 mikro meter). Mikro partikel dapat menginduksi imunitas yang dimediasi sel (CMI), termasuk CTLS dan imunitas humoral [379]. Nanopartikel kalsium fosfat menginduksi imunitas mukosal dan memberi proteksi melawan virus herpes simpleks tipe 2 pada mencit [237]. Chitosan membentuk mikro partikel dan nanopartikel yang melingkupi antigen dalam jumlah banyak, seperti misalnya ovalbumin, difteria toksoid, atau tetanus toksoid. Sistem pembawa obat partikulat Chitosan adalah kandidat menjanjikan untuk vaksinasi per oral. After memberikan Chitosan bersama antigen dalam studi vaksinasi via nasal, telah teramati penguatan respons imun yang kuat baik pada mukosa ataupun sistemik pada hewan percobaan mencit [141]. Saponin adalah adjuvan kimia kompleks yang diekstraksi dari tanaman, biasanya dari pohon Quillaja saponaria. Saponin adalah imunomodulator, dan dapat menginduksi respons yang kuat dari limfosit T-helper tipe 1 (Th1) dan Th2 demikian juga CTLS pada hewan. Saponin mungkin dapat menstimulasi CMI untuk antigen yang biasanya hanya dapat menarik antibodi saja [150, 372]. ISCOMS adalah struktur mirip sangkar yang mengandung saponin, kolesterol dan fosfolipid. Mereka dapat menginduksi reaksi Th1 dan CTL, diikuti dengan respons Th2 di bawah beberapa keadaan [379]. Kopolimer penghalang non-ionik adalah adjuvan sintetik yang terdiri dari poliksipropilen hidrofobik diapit oleh balok-balok polioksietilen. Sebagai adjuvan, zat kimia ini dapat memacu imunitas humoral untuk banyak antigen, akan tetapi sering kali zat kimia ini digunakan dalam emulsi bufer akueus, minyak-dalam-air, atau air-dalam-minyak [236]. Muramil peptida (MDP) adalah komponen aktif peptidoglikan yang bersifat imunomodulator dari mikrobakteria. MDP umumnya menginduksi respons Th1 dan Th2. Turunan MDP biasanya digabungkan dengan emulsi liposom, air-dalam-minyak dan minyak-dalam-air [6]. Toksin bakteria, toksin kolera (CT) dan eksotoksin rentan panas (LT) dari Escherichia coli telah diuji secara ekstensif kebanyakan sebagai adjuvan mukosal pada hewan model. Mereka tampaknya menginduksi respons humoral yang kuat demikian juga respons CTL-nya [87, 237]. Protein dan gen sitokin juga dianggap sebagai adjuvan vaksin [87, 114, 127, 260]. Efek spesifik dari sitokin yang muncul bervariasi, beberapa memicu aktivitas sel imun, sementara yang lainnya berlaku sebagai aktivator umu. Sitokin juga menginduksi sitokin lainnya dan hal ini dapat membuat efek dari sitokin yang spesifik sulit untuk diprediksi [202].
Hemaglutinin yang diekspresikan secara In-vivo
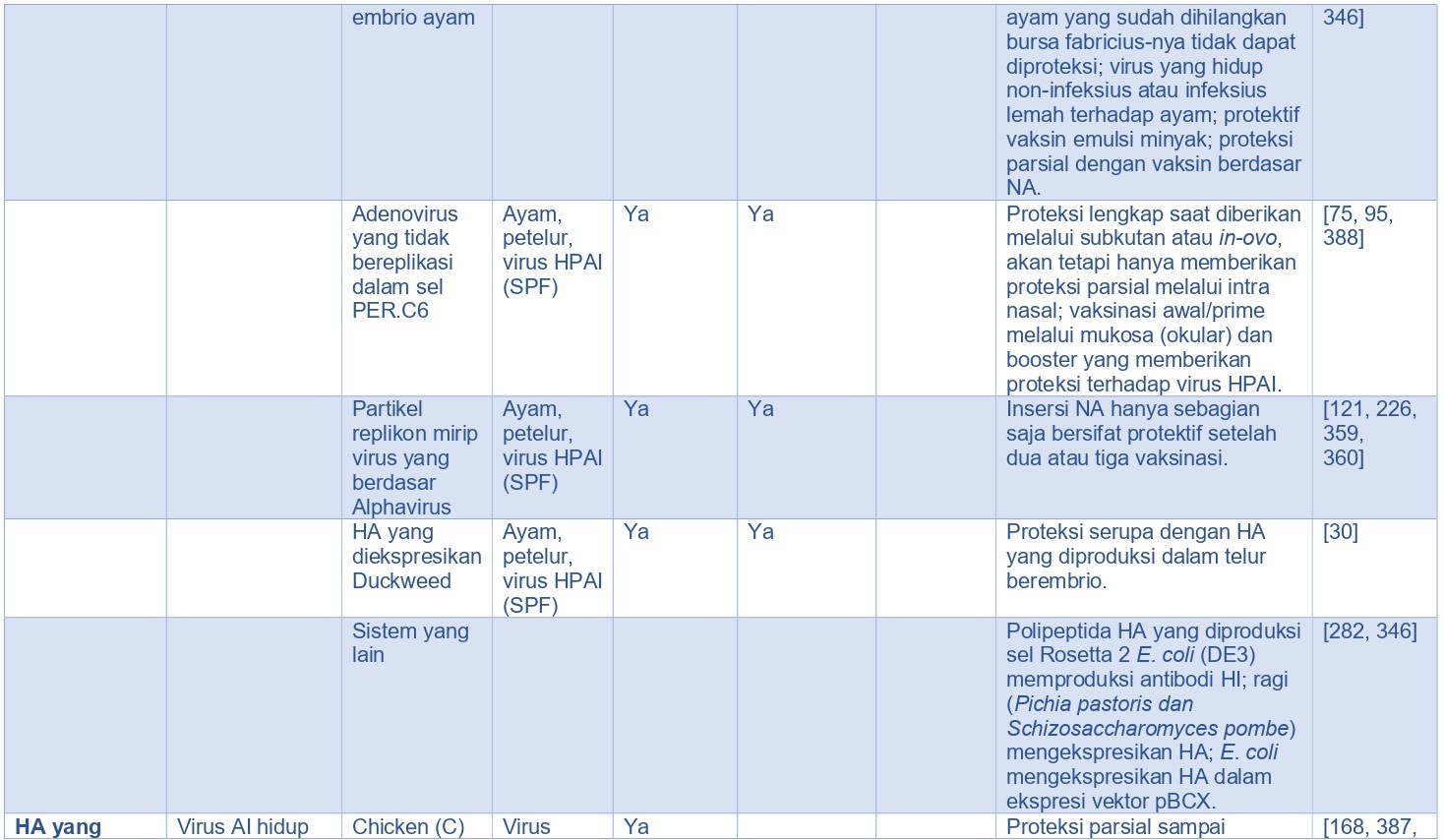
Dengan sistem yang diekspresikan in-vivo, immunogen diproduksi dalam tubuh hospes unggas dengan menggunakan bakteri hidup atau vektor virus seperti rFPV, rHVT, rekombinan duck virus enteritis (rDVE), beberapa Adenovirus, virus equine encephalitis dari Venezuela yang kurang bereplikasi (rdVEE), rekombinan virus avian leukosis (rALV), rekombinan virus infectious laryngotracheitis (rLIT), rNDV, AI-NDV chimera virus, spesies Salmonella, atau organisme lain [143, 224] (Tabel 15.5). Menurut teori metode ini memiliki biaya pembuatan yang rendah karena proses yang digunakan menggunakan sel unggas itu sendiri untuk memproduksi immunogen, jika dibandingkan sistem ekspresi in-vitro yang mahal. Keuntungan tipe vaksin ini adalah ia dapat menstimulasi imunitas humoral dan seluler saat diberikan melalui jalur parenteral, dan jika ia bereplikasi pada mukosa ia dapat menginduksi imunitas humoral. Vaksin virus hidup biasanya superior dibandingkan dengan vaksin inaktif dalam menginduksi imunitas humoral dan kemudian mengurangi pendedahan virus, akan tetapi rentan terhadap inhibisi replikasi vektor jika terdapat imunitas aktif atau pasif yang telah ada terlebih dahulu melawan vektor tersebut dan kadang kala melawan virus HA AI yang sudah masuk terlebih dahulu.
Vaksin AI hidup (Live AIV Vaccines)
Vaksin LPAI hidup telah dipelajari secara eksperimental pada unggas (Tabel 15.5). Vaksin ini menawarkan keuntungan perlindungan yang baik melawan virus HPAI, dapat diaplikasikan secara massal melalui spray atau dalam air minum, lebih ekonomis, dan memberikan perlindungan yang lebih cepat dibandingkan vaksin inaktif [334]. Akan tetapi, strain virus LPAI hidup yang tidak diubah tidak direkomendasikan untuk digunakan sebagai vaksin unggas karena beberapa alasan [13, 14, 225]. Pertama, mereka dapat menimbulkan kerugian produksi yang penting secara ekonomi yang berhubungan dengan penyakit respiratorik atau penurunan produksi telur. Kedua, virus dapat menyebar dengan mudah dari unggas ke unggas lain dan satu peternakan ke peternakan lainnya yang berpotensi menciptakan infeksi endemik dan penyakit, yang kemudian mengharuskan dilakukannya eradikasi terhadap strain vaksin tersebut. Ketiga, beberapa virus LPAI memiliki potensi mutasi atau reasortansi, menciptakan virus yang lebih patogen, seperti yang sudah pernah dilaporkan, sebagai contoh pada beberapa kasus virus LPAI H5 dan H7 menjadi virus HPAI di lapangan. Saat ini tidak ada vaksin AI hidup yang dilisensikan dan digunakan di lapangan.
Akan tetapi, berbagai virus influenza A yang diubah secara genetik yang telah dikembangkan dan diinvestigasi pada mamalia dan unggas, memungkinkan regulasi replikasi virus dan induksi imunitas tanpa mempengaruhi secara negatif pertumbuhan individu atau menurunkan imunitas individu. Strategi untuk mengembangkan vaksin dari virus influenza A hidup yang diubah secara genetik melibatkan atenuasi virus sampai level patogenitas rendah baik melalui pasase di laboratorium untuk menciptakan fenotipe yang sensitif temperatur dan dapat beradaptasi di suhu dingin, atau melalui bioteknologi untuk merubah secara langsung genom virusnya. Sebagian besar tipe vaksin ini telah dikembangkan dan diuji pada model mamalia [14, 15, 18, 192]. Baru-baru ini, melalui teknologi pembalikan genetik (rg), mutasi sensitif temperatur telah diperkenalkan ke dalam gen PB1 dan PB2 dari virus LPAI H9N2 untuk memproduksi tulang punggung vaksin LPAI hidup [76, 97, 210, 318]. Virus H9N2 yang beradaptasi dengan suhu dingin ini digunakan sebagai tulang punggung vaksin dengan sistem rg untuk menggantikan gen H9 dan N2 dengan gen H5 dan N1, dan memproduksi strain vaksin LPAI H5N1 yang telah beradaptasi dengan suhu dingin yang melindungi ayam baik dari uji tantang dengan virus LPAI H9N2 (konstruksi vaksin H9N2 orisinal) maupun uji tantang dengan virus HPAI H5N1 (konstruksi rgH5N1) [291]. Vaksin memicu imunitas selular dan humoral. Kekhawatiran yang muncul secara teoritikal adalah tentang potensi vaksin virus AI hidup yang telah beradaptasi dengan suhu dingin untuk berubah kembali menjadi tipe liar atau mengalami rekombinasi dengan virus di lapangan, berakibat munculnya virus dengan patogenitas yang meningkat atau meluasnya kisaran hospes. Akan tetapi, fenotipe yang mampu beradaptasi dengan suhu dingin yang merupakan hasil reasortansi telah diaplikasikan kepada vaksin influenza A yang digunakan pada manusia tanpa menimbulkan efek samping serius dan tanpa adanya bukti perubahan menjadi virus yang virulen [233]. Vaksin AI hidup saat ini tidak diizinkan untuk digunakan pada unggas komersial.
Sebagai tambahan dari virus influenza A hidup yang merupakan mutan sensitif temperatur, virus AI yang telah dipasase di laboratorium dan diatensi telah digambarkan juga ada yang tidak berdasarkan aplikasi suhu dingin. Virus AI ini memiliki trunkasi gen NS1 dalam virus LPAI H7N3 A/turkey/Oregon/1971, dan berakibat menurunnya replikasi pada ayam dan atenuasi virulensi [386], akan tetapi atenuasi ini tidak cukup untuk memungkinkan vaksinasi in-ovo, karena tingkat kemampuan menetas menjadi berkurang [72, 192, 382]. Virus ini memiliki potensi untuk digunakan sebagai vaksin pasca penetasan, akan tetapi keamanannya harus dipastikan dulu sebelum diberi lisensi penggunaan di lapangan. Dalam salah satu studi mutan NA yang telah ditrunkasi, pasase vaksin rgH5N3/NS1/144 sebanyak 5 kali berakibat pada reversi/pembalikan kembali kepada fenotipe virus LPAI tipe liar [383], mengindikasikan perlunya menilai vaksin AI hidup terhadap kemungkinan perubahan menjadi tipe virulen sebelum dilakukan registrasi dan aplikasi vaksin di lapangan.
Perkembangan klon infeksius melalui teknologi pembalikan genetik untuk virus influenza A telah menciptakan sistem yang memungkinkan mutasi yang terarah pada satu atau lebih segmen gen virus influenza yang dapat berakibat pada atenuasi yang mencukupi untuk memungkinkan penggunaannya sebagai strain bibit vaksin hidup. Baru-baru ini, vaksin virus AI baru telah dikembangkan yang memuat 8 segmen gen virus HPAI H5 (tempat pembelahan HA diubah dari HP ke LP), akan tetapi memuat ectodomain gen HN dari NDV alih-alih gen NA dari virus AI [38]. Virus hasil dari proses ini kemudian diatenuasi seperti yang digambarkan dengan replikasi yang tidak konsisten pada anak ayam berumur 2 minggu, akan tetapi virus yang diberikan in-ovo memproduksi respons antibodi humoral, dan ayam yang divaksin terlindungi saat uji tantang dari baik virus HPAI H5 dan virus ND virulen [244].
Vaksin vektor hidup (virus non-influenza A dan bakteria)
Tipe lain vaksin virus hidup telah dikembangkan untuk AI menggunakan konstruksi vektor virus alternatif atau menggunakan vektor bakteri, dan dapat memproduksi beberapa keuntungan imunologi dari vaksin hidup tetapi tanpa risiko reasortansi virus yang muncul ketika menggunakan virus AI hidup yang kompeten secara penuh untuk melakukan replikasi (Tabel 15.5) [297]. Kategori vaksin ini memberikan proteksi yang lebih luas terhadap virus-virus AI yang berbeda secara antigenik dalam satu sub tipe yang sama [334]. Tipe vaksin seperti ini menggunakan teknologi rekombinan DNA untuk menggabungkan material genetik dari genom virus AI, terutama gen HA, ke dalam struktur (backbone) virus yang digunakan untuk ekspresi gen secara in vivo. Banyak contoh vaksin tipe ini telah didokumentasikan dalam literatur, dengan berbagai level keberhasilan, akan tetapi sistem yang paling sering dilaporkan adalah rekombinan virus cacar unggas (rFPV), dengan insersi gen virus AI HA (rFPV-H5), H7 (rFPV-H7), atau H9 (rFPV-H9) [164, 325]. Vaksin rFPV-H5 telah dilisensikan di tahun 1998 di Amerika Serikat untuk digunakan dalam keadaan darurat wabah HPAI, akan tetapi sampai saat ini belum pernah digunakan kembali di lapangan di Amerika Serikat [17, 28, 36, 37, 43, 44, 79, 124, 155, 199, 255, 257, 258, 320, 321, 325, 232, 361, 389]. Akan tetapi, vaksin ini telah digunakan secara ekstensif di Meksiko, El Salvador, dan Guatemala untuk melawan endemi virus LPAI H5N2 (1998-2015) [229]. Vaksin vektor rekombinan hidup yang lainnya telah direkayasa untuk mengekspresikan gen AI dan telah menunjukkan proteksi pada ayam secara eksperimental. Hal ini meliputi vektor virus (virus rILT [herpervirus], rNDV [paramyxovirus tipe 1], virus rdVEE [alphavirus], rALV [retrovirus], rHVT [herpesvirus], rDVE [herpesvirus itik], rekombinan adenovirus) dan bakteri (vaksin vektor Salmonella enteritidis, Salmonella typhimurium, dan Lactobacillus lactis) [377, 378]. Vektor rNDV, rILT dan beberapa rekombinan adenovirus dapat diaplikasikan secara masal melalui air minum atau spray untuk mengurangi biaya, karena mereka bereplikasi di membran mukosa. Akan tetapi, beberapa vektor seperti virus rdVEE [39, 75, 125, 185, 199, 204, 209,212, 226, 235, 266, 282, 290, 329, 248, 349, 373, 374, 381], vektor rekombinan adenovirus yang kurang kompeten dalam bereplikasi [282], rHVT [121, 301, 359], rDVE [290], rALV, dan rFPV [204, 381], memerlukan injeksi dalam rangka memproduksi respons imun secara efektif, akan tetapi pemberian vaksin vektor adenovirus rekombinan H5 yang kurang komponen dalam bereplikasi lewat mukosa (melalui kantong konjungtiva) dengan vaksinasi dua kali memang bisa melindungi melawan virus HPAI [19].
Meskipun proteksi yang diturunkan dari vaksin AI inaktif sebagian besarnya berdasarkan pada induksi antibodi penetralisir yang diproduksi untuk melawan sub tipe HA, limfosit T sitoksik (CTLs) cross-reaktif luas telah dilaporkan sebagai faktor kritikal untuk menghilangkan virus dari sel yang terinfeksi. Akan tetapi, hanya sedikit yang telah diketahui tentang induksi imunitas yang dimediasi sel melawan virus AI pada ayam. rHVT adalah rekombinan yang dikenal dapat menginduksi imunitas yang dimediasi sel secara spesifik [142, 262]. Baru-baru ini telah digambarkan aktivitas CTL cross reaktif dalam melawan protein HA setelah vaksinasi dengan rHVT pada ayam [161]. Epitope sel T yang ditemukan di dalam HA H5 telah dikenali baik oleh sel T ayam CD4+ dan CD8+ [135]. Imunitas yang dimediasi sel juga mengenali berbagai sub tipe virus AI yang berbeda, kesemuanya memiliki epitope ini dengan tingkat kesamaan yang berbeda-beda. Karena itulah, vaksin rekombinan virus hidup yang mengekspresikan HA tampaknya menginduksi imunitas yang dimediasi sel (CMI), yang mungkin berkontribusi terhadap munculnya proteksi.
Satu halangan tambahan terhadap aplikasi vaksin vektor virus di lapangan adalah status imunitas unggas melawan vektor tersebut. Sebagai contoh, kebanyakan unggas yang dipelihara di negara maju telah diimunisasi melawan virus ND, yang akan membatasi imunogenisitas vaksin vektor rNDV, kecuali jika imunitas NDV dimonitor secara serologis dan vaksin vektor diaplikasikan hanya jika level antibodinya sangat rendah untuk memproduksi respons anamnestic. Swayne dan koleganya telah menjelaskan bagaimana imunitas yang telah ada sebelumnya, yang mungkin saja berupa imunitas yang dimediasi oleh sel, melawan virus cacar unggas akan mengganggu respons imun primer terhadap vaksin rFPV-H5 pada ayam, yang mencegah proteksi [226], akan tetapi data di lapangan menunjukkan bahwa antibodi maternal melawan virus AI H5 ataupun vektor cacar unggas tidak mengganggu respons imun primer terhadap vaksin rFPV-H5 yang diberikan pada umur 1 hari [324]. Lebih jauh lagi, penggunaan sistem primer booster dengan vaksin rFPV-H5 dan vaksin AI H5 inaktif pada ayam dengan antibodi maternal positif H5 memberikan proteksi lebih baik pada uji tantang virus HPAI H5N1 daripada masing-masing vaksin jika diberikan sendiri-sendiri [56, 124].
Dalam rangka membuat vaksin rekombinan menjadi lebih efektif, beberapa modifikasi mungkin diperlukan untuk melindungi dari berbagai patogen dan meningkatkan replikasi dalam tubuh hospes untuk imunitas melawan patogen individual. Sebagai contoh, di beberapa negara berkembang dimana bersirkulasi banyak virus AI ditambah virus ND, penggunaan rFPV-H5, rFPV-H9 dan rFPV-NDV dalam vaksin trivalen bisa saja efektif terhadap paparan virus tantang [206]. Dengan rNDV-H5, vaksin yang telah ditingkatkan kemampuannya dibuat dengan memodifikasi rangka baca terbuka (open reading frame) dari gen H5 sehingga domain transmembrane dan sitoplasmik dari gen H5 digantikan oleh protein F dari virus ND [207]. Baru-baru ini, vektor chimera virus ND dikembangkan dengan menggunakan protein fusion (F) dan hemaglutinin-neuraminidase (HN) dari virus avian paramyxovirus tipe 8 (APMV-8) sebagai protein permukaan, dan tidak gen F dan HN dari virus ND. Vektor yang dihasilkan tidak dihalangi oleh antibodi maternal terhadap virus ND, dan memberikan proteksi terhadap insersi dan ekspresi gen H5 [235]. APMV-8 belum diidentifikasi pada unggas, dan karena itu sepertinya tidak memiliki antibodi maternal ataupun antibodi humoral perolehan yang muncul secara aktif.
Pada akhirnya, kisaran hospes itu penting dalam rangka mengenali spesies unggas mana yang dapat diimunisasi dengan setiap vaksin vektor. Sebagai contoh, rFPV dan rILT telah memproduksi imunitas protektif dan hanya digunakan pada ayam karena pembatasan hospes dari vektor, akan tetapi terdapat beberapa bukti bahwa rFPV-H5 dapat memproduksi respons imun protektif pada kucing dan angsa [300]. Ditambah lagi, rFPV dengan insersi gen NDV efektif melawan virus NDV virulen pada kalkun, sehingga eFPV dengan gen virus AI HA akan berpotensi efektif melawan uji tantang virus AI pada kalkun, eFPV paling baik diaplikasikan pada penetasan di umur 1 hari. Karena itulah, meskipun sudah jelas bahwa vaksin vektor hidup memiliki keuntungan dari segi imunitas, penggunaannya di lapangan mungkin akan dibatasi oleh faktor-faktor lainnya. Vaksin rDVE-H5 yang baru-baru ini dikembangkan memberikan proteksi yang baik pada itik domestik, dan ketika diberikan dengan dosis yang tinggi sebagai vaksin dapat melindungi ayam dari tantangan virus HPAI H5N1, dan tidak memiliki antibodi maternal yang akan mengganggu vektor, seperti yang terjadi pada rNDV-H5 [156, 166].
Protein virus yang diekspresikan secara in-vitro
Banyak sistem ekspresi in-vitro telah digunakan untuk memproduksi vaksin AI eksperimental akan tetapi tidak ada satu pun teknologi tersebut yang telah dikomersialisasikan untuk vaksin AI pada unggas (Tabel 15.5). Metodologi ekspresi spesifiknya bervariasi, namun jumlah total protein virus, terutama HA, yang diberikan diproduksi dalam kultur sel eukariota (misalnya sel tanaman dan hewan [204, 381]), sel tanaman (misalnya duckweed atau tembakau [88, 183]), ragi [30, 160], atau bakteri [221, 270], dengan sistem vektor virus digunakan untuk ekspresi di beberapa sistem eukariotik (misalnya vaccinia [170], beberapa adenovirus dan baculovirus yang kurang bagus replikasinya [12, 75, 95, 387]. Sistem yang paling sering digunakan melibatkan insersi virus AI HA ke dalam vektor baculovirus (virus serangga) dan kemudian menginfeksi sel kultur serangga, dengan ekspresi dan produksi HA [88, 301]. HA kemudian diambil dari supernatan atau sel yang dilisiskan, inaktivasi dengan kimia (jika diperlukan), dan di emulsi dengan cara yang sama dengan vaksin AI inaktif penuh. Dengan begitu keseluruhan kuantitas protein immunogenik (misalnya HA) diproduksi secara eksternal di luar hospes unggas.
Vaksin-vaksin DNA
Vaksin DNA berbasis plasmid eksperimental menggunakan gen HA telah memicu respons imun protektif pada ayam melawan berbagai virus HPAI H5 dan H7 [22, 88, 327]. Vaksin semacam itu memproduksi antigen in situ, meliputi induksi imunitas humoral dan selular adaptif serupa dengan respons yang ditimbulkan oleh infeksi virus hidup atau vaksinasi [188, 179, 180, 203, 265, 311]. Umumnya, vaksin DNA merupakan asam nukleat telanjang mengandung virus AI cDNA dalam plasmid di bawah kendali gen promotor mamalia [192]. Penelitian pada mamalia telah menunjukkan bahwa vaksin DNA mengekspresikan gen HA memproduksi proteksi yang lebih efektif melawan varian antigenik virus influenza dibandingkan dengan vaksin inaktif, dan inklusi gen NP semakin menambah proteksi [118, 179, 311]. Akan tetapi, proteksi yang diinduksi oleh vaksin DNA pada model avian (misalnya ayam) tidak begitu konsisten dan memerlukan lebih banyak vaksinasi daripada proteksi yang ditimbulkan vaksin AI inaktif penuh atau vaksin subunit ekspresi AH in-vitro atau in-vivo [192, 311]. Limitasi utama penggunaan vaksin DNA untuk unggas adalah dibutuhkannya asam nukleat berharga mahal dalam jumlah banyak per dosisnya untuk memproduksi imunitas protektif pada ayam, dan kenyataan bahwa proteksi hanya bisa dicapai setelah 3 kali vaksinasi atau lebih. Vaksin DNA tetap tidak bisa digunakan dengan alasan ekonomi di lapangan kecuali sampai promotor berhasil dikembangkan untuk mengurangi jumlah imunisasi dan kuantitas asam nukleat yang diperlukan per ekornya. Pada studi eksperimental, vaksinasi tunggal vaksin DNA memberikan proteksi yang sama efektifnya dengan vaksin berbasis protein, yang merupakan standar perizinan. Baru-baru ini, perkembangan dalam vaksinasi DNA telah ditunjukkan dalam beberapa studi eksperimental. Primer DNA diikuti dengan booster protein virus AI lebih efektif jika dibandingkan dengan strategi primer/booster dengan menggunakan hanya vaksin DNA saja pada ayam [180, 192, 261, 311], dan penggunaan sitokin spesifik secara bersamaan dengan vaksin DNA memperbaiki respons imunologi jika dibandingkan hanya menggunakan vaksin DNA saja [120].
Penggunaan Vaksin di Lapangan dan Permasalahan-permasalahan khususnya
Permasalahan vaksinasi avian influenza
Dalam kerangka vaksinasi AI yang dilakukan untuk melindungi unggas, idealnya empat tujuan harus terpenuhi, yaitu pengenalan resistensi penuh terhadap infeksi jika unggas terpapar virus, pencegahan replikasi virus di dalam tubuh dan ekskresi virus oleh unggas yang sudah divaksin, pencegahan penyakit klinis dan kematian, dan identifikasi hewan terinfeksi yang mudah dilakukan dalam populasi yang sudah divaksinasi (contoh prinsip DIVA) [203]. Akan tetapi, hanya sedikit vaksin AI yang tersedia secara komersial atau yang telah diuji secara eksperimental yang dapat secara konsisten memenuhi seluruh kriteria di atas [313]. Dalam studi eksperimental, kebanyakan vaksin AI memberikan proteksi yang konsisten melawan penyakit klinis dan kematian, akan tetapi tidak selalu memberikan proteksi absolut terhadap infeksi lewat mukosa atau pendedahan virus dari orofaring dan kloaka, yang tergantung pada dosis tantang virus. Risiko infeksi burung yang sudah divaksinasi berkurang secara signifikan, dan kemudian transmisi dan penyebaran virus menjadi berkurang, akan tetapi pencegahan infeksi secara absolut tidak mungkin dilakukan di bawah sebagian besar kondisi di lapangan. Efektivitas reduksi ekskresi virus dihubungkan dengan baik reduksi titer virus yang diekskresikan dan berkurangnya durasi pendedahan virus. “Infeksi senyap” telah diduga terjadi berdasarkan studi eksperimental dimana pendedahan virus terjadi pada ayam setelah diuji tantang dengan dosis tantang yang tinggi (106). Akan tetapi ‘infeksi senyap’ semacam itu masih belum meyakinkan dapat terjadi pada unggas yang proses vaksinasi di lapangannya buruk [192, 313], dan vaksinasi telah diperlihatkan dapat mengurangi risiko infeksi secara dramatis [288]. Ditambah lagi, risiko penyebaran virus dari ‘infeksi senyap’ berpotensi dalam flok yang sudah divaksin lebih rendah dibandingkan dengan flok yang belum divaksin, terbukti dengan adanya temuan bahwa ayam yang belum divaksin mengekskresikan 100 sampai 10.000 kali lebih banyak virus saat terinfeksi dibandingkan dengan ayam yang sudah divaksin [49, 51], dan ayam yang tidak divaksin memerlukan 100 sampai 100.000 kali lebih sedikit virus dalam rangka memunculkan infeksi dibandingkan dengan ayam yang sudah divaksin [139]. Karena itulah, bahkan vaksin yang kurang ideal masih dapat memberi manfaat dibandingkan tidak divaksin sama sekali. Akan tetapi, unggas yang menerima vaksin berkualitas rendah (misalnya kuantitas antigen HA yang rendah, sistem adjuvan yang buruk, atau bibit strain vaksin yang jauh kecocokan antigenik nya dengan virus di lapangan) mungkin saja dapat memproteksi dari gejala klinis dan kematian, akan tetapi virus tantang/lapangan dapat bereplikasi yang kemudian diekskresikan dalam jumlah yang signifikan ke lingkungan [45, 63].
Hanya vaksin AI yang mendapatkan izin dari otoritas veteriner nasional harus dipertimbangkan untuk digunakan di lapangan. Selain itu, vaksin semacam itu harus memenuhi persyaratan minimum Organisasi Kesehatan Hewan Dunia (OIE) [122]. Standar internasional diperlukan untuk memastikan potensi dan efikasi vaksin AI yang seragam [238]. Setidaknya vaksin AI harus memenuhi kriteria sebagai berikut:
- Kemurnian vaksin ditentukan dengan melihat kandungan vaksin yang hanya memiliki immunogen yang diinginkan dan campuran adjuvan atau bahan pembawa lainnya, dan komposisi kandungannya harus konsisten,
- Keamanan vaksin seperti ditunjukkan dengan tidak adanya efek samping pada hospes yang divaksin dan lingkungan
- Efektivitas vaksin dalam melindungi terhadap uji tantang virus AI spesifik yang ditunjukkan dengan hasil pengujian yang terkuantifikasi dan ter standarisasi
- Potensi yang mengindikasikan bahwa vaksin memiliki massa antigen HA yang cukup (untuk vaksin inaktif) atau dosis yang cukup (untuk vaksin vektor hidup) untuk memastikan adanya proteksi di bawah kondisi-kondisi berbeda.
Proteksi pada unggas yang divaksinasi melawan virus AI dipengaruhi dengan faktor yang berhubungan dengan antigen dalam bibit strain vaksin dengan virus tantang, dosis vaksin (“kualitas vaksin”), rute pemberian vaksin, kondisi manajemen, juga metode aplikasi dan cakupan vaksinasi di lapangan. Potensi vaksin dan aplikasi di lapangan harus diberi peringkat satu dan dua dalam hal kepentingannya (D. Halvorson, komunikasi personal, 31 Mei 2007).
Strain benih vaksin
Kriteria seleksi
Karena HA adalah protein protektif utama dan menginduksi protektif yang bersifat sub tipe spesifik, strain vaksin haruslah cocok dengan sub tipe HA dari virus yang ada di lapangan. Akan tetapi, tidak seperti virus influenza A manusia beradjuvan dimana antigenic driftyang terjadi pada virus di lapangan memerlukan perubahan strain vaksin setiap 3 – 4 tahun sekali, vaksin unggas inaktif beradjuvan minyak dan rFPV-H5 sangat kurang terdampak oleh drift virus di lapangan sampai akhir tahun 1990-an [330]. Sebagai contoh, berbagai strain vaksin LPAI H5 dan rFPV-H5 memberikan proteksi silang yang luas terhadap mortalitas melawan berbagai virus HPAI H5 di lapangan (1959-1997) yang memiliki perbedaan sampai 12% dalam sekuens asam aminonya pada HN1 [312] dibandingkan dengan virus HPAI yang ditantang. Akan tetapi, proteksi luas sub tipe spesifik ini tidak bersifat absolut untuk semua sub tipe dan semua kondisi di lapangan, tetapi tampaknya paling cocok untuk virus HPAI yang secara antigenik dekat dengan virus LPAI pendahulunya pada unggas liar [323, 325, 327]. Bahkan untuk skenario yang terakhir ini, semakin dekat kesamaan sekuens gen HA antara vaksin rFPV-H5 dengan virus HPAI tantang, semakin besar berkurangnya replikasi virus dan pendedahannya dari saluran respirasi [344].
Sejak pertengahan tahun 2000-an, virus HPAI dan LPAI yang resistan terhadap vaksin AI telah muncul di lapangan, terutama setelah penggunaan vaksin AI dalam jangka waktu yang lama di lapangan [32], atau pada populasi unggas yang tidak di vaksin setelah virus LPAI bersirkulasi yang menginduksi imunitas pasca infeksi [71, 132, 190]. Vaksin AI H5N2 Inaktif yang digunakan di Meksiko dari tahun 1995 sampai 2009 menggunakan strain LPAI H5N2 1994 Meksiko (A/chicken/Mexico/232/1994 [H5N2], dan memberikan proteksi pada ayam melawan virus HPAI 1995 di lapangan dan virus LPAI H5N2 awal di lapangan [190]. Akan tetapi, strain vaksin tahun 1994 tidak protektif melawan dua virus berikutnya dari garis keturunan virus LPAI H5N2 yang diisolasi di tahun 1998 dari Meksiko selatan dan tahun 2003 dari Guatemala, yang dibuktikan dengan replikasi dan pendedahan virus dengan jumlah yang sama melalui saluran respirasi baik dari ayam yang sudah divaksin maupun ayam yang tidak divaksin [122, 190]. Belum jelas apakah drift pada virus di lapangan adalah akibat dari imunitas mengikuti infeksi pada unggas yang tidak divaksin, atau dari vaksinasi yang tidak sesuai yang kemudian diikuti infeksi pada unggas yang sudah divaksin [103, 190]. Bibit strain dalam vaksin H5N2 Meksiko diubah pada tahun 2009 menjadi A/chicken/Durango/1558/2006 (H5N2). Bukti tambahan berkurangnya perlindungan absolut luas dalam satu sub tipe karena adanya percabangan antigenik dalam HA datang dari studi eksperimental virus AI H7 menggunakan vaksin vektor rFPV-H5 [190]. Ayam yang ditantang virus HPAI A/turkey/Italy/4580/1999 (H7N1) hanya bersifat protektif jika ayam tersebut telah menerima vaksin rFPV-H7 dengan insersi H7 Eurasia, dan ayam yang divaksin dengan rFPV mengandung insersi gen HA dari Australia (A/chicken/Victoria/1/1985 [H7N7] atau Amerika Utara (A/turkey/Virginia/158512/2002 [H7N7] tidak terlindungi [44]. Karena vaksin AI H7 tidak digunakan atau hanya digunakan secara terbatas di Australia dan Amerika Utara, drift virus AI H7 mungkin merupakan akibat dari isolasi geografis virus H7 pada burung liar antara benua yang berbeda dan virus yang muncul secara alami mengalami drift dalam jangka waktu yang panjang. Pada akhirnya resistensi virus HPAI H5N1 di lapangan terhadap vaksin AI yang telah diizinkan telah diidentifikasi di China, Wilayah Administrasi Khusus Hong Kong, Mesir, Indonesia, dan Vietnam, dimana vaksinasi AI yang berkepanjangan telah dilaksanakan [334]. Karena itulah strain vaksin haruslah dinilai kembali dengan uji proteksi in-vivo dan in-vitro secara rutin, atau minimal setiap 2 tahun sekali jika diuji secara in-vivo melawan virus yang sedang bersirkulasi di lapangan dalam rangka menilai kemampuan proteksinya [2, 86, 344]. Jika strain vaksin tidak bersifat protektif, strain baru harus dipilih berdasarkan studi proteksi.
Dalam sejarahnya, kebanyakan strain bibit vaksin AI inaktif telah dipilih dari wabah virus LPAI yang memiliki sub tipe HA yang sama. Kebanyakan telah digunakan sebagai vaksin autogenus untuk mengendalikan wabah LPAI awal/orisinalnya [332], atau digunakan kemudian untuk mengendalikan wabah LPAI lain yang memiliki sub tipe HA yang sama [115]. Untuk HPAI, strain vaksin LPAI dengan sub tipe HA telah bersifat protektif pada unggas, dan sejak tahun 1995 beberapa virus HPAI telah digunakan sebagai strain vaksin untuk beberapa epidemi, sebagai contoh di Pakistan (H7N3 dan H5N1), Rusia (H5N1), dan Indonesia (H5N1 CLADE 2.1) [314]. Bertentangan dengan kepercayaan populer, strain virus HPAI memang bereplikasi sampai jumlah titer yang cukup dalam telur ayam berembrio sehingga dapat digunakan untuk vaksin AI inaktif, akan tetapi titernya lebih rendah dibandingkan dengan banyak strain vaksin LPAI. Akan tetapi, keamanan dan penggunaan strain HPAI yang aman secara biologis dalam vaksin memerlukan fasilitas pembuatan vaksin dengan level biokontainmen yang tinggi, dan atau disertai dengan prosedur biosekuriti dan personel biosafety khusus. Penggunaan strain virus LPAI hanya menimbulkan kekhawatiran biosekuriti dan biosafety yang lebih sedikit dalam hubungannya dengan pembuatan vaksin, dan lebih disukai dibandingkan virus HPAI. Ketika virus wabah LPAI dan HPAI digunakan sebagai strain vaksin, virus tersebut haruslah memiliki kecocokan genetik dengan gen HA dari virus yang sedang menimbulkan wabah saat itu dan juga memiliki karakteristik pertumbuhan virus yang tinggi dalam ECE untuk dapat memproduksi kuantitas antigen yang cukup untuk menjadi immunogenik dan protektif.
Selama lebih dari dua dekade terakhir, kemajuan teknologi dalam bidang bioteknologi telah memungkinkan pembuatan klon infeksius rg strain bibit virus AI yang dibiakkan di laboratorium untuk digunakan dalam vaksin inaktif atau insersi gen H untuk digunakan dalam vektor in-vitro maupun in-vivo, atau dalam vaksin DNA. Klon virus-virus AI infeksius diproduksi dengan pembalikan genetik menggunakan enam gen internal yang berasal dari strain vaksin influenza A seperti misalnya PR8, dan gen HA dan NA dari virus-virus penyebab wabah atau yang berkerabat dekat dengan virus penyebab wabah [40, 84, 230, 293]. Penggunaan gen internal PR8 mempengaruhi kemampuan virus untuk bereplikasi untuk menghasilkan titer yang tinggi dalam telur ayam berembrio yang sering digunakan sebagai substrat dalam proses pembuatan vaksin. Jika donor gen HA berasal dari virus HPAI, tempat pembelahan proteolitik HA harus diubah dari sekuens HPAI menjadi LPAI, yang kemudian menghasilkan strain bibit vaksin LPAI yang kemudian dapat diproduksi dalam fasilitas dengan level biosafety yang lebih rendah dibandingkan dengan fasilitas untuk pembuatan vaksin HPAI. Gen NA dapat dipilih dari 9 sub tipe NA yang ada agar berbeda dengan virus penyebab wabah, sehingga menciptakan vaksin dengan sub tipe NA heterolog yang akan memungkinkan pengujian serologis dapat mengidentifikasi unggas terinfeksi dalam populasi tervaksin (lihat bagian tentang surveilans di bawah bagian ini). Vaksin klon rg infeksius sama efektifnya dengan vaksin berlisensi yang ada sekarang ini jika didasarkan pada wabah virus LPAI dan HPAI. Di Amerika Serikat, bibit strain yang dikembangkan dengan pembalikan genetik (rg) harus dibuktikan sebagai virus LPAI dengan melewati tiga pengujian (misalnya sekuensing, kegagalan terbentuknya plak dalam kultur sel tanpa tripsin eksogenik, dan virulensi yang rendah dalam uji IVPI pada ayam) sebelum virus dapat dikeluarkan dari ketentuan regulasi agen penyakit tertentu yang menunjukkan virus tersebut bukan HPAI [191, 205, 392]. Terakhir, perkembangan bioteknologi telah memungkinkan seleksi cepat gen HA dari virus penyebab wabah menjadi bahan insersi gen untuk digunakan dalam vaksin vektor seperti adenovirus atau rFPV [153], dan baru-baru ini dengan terjadinya wabah virus HPAI H5 keturunan Gs/GD di Amerika Serikat, dengan menggunakan alfavirus rdVEE yang juga disebut sistem partikel RNA, yang memungkinkan pencocokan genetik sedekat mungkin antara vaksin dan virus AI di lapangan. Di dalam semua vaksin vektor, HA harus diubahnya tempat pembelahannya dari HP menjadi LP untuk memaksimalkan titer replikasi dalam sistem in-vitro tanpa menjadi sangat sitolitik terhadap kultur sel maupun telur ayam berembrio (ECE). Baru-baru ini telah dikembangkan sistem plasmid tunggal yang disederhanakan untuk pembuatan bibit vaksin AI dengan pembalikan genetik [121]. Kebanyakan vaksin AI H5 inaktif yang dibuat dan digunakan di seluruh dunia telah mempergunakan bibit strain virus LPAI dari pembalikan genetik (rg) [403].
Vaksin avian influenza yang berizin/ memiliki lisensi
Berbagai teknologi vaksin dan strain virus telah dilisensikan dan digunakan di lapangan. Di Amerika Serikat, hanya empat teknologi vaksin AI yang telah dilisensi: beberapa vaksin AI inaktif penuh, vaksin rFPV-H5 dengan insersi gen H5 yang didapat dari A/turkey/Ireland/83 (H5N8), vaksin rHVT-H5 dengan gen H5 yang didapat dari A/Swan/Hungary/4999/2006 (H5N1) (clade 2.2), dan rdVEE dengan insersi H5 yang didapat dari A/Gyrfalcon/Washington/41088/2014 (H5N8) (clade 2.3.4.4) (H5N1) [78, 338]. Berbagai variasi vaksin sub tipe HA telah dilisensi oleh USDA di bawah ketentuan autogenus, kondisional, dan lisensi penuh sebagai vaksin inaktif. Akan tetapi, aplikasi vaksin H5 dan H7 yang telah dilisensikan untuk dipakai di lapangan memerlukan persetujuan baik dari negara bagian maupun pemerintah federal, akan tetapi sub tipe yang lainnya mungkin hanya memerlukan persetujuan negara bagian jika digunakan untuk spesies yang termasuk dalam daftar pembatasan lisensi produk. Dalam sejarahnya, vaksin belum digunakan di Amerika Serikat untuk epidemi HPAI, akan tetapi rencana darurat untuk wabah di masa depan mungkin dapat mengizinkan penggunaannya. Vaksin melawan virus LPAI masih hanya digunakan secara terbatas di Amerika Serikat. rFPV-H5 telah dilisensi dan digunakan di Meksiko, El Salvador, dan Guatemala. Di Meksiko, vaksin rHVT-H5 dilisensikan [164, 332]. rHVT-H5 dilisensikan dan digunakan di Mesir dan Meksiko[209], dan rNDV-H5 dilisensikan dan digunakan di China [164], dan rDVE-H5 hampir selesai dilisensikan dan digunakan di China.
Secara global, kebanyakan vaksin AI berizin adalah vaksin AI inaktif penuh, terutama sub tipe H5, H7 dan H9. Untuk panzootik virus HPAI H5 keturunan Gs/D yang terjadi saat ini, vaksin AI inaktif berizin yang digunakan di Asia, Afrika dan Eropa telah menggunakan berbagai bibit strain untuk vaksin inaktif dan insersi gen HA H5 yang berbeda untuk rekombinan eFPV, rHVT, rDVE dan rNDV (Tabel 15.6) [78]. Persyaratan lisensi vaksin AI akan berbeda untuk setiap negara, tergantung kepada persyaratan spesifik yang diprasyaratkan oleh otoritas biologi veteriner nasional yang ada di negara itu yang meliputi area keamanan, kemurnian, potensi dan persetujuan label untuk masing-masing spesies, juga umur dan rute pemberian vaksin.
Penggunaan vaksin avian influenza di lapangan
Kuantitas vaksin AI yang telah diproduksi dan digunakan pada unggas sebelum dua dekade terakhir pencatatannya sangat buruk, akan tetapi penggunaan global masih tetap rendah sampai pertengahan tahun 1990-an, dan kemudian pembuatan vaksin meluas secara geometris pada dekade awal abad 21. Untuk vaksin H5 dan H7, survei yang dilakukan pada awal tahun 2002 mengidentifikasi hanya ada dua perusahaan pembuat diantara negara anggota OIE yang merespons terhadap survei tersebut, akan tetapi di tahun 2006 dan 2007 OIE membuat daftar 38 perusahaan pembuat vaksin AI, dan FAO dari PBB membuat daftar 41 jenis vaksin AI untuk digunakan untuk melawan HPAI H5 dan H7 yang tersedia dari China, Perancis, Jerman, Italia, Meksiko, Belanda, Pakistan dan Amerika Serikat [125]. Sampai 2012, hanya 27 perusahaan vaksin dikenali sebagai produsen vaksin AI H5 dan H7 [220, 239, 268]. Karena LPAI H1-H4, H6, H8, dan H10 bukan merupakan penyakit yang harus dilaporkan kepada OIE atau kebanyakan otoritas negara, hanya sedikit yang diketahui tentang ketersediaan dan penggunaan vaksin untuk pengendaliannya. Akan tetapi, vaksin yang menggunakan bibit strain vaksin LPAI H9N2 telah digunakan secara rutin pada unggas komersial di 10 negara yang tersebar di Timur Tengah dan Asia [73]. Tabel 15.6 berisi daftar strain bibit yang saat ini tersedia dan yang telah diproduksi di masa lalu tetapi tidak lagi tersedia.
Dalam sejarahnya di Amerika Serikat, vaksin AI hanya untuk digunakan secara terbatas, kebanyakan untuk mengendalikan dan mengeradikasi virus LPAI yang ada pada wilayah geografis berukuran kecil yang berisiko tinggi, seperti misalnya vaksinasi darurat pada kalkun di negara bagian Minnesota untuk mengendalikan virus LPAI yang berasal dari itik, dan selama tahun 1978 sampai 1996 hanya 22 juta dosis vaksin AI inaktif yang telah digunakan [338]. Sebagai respons dari risiko yang terus menerus ada, industri kalkun di Minnesota menghilangkan sama sekali sistem produksi outdoor di tahun 1997, dengan demikian mengurangi terpaparnya kalkun dengan unggas air liar dan risiko infeksi virus influenza dari unggas air liar, dan penggunaan vaksin untuk melawan virus LPAI asal itik liar juga telah dihentikan [137]. Di Utah selama tahun 1995 wabah LPAI H7N3 telah dieradikasi dengan menggunakan 2,03 juta dosis vaksin inaktif yang diaplikasikan selama 4 bulan, bersama komponen lain dalam program pengendalian wabah [137, 140]. Pada peternak breeder kalkun di California, telah digunakan vaksin AI inaktif sebanyak 2,3 juta antara tahun 1979 dan 1985 [115].
Contoh lain vaksinasi darurat dan preventif melawan LPAI dilakukan di Italia Utara, dimana sejumlah 202.140.000 dosis vaksin AI digunakan antara bulan November 2002 dan Desember 2006, kebanyakan pada ayam petelur dan kalkun pedaging, juga beberapa capon (ayam jantan yang dikebiri untuk digemukkan), ayam guinea dan ayam jantan. Kebanyakan vaksin AI adalah H7 inaktif yang digunakan dalam kampanye vaksinasi darurat melawan LPAI, tetapi ada juga beberapa vaksin bivalen H5 dan H7 yang digunakan selama 2005 dan 2006 untuk kampanye pencegahan LPAI [223]. Sebagai contoh vaksin influenza rutin, virus influenza babi (SIV) menyebabkan infeksi dan kerugian ekonomi breeder kalkun yang terletak di negara bagian tertentu di Amerika Serikat dimana babi dan kalkun dibesarkan dalam area geografis yang sama. Sebagai contoh, vaksin influenza A H1 inaktif yang digunakan untuk breeder kalkun di Amerika dilaporkan sebesar 2.6 juta dosis di tahun 2001 dan 7.965 dosis di tahun 2009, untuk melindungi terhadap virus SIV H1 atau H3 [50]. Akan tetapi, penggunaan vaksin AI inaktif paling ekstensif adalah di Timur Tengah dan Aisa, dimana sejak akhir tahun 1990-an milyaran dosis telah digunakan pada ayam petelur, pedaging dan unggas lainnya.
Penggunaan vaksin AI untuk pengendalian HPAI pertama kali dilaporkan di Meksiko tahun 1995 selama epidemi HPAI H5N2, dan di Pakistan selama epidemi HPAI H7N3. Virus HPAI H5N2 berhasil dieradikasi di Meksiko selama tahun 1995, akan tetapi prekursor virus LPAI H5N2 terus bersirkulasi dan menyebabkan infeksi pada unggas, dan telah menyebar ke Guatemala dan El Salvador. Antara tahun 1995 dan 2006, dan telah menyebar ke Guatemala dan El Salvador. Antara tahun 1995 dan 2006, 3.8 milyar dosis vaksin telah digunakan (1.8 milyar dosis vaksin inaktif H5N2 dan lebih dari 2 juta dosis vaksin Rfpv-h5) [44, 334]. Antara tahun 1998 dan 2014, 7 milyar rFPV-H5 digunakan di Amerika Tengah pada ayam (Michel Bublot, komunikasi personal, 15 Mei 2014). Di Pakistan, penggunaan vaksin H7N3 inaktif telah dimulai dari tahun 1995, kemudian diperpanjang penggunaannya saat LPAI H7N3 terjadi di wilayah lain di Pakistan selama tahun 2001, dan kemudian wabah HPAI H7N3 terjadi di Pakistan Selatan di tahun 2004 [338]. Vaksinasi melawan H9N2 telah diimplementasikan pada tahun 1998. Pada tahun 2006, dengan terjadinya wabah HPAI H5N1, Pakistan mulai menggunakan vaksin inaktif trivalen yang mengandung sub tipe H5, H7 dan H9. Kemunculan HPAI H5N1 di Asia yang menyebar ke Afrika telah menyebabkan penggunaan vaksinasi AI dalam keadaan darurat, vaksinasi rutin dan vaksinasi pencegahan, dimulai dengan penggunaan vaksin AI H5N2 inaktif pada unggas di Hong Kong tahun 2002, diikuti dengan implementasi program vaksinasi di Indonesia tahun 2003, di China tahun 2004, di Vietnam tahun 2005, di Pantai Gading, Mesir, Perancis, Israel, Kazakhstan, Mongolia, Belanda, Pakistan dan Rusia tahun 2006, dan di Bangladesh di tahun 2012 [203, 231].
Antara tahun 2009 dan 2010, 113,9 milyar dosis vaksin AI H5 atau H7 (95,5% vaksin inaktif penuh beremulsi minyak dan 4,5% vaksin rekombinan (misalnya rFPV-H5, rHVT-H5 dan rNDV-H5) digunakan untuk melindungi unggas, sebagian besarnya digunakan oleh negara penghasil dan konsumen unggas terbesar di dunia, yaitu China yang telah memberikan 104 milyar dosis (91%) dalam program vaksinasi unggas rutin nasional (Gambar 15.3) [338]. 8% dosis tambahannya digunakan di Mesir (5 milyar dosis, 4,65%), Indonesia (2,6 milyar dosis, 2,32%), dan Vietnam (1,6 milyar dosis, 1,43%), dengan 1% sisanya digunakan dalam program vaksinasi tertarget untuk unggas berisiko tinggi, baik sebagai upaya pencegahan maupun sebagai alat manajemen kontrol dalam proses eradikasi. Negara sisanya meliputi Rusia (0,37%), Pakistan (0,12%), Wilayah Administrasi Khusus Hong Kong (0,08%), Kazakhstan (0,03%), Pantai Gading (<0,01%), Korea Utara/ Republik Rakyat Korea (<0,01%, hanya untuk HPAI H7N7 saja), Perancis (<0,01%), Israel (0,01%), Mongolia (<0,01%), Belanda (<0,01), dan Sudan (<0,01%) (Gambar 15.3). Pada saat artikel ini ditulis, vaksinasi masih berlanjut di Hong Kong, China, Mesir, Vietnam, Pakistan dan Bangladesh dengan level yang diperkirakan sama dengan level tahun 2009, akan tetapi kebanyakan negara lain telah menghentikan program vaksinasi. Jika dibandingkan, antara tahun 2002 dan 2010 kurang dari 300.000 dosis (0,000003% dari total vaksin yang digunakan dalam program HPAI) vaksin H5 dan H7 telah digunakan pada unggas di kebun binatang, unggas di wilayah perburuan, unggas peliharaan, unggas dalam program konservasi, dan unggas langka dan terancam punah, yang mewakili program vaksinasi HPAI pencegahan di 20 negara Eropa dan Asia di 292 tempat [338]. Tidak ada studi mengenai uji tantang, akan tetapi respons serologi HI sebanyak ≥ 32 dilaporkan sebesar masing-masing 76%, 80,5% dan 81,5% unggas dalam setiap studi yang dilakukan. Respons serologis dari unggas yang berasal dari ordo berbeda dilaporkan bervariasi antar laporan individu yang sudah dikumpulkan [27, 247, 248, 338].
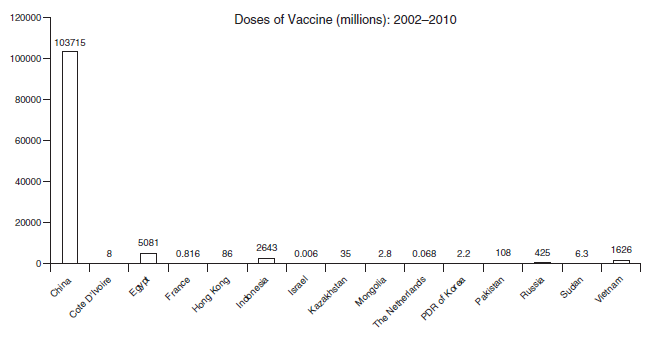
Gambar 15.3 Simpulan tentang vaksin H5 yang digunakan pada unggas di 15 negara yang memvaksinasi unggas melawan HPAI dari tahun 2002 sampai 2010. Avian Diseases 56(4):818–828, 2012; [341]. Digunakan dengan izin dari The American Association of Avian Pathologists.
Proteksi homosubtipik secara luas
Dalam sejarahnya, vaksin AI unggas telah menunjukkan proteksi homosubtipik yang lebih luas dan lebih panjang jika dibandingkan dengan strain vaksin influenza A (H1 dan H3) dan B penyebab influenza musiman pada manusia. Pemetaan antigen telah menunjukkan bahwa virus LPAI H5, setelah mereka muncul dari reservoir unggas liar dan menginfeksi unggas, memiliki HA yang serupa secara antigenik, membuatnya menjadi strain bibit vaksin yang baik untuk melawan virus HPAI dan LPAI H5 [014]. Sebagai contoh, penelitian yang menggunakan bibit strain H5N2 Meksiko tahun 1994 telah menunjukkan proteksi silang yang luas terhadap bukan hanya virus HPAI Amerika Utara tetapi juga virus HPAI H5 Eurasia [344]. Akan tetapi, proteksi homosubtipik tidak bersifat absolut, dan tingginya prevalensi infeksi virus LPAI H9N2 dan HPAI H5N1 pada unggas di beberapa negara berkembang, dan tingginya penggunaan dan ketergantungan terhadap vaksin dalam sebuah program pengendalian, telah dihubungkan dengan meningkatnya tekanan imunitas terhadap virus AI di lapangan dan drift nya yang semakin menjauh dari beberapa strain vaksin yang ada. Akibatnya, telah muncul virus di lapangan yang resistan terhadap strain vaksin LPAI klasik yang telah berumur tua atau bahkan juga bibit strain vaksin rg yang lebih tua [354, 357]. Akibatnya, strain vaksin mungkin harus diubah lebih sering dan mungkin memerlukan peningkatan penggunaan teknologi pembalikan genetik (rg) [357] untuk membuat strain vaksin LPAI pengganti, atau pengganti gen virus AI HA dalam produk vaksin vektor seperti vaksin rFPV atau rNDV yang baru untuk mempertahankan vaksin yang dapat digunakan secara efektif di lapangan. Penggunaan vaksin H7N3 heterolog di Italia selama tahun 2002-2004 dan penggunaan vaksin H5 di Indonesia selama tahun 2003-2006 dihubungkan dengan kejadian dimana virus di lapangan mendapatkan perubahan asam amino spesifik pada tempat pembelahan antibodi HA-nya [191, 205]. Hal ini menyoroti perlunya strain bibit homolog agar meminimalisir seleksi terhadap varian antigenic drift semacam itu.


Untuk mengkompensasi perbedaan antigenik yang minor dan mengoptimasi proteksi homosubtipik, meningkatkan jumlah vaksinasi yang diperlukan dan/atau kuantitas antigen yang diperlukan dalam setiap dosis dapat memperluas respons imun protektif. Vaksinasi dalam jumlah banyak dengan vaksin H5N2 yang sudah dimatikan mampu memperluas profil antigenik pada ayam breeder broiler dan meniadakan perbedaan antigenik kecil antara vaksin dan virus di lapangan, akan tetapi strategi tersebut tidak memberikan proteksi terhadap uji tantang ketika perbedaan antigeniknya luas [23, 344]. Ditambah lagi, penggunaan kandungan antigen HA yang tinggi dalam setiap dosis vaksin H5 telah memberikan perluasan proteksi homosubtipik melawan virus tantang H5N1 yang berbeda jauh secara antigenik [2], akan tetapi hal ini pun memiliki keterbatasan.
Selain dari kesamaan antigenik dalam sub tipe HA yang sama, proteksi yang lebih luas dan lebih lama yang diberikan oleh vaksin AI unggas dibandingkan dengan strain vaksin influenza A (H1 dan H3) dan influenza B penyebab influenza musiman pada manusia mungkin merupakan akibat dari hal sebagai berikut [365]:
- Vaksin AI unggas inaktif menggunakan adjuvan emulsi minyak racikan sendiri milik perusahaan vaksin, yang menimbulkan respons imun yang lebih intens dan berumur lebih lama pada unggas jika dibandingkan dengan vaksin adjuvan influenza A dan B pada manusia.
- Respons imun vaksin AI pada unggas tampaknya lebih luas daripada pada manusia.
- Imunitas dalam populasi unggas domestik lebih seragam karena pada manusia terdapat homogenitas genetik hospes yang lebih besar.
- Penggunaan vaksin AI pada unggas ditargetkan kepada populasi unggas sehat berumur relatif muda, sementara vaksin AI pada manusia dioptimasikan untuk kelompok-kelompok yang memiliki risiko tinggi mengalami penyakit parah dan kematian.
- Dalam sejarahnya, hanya sedikit endemik virus influenza di unggas jika dibandingkan dengan yang terjadi pada populasi manusia. Untuk yang terakhir ini di negara-negara maju, paparan virus AI yang relatif jarang bersama dengan jarangnya penggunaan vaksin AI telah memberikan tekanan seleksi yang lebih sedikit pada virus AI untuk melakukan drift.
Kualitas Vaksin
Kontrol kualitas dalam pembuatan vaksin bersifat kritikal untuk meyakinkan produk yang dihasilkan aman dan efektif [332]. Kualitas vaksin komersial memiliki dampak besar terhadap efektivitas vaksin di lapangan, terkait hal-hal antara lain sebagai berikut:
- Keterikatan antigenik antara bibit strain dengan virus di lapangan;
- Kuantitas antigen – antigen HA yang cukup harus ada (dalam vaksin inaktif) atau harus mengandung titer yang cukup tinggi (dalam vaksin hidup) untuk memproduksi respons imun protektif yang dapat diukur secara serologis, dan harusnya hanya ada sedikit variasi kandungan antigen dari batch satu ke batch lainnya.
- Adjuvan – untuk vaksin inaktif, adjuvan dengan kualitas tinggi dibutuhkan untuk meningkatkan
- Sterilitas – untuk vaksin inaktif, strain vaksin harus diinaktifkan secara keseluruhan
- Kemurnian – tidak ada kontaminan berupa jamur, bakteri dan virus dalam vaksin inaktif ataupun vaksin hidup.
Pencocokan antigenik dengan strain bibit vaksin
Strain bibit yang digunakan harus cocok secara antigenik dengan virus di lapangan untuk memberikan proteksi maksimal, dan harus dikonfirmasi strain bibit spesifik yang terdapat di dalam vaksin apakah sesuai dengan yang telah diregistrasi. Ketika strain bibit telah digunakan di negara dimana infeksi telah menjadi endemik, antigenic drift dan berkurangnya proteksi telah teridentifikasi, seperti di Meksiko oleh virus LPAI H5N2 [355] dan di Mesir [190], juga virus HPAI H5N1 di Hong Kong [132], Indonesia [86], dan Vietnam [344]. Untuk beberapa hal, badan-badan yang berwenang dalam regulasi tampaknya sangat lambat dalam merubah bibit strain. Sebagai contoh, pemeriksaan strain bibit vaksin dalam produk akhir vaksin inaktif H5N2 Meksiko mendemonstrasikan bahwa dua dari sepuluh strain bibit tidak sesuai dengan strain bibit yang sudah diregistrasi, akan tetapi dua vaksin ini adalah satu-satunya yang memberikan proteksi seperti yang sudah diukur dengan berkurangnya pendedahan virus tantang melalui swab mulut [74]. Serupa dengan itu, studi yang lain mengidentifikasi tiga vaksin asal China yang mengandung strain bibit vaksin yang tidak sesuai dengan strain yang teregistrasi yang tertulis pada label di produk akhirnya [103].
Kuantitas antigen
Vaksin harus diformulasi dengan antigen HA yang cukup untuk memproduksi respons protektif yang konsistensi pada spesies target. Dalam tahun 1998, Garcia dan kolega memeriksa enam vaksin komersial H5N2 dari Meksiko tentang kemampuannya memberikan proteksi pada ayam melawan uji tantang virus HPAI H5N2, dan menemukan bahwa seluruhnya memberikan proteksi yang baik terhadap kematian, akan tetapi juga menunjukkan variabilitas individu dalam mengurangi pendedahan virus melalui orofaring dan kloaka, dan dalam menginduksi respons serologi HI [344]. Dosis vaksinasi tunggal sebanyak ≥ 4 µg protein HA diperlukan untuk mengurangi replikasi dalam saluran pernafasan dan saluran makanan setelah diuji tantang melalui intra nasal dengan dosis virus HPAI menengah (102 dosis letal rata-rata per ayam /mean chicken lethal dose [CLD50]). Dalam studi lainnya yang menggunakan vaksin eksperimental, vaksin AI inaktif yang mengandung 3-8 µg protein HA per dosis, atau vaksin vektor baculovirus mengandung 2µg HA per dosis, bersifat protektif pada ayam yang telah diuji tantang dengan virus HPAI secara intranasal (IN) jika dibandingkan dengan dosis 0,1 – 0,3 µg dan 0,2 µg yang masing-masing tidak memberikan proteksi secara penuh [122]. Selain itu, dalam model transmisi kontak, vaksin AI inaktif beremulsi minyak yang mengandung 0,3 µg HA berhasil mencegah penyakit klinis pada ayam yang telah diuji tantang dengan virus HPAI, 0,1 µg HA per dosis tidak melindungi terhadap penyakit klinis, sementara 0,9 µg HA dalam vaksin memberikan perlindungan optimal tanpa isolasi virus tantang dalam swab saluran respirasi atau saluran pencernaan [327]. Studi lain yang menggunakan dua kali vaksinasi melaporkan bahwa 0,5µg HA adalah dosis minimum yang diperlukan untuk memproduksi proteksi optimal [394]. Kuantitas HA yang cukup dapat diketahui dengan evaluasi serologis pada ayam SPF yang diimunisasi dengan dosis tunggal dengan mengikuti petunjuk dari perusahaan pembuatnya. Pencegahan kematian telah dihubungkan dengan titer antibodi HI rata-rata (GMT) sebesar ≥ 8 – 10 [98], dan pencegahan pendedahan virus melalui orofaring dihubungkan dengan GMT antibodi sebesar ≥ 128 [182, 323].
Cara yang lebih akurat dan lebih baik untuk dapat dilaksanakan terus menerus untuk menentukan kandungan antigen HA yang diperlukan melibatkan penggunaan penentuan PD50. Pada sebuah studi eksperimental pada ayam menggunakan vaksin AI eksperimental bersifat inaktif mengandung sistem adjuvan minyak emulsi generik terstandarisasi dan diuji tantang dengan virus HPAI H5N2 (103 CLD50), kisaran PD50 berdasarkan angka kematian antara 0.006-0.156 µg HA, yang kemudian diterjemahkan menjadi kisaran dosis minimal standar untuk mencapai PD50 akan memerlukan kandungan HA per dosis vaksin sebesar 0.3 – 7.8 µg [333]. Kesimpulan dari banyak eksperimen yang telah dilakukan menemukan kandungan HA minimal yang harus ada dalam satu dosis vaksin sebesar 1 -5 µg [323]. Akan tetapi, kuantitas antigen yang diperlukan akan bervariasi tergantung strain vaksin, strain dan dosis virus tantang, dan adjuvan yang digunakan untuk vaksin.
Adjuvan
Untuk vaksin inaktif, penggunaan adjuvan minyak penting untuk memproduksi titer antibodi protektif secara konsisten, luas dan berlaku panjang. Kebanyakan perusahaan biologi veteriner menggunakan sistem adjuvan milik sendiri untuk vaksin unggas inaktif. Informasi yang lebih detail dapat ditemukan pada bagian yang membahas tentang adjuvan.
Sterilitas
Selama pembuatan vaksin inaktif, proses kimia digunakan untuk strain vaksin inaktif, dan inaktivasi harus diverifikasi dengan ECE atau inokulasi jaringan. Selain itu antigen harus diuji sterilitasnya untuk memastikan bahwa tidak ada bakteri kontaminan atau agen lain di dalamnya.
Kemurnian
Untuk vaksin hidup, produk input (ECE atau kultur jaringan dan stok bibit) harus diuji untuk memverifikasi tidak adanya agen jamur, virus, atau bakterial dengan menggunakan seperti metode isolasi atau teknologi deteksi asam nukleat (misalnya RRT-PCR [332].
Rute Pemberian Vaksin
Rute inokulasi memberikan dampak besar terhadap perkembangan respons imun protektif, dan dipengaruhi oleh tipe vaksin, sistem manajemen, spesies hospes dan umur hospes.
Pemberian vaksin melalui parenteral setelah unggas menetas
Untuk kebanyakan vaksin AI yang digunakan di lapangan, pemberian dilakukan dengan injeksi parenteral, dan hal ini melibatkan proses menangkap unggas, handling dan melakukan penyuntikan individu unggas untuk memproduksi respons imun protektif. Pemberian lewat parenteral pada umumnya dicapai dengan injeksi subkutan (SC) di bawah kulit atas leher, akan tetapi beberapa vaksin memerlukan injeksi intramuskuler (IM) atau jaringan sayap/wing web (WW). Kebanyakan vaksin AI inaktif yang telah diizinkan penggunaannya memerlukan injeksi SC atau IM. Meskipun virus cacar ayam tipe liar dapat menimbulkan infeksi dan lesi pada mulut, faring dan trakea, vaksin rFPV-H5 lebih terbatas dalam tempat replikasinya untuk vaksin-vaksin yang diberikan melalui rute SC maupun WW, dan vaksin yang diberikan secara intranasal (IN) atau dalam air minum tidak akan melindungi terhadap uji tantang HPAI [240]. rHVT diberikan melalui SC atau rute in-ovo, sedangkan rDVE diberikan rute IM.
Di Amerika Serikat, biaya vaksin ditambah pemberian secara parenteral itu mahal, dengan biaya vaksin di kisaran 0,05 – 0,10 dolar Amerika Serikat per dosisnya, dan karena harus menghandle unggas yang akan divaksin, perkiraan biaya pemberian vaksin antara 0,05 – 0,07 dolar Amerika Serikat per ekor unggas [19]. Akan tetapi, biaya aktualnya akan bervariasi tergantung pada tipe dan kualitas vaksin, ukuran dan umur unggas yang dihandle, dan biaya program pengendalian, surveilans dan upah petugas vaksinasi yang dikeluarkan oleh pemerintah.
Pemberian vaksin secara massal
Metode berbiaya rendah untuk melaksanakan imunisasi masal unggas melawan AI akan sangat menguntungkan, memberikan cara untuk mengurangi pengeluaran yang diperlukan ketika memberikan vaksin AI, yang akan menjadi insentif ekonomi untuk memvaksin, dan kemudian akan meningkatkan penggunaan vaksin di wilayah atau negara dimana vaksinasi masih diperlukan untuk mengendalikan AI. Metode untuk imunisasi masal melawan AI dapat mencakup pemberian vaksin secara in-ovo, atau pemberian vaksin pasca menetas melalui saluran pernafasan (melalui spray) atau saluran makanan (melalui air minum atau pakan).
Pemberian secara in-ovo
Pada awal tahun 1980-an, vaksinasi dengan cara injeksi langsung ke dalam embrio ayam yang sedang berkembang (pemberian in-ovo) dikembangkan untuk memberikan proteksi pasca menetas terhadap virus herpes penyebab penyakit Marek (MDV) [332]. Metodologinya dibuat otomatis, yang memungkinkan dilakukannya vaksinasi massal pada embrio ayam berumur inkubasi 18 – 19 hari. Pada saat ini, kebanyakan ayam broiler yang diproduksi di Amerika Serikat divaksinasi untuk melindungi terhadap MDV dengan menggunakan teknologi in-ovo dan metodologi ini diterima secara luas dalam industri perunggasan komersial terintegrasi di seluruh dunia. Pada saat ini, tidak ada vaksin AI yang diberi izin untuk pemberian secara in-ovo. Akan tetapi, banyak studi eksperimental yang telah dilakukan dan memperlihatkan bukti konsep proteksi terhadap AI, meliputi vaksin AI inaktif [286], adenovirus bereplikasi sedikit dengan insersi gen virus AI H5 [302], rHVT-H5 [226, 359], rdVEE [151], virus AI hidup yang diatenuasi dengan trunkasi gen NS atau perubahan genetik lainnya [282], dan chimera AI-NDV-HN [291, 383]. Kemungkinan teoritis lainnya untuk vaksin AI in-ovo adalah vaksin kompleks antibodi AI HA, serupa dengan vaksin antibodi virus infectious bursal disease (IBDV), akan tetapi hal ini akan memerlukan penggunaan virus AI inaktif di dalam kompleks antigen-antibodi [297].
Pemberian melalui jalur saluran pernafasan (melalui spray dan tetes mata)
Vaksin virus infectious bronchitis dan virus ND adalah vaksin virus hidup yang paling banyak diaplikasikan secara masal pada unggas, milyaran dosis digunakan per tahunnya di seluruh dunia meliputi seluruh sektor produksi perunggasan [154]. Sering kali vaksin-vaksin ini diaplikasikan secara massal di fasilitas penetasan dengan peralatan lemari semprot dan di lapangan dengan menggunakan alat semprot yang dipanggul di sebuah kandang produksi. Aplikasi dengan cara itu menyebabkan paparan virus melalui konjungtiva dan jalur pernafasan atas, diikuti replikasi virus dalam vaksin dan produksi respons imun mukosal dan sistemik. Karena luasnya penggunaan vaksin ND dengan virus hidup, konsep penggunaan sistem klon infeksius untuk memproduksi vaksin vektor virus AI telah dikembangkan [328]. Vektor rNDV semacam itu menggunakan insersi gen HA dari virus AI H5 atau H7 dan sudah digunakan untuk imunisasi ayam, dan diketahui telah memberikan perlindungan dalam uji tantang melawan virus ND maupun HPAI [181, 232, 245]. Dua vaksin rNDV-H5 telah terdaftar di China dan Meksiko untuk digunakan di lapangan melawan virus ND dan HPAI H5 [125, 209, 244, 329, 374], akan tetapi imunitas maternal pada keturunannya melawan insersi vektor virus ND atau influenza HA telah dihambat terutama oleh respons imun primer dan proteksi yang ditimbulkannya.
Dalam hubungannya dengan vaksin AI potensial lainnya, aplikasi vaksin AI H5N2 inaktif yang mengandung adjuvan khusus melalui semprot/spray mampu mengurangi replikasi virus LPAI H5N2 saat ditantang melalui pemberian virus secara tetes mata pada kantong konjungtiva [209, 406]. Akan tetapi, vaksin AI-H5 dengan vektor Adenovirus bereplikasi sedikit gagal melindungi ayam setelah diberikan satu kali vaksinasi melalui intranasal (IN), intra trakea (IT), konjungtiva, atau in-ovo melawan virus HPAI H5N1 homolog yang diberikan secara intranasal (IN), mengindikasikan bahwa vaksin tersebut tidak mungkin digunakan sebagai vaksin topikal atau spray/semprot yang diaplikasikan secara massal [211]. Sebaliknya, aplikasi vaksinasi pertama (prime) dan kedua (boost) vaksin AI H5 dengan vektor adenovirus dengan defisiensi replikasi melalui kantong konjungtiva melindungi ayam dari uji tantang letal virus HPAI H5N2 Meksiko 1995 melalui jalur IN, sementara vaksinasi tunggal melalui spray atau melalui kantong konjungtiva hanya memberikan proteksi parsial [121, 301]. Vaksin rg LPAI mutan H5 dan H7 yang sensitif temperatur jika diberikan secara topikal mampu melindungi melawan uji tantang letal virus HPAI pada ayam [360].
Pemberian melalui jalur saluran pencernaan (air minum dan pakan)
Saat ini, tidak ada vaksin AI berlisensi yang tersedia untuk diberikan lewat air minum atau pakan. Vaksin inaktif telah diberikan secara eksperimental melalui oral terbukti memberikan proteksi terhadap uji tantang dengan virus HPAI, akan tetapi imunisasinya memerlukan dosis vaksin yang sangat tinggi sampai 9 kali imunisasi untuk memberikan proteksi pada ayam SPF, menjadikan pemberian melalui jalur pencernaan tidak layak dilakukan [291]. Berbagai metode induksi antigen protektif dalam tanaman untuk dikonsumsi secara oral juga telah diajukan, akan tetapi belum ada yang telah mampu menunjukkan perlindungan terhadap uji tandang virus HPAI. Vaksin AI HA non-hidup semacam itu mungkin saja memerlukan dosis yang sangat tinggi dan adjuvan spesial untuk memproduksi respons imun protektif.
Baru-baru ini, vektor Salmonella enteritidis ∆aroA dengan insersi gen AI-M2e dapat memproduksi antibodi penetralisir setelah dilakukan dua kali vaksinasi melalui saluran makanan pada ayam, dan juga mampu mengurangi replikasi dan pendedahan virus setelah ditantang dengan virus LPAI H7N2, tetapi tidak melindungi terhadap kematian karena uji tantang virus HPAI H5N1 [89]. Serupa dengan itu, hiperekspresi M2e pada E coli hanya memberikan proteksi parsial pada ayam terhadap virus HPAI H5N1 [85, 185]. Sebaliknya, strain vaksin Salmonella enterica serovar Typhimurium mengekspresikan gen HA H5 yang diberikan secara oral dalam interval 4 minggu, memberikan proteksi parsial akan tetapi tidak memberikan proteksi penuh terhadap kematian akibat uji tantang virus HPAI homolog dan heterolog [404].
Kondisi Manajemen dan Lingkungan
Proteksi yang diinduksi oleh vaksin yang diberikan dalam kondisi lingkungan laboratorium dengan variabel pengganggu yang dikendalikan pada unggas SPF mampu memberikan respons imun terbaik. Akan tetapi di lapangan, proteksi yang diinduksi oleh vaksin akan kurang dari optimal kecuali jika seluruh variabel manajemen pemeliharaan yang memiliki dampak negatif terhadap perkembangan imunitas hospes dikendalikan dengan baik. Beberapa studi vaksin AI telah melaporkan ‘sterilitas imunitas’ di lokasi-lokasi mukosa, akan tetapi di lapangan ‘sterilitas imunitas mukosa’ tidak dapat dipraktikkan atau tidak dapat dicapai. Akan tetapi, vaksin dapat mengurangi secara signifikan replikasi virus AI dan pendedahan virus dari saluran respirasi dan saluran makanan, yang akan berakibat berkurangnya virus di lingkungan dan berkurangnya atau tereliminasinya transmisi virus [201]. Manajemen variabel lingkungan yang dapat menghambat atau mengurangi proteksi di lapangan harus menjelaskan situasi berikut:
- Kegagalan dalam memvaksinasi sejumlah unggas yang diharuskan dalam populasi tersebut untuk dapat mencapai kekebalan kelompok.
- Memberikan vaksin kurang dari dosis yang ditentukan untuk setiap unggas.
- Penggunaan vaksin yang murah dan berkualitas jelek (misalnya mengandung antigen yang sedikit).
- Penyimpanan dan transport vaksin yang tidak benar.
- Vaksinasi yang tidak benar, dengan injeksi yang banyak meleset.
- Imunosupresi yang merupakan akibat dari infeksi virus spesifik (misalnya infectious bursal disease, chicken anemia virus, adenovirus, dan lainnya), terpapar dengan campuran immunosupresif yang terbentuk secara alami misalnya aflatoksin, atau terpapar kondisi manajemen yang membuat stres.
Biosekuriti, pendidikan, diagnostik dan surveilans, dan eliminasi unggas terinfeksi AI sangat penting, karena vaksin dan penggunaannya tidaklah sempurna. Vaksinasi hanya harus digunakan sebagai salah satu alat dalam program pengendalian AI yang komperhensif.
Metode aplikasi dan cakupannya di lapangan
Program vaksinasi
Pengembangan strategi vaksinasi yang layak memerlukan pemeriksaan berbagai segi, meliputi:
- Tipe virus AI yang harus dikendalikan – yaitu: virus HPAI, virus LPAI H5/H7, atau virus LPAI non-notifiable/tidak harus dilaporkan (H1-H4, H6, dan H8 – H16).
- Tujuan atau hasil yang diinginkan dari program pengendalian, yaitu untuk mencegah, mengontrol, atau mengeradikasi AI.
- Level risiko masuknya virus AI, dan peranan yang dapat dimainkan vaksinasi dalam strategi pengendalian.
- Spesies unggas yang akan divaksinasi.
- Sektor atau sistem produksi yang terlibat.
- Sokongan logistik, termasuk peraturan terkait, ketersediaan vaksinator terlatih, dan kemampuan surveilans.
- Tipe dan ketersediaan vaksin.
Penggunaan vaksin secara umum diterima untuk dapat mengendalikan penyakit unggas endemik umum yang secara ekonomi berdampak signifikan, seperti misalnya infectious bronchitis (IB) dan infectious bursal disease (IBD) dan di dalam beberapa negara, zona dan kompartemen (CZC), termasuk juga LPAI. Sebagai contoh, di sebagian besar Asia dan Timur Tengah, virus LPAI H9N2 endemik pada unggas, dan vaksin rutin digunakan untuk menangani infeksi dan penyakit untuk mempertahankan produksi unggas yang berarti secara ekonomi. Akan tetapi eradikasi LPAI H9N2 masih belum menjadi tujuan (LPAI H9N2 endemik pada populasi unggas tersebut, demikian juga IB dan IBD). Sebaliknya, di kebanyakan negara maju, virus LPAI dari seluruh sub tipe bersifat sporadis pada unggas dan terlokalisir di alam, menyebabkan penggunaan vaksin secara luas tidak cocok dengan strategi umum pencegahan maupun strategi eradikasi [106, 380]. Akan tetapi dengan satu pengecualian, kalkun domestik rentan terhadap virus SIV H1 dan H3 yang endemik pada babi di seluruh dunia [18]. Karena itulah, di banyak negara maju, breeder kalkun dan kadang juga peternak kalkun pedaging mungkin melaksanakan vaksinasi strategis melawan virus SIV H1 dan H3 di wilayah geografis dengan risiko tinggi dimana baik babi dan kalkun diproduksi [101]. Vaksinasi jarang dilakukan untuk melawan LPAI H5 dan H7, karena program stamping-out pada umumnya digunakan untuk eradikasi [338].
Vaksinasi unggas jarang dilakukan untuk melawan HPAI pada negara-negara maju dimana diagnosis awal dan stamping-out tanpa vaksinasi adalah praktik yang paling umum dilaksanakan untuk mencapai eradikasi cepat [338]. Akan tetapi, di negara berkembang, penggunaan vaksin melawan virus LPAI dan HPAI tipe H5 dan H7 tergantung pada status endemik dan kemampuan program stamping-out dalam secepatnya mengeradikasi virus. Pada 37 wabah epidemi HPAI yang terjadi antara tahun 1959 sampai 2015, hanya 5 epizootik yang menggunakan vaksinasi yang dikombinasikan dengan stamping out; 32 epizootik lainnya hanya memberlakukan program stamping out saja [338]. Vaksinasi AI diimplementasikan tahun 1995 untuk mengatasi epidemi HPAI H2N5 di Meksiko, tahun 1995 untuk mengatasi epidemi HPAI H7N3 di Pakistan, tahun 2022 untuk mengatasi epidemi HPAI H5N1 keturunan Gs/GD di Asia, tahun 2005 untuk mengatasi epidemi HPAI H7N7 di Korea Utara, dan tahun 2012 untuk mengatasi epidemi HPAI H7N3 di Meksiko. Untuk LPAI tipe H5 dan H7 penggunaan vaksin dapat bergantung pada situasi lokal, dan dalam sejarahnya vaksinasi telah digunakan sebagai cara untuk mengendalikan pemasaran.
Pada situasi dimana vaksin dipertimbangkan untuk digunakan, risiko infeksi AI harus ditentukan, dan jika risiko tinggi, vaksinasi yang tepat dapat digunakan sebagai alat pencegahan yang efektif sebagai salah satu bagian dari strategi pengendalian AI multikomponen. Sebagai contoh, pada tahun 2002 di Hong Kong vaksinasi wajib diberlakukan karena pemasukan virus HPAI H5N1 yang terus menerus melalui unggas impor dari China selatan, dan karena keberadaan infeksi endemik di dalam wilayah itu [344]. Strategi ini telah berhasil dalam mencegah wabah pada unggas di Hong Kong dan mencegah paparan dan infeksi virus pada manusia. Akan tetapi penggunaan vaksinasi selimut dalam semua situasi tidak boleh dianjurkan, karena vaksin yang digunakan tanpa biosekuriti dan surveilans yang memadai dapat membuat deteksi dini infeksi virus AI menjadi sulit dan mencampurbaurkan deteksi cepat dengan program stamping-out. Program vaksinasi yang baik harus didesain untuk memenuhi keperluan sesuai tujuan spesifik dan epidemiologi penyakit.
Berbagai strategi telah diajukan untuk menggunakan vaksin sebagai bagian program pengendalian baik HPAI maupun LPAI [105]. Dalam sejarahnya, vaksinasi melawan penyakit eksotik seperti misalnya penyakit mulut dan kuku (PMK) dan rinderpest pada hewan ternak besar telah dilakukan dengan strategi vaksinasi cincin – yaitu vaksinasi zona kontrol atau zona surveilans di sekeliling wilayah wabah, yang didasarkan pada konsep epidemiologi pergerakan jarak dekat hewan ternak besar yang terinfeksi (misalnya sapi dan babi) dan bahan tercemar (fomite) yang mengandung virus (Gambar 15.4). vaksinasi cincin telah diajukan sebagai program vaksinasi darurat untuk pengendalian HPAI, akan tetapi strategi semacam itu tidak selamanya sepenuhnya efektif karena mudahnya perpindahan unggas kecil melalui jarak yang jauh dari dan ke dalam sistem pasar unggas hidup, terutama di negara-negara berkembang dimana unggas berukuran kecil dapat dibawa dengan mudah dalam kandang-kandang kecil yang dicantelkan pada sepeda motor dan dibawa dari peternakan ke pasar dan sebaliknya. Strategi lainnya yaitu vaksinasi ‘supresor’ dalam zona wabah HPAI yang diberlakukan kepada flok yang belum terinfeksi untuk meningkatkan resistensi flok-flok tersebut terhadap virus AI, dan juga pada flok terinfeksi terutama dengan virus LPAI untuk menginduksi level imun tinggi yang konsisten dengan tujuan menghentikan pendedahan dan transmisi virus (Gambar 15.4). Yang disebutkan terakhir dapat memberikan manfaat tambahan yaitu menghentikan persebaran virus AI dalam peternakan, bahkan dalam kandang yang sudah terinfeksi, seperti yang telah ditunjukkan dalam percobaan vaksinasi di lapangan melawan virus HPAI H5N2 di Pennsylvania selama tahun 1983 dan melawan virus HPAI H5N1 di Hong Kong selama tahun 2002 [58, 61, 64-67, 137, 139, 192, 218, 314, 328, 330]. Sebagai alternatif vaksinasi supresor dapat digunakan selama repopulasi dengan menempatkan unggas yang sudah divaksin kembali ke lingkungan pemeliharaan dimana masih terdapat kantong-kantong residu virus yang berisiko di lingkungan tersebut yang tidak dapat dibersihkan dan didesinfeksi secara tuntas, atau di wilayah-wilayah dengan tingkat infeksi rendah yang tidak terdeteksi pada unggas pedesaan yang sulit dijangkau. Repopulasi dengan unggas yang sudah divaksin harusnya dapat mengurangi potensi kemunculan kembali virus AI. Strategi vaksinasi serupa dapat digunakan untuk pengendalian LPAI. Untuk kasus LPAI, vaksinasi dipraktikkan pada beberapa peternakan ayam petelur terdampak yang memiliki beberapa kandang ayam berukuran besar yang mengalami infeksi virus LPAI H7N2 di Connecticut, Amerika Serikat selama tahun 2003 sampai 2005 [105, 106]. Dalam situasi ini virus LPAI tidak memproduksi infeksi secara konsisten kepada semua ayam di dalam kandang berukuran besar, dan vaksinasi kemudian diberlakukan untuk meningkatkan imunitas keseluruhan ayam dalam level yang konsisten dan protektif yang memungkinkan produksi dan pemasaran telur unggas yang aman dari virus. Setelah 18 bulan, seluruh ayam yang sudah divaksin dalam kandang terdampak kemudian diafkir, dan tidak ada virus LPAI H7N2 yang terdeteksi selama surveilans [314].
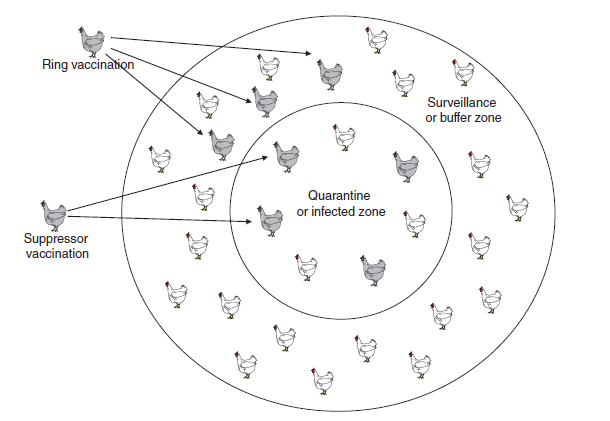
Gambar 15.4 Konsep aplikasi vaksin AI di lapangan selama berlangsungnya vaksinasi darurat. Sumber David E. Swayne.
Vaksinasi dalam satu wilayah geografis dapat dilaksanakan sebagai vaksinasi cincin mengelilingi wilayah/zona wabah, atau pada kasus wilayah berukuran kecil tetapi berisiko tinggi, dapat dibuat sebagai populasi tertarget dalam sebuah wilayah yang telah diidentifikasi secara geografis, kompartemen dan spesies unggasnya. Rencana strategis mendetail untuk vaksinasi AI mencakup kategori berikut: vaksinasi rutin dalam wilayah endemik, vaksinasi darurat selama epidemi, dan vaksinasi pencegahan atau profilaktik ketika risiko masuknya virus AI sedang tinggi [314]. Dalam sebuah program vaksinasi darurat, harus dikembangkan sebuah strategi jalan keluar (exit strategy) yang akan diimplementasikan sebagai bagian strategi eradikasi, jika tidak program vaksinasi akan secepatnya menjadi kegiatan rutin, diikuti dengan menerima terjadinya infeksi AI, dan kemudian penyakit akan menjadi endemik.
Dalam lingkungan laboratorium, vaksin inaktif dosis tunggal pada ayam dan kalkun umur ≥ 2 minggu tanpa antibodi terhadap virus AI biasanya memberikan perlindungan terhadap uji tantang virus virulen, akan tetapi pada uji tantang terhadap beberapa spesies unggas menunjukkan bahwa satu dosis tunggal tidak memberikan perlindungan optimal. Sebagai contoh, vaksinasi tunggal dengan vaksin H5N1 keturunan Gs/GD (clade 0) yang diberikan kepada itik Peking memberikan perlindungan yang lebih baik dibandingkan pemberian vaksin yang sama kepada Entok yang ditantang dengan virus heterolog HPAI H5N1 keturunan Gs/GD (clade 1), dan serupa dengan itu pula vaksinasi dosis tunggal tidak memberikan perlindungan optimal pada itik domestik maupun angsa domestik dari uji tantang virus HPAI H5N1 [218]. Ditambah lagi, penggunaan vaksin inaktif pada umur satu hari (DOC), dengan dan tanpa antibodi maternal, gagal melindungi terhadap uji tantang virus HPAI H5N1 [53, 54, 102]. Di lapangan, vaksinasi dosis tunggal jarang dapat memberikan perlindungan yang cukup untuk semua spesies unggas, kecuali mungkin pada ayam pedaging yang berumur pendek yang tidak mempunyai antibodi maternal. Paling minimal diperlukan dua dosis vaksinasi untuk ayam pedaging dengan antibodi maternal terhadap virus AI, dan dua atau lebih dosis vaksin akan diperlukan untuk kalkun pedaging, ayam, kalkun dan itik breeder dan petelur yang memiliki umur produksi panjang untuk memberikan imunitas yang cukup sepanjang umur produksinya. Sebagai contoh di Italia infeksi klinis pada flok kalkun yang sudah divaksin telah dihubungkan dengan titer antibodi yang rendah, dan vaksinasi dalam beberapa dosis telah terindikasi diperlukan untuk memproduksi respons imun yang dapat bertahan untuk seluruh siklus produksi (Giovanni Ortali, komunikasi personal 14 November 2003).
Terdapat kurangnya pengalaman dalam penggunaan vaksin untuk burung chukar partridge, burung puyuh, ayam guinea, ratite, dan unggas di kebun binatang. Untuk unggas kebun binatang, penelitian di Perancis, Spanyol, dan negara-negara Uni Eropa (UE) lainnya mengidentifikasi bahwa 71-81.5% unggas dari takson yang beragam memiliki titer HI protektif (GMT ≥ 32) setelah satu kali imunisasi, akan tetapi untuk meningkatkan jumlah dan proteksi yang berlangsung lama, diperlukan minimal dua dosis vaksinasi, dan kemudian booster setelah 6 bulan mungkin juga diperlukan [96]. Protokol vaksinasi harus dibuat dengan membaurkan pengalaman di lapangan dengan data laboratoris untuk menciptakan program yang akan dapat memastikan terlaksananya vaksinasi yang tepat untuk unggas, yang akan memberikan imunitas individu dan populasi. Protokol itu dapat memasukkan vaksin AI inaktif maupun vaksin hidup dengan rekombinan vektor.
Jika dilihat dari dasar populasi di lapangan dalam wilayah geografis yang telah ditentukan, vaksinasi dapat mengurangi jumlah wabah dan penyebaran virus AI. Sebagai contoh, penggunaan program vaksinasi AI pada unggas di pedesaan, terutama dengan kombinasi bersama vaksinasi ND mengurangi insidensi HPAI H5N1 dan ND di Indonesia berdasarkan program surveilans partisipatif [27, 90, 108, 188, 247, 248, 279, 375]. Akan tetapi tingkat cakupan vaksinasi dalam populasi penting untuk menghentikan transmisi dan mengurangi persebaran. Sedikitnya 60% unggas dalam populasi haruslah kebal dalam rangka untuk mengurangi transmisi untuk dapat di deteksi, dengan reduksi optimal terlihat ketika tingkat imunisasi sebesar lebih dari 80% telah tercapai [31]. Virus HPAI H5N1 keturunan Gs/GD tetap endemik di Mesir meskipun telah dilakukan kampanye vaksinasi nasional, akan tetapi analisis titer HI protektif di lapangan menunjukkan bahwa imunitas populasi efektif tidak terjadi pada unggas, karena hanya 33.2%, 36,4% dan 46% dari unggas yang disurvei memiliki titer protektif [33, 369, 370], menjadikan imunitas kelompok yang efektif di Mesir menjadi sulit dipahami.
Prioritas vaksinasi
Saat mendesain sebuah program vaksinasi dengan sumber daya yang terbatas, sektor dan spesies untuk penggunaan vaksin AI harus didasarkan pada nilai ekonomis dan analisa risiko. Sebuah algoritma sederhana untuk penggunaan vaksin dan jumlah aplikasi yang semakin menurun haruslah diurutkan sebagai berikut:
- Unggas dan burung lain dalam kompartemen, sektor atau situasi berisiko tinggi dalam kondisi wabah, menggunakan vaksin supresor jika stamping out tidak bisa dengan cepat dilaksanakan.
- Unggas langka di penangkaran seperti yang berada dalam koleksi taman zoologi sebagai salah satu upaya pencegahan saat risiko masuknya virus AI sedang tinggi.
- Stok genetik unggas yang sangat berharga seperti pure lines (garis keturunan murni), ras unggas heritage (ras unggas warisan leluhur) [148], atau grandparent stock dimana nilai setiap individu sangat berharga dan saat dimana risiko masuknya virus AI ke dalam populasi sangat tinggi.
- Unggas dengan masa hidup yang panjang, seperti ayam petelur atau parent breeder dalam wilayah endemis
- Unggas penghasil daging.
Biosekuriti selama vaksinasi
Setiap pergerakan orang, peralatan atau suplai di dalam atau luar peternakan menciptakan risiko pemasukan atau penyebaran virus AI antar wilayah dan tempat. Selama kampanye vaksinasi berjalan, biosekuriti dengan level tertinggi harus dijalankan dalam rangka mengurangi risiko tersebarnya virus di lapangan oleh tim vaksinasi ketika mereka berpindah satu tempat ke tempat lainnya. Bahaya tersebut dilaporkan dalam upaya eradikasi yang dilakukan di tahun 1970 selama epidemi Newcastle Disease di California. Tim vaksinasi terkait secara epidemiologi dengan perpanjangan terjadinya wabah karena menyebarkan virus di lapangan dari peternakan ke peternakan [144]. Akan tetapi, setiap lalu lintas di dalam dan di luar peternakan, seperti misalnya pengunjung (keluarga, teman, dst.), pegawai peternakan, tim pembawa peralatan, tim penangkap hewan, truk pakan, dan seterusnya membawa risiko menyebarkan virus AI [366].
Surveilans
Flok yang sudah divaksin harus dimonitor untuk menentukan apakah vaksinasi telah memproduksi kekebalan flok yang mencukupi, untuk menentukan kekebalan telah berkurang secara signifikan sehingga memerlukan vaksinasi booster, dan untuk menentukan apakah flok tersebut telah terinfeksi oleh virus AI di lapangan. Monitoring semacam itu dapat dilakukan dengan metode virologi dan/ atau serologi, tergantung tujuan dan kebutuhan spesifik sebuah program pengendalian AI.
Penilaian vaksinasi dan imunitas
Pengujian laboratorium dapat digunakan untuk menilai efektivitas vaksinasi (misalnya jumlah unggas atau persentase dalam populasi yang sebelumnya telah divaksinasi dengan tepat dan baik dengan vaksin yang poten) dan memberikan estimasi perlindungan lapangan (misalnya menentukan persentase dari populasi yang terlindungi dari virus yang bersirkulasi di lapangan). Pertama, penggunaan antigen yang homolog dengan vaksin dalam pengujian serologi HI adalah sebuah cara efektif untuk menilai kesuksesan vaksinasi pada ayam melalui penilaian produksi respons imun melawan vaksin [139, 344]. Yang kedua, imunitas humoral yang diproduksi untuk melawan protein HA sesuai sub tipe spesifiknya, seperti yang diukur melalui pengujian HI atau uji netralisasi virus menggunakan virus yang bersirkulasi di lapangan, memberikan pengukuran prediksi positif terhadap perlindungan yang diberikan vaksin pada setiap individu unggas dan bahkan mendeteksi imunitas protektif dalam flok atau populasi jika evaluasi dilakukan secara kolektif.
Saat menggunakan metode pengujian terstandarisasi, hasil serologi dapat dibandingkan dengan hasil penelitian perlindungan in-vivo untuk menentukan titer minimal perlindungan serologi dan untuk menentukan titik dimana vaksinasi booster harus dilakukan untuk mencapai respons imun sekunder atau booster yang optimal. Akan tetapi, penentuan titer proteksi minimal tunggal untuk semua spesies unggas berdasarkan hasil uji HI tidak mungkin dilakukan karena titer HI akan bervariasi tergantung pada prosedur uji HI yang dilakukan, spesies dan ras unggas yang diuji, durasi waktu pengukuran pasca vaksinasi dan tipe vaksin dan adjuvan yang digunakan. Pada studi eksperimental yang sebelumnya yang menggunakan vaksin AI H5 inaktif pada ayam white leghorn SPF yang diuji tantang dengan virus HPAI H5, tercegahnya kematian dihubungkan dengan titer antibodi geometrik HI rata-rata (GMT) sebesar ≥ 8 (344) atau ≥ 10 [323], sementara pencegahan replikasi orofaring dan pendedahan virus tantang terlihat pada sebagian besar ayam tervaksin dengan GMT antibodi HI sebesar ≥ 40 [182]. Tercegahnya pendedahan virus melalui orofaring secara total hanya terlihat pada ayam tervaksin dengan GMT antibodi HI sebesar ≥ 128 [182]. Mengembangkan dan mengimplementasikan standar potensi serologis minimum akan memastikan bahwa antigen dengan jumlah cukup yang terkandung dalam vaksin unggas AI komersial dapat memberikan perlindungan respons imun protektif di lapangan untuk vaksin-vaksin yang mengandung virus yang memiliki kecocokan antigenik dekat dengan strain yang bersirkulasi di lapangan, akan tetapi jika vaksin dan virus yang ada di lapangan berbeda secara antigenik maka perlindungan serologi yang diberikan vaksin menjadi kurang dapat diprediksi, sehingga mungkin memerlukan titer antibodi yang lebih tinggi untuk dapat memprediksi proteksi. Lebih jauh lagi, titer HI protektif biasanya lebih rendah pada kalkun, itik dan angsa pedaging dan breeder komersial dibandingkan dengan ayam petelur SPF.
Identifikasi hewan terinfeksi di dalam populasi yang sudah divaksinasi
Flok yang sudah divaksinasi harus diawasi terhadap infeksi AI dalam rangka menilai kesuksesan program vaksinasi dan untuk mengidentifikasi infeksi dalam flok tervaksin yang harus segera di eliminasi (misalnya dengan sistem DIVA). Secara konsep, prinsip DIVA dalam proses monitoring dapat dicapai dengan berbagai metode surveilans virologis dan atau serologis saat menggunakan uji yang sensitif dan tepat untuk sampel yang diambil (Gambar 15.5) [333]. Prinsip dasar untuk surveilans AI tersebut tersedia melalui OIE [314, 315].
Surveilans virologi
Cara paling akurat dan langsung untuk mengidentifikasi infeksi virus AI adalah melalui deteksi virus dalam flok atau populasi tervaksin. Sistem surveilans yang paling sederhana dan paling sensitif melibatkan monitoring populasi sangat rentan dalam populasi tervaksin (konsep biosensor), karena sebagian besar unggas tervaksin akan menjadi kebal dan karena itu resistan terhadap infeksi virus AI (membuat sebagian besar dari unggas tervaksin dan unggas yang asimptomatik menjadi subyek yang buruk untuk koleksi sampel saat ingin mendeteksi virus dan menentukan isolasi). Karena itulah program surveilans harus menekankan pada surveilans klinis atau sindromik terhadap individu sangat rentan di dalam populasi tervaksin sebagai berikut:
- Menandai secara permanen atau mengidentifikasi unggas sentinel yang tidak divaksin yang berasal dari sumber eksternal yang aman secara biologi atau yang didapat dari sumber flok, akan tetapi dengan sengaja tidak divaksin; atau
- Sub populasi dari unggas yang tidak ditandai yang tidak mengembangkan kekebalan protektif karena individu unggas tersebut tidak dapat ditangkap pada saat ingin divaksin sehingga tidak divaksinasi, individu unggas yang divaksin akan tetapi tidak divaksin dengan tepat (misalnya vaksin tidak diberikan melalui jalur yang benar), atau karena alasan lainnya dimana unggas berhasil ditangkap dan divaksin akan tetapi tidak mengembangkan kekebalan.
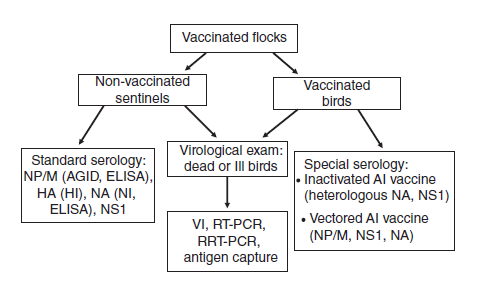
Gambar 15.5 Diagram alur untuk surveilans virologi dan serologis pada flok tervaksin untuk deteksi infeksi virus AI (misalnya strategi DIVA). Sumber: David E. Swayne.
Pada wilayah yang terdampak HPAI, kematian individu unggas yang sangat rentan AI seperti ayam atau unggas gallinaseus lainnya memiliki peranan dalam surveilans sindromik sebagai sistem peringatan awal klinis atau yang disebut ‘biosensor’ untuk identifikasi cepat kasus-kasus yang berpotensi dilakukan pengujian AI. Akan tetapi, untuk LPAI, infeksi yang terjadi tidak selalu menyebabkan kematian, dan pengujian seluruh unggas sakit bersama dengan unggas yang mati seluruhnya harus dimasukkan ke dalam surveilans sindromik. Penggunaan kematian sebagai biosensor dalam flok tervaksin telah banyak diperlihatkan dengan jelas melalui studi eksperimental sebagai berikut. Pertama, unggas tervaksin yang tidak mengembangkan imunitas (seperti yang ditunjukkan oleh rendahnya level antibodi HI) rentan terhadap infeksi dan mati setelah terpapar virus HPAI [238], dan kedua, unggas tidak tervaksin yang ditempatkan berkontak dengan unggas yang telah divaksin dan diuji tantang dengan virus AI melalui intranasal berlaku sebagai sentinel dengan deteksi sekresi virus HPAI (Tabel 15.4) [333]. Dalam program vaksinasi LPAI H7N2 Connecticut tahun 2003-2005, surveilans yang sukses mendeteksi bukti infeksi dilakukan melalui kombinasi pengujian serologis kematian per harinya pada unggas tervaksin dan pengujian serologis pada unggas sentinel [46].
Akan tetapi, surveilans serologis hanya harus dilakukan jika sampel dengan jumlah mencukupi dan tepat telah dikoleksi dari sub populasi unggas yang tepat dan diuji dengan metodologi laboratoris yang tepat pula. Sebagai contoh, sampling unggas sakit atau mati, dimana biasanya terdapat ekskresi virus dalam jumlah banyak dari orofaring dan/atau kloaka, telah menunjukkan deteksi virus yang konsisten, baik LPAI maupun HPAI dengan menggunakan isolasi virus, RRT-PCR, atau deteksi antigen dengan berbagai metode uji ELISA penangkap antigen [314]. Akan tetapi, sampling unggas terinfeksi yang bersifat pre klinis, dimana pendedahan virus masih rendah, hanya akan mendeteksi virus jika menggunakan metode yang paling sensitif (misalnya isolasi virus dan RRT-PCR). Penggunaan uji penangkap antigen telah menunjukkan 79-80% sensitivitas dan 99-100% sensitivitas dalam mendeteksi virus dalam sampel yang berasal dari ayam yang sakit atau mati karena virus LPAI [91, 283]. Uji RRT-PCR memiliki 95% sensitivitas dan 99% spesifisitas untuk data yang sama. Karena itulah, untuk meningkatkan sensitivitas deteksi unggas terinfeksi, koleksi dan pengujian rutin harian unggas yang mati atau yang terlihat sakit harus digunakan untuk memonitor secara virologi kelompok unggas yang sudah divaksin untuk menjaga kemungkinan infeksi virus AI, dan uji virologi yang paling sensitif harus dipergunakan. Sebagai contoh surveilans virologi yang dilakukan di Mesir tahun 2007-2008, yang melibatkan unggas komersial maupun unggas belakang rumah mengidentifikasi virus AI di 35 peternakan dari 3610 peternakan (0.97%) pada tahun 2007 dan 27 peternakan dari 8682 peternakan (0.31%) pada tahun 2008 khusus peternakan unggas komersial, dan 246 peternakan dari 816 peternakan (30%) pada tahun 2007 dan 89 dari 1723 peternakan (5.2%) khusus flok unggas belakang rumah. Hal ini mengindikasikan rendahnya level infeksi virus dalam populasi yang sudah divaksin [93, 94, 283, 408]. Akan tetapi virus HPAI H5N1 bersifat endemik di Mesir dikarenakan rendahnya capaian vaksinasi nasional [134] dan penggunaan vaksin dengan kecocokan antigenik yang rendah [338, 339].
Surveilans serologi
Monitoring serologis memberikan pandangan sejarah infeksi dalam satu flok, yang dapat dipergunakan untuk menilai kesuksesan program vaksinasi, akan tetapi tidak dapat digunakan untuk mengidentifikasi flok yang terinfeksi secara aktif. Surveilans virologi diperlukan untuk menentukan apakah flok saat ini sedang terinfeksi dan risiko apa, jika ada, yang dimiliki oleh flok sebagai reservoir virus, dan risiko transmisinya. Berbagai sistem surveilans serologis telah dijelaskan, masing-masingnya memiliki keuntungan dan kerugian spesifik, akan tetapi tidak ada hanya satu sistem saja yang akan berguna untuk semua jenis vaksin dan semua situasi di lapangan. Seluruh sistem surveilans serologis didasarkan pada produksi antibodi yang berbeda melawan beragam protein virus setelah infeksi virus AI jika dibandingkan dengan vaksinasi (Tabel 15.7).

Tantangan utama surveilans serologis adalah identifikasi antibodi pada unggas terinfeksi yang berbeda dengan yang ada pada unggas yang tervaksin AI. Antibodi melawan protein NP/M yang terdeteksi dengan uji agar gel immunodiffusion (AGIS) atau ELISA, terdapat pada semua unggas yang telah terinfeksi dengan sub tipe virus AI apa saja, dan tidak dapat digunakan sebagai uji diferensial untuk membedakan unggas yang terinfeksi dengan unggas yang telah tervaksin dengan virus AI inaktif. Akan tetapi, beberapa sistem dapat mengidentifikasi infeksi virus AI dalam populasi tervaksin.
Unggas sentinel
Sejak akhir tahun 1970-an di Minnesota, unggas sentinel telah berhasil digunakan untuk deteksi serologis terhadap infeksi LPAI di dalam flok kalkun yang telah divaksinasi vaksin AI inaktif [132, 172]. Sistem sentinel telah dikembangkan untuk digunakan pada wabah LPAI lain pada kalkun dan ayam di Amerika Serikat dan di wilayah lainnya di seluruh dunia [138]. Secara teori, deteksi antibodi melawan kesepuluh protein virus adalah indikasi adanya infeksi, dan sentinel dapat digunakan sebagai langkah mitigasi untuk mendeteksi ‘infeksi senyap’ dalam flok yang telah divaksinasi (Tabel 15.7) [115, 217, 283]. Akan tetapi, sentinel tersebut harus ditandai atau diidentifikasi secara permanen sehingga sistem surveilans dapat dikendalikan dengan baik. Pertama, hal ini memungkinkan mudahnya observasi unggas rentan dalam flok untuk surveilans gejala penyakit (syndrome surveilllance), yaitu observasi gejala klinis atau kematian yang akan memicu investigasi AI). Yang kedua, hal ini memungkinkan akses mudah terhadap unggas untuk pengambilan sampel cepat untuk uji serologis ataupun virologis. Dan yang terakhir, hal ini mencegah sabotase tidak etis dan melanggar hukum dari seseorang tidak bertanggung jawab yang berharap dapat merubah hasil pengujian dengan mengganti unggas sentinel dengan unggas lain. Pada umumnya, pemerintah negara bagianlah yang mengelola program unggas sentinel. Selama wabah LPAI H7N1 yang terjadi di Italia tahun 2000-2002, 1% unggas dalam flok tervaksin dipertahankan sebagai unggas sentinel, dan minimal 10 ekor unggas per kandang diambil darahnya setiap 45 hari sekali untuk mengetahui infeksi melalui uji serologis [274]. Unggas sentinel harus diidentifikasi dengan menggunakan sistem penanda elektronik atau penanda visual yang tidak dapat diubah yang dapat mengidentifikasi setiap unggas sebagai sentinel. Pengelolaan sentinel lebih mudah pada kandang baterai seperti pada kandang ayam petelur, karena setiap unggas dapat dengan mudah dikenali dan diletakkan di kandang yang sudah ditandai yang dapat dipetakan secara fisik untuk memudahkan observasi yang cepat dan rutin. Unggas yang dibesarkan di dengan lantai kandang yang rata tanah (floor-caging) akan lebih sulit untuk dikelola, dan mungkin memerlukan pengembangan dan penggunaan beberapa identifikasi visual kreatif selain sistem penomoran permanen yang sudah ada, seperti misalnya menempatkan sentinel dalam kandang rata tanah yang disebarkan dalam kandang unggas, atau untuk unggas yang diumbar, identifikasi visual dengan menggunakan penanda pada sayap yang berukuran besar dan berwarna terang, memberikan cat pada bulu untuk ayam yang berwarna putih, atau menggunakan ras yang berbeda warnanya dari burung tervaksinasi sebagai sentinel.
Unggas yang sudah divaksinasi
Sebagian besar vaksin AI yang digunakan untuk unggas adalah vaksin AI inaktif. Karena proteksi bersifat spesifik sesuai sub tipe HA-nya, vaksin AI inaktif tidak memerlukan kecocokan sub tipe NA antara vaksin dan virus di lapangan untuk dapat memberikan perlindungan [59]. Pada pertengahan tahun 1980-an dan 1990-an, deteksi serologis NA heterolog diajukan sebagai metode untuk mengidentifikasi unggas terinfeksi dalam populasi unggas yang sudah di vaksinasi [16]. Konsep ini digunakan dengan sukses selama wabah LAPI H7N1 di Italia selama tahun 2000, dan di tahun-tahun berikutnya melawan virus LPAI H5 dan H7 [16, 99, 304]. Pada dasarnya vaksin AI memiliki sub tipe HA yang sama akan tetapi memiliki NA yang berbeda dengan virus AI di lapangan, kemudian memungkinkan berkembangnya antibodi protektif terhadap HA, akan tetapi unggas yang telah divaksin tidak memiliki antibodi melawan sub tipe NA di lapangan kecuali mereka juga terinfeksi (Tabel 15.7). Akan tetapi, untuk menggunakan strategi ini sebagai program vaksinasi preventif, bank vaksin yang sudah ada diperlukan dengan memiliki minimum dua sub tipe NA berbeda untuk setiap vaksin sub tipe HA, vaksin harus memiliki sub tipe NA yang jarang ada, seperti misalnya N5, atau vaksin dapat menggunakan NA sintetik dari virus influenza B dalam virus influenza A regeneratif [57 – 60, 62, 69, 70]. Bibit strain vaksin bisa saja merupakan virus LPAI dari wabah, dapat dibuat dengan teknis reasortansi klasik [20, 113], atau dapat diproduksi dengan sistem rg [20, 316]. Berbagai vaksin AI inaktif untuk unggas dan manusia telah dikembangkan menggunakan HA H5 atau H7 yang berasal dari isolat di lapangan, akan tetapi dibuat untuk mengandung banyak sub tipe NA berbeda (misalnya N1-9). Di Amerika Serikat, selama pertengahan tahun 2000-an, USDA/APHIS memasukkan dalam bank vaksin, vaksin AI unggas yang hanya untuk melawan sub tipe H5 dan H7 saja, masing-masing dengan dua sub tipe NA berbeda, akan tetapi bank vaksin ini tidak dilanjutkan di tahun 2010, dengan menyebutkan berakhirnya kontrak dan berpotensi rendah untuk digunakan. Akan tetapi setelah wabah virus HPAI H5N8/H5N2 keturunan GS/GD dari clade 2.3.4.4 di Amerika utara, bank vaksin AI yang baru dikembangkan lagi. rHVT-H5 mengandung insersi gen HA clade 2.2 dari virus A/swan/Hungary/4999/2006 (H5n1) dan rdVEE-H5 mengandung insersi gen HA clade 2.3.4.4 dari virus A/gyrfalcon/Washington/41088/2014 (H5N8), dengan tempat pembelahan HA diubah untuk patogenitas rendah, pertama kali dibeli. Selain itu, bibit strain vaksin H5 inaktif telah dikembangkan menggunakan clade 2.3.4.4. dari gen HA yang berasal dari virus A/gyrfalcon/Washington/41088/2014 (H5N8) dengan tempat pembelahan HA yang diubah untuk patogenitas rendah, dan tujuh segmen gen lain dari strain vaksin PR8. Penggunaan gen PR8 N1 dalam vaksin akan memungkinkan identifikasi infeksi virus HPAI H5N8 dan H5N2 dalam flok tervaksin dengan deteksi antibodi N8 dan N2.
Antibodi untuk sembilan sub tipe NA spesifik dalam strategi DIVA dapat di deteksi dengan menggunakan berbagai pengujian, meliputi inhibisi neuraminidase [97, 191, 205, 222, 317, 356, 384, 392], imunofloresen tidak langsung/indirect [10, 152], atau uji ELISA [60, 0]. Akan tetapi, sistem NA heterolog harusnya tidak dipandang sebagai satu-satunya sistem DIVA serologis, karena banyak vaksin AI inaktif menggunakan strain yang mengandung sub tipe NA yang homolog dengan virus di lapangan, karena itulah antibodi yang homolog dengan NA tidak dapat digunakan untuk mengidentifikasi infeksi. Studi eksperimental telah dilakukan yang mendemonstrasikan penggunaan uji serologis untuk mendeteksi antibodi terhadap protein NS1 dan M2e untuk mengidentifikasi infeksi pada unggas yang telah divaksinasi dengan vaksin AI inaktif [123, 208]. Respons serologi terhadap protein NS1 telah diajukan sebagai tes pembeda/diferensiasi karena protein NS1 hanya diproduksi dalam sel terinfeksi, dan tidak termasuk dalam bagian virus AI yang sudah lengkap/packed [11, 184, 219, 351, 384]. Pada empat studi yang terpisah, antibodi melawan NS1 tidak terlihat pada ayam atau kalkun yang telah diimunisasi dengan vaksin eksperimental atau vaksin AI inaktif komersial kecuali jika mereka telah terinfeksi virus AI [11]. Akan tetapi, baik uji serologis NA maupun NS1 untuk mendeteksi infeksi dalam populasi tervaksin hanya memiliki sensitivitas yang moderat (63-64%) untuk mendeteksi infeksi yang semacam itu [11, 364, 384, 405]. Uji serologis M2e diharapkan memiliki sensitivitas serupa untuk mendeteksi infeksi pada populasi tervaksin daripada uji serologis NA dan NS1. Vaksinasi dengan satu, dua atau tiga dosis vaksin komersial tidak memproduksi antibodi untuk M2e , akan tetapi ketika di uji tantang, antibodi yang seperti itu terlihat, terutama 6 minggu atau sesudahnya setelah vaksinasi terakhir.
Strategi surveilans sederhana untuk mendeteksi infeksi pada unggas sudah divaksinasi yang terinfeksi AI melibatkan penggunaan vaksin AI yang dibuat menggunakan bioteknologi yang hanya mengandung protein HA, seperti protein HA yang diekspresikan in-vitro atau in-vivo atau vaksin DNA HA, diikuti dengan penggunaan uji serologis yang terstandarisasi. Unggas yang telah divaksin AI ini memiliki antibodi protektif hanya untuk protein HA spesifik dalam vaksin, akan tetapi tidak ada antibodi untuk melawan protein virus lainnya. Karena itulah, unggas yang telah divaksin AI akan menunjukkan hasil positif jika di uji dengan uji HI spesifik, akan tetapi menunjukkan hasil negatif terhadap antibodi NP/M dalam pengujian AGID standar atau uji ELISA komersial yang digunakan seluruh dunia kecuali jika hewan telah terinfeksi. Sebagai contoh, ayam yang divaksinasi dengan vaksin rFPV-H5 pada umur 1 hari/DOC memiliki antibodi pada minggu ke 3 untuk melawan HA homolog, akan tetapi negatif antibodi untuk melawan NP/M sesuai dengan yang diukur dengan uji AGID [371]. Setelah infeksi AI, beberapa ayam mengembangkan antibodi untuk melawan NP/M sesuai dengan yang diukur dengan uji AGID. Semua strategi DIVA pada unggas yang divaksinasi harus diinterpretasikan sebagai pengujian terhadap flok dan bukan pengujian individual karena vaksinasi yang tepat akan meningkatkan resistensi terhadap infeksi pada sebagian besar unggas [335].
Kesimpulan
Akan tetapi, hanya vaksin inaktif AI rFPV-H5, rHVT-H5, dan rNDV-H5 yang telah diberikan izin dan digunakan di lapangan di berbagai negara di seluruh dunia. Dalam sejarahnya, vaksin AI inaktif telah menggunakan bibit strain virus yang terutama didasarkan pada wabah LPAI, dan kadang-kadang dari wabah HPAI. Bibit strain semacam itu secara umun telah bersifat protektif tergantung sub tipe HA nya dan hanya memerlukan perubahan strain benih yang lebih jarang daripada yang telah diperlukan untuk vaksin influenza A manusia musiman. Dalam waktu 5 tahun terakhir, beberapa bibit strain telah diproduksi dengan teknologi genetika terbalik menggunakan gen HA (dengan situs pembelahan berpatogenitas rendah) dan gen NA dari virus penyebab wabah dan enam gen internal dari strain vaksin influenza A dengan pertumbuhan tinggi. Vaksin AI telah digunakan dalam program vaksinasi darurat, rutin dan preventif.
Beberapa permasalahan yang penting dihubungkan dengan penggunaan vaksin AI di lapangan:
- Penggunaan vaksin AI harus merupakan bagian program pengendalian AI yang komprehensif,
- Strain vaksin haruslah menggunakan sub tipe HA yang sama dan harus bersifat protektif untuk spesies target berdasarkan studi in-vivo melawan virus yang bersirkulasi di lapangan,
- Vaksin harus memiliki jumlah HA yang mencukupi (sistem vaksin inaktif atau vaksin HA yang diekspresikan in-vitro dengan titer minimum dosis 1-5 µg HA/dosis) atau titer virus hidup yang cukup (vaksin vektor) yang cukup untuk memproduksi respons imun protektif,
- Sistem vaksin HA inaktif atau yang diekspresikan secara in-vitro harus diemulsifikasikan di dalam sistem adjuvan minyak yang baik;
- Pembuatan vaksin AI harusnya terstandarisasi dalam rangka memproduksi batch vaksin yang konsisten dan efektif;
- Harus ditetapkan prosedur untuk penyimpanan, distribusi dan pemberian vaksin yang baik;
- Praktik biosekuriti harus ditetapkan untuk melindungi dan melindungi petugas vaksinasi atau petugas lainnya dari penyebaran tidak sengaja virus di lapangan;
- Sistem surveilans serologis atau virologis harus ada untuk menentukan apakah vaksin telah berhasil menimbulkan imunitas protektif, dan untuk memonitor populasi hewan tervaksin dari kemungkinan sirkulasi virus di lapangan (misalnya DIVA);
- Strategi keluar dari penggunaan vaksin gawat darurat harus dikembangkan untuk mencegah vaksinasi menjadi program rutin yang terkait dengan endemisitas virus AI.
Vaksin AI harus secara periodik di evaluasi dalam rangka menentukan apakah mereka masih efektif melawan strain virus di lapangan, dan jika tidak produk tidak lagi bersifat protektif, seperti yang telah terjadi di lapangan setelah bersirkulasinya virus AI pada unggas secara berkepanjangan, strain virus harus diganti. Persyaratan untuk pemberian izin vaksin AI bervariasi di setiap negara, tergantung pada persyaratan spesifik dari otoritas veteriner nasional dengan memperhatikan kriteria keamanan (safety), kemurnian (purity), tingkat poten (potency), dan persetujuan label untuk spesies, umur dan rute pemberian.
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.

