Oleh: Thomas M. Chambers
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Tujuan Vaksinasi
Tujuan utama vaksinasi adalah proteksi terhadap penyakit. Untuk pemilik kuda dan untuk semua pihak yang tergantung pendapatan sehari-harinya kepada kuda, proteksi terhadap penyakit menjadi sangat penting. Akan tetapi terdapat berbagai faktor yang mempengaruhi penggunaan vaksin dan beberapa tujuan strategisnya.
Kuda berpindah lintas batas internasional, seperti juga penyakitnya. Terdapat beberapa contoh masuknya virus EIV kedalam populasi kuda naif yang berakibat tingginya morbiditas dan mortalitas dan gangguan berat terhadap perdagangan terkait kuda, meskipun untuk virus itu sendiri kejadian tersebut termasuk jarang terjadi, meskipun dalam kondisi eksperimental sekaligus. Setiap negara berbeda dalam peraturan terkait tentang status vaksinasi kuda impor. Negara-negara dan wilayah yang dianggap bebas equine influenza (New Zealand, Australia, Afrika Selatan, Hong Kong) memiliki persyaratan ketat untuk waktu vaksinasi booster terakhir kuda impor, sedangkan negara-negara seperti amerika Serikat dimana equine influenza bersifat enzootik tidak memiliki persyaratan semacam itu. Selain itu, telah dikonfirmasi bahwa beberapa wabah di masa lalu berasal dari masuknya virus hidup melalui kuda impor yang telah divaksinasi. Kuda dengan kekebalan parsial dapat menjadi terinfeksi secara subklinis meskipun masih mendedahkan virus dan mungkin menjadi sumber penularan tanpa diketahui. Karena itu tujuan teoritis dari vaksinasi adalah kekebalan “steril” (pencegahan infeksi dan pendedahan virus demikian juga pencegahan gejala klinis).
Anak kuda muda, terutama yang baru lahir, jika kurang proteksi antibodinya maka berada dalam resiko tinggi morbiditas dan mortalitas karena infeksi equine influenza. Karena itu tujuan lain dari vaksinasi adalah untuk meningkatkan titer antibodi pada induk kuda bunting, sehingga antibodi yang didapat secara maternal akan mampu melindungi anaknya. The American Association of Equine Practitioners (AAEP) merekomendasikan vaksinasi atau booster induk kuda bunting untuk diselesaikan 4 – 6 minggu sebelum melahirkan (www.aaep.org/-i-166.html) [132]. Antibodi maternal efektif untuk diandalkan seperti didemonstrasikan di negara-negara dimana flu kuda bersifat enzootik, induk kuda telah divaksinasi dengan baik dan anaknya jarang terkena influenza. Kuda memiliki plasenta lapis enam, sehingga antibodi maternal diberikan secara eksklusif melalui kolostrum, dan anak kuda yang gagal meminum kolostrum dalam jumlah yang cukup (karena kegagalan transfer pasif) berada dalam resiko.
Ketika equine influenza didiagnosa pada suatu peternakan atau pacuan yang memuat banyak kuda, praktisi terkadang memilih untuk memvaksinasi kuda yang tidak terdampak untuk meningkatkan imunitasnya menghadapi wabah. Terdapat bukti bahwa hal ini efektif jika kuda telah divaksinasi pertama (tidak naif) dan jika jarak antara vaksinasi booster dan kejadian terpapar virus infeksius cukup untuk memungkinkan produksi antibodi baru (sekitar 7 hari) [7]. Perpanjangan dari konsep ini adalah ‘vaksinasi cincin’ untuk mencegah wabah menyebar. Hal ini adalah bagian dari strategi pengurungan yang diadopsi oleh Pemerintah Australia untuk membatasi wabah equine influenza tahun 2007 dan kemudian mengeradikasi virus [106].
Kekebalan kelompok (herd immunity) merujuk kepada konsep bahwa sejumlah proporsi mencukupi yang hewan dalam populasi yang kebal terhadap penyakit infeksius, agen penyakit berkurang kemungkinannya untuk menemukan hospes rentan dan karena itu berkurang pula kemungkinannya untuk masuk ke dalam kawanan hewan. Pada kasus flu kuda bukti-bukti menunjukkan bahwa jika 70% dari kawanan kuda memiliki kekebalan penuh, maka hal ini sudah cukup memberikan kekebalan kelompok [6].
Kriteria dan model untuk mengukur efisiensi dan proteksi
Perizinan vaksin EIV memerlukan demonstrasi bahwa vaksin tersebut “sesuai dengan tujuannya’, yaitu dapat digunakan pada kuda dan efektif melawan penyakit dan infeksi disebabkan virus EIV. Pada awal dekade pertama dalam sejarah vaksin EIV, demonstrasi efikasi dapat berdasarkan imunogenitas (misalnya kuda yang menerima vaksin akan memproduksi antibodi). Pada saat ini, baik di Amerika Serikat maupun Eropa, otoritas regulator – US Department of Agriculture/Veterinary Services (USDA) dan European Medicines Agency (EMA) telah menerima validitas uji tantang eksperimental yang membandingkan kuda yang sudah divaksin dan tidak divaksin. Standar yang dipakai sebagaimana disebutkan dalam European Pharmacopoeia [3], bahwa terdapat perbedaan statistik yang signifikan pada perbedaan dalam gejala klinis dan ekskresi virus antara yang divaksin dan kontrol. Tidak ada persyaratan spesifik untuk ambang batas yang diizinkan pada kedua kategori tersebut [135]. Vaksin akan dilabeli sebagai mampu mengurangi gejala klinis, tidak mencegah penyakit, dan/atau mampu mengurangi replikasi dan pendedahan virus EIV. untuk berbagai alasan yang nantinya akan lebih jauh didiskusikan dalam Bab ini, vaksin EIV yang sangat efektif dalam kondisi eksperimental lebih mungkin memiliki efektivitas terbatas dalam kondisi lapangan.
Uji tantang pada kuda yang sudah divaksinasi dengan virus tipe liar (wild type/wt) diperlukan untuk produk vaksin baru, atau untuk perubahan teknologi vaksin atau proses pembuatannya. Dibawah pedoman USDA terkait (Veterinary Services Memorandum No. 800.111, 2007), disebutkan pemasukan subtipe virus baru ke dalam vaksin juga memerlukan uji tantang eksperimental untuk bukti efektivitasnya. Uji tantang eksperimental telah diterima secara luas sebagai indikator efektivitas klinis dan virologis dari vaksin EIV dan sekarang digunakan sebagai sistem model untuk menyelidiki berbagai pertanyaan yang tidak diperlukan untuk perizinan. Uji tantang pada awalnya tampaknya memproduksi infeksi tapi tidak menimbulkan gejala klinis (J. T. Bryans, komunikasi personal), tetapi dengan persyaratan uji tantang eksperimental yang ada sekarang ini, kuda naif influenza dapat mengeluarkan gejala klinis. Penulis berpendapat bahwa virus dengan pasase rendah sangat penting, demikian juga perlunya dosis virus tantang yang tinggi (kira-kira 10 6 atau lebih dosis infeksius telur/EDS per kuda). Dosis ini mungkin lebih tinggi daripada paparan alami, tetapi memastikan munculnya konsistensi gejala klinis pada kuda rentan. Model digambarkan oleh Mumford dan kolega [83], dan secara fundamental serupa dengan Holmes dan kolega [56]. Kuda yang sudah vaksinasi dan kuda kontrol, atau lebih seringnya kuda poni, terpapar virus aerosol melalui inhalasi, baik melalui topeng muka atau di dalam tenda sementara. Virus EIV adalah agen dengan level Biosekuriti 2, meskipun pada umumnya tidak membahayakan untuk kesehatan manusia, karena itulah prosedurnya dilakukan pada fasilitas yang ditentukan yang memiliki peralatan dan prosedur di tempat untuk mencegah penyebaran virus aerosol keluar dari fasilitas tersebut. Hewan kontrol naif influenza menunjukkan gejala klinis influenza biasa yaitu pireksia sampai 41o C, dan leleran hidung (pada awalnya serosa kemudian mukopurulen), biasanya dimulai pada hari ke-2 pasca uji tantang, dan gejala-gejala ini dapat bertahan 1 – 7 hari. Kongesti paru-paru yang terdeteksi melalui auskultasi juga merupakan indikasi keparahan penyakit, meskipun kuantifikasinya sulit. Laboratorium penulis menggunakan skala 0 – 5 yang meningkat dari mengi/wheeze normal sampai mengi inspirasi ringan, mengi inspirasi terlihat jelas, mengi inspirasi dan ekspirasi, mengi ditambah coarse crackles, dan muffling karena terisi cairan pleuropneumonia. Meskipun begitu, skoring ini bersifat subjektif, dan dua paru-paru ataupun bagian yang berbeda dalam setiap paru-paru mungkin memiliki skor berbeda, karena itu sistem ini tidak digunakan secara luas. Leukopenia yang terjadi selama 5 hari, setelah uji tantang pada kuda poni rentan juga sudah dilaporkan [72]. Level troponin cardiac I dalam plasma telah diukur sebagai marker biokimia potensial untuk keparahan penyakit, tetapi hanya melaporkan peningkatan singkat, dan tidak ada korelasi keseluruhan yang ditemukan [34]. Pendedahan virus diukur dengan koleksi nasal atau nasofaring kemudian diuji tantang dengan telur ayam berembrio atau sel Madin-Darby canine kidney (MDCK), antigen virus dengan ELISA atau nukleoprotein virus [22], atau RNA virus menggunakan metode RT-PCR kuantitatif maupun non-kuantitatif [71]. Untuk tujuan ini, swab nasofaring telah menunjukkan sensitivitas yang lebih dibandingkan swab nasal, mendapatkan virus dengan titer lebih tinggi untuk jangka waktu yang lama [102]. Pendedahan virus hidup dimulai pada saat atau bahkan sebelum onset pireksia, mencapai puncaknya pada hari ke-2 atau ke-3 setelah uji tantang, dan secara berangsur-angsur menjadi tidak terdeteksi antara hari ke-6 dan 10 [102]. RNA virus mungkin tetap terdeteksi melalui PCR dalam periode lebih lama (sampai 35 hari dalam satu laporan) [112]. Jika dibandingkan dengan kuda control yang naif, kuda yang telah divaksinasi dengan efektif menunjukkan reduksi atau eliminasi gejala pireksia dan gejala lainnya, dan reduksi atau eliminasi pendedahan virus yang terdeteksi.
Model ini efektif dan serbaguna. Strain virus tantang dapat bervariasi untuk mendemonstrasikan proteksi vaksin terhadap virus heterolog maupun homolog hewan uji dapat ditantang pada waktu yang bervariasi setelah vaksinasi untuk menguji durasi kekebalan, dan model dapat mendiferensiasi antara proteksi klinis dan proteksi virologi. Kekurangannya adalah karena kuda berukuran besar dan biaya pemeliharaannya mahal, jumlah hewan coba per eksperimen pada umumnya rendah yang mengurangi kekuatan statistik dari eksperimen tersebut. Meman terdapat beberapa sumber kuda dan kuda poni naif tersedia untuk peneliti, dan kedua hewan tersebut memiliki sedikit atau tidak ada uniformitas genetik, yang terlihat jelas dengan fakta bahwa kuda dan kuda poni sering dipergunakan sebagai ganti yang lainnya. .
Untuk mengatasi permasalahan ini, model hewan kecil telah dikembangkan menggunakan mencit atau hamster untuk mengevaluasi immunogenisitas vaksin EIV [31, 85, 131]. Hamster adalah model yang lebih sensitif dibanding kuda poni untuk mendeteksi perbedaan antigenik berdasarkan baik titer antibodi maupun ekskresi virus dengan serum single radial hemolysis (SRH). Meskipun begitu, model hewan kecil tidak bermanfaat untuk evaluasi proteksi klinis, karena virus EIV H3N8 tipe liar tanpa adaptasi umumnya memproduksi gejala klinis minimal pada mencit dan hamster. Virus H7N7 equine adalah pengecualian, menyebabkan penyakit letal pada mencit tanpa adaptasi [63], tetapi dipercaya bahwa subtipe ini tidak lagi bersirkulasi pada kuda sehingga sekarang tidak lagi direkomendasikan untuk vaksin.
Disisi lain standar regulasi untuk perizinan vaksin EIV telah meningkat sejak abad ke-20. Otoritas regulasi nasional kini telah menerima bahwa penting dilakukan pembaharuan strain virus dalam vaksin EIV tanpa mempertimbangkan vaksin yang diperbaharui dibuat sebagai produk baru (tanpa perlu memasukkan persyaratan perizinan penuh produk baru). Tujuannya adalah bahwa proses pembaharuannya dapat secepatnya tercapai sehingga jika ada kejadian darurat atau ditemukannya strain virus EIV baru dapat menjadi tersedia dalam waktu 1 tahun, tidak menunggu 5 tahun atau lebih yaitu waktu yang biasanya diperlukan untuk pembaharuan strain baru. Menurut pedoman USDA (No. 800.111), jika pembaruan tidak merubah subtipe virus dalam vaksin atau proses pembuatannya, maka USDA tidak akan mempersyaratkan uji efektivitas dan keamanan di lapangan dalam skala penuh. Pembuat vaksin harus mampu menunjukkan bahwa vaksin yang sudah diperbaharui dapat menimbulkan respon imun yang serupa dengan formulasi awal vaksin pada hewan hospes target atau pada hewan model laboratorium yang sesuai (studi serologi dianggap cukup untuk kebanyakan pembaruan vaksin), meskipun perbedaan pendapat dalam regulasi nasional kadang muncul sebagai persyaratan pembaharuan strain bibit vaksin. Kesamaan respons imun pada umumnya ditunjukkan dengan membandingkan titer antibodi serum rata-rata. Saat membandingkan hasil beberapa trial yang berbeda yang dilakukan dalam waktu yang berbeda dan mungkin di bawah kondisi eksperimental yang berbeda pula, perbandingan sederhana seperti titer maksimum rata-rata dapat berpotensi menyesatkan. Helden dan koleda [54] telah merekomendasikan kalkulasi ‘area dibawah kurva’ untuk meningkatkan analisis semacam itu, tetapi efek nya tidak diketahui. Uji serologis spesifik yang digunakan akan dijelaskan di bagian berikutnya.
Pengujian dan strategi mendeteksi respons imun spesifik virus EIV terhadap vaksin dan infeksi
Teknik mengukur kekebalan tubuh jarang diaplikasikan kepada populasi kuda yang dimiliki sendiri, karena populasi ini pada umumnya terdesentralisasi baik dalam geografi maupun manajemen. Dimana vaksinasi EIV diperlakukan, misalnya oleh UK Jockey Club sejak 1981, dokumentasi vaksinasi biasanya diterima sebagai ganti sampel serum.
Jika surveilans penyakit rutin terhadap populasi menetap diperlukan (misalnya untuk status bebas dari penyakit), koleksi serum dan pengujian kuda sentinel naif influenza secara periodik dapat dilaksanakan. Namun, dikala populasi kuda terus berubah, aktif berpindah, dan seropositifnya besar, sero surveilans hanya memiliki sedikit nilai, dan surveilans serologis dengan pengujian swab nasofaring haruslah diberlakukan untuk mendeteksi infeksi. Surveilans ini dapat bertarget atau acak, akan tetapi idealnya harus memasukkan kedua elemen itu. Selain itu, kuda-kuda yang teramati sakit dengan gejala respirasi harus diuji untuk setiap kasus, tetapi hanya pada situasi pengecualian luar biasa jenis surveilans ini akan dilakukan. Setelah wabah tahun 2007 di Australia, untuk memperoleh status bebas dari infeksi, surveilans acak dengan mengkoleksi swab nasal didesain untukmendeteksi infeksi EIV pada setidaknya 1% dari fasilitas-fasilitas peternakan beresiko tunggu di wilayah zona kontrol (Amber) dan 1% kuda dalam properti terinfeksi. Pada fasilitas beresiko rendah dimana kuda-kuda telah divaksinasi tetapi tidak ada bukti adanya penyakit, surveilans serologis dapat dilakukan menggunakan uji DIVA (membedakan yang terinfeksi dengan yang divaksin), misalnya nukleoprotein-ELISA (lihat dibawah), karena satu-satunya vaksin yang diizinkan – rekombinan canarypox hemaglutinin, tidak mengekspresikan nukleoprotein (NP), dan surveilans didesain untuk memberikan kepercayaan 95% bahwa infeksi dalam 5% fasilitas akan terdeteksi. Akhirnya untuk mendapat pengakuan formal status bebas equine influenza oleh OIE, surveilans aktif dengan swab nasal didesain untuk mendeteksi EIV jika ada dalam 0.01 – 0.5% prevalensi. Total sebanyak 44.000 ekor kuda dalam lebih dari 9700 fasilitas di New South Wales dan Queensland dilakukan pengujian (sekitar 5% populasi kuda di negara-negara bagian ini) [77].
Pengujian serologis yang digunakan untuk mendeteksi antibodi spesifik virus equine EIV adalah uji inhibisi hemaglutinasi (HI) dan uji SRH. uji-uji ini pada dasarnya sama dengan yang digunakan untuk spesies lain. Uji silang laboratorium telah mendemonstrasikan bahwa untuk serologi EIV, uji SRH memproduksi reproduksibilitas yang lebih tinggi daripada uji HI [28], dan terutama karena alasan inilah uji ini lebih disukai oleh banyak laboratorium. Uji HI secara teknis lebih sederhana dan tetapi digunakan secara luas, tetapi tidak ada satupun dari dua uji ini yang berguna untuk membedakan antara hewan yang terinfeksi alami dan hewan yang divaksin (DIVA). Uji netralisasi virus biasanya digunakan dengan hasil yang berkorelasi dengan baik dengan data SRH dan HI untuk kohort yang sama [79].
Dua modifikasi biasanya digunakan bersama dengan uji HI, yaitu pretreatment serum dan pretreatment antigen. Pretreatment serum equine penting dilakukan untuk membuang inhibitor non spesifik terhadap aglutinasi, yang jika dibiarkan akan memproduksi hasil positif palsu. Serum equine mengandung level tinggi 𝝰2-macroglobulin [109, 114], glikoprotein 720-kDa yang stabil panas dan menetralisir virus yang mengikat hemaglutinin (HA) melalui residu asam sialiknya dan menghalangi pengikatan HA dengan eritrosit. Pretreatment serum yang paling sering digunakan adalah enzim penghancur reseptor, periodate atau periodote tripsin dan adsorpsi kaolin/eritrosit. Perlakuan panas 56o C untuk 30 menit) saja tidak cukup. Laboratorium penulis telah menunjukkan bahwa perlakuan kaolin, yang digunakan secara luas di laboratorium diagnostik, efektif jika digunakan untuk antibodi equine melawan EIV H3, tetapi gagal untuk mengeliminasi hasil positif palsu saat diuji untuk antibodi melawan EIV H7 [12].
Pretreatment antigen dengan deterjen (Tween-80) dan ether [62] diperkenalkan untuk mengatasi masalah titer kuda pasca vaksinasi terhadap virus EIV H7. Hal ini dikaitkan dengan rantai karbohidrat samping yang lebih ekstensif pada HA H3 equine yang membuatnya sebagai antigen lemah, sementara HA H7 equine adalah antibodi yang efektif. Memodifikasi HA H3 dengan Tween-80 dan perlakuan lainnya, menciptakan partikel sub viral yang diselubungi HA, meningkatkan titer observasi ke level yang serupa dengan HA H7 yang tidak dimodifikasi (misalnya meningkatkan sensitivitas terhadap uji HI). Akan tetapi, jumlah peningkatan ini tidak konsisten karena variasi dari batch ke batch dalam setiap antigen yang diberi perlakuan. Karena itu praktek perlakukan semacam itu mungkin berkontribusi terhadap buruknya reproduksibilitas uji HI untuk studi serologi pada kuda.
Dua uji serologis telah dikembangkan spesifik untuk membedakan antara hewan yang sudah divaksin dengan yang tidak (DIVA), yang disebut immunoblot, atau alternatifnya ELISA yang mendeteksi antibodi spesifik terhadap protein NS1 dari virus [11, 95], dengan sensitivitas eksperimental lebih dari 70%. NS1 terdapat dalam sel terinfeksi namun tidak ada dalam partikel virus, sehingga antibodi anti-NS1 diproduksi sampai level yang dapat dideteksi pada kejadian infeksi tetapi tidak setelah vaksinasi konvensional. Vaksin EIV dari virus hidup yang dimodifikasi (MLV) kemungkinan menginduksi respons antibodi anti-NS1, tetapi masih belum dikonfirmasi. Antibodi anti-NS1 pada kuda relatif singkat masa hidupnya, tetapi untuk sampel yang dikoleksi dalam waktu 1-2 bulan setelah wabah metode ini memberikan kapabilitas DIVA.
Di tahun 2007 pada wabah EIV H3N8 di Australia satu-satunya vaksin yang disetujui untuk digunakan yaitu rekombinan canarypox mengekspresikan hanya HA EIV saja, sebagian sengaja dipilih untuk tujuan DIVA karena tidak akan menstimulasi respons terhadap protein EIV lainnya, seperti misalnya neuraminidase (NA) [106]. Dalam kejadian itu, untuk ELISA digunakan protein NP dari EIV, bukan NA [39, 64, 115]. ELISA yang digunakan sama atau sedikit dimodifikasi yang didesain untuk mendeteksi antibodi reaktif terhadap NP dalam serum avian atau swine. Uji ini kurang sensitif dibandingkan dengan HI atau SRH dalam mendeteksi serokonversi, dan juga biasanya kurang kemampuan DIVA-nya dibandingkan dengan vaksin konvensional atau MLV EIV. Tetapi dalam situasi khusus yang menggunakan rekombinan canarypox dengan HA tetapi tidak ada NP seperti yang ditunjukan dalam wabah 2007 di Australia, uji ini berguna sebagai uji DIVA.
Imunitas yang dimediasi sel (CMI)
Selama bertahun-tahun mengukuran respons CMI jarang sekali dilakukan, karena kurangnya reagen khusus equine dan karena proses pengujian 51Cr-release yang sulit dan melelahkan. Hannant dan koleganya menunjukkan bahwa jika infeksi virus EIV pada kuda menginduksi respons limfosit T sitotoksik (CTL) spesifik antigen yang dibatasi MHC, vaksinasi menggunakan vaksin virus inaktif ber adjuvan konvensional tidak menginduksi aktivitas CTL yang terdeteksi [45, 47]. Kuda poni yang divaksin tidak menunjukkan proliferasi limfosit seperti yang dideteksi setelah stimulasi in vitro sel mononuklear darah perifer (PBMC) dengan virus EIV inaktif. Sejak saat itu uji CTL ini telah diperbaiki dengan menggunakan virus EIV hidup untuk stimulasi in vitro prekursor CTL, dan sel dermal kuda sebagai sel target, tetapi metodenya masih melelahkan untuk dilakukan [98]. Pendekatan alternatif antara lain analisis sitokin serum atau sitokin yang berhubungan dengan sel, terutama interferon gamma (IFN-ℽ), yang merupakan sitokin proinflamasi yang berhubungan dengan respons Th-1. IFN-ℽ yang berhubungan dengan sel diukur dengan flowsitometri PBMC yang diwarnai dengan antibodi setelah stimulasi in vitro dengan virus EIV dan diberi perlakuan dengan brefeldin A untuk menghalangi sekresi IFN [96]. Peningkatan signifikan dalam persentase sel yang mengekspresikan IFN-ℽ setelah re-stimulasi in vitro dengan virus EIV telah diamati dalam uji tantang eksperimental atau vaksinasi hewan naif [1, 97-101], tetapi tidak ketika kuda memiliki imunitas terhadap EIV yang telah ada lebih dulu [1]. Bioassay untuk sitokin kuda, termasuk IFN (terutama IFN-𝝰), IL-6 dan TNE-𝝰 telah dideskripsikan menggunakan serum atau sekresi nasal sebagai sampel untuk respons sistemik atau lokal [129]. Seperti yang diukur dengan bioassay, infeksi virus EIV pada kuda poni naif menginduksi IFN dan IL-6 lokal (nasal), dan IL-6 sistemik (serum) level rendah, tetapi tidak IFN. Level dan durasi sekresi tampaknya berkorelasi positif dengan keparahan penyakit membuatnya sebagai penanda patogenitas. TNF-𝝰 tidak terdeteksi [129].
Kemajuan RT-PCR real time kuantitatif dan ketersediaan genome kuda [127] telah memberikan alat baru yang mudah untuk menganalisa banyak respons sitokin pada kuda dengan mengukur transkripsi sitokin dalam sel imun. Pada umumnya sumber sel yang digunakan adalah leukosit darah perifer, yang langsung lisis segera setelh dikoleksi dalam tabung yang mengandung buffer stabilisator RNA. Sampel-sampel ini juga dapat diambil dengan mudah dan dalam diproses dengan santai. Tetapi, dalam pandangan hasil uji bioassaynya [129], dapat dipertanyakan apakan leukosit darah perifer adalah sampel yang cukup untuk mengungkapkan aktivitas sitokin terkait virus EIV. Basuhan transtrakeal atau teknis bilasan bronkoalveolar dapat memproduksi populasi sel saluran pernafasan yang cocok untuk analisis transkripsi sitokin atau stimulasi prekursor CTL secara in-vitro [15], tetapi metode-metode sampling ini lebih susah dilakukan dibandingkan koleksi darah perifer dan, karena metode tersebut menginduksi peradangan lokal, tidak boleh digunakan berkali-kali secara berturut-turut pada hewan yang sama. Set primer/probe telah dikembangkan untuk mRNA untuk lebih dari 50 sitokin dan marker sel imun kuda, meliputi yang secara spesifik berhubungan dengan Th-1 (IL-2, IFN-ℽ, dan Tbet), Th-2 (IL-4, IL-13 dan GATA-3), Treg (IL-10, TGF-ꞵ, dan FoxP3), dan pengganti CTL (perforin dan granzyme B) (sebagian daftar tersedia pada www2.ca.uky.edu/gluck/HorohovDW_EIRClonedCytokines.asp). Quinlivan dan kolega [110] membandingkan level mRNA sitokin plasma sel pasca uji tantang pada kuda yang divaksinasi dan tidak divaksinasi, dan mendeteksi peningkatan ekspresi signifikan dari IFN-𝝰 dan IL-6, tapi tidak TNF-𝝰 dan hanya sedikit meningkatkan IL-1ꞵ pada hari ke-2 pasca uji tantang pada kuda yang tidak divaksin, sementara kuda yang baru divaksin menunjukkan tidak ada perubahan. Studi yang lain mereproduksi elevasi IL-6 mRNA pada hari ke-2 pasca tantang dan menunjukkan elevelasi signifikan IL-1ꞵ mRNA [21]. Pola ekspresi ini konsisten dengan yang ditemukan pada spesies lain setelah uji tantang influenza [misal 49]. IFN-ℽ juga telah diukur. Elevasi IFN-ℽ pasca uji tantang tidak selalu konsisten teramati, tetapi jika dilaporkan dihubungkan dengan imunitas protektif [5]. Setelah vaksinasi primer, Gildea dan kolega [41] mengamati adanya peningkatan signifikan IFN-ℽ mRNA yang mencapai puncaknya 7 hari pasca uji tantang, yang berhubungan dengan temuan yang telah disebutkan diatas dari uji CMI in-vitro. Para peneliti tersebut juga mengamati peningkatan IL-1ꞵ dan IL-4 mRNA yang mencapai puncaknya di hari ke-14 pasca uji tantang. Seperti yang terdeteksi melalui real time RT-PCR dari sampel sel plasma, magnitudo peningkatan ini biasanya kecil (biasanya kurang dari dua kali lipat).
Korelasi proteksi dan evaluasi kesuksesan vaksinasi
Korelasi proteksi
Vaksin inaktif dan subunit utamanya ditujukan untuk menstimulasi antibodi serum. Stimulasi dari cabang lain sistem imun (misalnya CMI, imunitas mukosa) adalah bonus, tetapi juga lebih sulit untuk diukur. Titer antibodi dalam serum telah dikorelasikan dengan proteksi klinis atau virologi menggunakan uji SRH, memberikan pengukuran berguna tentang efektivitas vaksinasi. Saat dilakukan pengukuran proteksi terhadap virus yang secara antigenik serupa dengan stain vaksin, titer serum SRH sebesar 85 mm2, atau titer HI sebesar 64 berkorelasi dengan proteksi klinis (misalnya ketiadaan gejala klinis). Dalam rangka mencapai proteksi virologi (resistensi penuh terhadap infeksi berdasarkan tidak adanya pendedahan virus yang terdeteksi). Diperlukan titer SRH terdeteksi yang lebih dari 120 mm2 dan direkomendasikan titer sebesar 154 mm2 [84, 86, 87,91]. Akan tetapi di lapangan, hewan yang divaksin mungkin terekspos dengan virus tipe liar yang lebih kurang berbeda dengan strain vaksin, terutama karena proses pembaharuan vaksin untuk produsen vaksin EIV dapat melebihi 5 tahun terhitung dari saat rekomendasi pembaharuan dikeluarkan. Bukti dari wabah EIV tahun 2003 di Inggris, pertama kali masuknya clade 2 sub keturunan Florida, merujuk kepada perlunya proteksi titer SRH yang lebih tinggi terhadap virus heterolog. Dengan surveilans yang dilakukan secara terus menerus, dalam jarak 2 yard kuda-kuda yang memiliki titer rata-rata 156 mm2 masih mengalami serokonversi setelah terpapar virus mengindikasikan bahwa kuda-kuda tersebut masih rentan infeksi, sementara titer rata-rata kuda yang tidak mengalami serokonversi dan karena itu resisten terhadap infeksi berada pada angka 203 mm2 [90].
Faktor resiko dari hospes
Selain dari faktor manajemen, faktor hospes memainkan peranan dalam efektivitas vaksin. Masalah yang paling terkenal adalah beberapa kuda, terutama hewan muda merespon kurang baik terhadap setidaknya vaksinasi primer, meskipun mereka dapat merespon terhadap dosis berikutnya [40, 91]. Responder yang rendah dalam populasi dapat meningkatkan resiko penyakit pada keseluruhan populasi dengan memberikan jalan masuk virus dan hospes rentan untuk amplifikasi dan diseminasi virus, dan manajer peternakan bisa juga memiliki kepercayaan diri tidak berdasar tentang keamanan kawanan kuda miliknya. Kuda berumur 3 tahun atau lebih telah dilaporkan lebih rentan terhadap infeksi dibanding kuda berumur 2 tahun meskipun titer antibodi dalam serum pasti akan memprediksi bahwa tidak ada perbedaan [90], dan hal ini telah diasosiasikan dengan panjangnya harak waktu yang telah berlalu sejak vaksinasi terakhir [7]. ‘Dosa asli antigenik’ juga mungkin mempunyai peranan [90]. Dalam studi itu pula [7], kuda jantan ditemukan memiliki resiko tinggi terhadap infeksi dibandingkan dengan kuda jantan, meskipun titer antibodi serum sama saja, dan hal ini dikaitkan dengan efek imunosupresif dari testosteron.
Gangguan antibodi maternal
Permasalahan gangguan antibodi maternal terhadap vaksin EIV pada anak kuda dimunculkan pada tahun 1991 oleh Van Oirschot dan koleganya [126]. Vaksinasi EIV pada induk kuda bunting direkomendasikan dalam rangka menaikkan titer antibodi spesifik EIV dalam kolostrum, akan tetapi terdapat bukti yang cukup bahwa antibodi maternal mengganggu respon imun aktif pada anak kuda terhadap vaksin EIV konvensional [26, 55, 125, 133], mencegah perkembangan titer antibodi serum yang cukup sampai banyak dosis vaksin diberikan. Holland dan koleganya menunjukkan bahwa gangguan antibodi maternal pada anak kuda bersifat sepsifik terhadap subtipe EIV yang sama dengan subtipe EIV dimana ibunya sudah kebal [55]. Wilson dan koleganya menunjukkan bahwa jika vaksinasi dimulai pada umur 3 bulan, anak kuda tidak responsif terhadap dua kali vaksinasi dan memerlukan satu sampai tiga kali booster untuk mendapatkan titer yang sama dengan anak kuda umur 1 tahun (yearling) yang sudah divaksinasi 2 dosis [133]. Analisis wabah EIV 2003 di Inggris menunjukkan resiko infeksi yang meningkat secara signifikan dihubungkan dengan pemberian vaksin pertama saat umur dibawah 6 bulan, dibandingkan dengan pemberian vaksin pada umur 6 – 18 bulan [7]. Vaksinasi EIV anak kuda dari induk kuda yang sudah di vaksin menggunakan vaksin komersial tidak direkomendasikan sebelum mencapai umur 6 bulan. EIV jarang menjadi masalah pada anak kuda yang memiliki antibodi maternal, sehingga penundaan vaksinasi anak kuda secara biologis mungkin dilakukan, akan tetapi setelah disapih anak-anak kuda ini mungkin memerlukan vaksinasi EIV untuk dijual atau ditransportasikan, dan karena itulah manajemen perlu melakukan vaksinasi awal. Umur anak kuda dimana antibodi telah memudar signifikan untuk memungkinkan dilaksanakan vaksinasi efektif masih belum jelas. Berdasarkan uji HI, antibodi ini seringkali menjadi tidak terdeteksi dalam serum sekitar umur 4 bulan [125], akan tetapi gangguan ini mungkin berlanjut terus setelah umur 4 bulan [55]. Pada satu waktu pernah dianggap bahwa gangguan antibodi maternal mungkin berarti induksi status toleransi imunitas (misalnya vaksinasi saat antibodi maternal masih ada membatasi respons terhadap dosis vaksin yang diberikan kemudian di masa depan demikian juga dengan dosis yang diberikan sekarang) [26], tetapi selain respons antibodi serum tidak ada bukti lain yang menunjukkan toleransi imunitas, dan respons yang buruk mungkin karena vaksin yang digunakan berpotensi rendah. Pada anak kuda yang tidak memperoleh antibodi maternal (karena gagalnya transfer pasif atau pada wabah di Australia tahun 2007 dimana banyak induk kuda naif influenza), anak kuda bisa divaksinasi lebih awal, misalnya pada umur 1 bulan [132].
Jadwal vaksinasi
Rekomendasi umum jadwal vaksinasi primer menggunakan vaksin virus inaktif konvensional (misalnya American Association of Equine Practitioners [AAEP] Risk-Based Vaccination Guidelines, www.aaep.org/-i/166.html) menyarankan memulai serangkaian tiga dosis vaksinasi dimulai pada umur 6 bulan, dosis kedua diberikan 4 -6 minggu setelah yang pertama (vaksin primer), dan dosis ketiga (booster pertama) diberikan 5 – 7 bulan kemudian. Pada kuda muda titer antibodi yang naik karena vaksinasi pertama menggunakan vaksin konvensional hanya berjangka pendek dan turun dibawah ambang batas 88 mm2 untuk proteksi klinis sebelum pemberian booster pertama [misal 40]. Periode kerentanan klinis ini dikenal sebagai ‘celah imunitas’ [53]. Pada kuda lebih tua yang divaksin secara rutin, dan titer serum antibodi cukup stabil, dan hewan model telah menunjukkan bahwa re-vaksinasi dengan jarak 6 bulan diharapkan mampu menurunkan secara signifikan resiko wabah EIV jika dibandingkan dengan revaksinasi dengan jarak 12 bulan [104], meskipun jangka waktu yang lama masih sesuai untuk kuda-kuda yang beresiko rendah (misalnya yang tidak melakukan perjalanan atau tidak terpapar dengan kuda yang baru masuk). Pada anak kuda sulit untuk menutup celah imunitas menggunakan vaksin konvensional. Helden dan kolega [53] mengeksplorasi sebuah strategi menggunakan percepatan booster pada 8 minggu setelah vaksinasi primer dan tidak menemukan manfaat. Vaksin pada saat adanya antibodi diinduksi vaksin tampaknya menunjukkan hasil yang sama seperti vaksinasi saat adanya antibodi maternal, dengan adanya peningkatan yang tidak terlalu tinggi dan berumur pendek titer serum. Vaksin kompleks stimulasi imun (ISCOM)-Matrix lebih sukses dalam menginduksi titer yang masih tetap mencukupi proteksi klinis untuk 5 bulan setelah vaksinasi primer/pertama [51]. Mengurangi interval antara dosis pertama dan kedua menjadi 3 minggu tidak menimbulkan efek buruk, sementara meningkatkan interval menjadi 13 minggu tidak merubah level titer yang dinaikkan tetapi hanya meningkatkan periode sebelum dosis kedua selama titer tidak cukup untuk memberikan proteksi [25].
Imunitas mukosa
Meskipun level antibodi serum sangat kuat korelasinya dengan proteksi, imunitas mukosal mungkin memainkan peranan penting, seperti yang ditunjukkan pada spesies lainnya, termasuk manusia [misalnya 122]. Bukti kunci yang menunjukkan pentingnya imunitas mukosa atau respons yang dimediasi sel adalah temuan bahwa anak kuda setelah diinfeksi secara eksperimental, durasi imunitas klinis melawan reinfeksi jauh lebih lama dibandingkan durasi antibodi yang terdeteksi dalam serum [48]. Hannant dan koleganya menguji strategi primer-booster menggunakan vaksin konvensional beradjuvan alum untuk priming, diikuti dengan dua dosis vaksinasi intranasal (IN) menggunakan adjuvan EIV dengan subunit kolera toksin B [44]. Mereka menemukan bahwa hal ini efektif memprimer respons antibodi, terutama IgA, dalam mukosa nasal seperti yang terdeteksi dalam basuhan nasal, dan bersifat protektif dan virologis. Respons anamnestik antibodi mukosa nasofaring pada kusa lebih cepat daripada respon anamnestik dalam serum [46], sehingga stimulasi imunitas mukosa adalah strategi vaksin yang menjanjikan.
Salah satu strategi menggunakan vaksin ISCOM komersial, meliputi dosis vaksin primer dengan injeksi intramuskular (IM) diikuti dengan dosis booster yang diberikan dengan IN dieksplorasi oleh Crouch dan koleganya [24]. Dalam salah penelitian tersebut, regimen IM-IN tidak begitu protektif dibandingkan regimen standar IM-IM, tetapi hasilnya mengindikasikan bahwa regimen IM-IN lebih efektif dibandingkan vaksinasi IM saja dalam priming sistem imun mukosa untuk mengeluarkan respon antibodi IgA. Hal ini mungkin memiliki manfaat memperkuat proteksi silang melawan strain tantang heterolog, dan strategi prime-boost semacam itu bukan merupakan subjek perhatian berkelanjutan, tetapi memerlukan pemeriksaan lebih lanjut.
Surveilans dan pembaharuan vaksin
Antigenic drift lebih lambat terjadi pada virus EIV H3 daripada virus influenza A manusia (hanya sepertiga sampai seperempat dari kecepatannya) [9]. Sebagai konsekuensinya vaksin untuk EIV tidak memerlukan asesmen tahunan dan dilakukan pergantian bibit strain vaksin dalam waktu 2 sampai 4 tahun seperti juga yang dilakukan pada vaksin influenza manusia. Meskipun begitu kejadian wabah besar pada kawanan ternak yang telah divaksin (sebagai contoh wabah tahun 1989 di Eropa [69], tahun 1992 di Hong Kong [108], dan tahun 2003 di Eropa lagi [90] menunjukkan bahwa perlunya melacak antigenic drift dan saat diperlukan melembagakan pembaharuan vaksin EIV. Surveilans internasional untuk wabah EIV telah berkembang lebih baik sebagai akibat prosedur yang lebih efektif (PCR, kit rapid test) menggantikan penggunaan isolasi virus dalam telur ayam berembrio. Sistem surveilans yang dilakukan telah dibangun di beberapa negara seperti misalnya Inggris, Irlandia, dan Perancis, dimana pendanaan tersedia untuk merekrut praktisi dan praktek sentinel di dalam sistem tersebut [38, 67]. Akan tetapi, surveilans masih tertinggal sekali di banyak negara, termasuk Amerika Serikat, dimana equine influenza bukan merupakan penyakit yang harus dilaporkan dan praktisi kuda masih belum diberi insentif untuk mengumpulkan swab nasofaring dari kasus-kasus suspek.
Langkah penting ke depan adalah formalisasi proses review surveilans internasional dengan pembentukan OIE/WHO Equine Influenza Expert Surveillance Panel (ESP) di tahun 1995 [82]. Kelompok ini terdiri dari para ahli dari laboratorium referensi OIE untuk equine influenza di Inggris, Jerman dan Amerika Serikat, dan ahli equine influenza dari beberapa laboratorium lain yang mewakili seluruh benua. Pada setiap pertemuan tahunan pool data survei penyakit dan karakterisasi virus dikaji dengan perhatian khusus tentang kejadian kerusakan vaksin, atau kemunculan varian antigenik baru. Berdasarkan rekomendasi tahunan inilah seleksi strain vaksin disetujui dan dipublikasikan dalam Buletin OIE [4]. Selama bertahun-tahun tidak terdapat bukti yang cukup yang menunjukkan perlunya perubahan rekomendasi panel. Sampai sekitar tahun 2000, kebanyakan vaksin EIV mengandung strain H7N7 dan strain H3N8. Subtipe H7N7 dianggap tidak relevan secara epidemiologi dan berhenti direkomendasikan setelah tahun 2000, meskipun pada saat tulisan ini ditulis virus H7N7 equine/Prague/56 masih ditemukan dalam vaksin di beberapa wilayah di dunia. Dimulai dari tahun 1995 [92], ESP telah merekomendasikan dua strain H3N8. Dari tahun 1995 sampai 2010 strain ini merupakan perwakilan dari keturunan Amerika dan Eurasia [30, 138], dan sejak 2010 strain itu adalah perwakilan dari dua clade yang diturunkan dari keturunan Amerika (Florida clade 1 dan 2) [4]. Dari tahun 2010, keturunan Eurasia tidak lagi direkomendasi, karena secara epidemiologi tidak penting, meskipun mungkin virus tersebut masih bersirkulasi dalam level yang rendah. Saat strain baru direkomendasikan, laboratorium referensi OIE mampu untuk mensuplai strain atau strain yang serupa antigennya dengan produsen vaksin. Otoritas perizinan (USDA, EMA) telah menerima peranan ESP sebagai badan penasehat terpilih untuk menjustifikasi strain yang dipilih untuk diperbaharui oleh produsen vaksin.
Karakterisasi molekuler isolat virus berfokus pada sekuens asam amino HA1. Meskipun sekuensing genome penuh (whole genome) adalah metode tambahan yang bermanfaat, metode ini masih belum berdampak terhadap rekomendasi strain vaksin, karena tidak ada kemunculan subtipe EIV baru sejak 1963 (atau mungkin virus H3N8 equine/Jilin/89 avian like tahun 1989 [43]), tidak ada kemunculan kembali virus EIV subtipe H3N8 yang terkonfirmasi sejak tahun 1979 [130], dan tidak ada bukti reassortment antar subtipe sejak tahun 1970-an [8], dan meskipun terdapat kejadian reassortment antar subtype [88, 136], kejadian itu tidak memerlukan perubahan dalam rekomendasi strain. Beberapa pohon filogeni evolusi HA virus H3 EIV telah dipublikasikan, paling baru oleh Woodward dan koleganya [136]. Metode untuk menghubungkan secara kuantitatif substitusi asam amino terhadap efektivitas vaksin, nilai P epitope, telah diajukan [29], meskipun memerlukan penguatan yang lebih kuat, dan terdapat bukti bahwa satu saja substitusi asam amino yang kritis dapat menjadi lebih relevan terhadap reaksi silang vaksin daripada akumulasi perubahan non-kritikal [68, 137]. Bersama evolusi sekuens nukleotida, keterkaitan antigenik isolat virus telah dianalisis dengan uji HI komparatif menggunakan panel referensi serum musang yang sudah ditetapkan. Analisis secara konsisten menunjukkan perbedaan 2 sampai 16 kali lipat dalam reaktivitas antar strain Florida clade 1 dan clade 2 [18, 19, 136]. Kartografi antigenik [68, 136] telah sangat memfasilitasi analisis komparatif ini, dan mendemonstrasikan bahwa sementara evolusi genetik tetap berlanjut pada strain yang bersirkulasi, strain yang paling baru terus memetakan klaster yang sama yang diidentifikasi oleh keturunan Florida clade 1 dan 2. Akan tetapi seperti yang telah dikatakan oleh Woodward dan koleganya [136], reaksi silang tidak selalu berkorelasi dengan proteksi silang.
Tipe vaksin dan metode pemberiannya
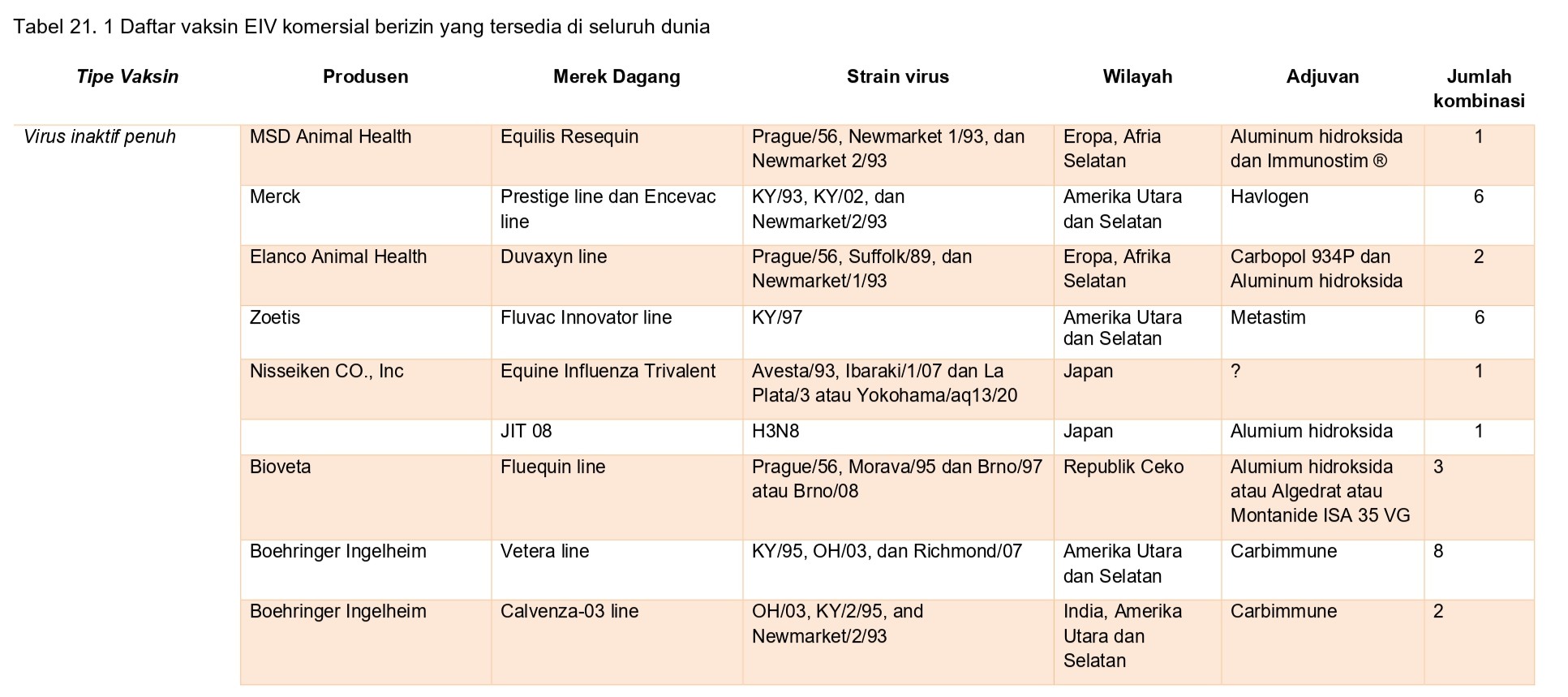
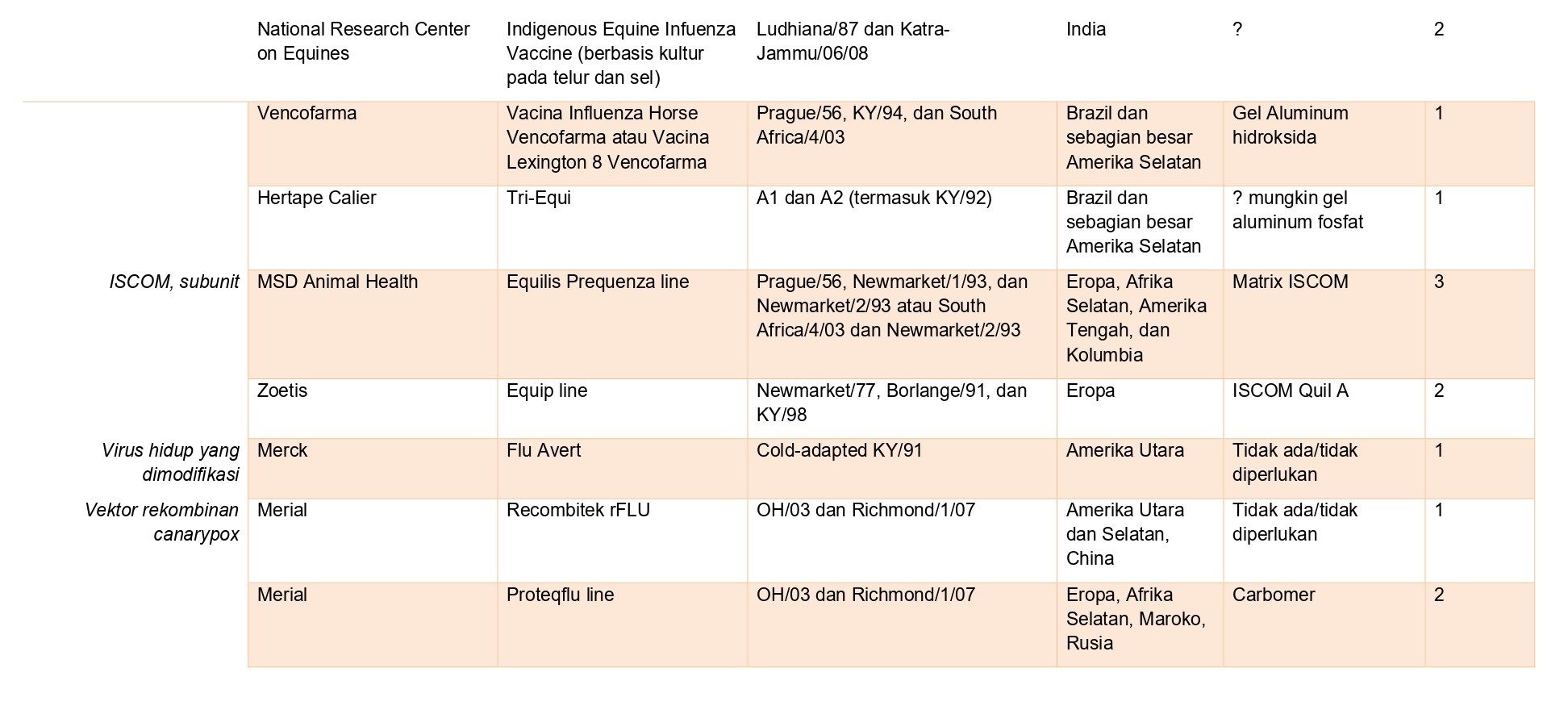
Vaksin EIV yang tersedia secara komersial dan telah mendapatkan izin disajikan dalam daftar pada tabel 21.1, dan berdasarkan pada berbagai platform dan teknologi vaksinasi.
Vaksin konvensional
Vaksin inaktif virus EIV penuh ditambah adjuvan pertama kali dikembangkan di tahun 1960 oleh Bryans dan teman kerjanya [17]. Studi awal yang dilakukan oleh mereka menggunakan virus dibiakkan dalam telur ayam berembrio dan diinaktivasi dengan formalin. Adjuvan kemudian sesegera mungkin ditambahkan, karena tanpa adjuvan virus EIV H3N8 inaktif yang diberikan melalui injeksi IM, tidak menginduksi respon antibodi HI serum setelah diberikan dua dosis, sementara virus EIV H7N7 tanpa adjuvan menginduksi antibodi HI. Vaksin virus penuh inaktif ber adjuvan masih tetap menjadi tipe vaksin EIV yang paling umum. Dari 8 produk vaksin EIV komersial yang saat ini dipasarkan di Amerika Serikat, lima diantara berasal dari tipe ini dan menggunakan carbomer atau adjuvan berbasis lipid. Kebanyakan adalah vaksin multivalen mengandung dua strain EIV, seperti A/equine/Ohio/03 (keturunan Florida clade 1) dan A/equine/Richmond/07 (keturunan Florida clade 2), dan selain itu pula strain itu mungkin diformulasikan sebagai vaksin kombinasi untuk penyakit kuda yang lainnya, termasuk tetanus, equine herpesvirus ¼, virus equine encephalomyelitis eastern, western, dan Venezuela, dan virus West Nile. Vaksin-vaksin ini bergantung pada stimulasi antibodi serum untuk kekebalan. Adjuvan sangat penting untuk kesuksesan vaksinasi, dan sifat adjuvan sangat kuat mempengaruhi respon imun yang timbul. Vaksinasi dengan antigen mati/’killed’ pada umumnya menyebabkan prosesing antigen melalui jalur eksogen, dan presentasi preferensi terhadap sel T CD4+ berhubungan dengan molekul MHC kelas II. Generasi pertama vaksin EIV seringkali menggunakan alum (aluminum hydroxide atau aluminum fosfat) as adjuvan, yang diketahui mampu memicu respon Th2. Meskipun hal ini mampu menstimulasi respon proliferasi limfosit pada kuda poni yang divaksinasi, vaksin ini tidak mampu menginduksi respon CTL [45]. Sebaliknya, penggunaan adjuvan vaksin berbasis lipid atau polimer seperti Carbopol (polyacrylic acid) dapat meningkatkan prosesing antigen melalui jalur endogen dan presentasi dalam konteks kelas MHC I [121]. Bukti bahwa vaksin ini mampu memperkuat CMI demikian juga respon humoral didasarkan pada elevasi produksi IFN-ℽ dalam limfosit darah perifer [41, 101].
Adjuvan juga mempengaruhi isotipe antibodi spesifik yang diproduksi vaksinasi [89]. Sementara respon antibodi terhadap infeksi eksperimental pada kuda poni naif terutama isotype IgA mukosa dan IgA dan IgG serum (juga disebut equine IgG1 dan IgG4/7 [128]), isotype yang dominan setelah vaksinasi dengan vaksin komersial ber adjuvant alum (dua dosis, terpisah 3 minggu) adalah IgG (T) (IgG3/5), paling dikenal menetralisir toksin tetanus dan respon terhadap parasit internal kuda [105]. Kuda-kuda poni yang divaksin ini juga gagal memunculkan respons antibodi serum yang dapat terdeteksi melalui HI, sehingga ketiadaan proteksi saat hewan yang divaksin sebelumnya di tantang dengan virus EIV tipe liar dapat menjelaskan baik dari isotipe antibodi yang secara kualitatif tidak sesuai atau respon kuantitatif yang tidak mencukupi [89]. Meskipun kemungkinan respon yang tidak mencukupi tidak dapat dikecualikan, bukti isotope antibodi yang tidak sesuai meliputi temuan bahwa, pada kuda IgA dan IgGb lebih superior dibandingkan IgG (T) dalam kondisi fiksasi komplemen dan sitotoksisitas seluler tergantung antibodi [74], dan model tikus juga telah menunjukkan bukti proteksi saluran pernafasan bawah yang lebih superior melawan uji tantang ketika isotipe yang diinduksi vaksin (IgA dan IgG2a) cocok dengan isotipe yang diinduksi infeksi [misalnya 10].
Vaksin EIV konvensional diberikan melalui injeksi IM, biasanya pada otot brachiocephalicus/serratus cervicis pada leher. Kuda yang dipelihara dengan baik menerima beragam injeksi pada lokasi penyuntikan itu dan dapat menjadi terbiasa dengan prosedur ini sehingga begitu bereaksi berlebihan lagi. Lokasi pada leher ini memiliki manfaat lebih yang memungkinkan efek samping terhadap vaksin berupa pembengkakan lokal, serta panas dan sakit di tempat suntikan, dapat terlihat pada saat pemeriksaan. Jika efek samping, reaksi semacam itu dihubungkan dengan sifat dan kuantitas adjuvan, dan menghindari efek samping adalah faktor kritis yang menentukan seleksi adjuvan untuk vaksin equine komersial, bahkan lebih penting dari kualitas respon imun. Pada umumnya untuk menghindari efek samping, maksimal volume yang diinjeksikan via IM untuk satu kali injeksi adalah 2 ml, yang memberikan batasan fisik potensi antigenik dalam vaksin kombinasi yang mengandung banyak antigen. Terdapat bukti yang bertolak belakang antara performa relatif vaksin monovalen versus vaksin kombinasi untuk EIV [26, 52, 58], dan mungkin antigen tertentu yang ada dalam kombinasi adalah antigen sangat penting, meskipun hal ini memerlukan penyelidikan lebih lanjut.
Pencatatan performa vaksin konvensional yang ada selalu ada ‘lubangnya’. Uji coba lapangan terkontrol, acak, dan ‘double-blinded’ yang dilakukan di tahun 1990-an [80] menemukan bahwa vaksinasi tidak menurunkan resiko penyakit, meskipun durasi penyakit berhasil dikurangi. Uji coba yang lebih baru [58] membandingkan beberapa vaksin konvensional pada kuda non-naif dewasa menyimpulkan bahwa tidak ada satupun diantara vaksin-vaksin tersebut yang memberikan respon antibodi pada level yang berhubungan dengan proteksi, tetapi studi yang lain yang dilakukan pada anak usia sapih [40] menemukan bahwa vaksin konvensional berbeda menunjukkan performa superior bahkan jika dibandingkan dengan vaksin yang berbasis teknologi lebih modern (termasuk ISCOM dan canarypox-HA yang dijelaskan dibawah). Harus ditekankan bahwa bahkan saat efektivitas vaksin disokong dengan data uji eksperimental, uji-uji tantang itu diberikan dibawah kondisi optimum dimana tidak bisa sepenuhnya diekstrapolasikan dengan kondisi lapangan, dimana kuda yang berbeda status kesehatannya atau memiliki sejarah manajemen, vaksinasi, paparan sebelumnya, kondisi kronis yang dialami atau stress (karena perjalanan) yang berbeda-beda mungkin ikut berbaur satu sama lain.
Vaksin berbasis ISCOM
Vaksin subunit untuk EIV adalah ISCOM yang mengandung antigen HA dan NA yang dimurnikan. Antigen mungkin dicampur langsung dengan komponen matriks (saponin Quil-A ®, fosfolipid, kolesterol) (vaksin ISCOM) atau diintegrasikan dengan micelles ISCOM yang belum terbentuk (pre-formed) (vaksin ISCOM-Matriks). Kedua tipe vaksin tersebut telah dikembangkan menjadi vaksin EIV komersial. Quil-A ® saponin memiliki sifat adjuvan, dan vaksin ISCOM dipercaya memproses antigen baik melalui jalur eksogen dan endogen, dan menyajikan mereka dengan hubungannya dengan molekul MHC kelas I dan kelas II [78], membuat respon imun bawaan dan respon imun Th1 menjadi poten [119]. Vaksinasi kuda poni naif dengan vaksin ISCOM EIV terutama menginduksi antibodi IgGa dan IgGb, terutama setelah dosis pertama [23]. Vaksin ISCOM-Matriks EIV juga dapat menginduksi respons CMI berdasarkan produksi IFN-𝛾 [100]. Vaksin kombinasi ISCOM/tetanus dilaporkan menimbulkan elevasi amiloid A, fibrinogen plasma, dan sel darah putih dalam jangka pendek secara signifikan, dan menurunkan konsentrasi zat besi dalam serum secara signifikan [2]. Beberapa eksperimen telah mendemonstrasikan respons protektif berdurasi panjang melawan uji tantang eksperimental dengan EIV tipe liar [23, 50, 51, 97].
Vaksin DNA
Vaksin DNA memiliki manfaat potensial keamanan dan kemudahan pembaharuannya. Untuk virus EIV, vaksin eksperimental berupa bola-bola emas yang dilapisi DNA yang mengekspresikan HA sudah dikembangkan [73]. Setelah tiga dosis yang diberikan dalam jarang 2 bulan melalui injeksi ke dalam kulit (kulit inguinal dan perineum) dan mucosal (ventrum lidah, conjunctiva dan selaput mata ketiga/third eyelid) pada kuda poni, dengan total DNA 12-37.5 ug per dosis, vaksin DNA ini terbukti imunogenik dengan induksi isotipe antibodi IgGa dan IgGb, dan memberikan proteksi virologi parsial dan proteksi klinis hampir lengkap terhadap tantang [73]. Di beberapa kuda poni, respon terlihat setelah diberikan dosis kedua. Respon limfoproliferatif dan IFN-ℽ yang mengindikasikan CM juga teramati. Pemberian bersama DNA untuk ILD-6 tidak mempengaruhi respon imun mukosa lokal, meskipun mempromosikan produksi IgG(T), menunjukkan adanya elevasi respon Th2 [116]. IgA nasal terdeteksi dalam level yang sangat rendah. Untuk mempromosikan IgA nasal, strategi lain digunakan meliputi dua dosis vaksin DNA dicampur dengan 1 mg vaksin kolera toksin B dan diberikan melalui IN, diikuti dengan dua dosis vaksin DNA yang diberikan dalam bentuk partikel diberikan di banyak tempat di mukosa seperti yang dijelaskan di atas. Hal ini memang menstimulasi IgA nasl dan juga IgB nasal, meskipun hanya dua dosis terakhir yang menstimulasi antibodi serum [118].
Percobaan vaksinasi DNA awal pada kuda poni ini memakai PowderJect-XR Gene Gun, alat ditenagai helium yang menghantarkan mikropellet emas yang dilumuri vaksin DNA ke dalam kulit dan jaringan mukosa. Seperti yang dijelaskan diatas [73], untuk setiap dosis dilakukan inokulasi sebanyak 26 – 60 kali di beberapa tempat, dan untuk itu sedasi kuda poni penting dilakukan. Hal ini berbiaya sangat mahal dan tidak praktis untuk dilakukan di lapangan secara rutin. Sebagai alternatif, Landolt dan kolega [66] menguji injeksi vaksin DNA langsung ke dalam limfoglandula submandibular yang gampang dideteksi tempatnya pada kuda. Menggunakan tiga dosis masing-masing 50 µg (25 µg di setiap limfonodus), mereka mendapatkan titer serum IgGa dan IgGb yang serupa dengan yang diambil dengan Gene Gun, meskipun kurang dari yang didapat dari vaksinasi konvensional. Studi terkini lainnya telah menggunakan alat jer ditenagai pegas bebas jarum untuk menghantarkan larutan vaksin yang mengandung DNA secara subdermal [5]. Meskipun tidak diperlukan sedasi, lokasi injeksi dicukur, dan teramati adanya pembengkakan sementara setelah inokulasi. Vaksinasi DNA dengan injeksi IM dibandingkan dengan pemberian tanpa jarum, dan keduanya menimbulkan respon protektif serologi dan klinis, meskipun titer antibodi dalam serum lebih sedikit daripada yang didapat dari alat bebas jarum [5]. Kerugian relatif baik metode IM ataupun tanpa jarum dibandingkan dengan Gene Gun adalah bahwa lebih banyak DNA yang diperlukan (sampai 4 µg). Di masa lalu, persiapan DNA sebanyak itu tidak praktis, tapi seharusnya tidak lagi seperti itu lagi di masa depan.
Vaksin virus hidup yang dimodifikasi
Vaksin MLV untuk influenza diprediksi meniru proses infeksi influenza alami dan karena itu menginduksi respon imun hospes, meliputi respon muksa dan CMI, yang bisa dibilang lebih superior dibandingkan dengan yang dihasilkan dari vaksin virus inaktif. Serangkaian MLV sensitif temperatur (ts) diproduksi dengan reassortment 6+2 antara virus EIV H7N7 tipe liar (wt) dan virus H3N2 manusia dibuat ts dalam PB2 dan NP dengan mutagenesis kimia, hasilnya membawa virus EIV H7 HA dan N7 NA [16]. Hasil reasortansi 6+2 antara virus ini dan virus EIV H3N8 tipe liar (wt) menghasilkan virus ts H3N8. Pada kuda poni yang diberikan virus ini lewat aerosol baik virus H7N7 maupun virus ts H3N8 memproduksi pendedahan virus dan serokonversi, tetapi tidak ada gejala klinis yang luar biasa selain hiperemia ringan mukosa hidung atau leleran hidung serosa, dan kuda poni tersebut terlindungi dari infeksi melawan uji tantang 1 bulan kemudian [56, 57]. Virus hasil reasortan 6+2 diproduksi dari virus EIV ts H3N8 dan virus avian influenza A/Duck/New York/6750/78 (H2N2). Virus-virus ini kompeten dalam replikasi tapi atenuasinya pada kuda poni yang diekspos virus melalui rute aerosol bersifat imunogenik, dan memberikan proteksi klinis dan virologis parsial pada kuda poni yang diuji tantang 5,5 bulan setelah vaksinasi [85]. Akan tetapi, kemungkinan bahwa virus ini menyebabkan infeksi pada manusia atau unggas menghambat pengembangan berikutnya sebagai kandidat vaksin.
Vaksin MLV seluruhnya berasal dari virus EIV sekarang ini dipasarkan di Amerika Serikat. Vaksin ini dikembangkan melalui adaptasi dingin dari strain induknya, yaitu tipe liar A/equine/Kentucky/91 (H3N8), melalui proses melibatkan banyak pasase virus dalam telur berembrio dibawah temperatur dingin secara terus menerus [139]. Virus yang dihasilkan mampu bereplikasi pada suhu 33 o C, yang merupakan temperatur rata-rata dalam saluran respirasi atas kuda, tetapi telah berkurang kemampuannya untuk bereplikasi pada suhu 37 oC atau temperatur lebih tinggi. Vaksin diberikan dengan penyemprotan (spray) melalui kateter intranasal. Dalam vaksinasi eksperimental virus bersifat non-patogenik bahkan di bawah kondisi imunosupresi yang diinduksi exercise [72], dan kemampuan penularan spontannya rendah [20]. 6 bulan setelah pemberian vaksin pertama dosis tinggal kepada kuda naif influenza, terlihat proteksi klinis penuh, tetapi tidak memberikan proteksi virologi penuh, dimana proteksi parsial masih ditemukan pada 12 bulan [20, 123]. Akan tetapi, titer antibodi serum pasca vaksinasi terlalu rendah untuk terdeteksi. Hal ini menunjukkan bahwa bahwa mekanisme proteksi melibatkan baik antibodi mukosa dalam saluran respirasi, atau respon CMI, tetapi hal ini masih belum didemonstrasikan. Mutasi spesifik yang bertanggungjawab terhadap adaptasi dingin virus ini masih belum dideskripsikan.
Vaksin influenza MLV equine lainnya sedang dikembangkan [120], yaitu A/Hong Kong/Otar/6:2/2010. Ini adalah reasortan 6+2 membawa antigen permukaan (HA, NA) dari strain influenza tipe liar A/equine/Otar/764/2007 (H3N8) dalam dasar backbone dari strain donor reasortan asal manusia yang telah beradaptasi dingin yaitu A/Hong Kong/1/68/162/35CA. Vaksin ini juga diberikan melalui rute IN, dan seperti juga US, MLV adalah pemicu antibodi serum HI yang buruk. Dalam eksperimen, setelah diberikan dua dosis vaksin dengan interval minggu, terdapat proteksi klinis dan virologi penuh selama 3 bulan dan proteksi klinis yang kuat selama 12 bulan terhadap uji tantang dengan virus dengan antigen homolog. Setelah diuji tantang dengan virus heterolog (A/equine/Sydney/2007) masih terdapat proteksi parsial selama 12 bulan. Penulis berpendapat bahwa vaksin yang memiliki kapabilitas DIVA berdasarkan ketiadaan antibodi serum HI pasca vaksinasi dan meningkatnya respon pasca uji tantang dibandingkan dengan kontrol, tetapi hal ini tampak problematik untuk digunakan di lapangan, dimana jangka waktu antara potensi paparan dan koleksi sera untuk analisis mungkin tidak diketahui. Pertanyaan apakah MLV yang membawa gen-gen yang berasal dari virus influenza manusia dapat menginfeksi manusia tampaknya masih belum diperiksa.
Serangkaian MLV eksperimental telah dideskripsikan, yang dasar atenuasinya bukan berupa adaptasi dingin tetapi trunkasi progresif NS1 [111] dengan pembalikan genetik (reverse genetic). MLV-MLV ini mengekspresikan asam amino pertama 73, 99, atau 126 dari sejumlah 219 asam amino NS1. Fungsi NS1 meliputi antagonisme respon interferon tipe I hospes [32, 65]. Virus mutan dengan fungsi NS1 yang rusak tidak dapat bereplikasi di dalam hospes dengan interferon yang kompeten, dan terbatas perkembangannya dalam sel MDCK dan mencit demikian juga dalam telur berembrio berumur lebih dari 9 hari [111]. Kebalikan dari temuan dengan trunkasi NS1 virus influenza manusia, virus EIV mutan dengan trunkasi NS1 paling sedikit (126 asam amino) paling sering diatenuasi. Saat diuji dengan pemberian dua dosis melalui IN pada kuda, bahwa mutant virus EIV aman, menginduksi serokonversi, dan setelah uji tantang mengurangi secara signifikan gejala klinis dan pendedahan virus, meskipun tidak hilang seluruhnya [21]. Pembalikan genetik (rg) virus influenza memiliki manfaat bahwa pembaharuan genetik dapat secepatnya dilakukan dengan memutasikan kodon spesifik di dalam backbone genome yang stabil. Atenuasi yang berada dalam NS1 virus membebaskan gen HA dan NA untuk dirubah antigennya.
Inokulasi intranasal telah digunakan untuk memberikan vaksin virus influenza hidup. Pada kuda, metode yang digunakan adalah memasukkan kateter hidung melalui lubang hidung, dimana larutan vaksin kemudian terhirup oleh kuda. Metode ini memiliki beberapa kekurangan. Tanpa penggunaan obat penenang atau restrain paksa (penggunaan twitch), kuda yang tidak terbiasa dengan metode ini akan bereaksi keras. Meatus hidung pada kuda lurus dengan panjang sekitar 25 cm, sehingga dengan kateter berukuran panjang 10 cm terdapat kemungkinan beberapa larutan vaksin yang menetes keluar. Pada akhirnya, kateter semacam itu bukanlah peralatan veterinar standar. Dengan alasan-alasan inilah, vaksinasi IV tidak pernah disukai diantara praktisi kuda di Amerika Serikat. Alat inhalasi yang didesain khusus, diposisikan dengan ketat di bagian luar hidung, yang membuat larutan vaksin menjadi aerosol dan memasukkannya ke dalam saluran pernafasan atas dengan tekanan udara paksa tanpa perlu memasukkan selang ke dalam meatus, akan mengatasi permasalahan ini. Alat semacam itu pernah dipergunakan dalam percobaan, tetapi tidak pernah dipasarkan sebagai sistem pemberian vaksin komersial, dan mungkin tidak lagi tersedia dari produsen vaksin.
Vaksin virus rekombinan
Kekhawatiran dasar tentang vaksin MLV adalah pembalikan ke keadaan virulen, dan keamanannya pada hewan bunting dan individu dengan kelainan imun. Pembalikan ke keadaan virulen dapat terjadi baik melalui mutasi atau melalui reasortansi dengan virus tipe liar yang bersirkulasi. Tidak terdapat bukti bahwa hal ini pernah terjadi (MLV EIV telah dipasarkan di Amerika Serikat selama lebih dari satu dekade), tetapi permasalahan ini telah memotivasi perkembangan teknologi vaksin lainnya. Untuk mempertahankan manfaat respon imun terhadap vaksin virus hidup sementara menghindari resiko pembalikan ke keadaan virulen, salah satu pendekatan yang dilakukan adalah pengembangan vaksin virus rekombinan dimana virus induknya tidak patogenik atau menular pada kuda.
Vaksin berbasis poxvirus
Pekerjaan menggunakan poxvirus [12, 14, 27] telah menunjukkan bahwa vaksin virus rekombinan mengekspresikan HA EIV bersifat protektif imunogenik dan klinis pada kuda poni saat digunakan baik sendiri atau sebagai booster setelah vaksin pertama dengan vaksin HA-DNA. Prime boost dengan NP-DNA dan vaccinia-NP kurang efektif. Antibodi spesifik terdiri uramanua dari IgGa, IgGb dan IgA diproduksi baik dalam serum dan sekresi nasal, dan bahkan lebih kuat saat vaccinia-HA digunakan sendiri (dua atau tiga dosis) dibandingkan dengan regimen vaksin DNA sebagai primer/booster. Respons CMI terlihat berdasarkan stimulasi IFN-ℽ. Akan tetapi, keamanan vaksin berdasarkan virus vaccinia masih menjadi kekhawatiran.
Rekombinan canarypox adalah vektor poxvirus yang dianggap aman digunakan di lapangan karena dalam sel mamalia replikasinya bersifat abortif, tetapi masih bersifat imunogenik karena produk gen awalnya masih diekspresikan [misalnya 107]. Vaksin virus hidup rekombinan vanaypox untuk EIV telah tersedia secara komersial dan tersebar luas sejak tahun 2003. Vaksin ini menggunakan Adjuvan Carbomer (asam poliakrilat) dan diberikan dengan injeksi IM. rekombinan virus mengekspresikan HA dari dua strain EIV H3N8 (pada awalnya mewakili keturunan Amerika dan Eurasia, sejak itu diperbaharui dengan strain Florida clade 1 menggantikan strain keturunan Amerika, dan kemungkinan akan diperbaharui lagi dengan strain Florida clade 2 menggantikan strain keturunan Eurasia). Secara eksperimental bahkan satu dosis saja dapat menginduksi antibodi serum yang terdeteksi melalui uji SRH [35, 36, 99] dan menginduksi level proteksi klinis dan virologi signifikan melawan uji tantang virus heterolog 2 minggu setelah vaksinasi [35, 117]. Respons cepat ini terutama berguna ketika populasi naif influenza berada dalam resiko jangka pendek terpapar virus, seperti yang terjadi pada wabah tahun 2007 di Australia, dan sebuah studi disana menunjukkan bahwa jarak tipikal 4 – 6 minggu antara dua dosis vaksinasi pertama/primer dapat dengan sukses dipersingkat menjadi 2 minggu [36]. Setelah dua dosis vaksinasi primer durasi imunitas klinis dan virologis yang signifikan, meskipun tidak penuh, berlangsung sampai 6 bulan [117]. Meskipun titer antibodi serum pada beberapa kuda poni telah berkurang dibawah ambang batas 85 mm2 dalam 5 bulan [75]. Demikian dengan booster yang biasanya (dosis ketiga) pada 5 – bulan hanya terdapat sedikit resiko celah imunitas. Saat mencapai 12 bulan setelah booster level proteksi klinis dan virologi terlihat tidak berubah, dan titer serum antibodi juga relatif stabil, dengan nilai rata-rata 110 mm2 [75]. Antibodi serum isotipe IgGa dan IgGb terdeteksi setelah dua dosis vaksin pertama [117]. Setelah vaksinasi, produksi IFN-ℽ oleh PBMC yang distimulasi dalam in-vitro tidak berbeda dengan kontrol yang tidak divaksin. Akan tetapi, secara signifikan meningkat dalam kuda yang divaksin dibandingkan dengan kontrol 1 dan 2 minggu setelah uji tantang [99], yang menunjukkan bahwa vaksinasi sel T prime untuk respon CMI spesifik EIV. Hasil yang serupa didapat pada kuda cukup berumur (20-28 tahun) [1], yang menunjukkan berkurangnya respon antibodi [42, 59] dan juga berkurangnya respon anamnestik terhadap vaksin EIV konvensional dibandingkan kuda berumur muda, bahwa saat titer pre-vaksinasi serupa satu sama lain [81]. Karena vaksin canarypox mengekspresikan hanya HA saja dan tidak mengekspresikan target CTL yang lebih penting seperti NP atau M, efektivitas respon CMI yang dianggap terpisah dari respon humoral masih belum diketahui.
Penelitian telah mengeksplorasi dampak antibodi maternal influenza terhadap vaksin canarypox-HA pada anak kuda [40, 76]. Saat diberikan dengan keadaan antibodi maternal masih ada pada umur 10 – 20 minggu, tidak terjadi serokonversi. Meskipun, terdapat bukti efek vaksinasi primer, karena anak kuda yang sama yang direvaksinasi sekitar 6 bulan kemudian (saat antibodi maternal seharusnya tidak lagi ada), menunjukkan respon antibodi serum yang cukup kuat daripada anak kuda kontrol berumur sama yang divaksinasi untuk pertama kalinya. Kemungkinan hal ini mampu memuaskan keperluan manajemen untuk memvaksinasi anak kuda dan/anak kuda sapih pada umur dimana antibodi maternal mungkin mengganggu vaksin konvensional.
Terus berkembangnya penggunaan vaksin EIV vektor canarypox bersama dengan pengembangan vaksin vektor canarypox untuk penyakit kuda lainnya meningkatkan kemungkinan bahwa imunitas yang telah ada terhadap vektor canarypox dapat membatasi efektivitas booster vaksin canarypox mana saja. Hal ini dipelajari dengan menggunakan vaksin virus canarypox West Nile [37], dimana kuda menerima dua dosis vaksin primer yang terpisah 28 hari diikuti oleh booster hari ke-300+ dan 454+ setelah dosis vaksin pertama. Antibodi spesifik canarypox dan PBMC yang memproduksi IFN-ℽ terdeteksi setelah vaksin pertama, dan respon antibodi anamnestik terobservasi setelah booster pada dua waktu tersebut, tetapi respons pengingat kepada antigen virus West Nile juga diproduksi, dan karena itulah imunitas yang sudah ada sebelumnya terhadap vektor tampaknya tidak menghambat imunogenitas vaksin.
Sebuah MLV eksperimental telah dideskripsikan yang mengekresikan HA EIV (strain Ohio/03) dari rekombinan equine herpesvirus tipe I (EHV-1) [124]. Vektor rekombinan ini yang diselamatkan dari kromosom buatan bakteri yang bermutasi, diatenuasi dengan delesi gen awal IR-6 EHV-1 [94], demikian juga rangka baca terbuka (open reading frame)-1 (ORF-1), dan HA EIV dengan optimasi kodon dimasukkan sebagai ganti ORF-1 downstream (posisi gen menuju arah ujung 3’) dari promotor awal virus cytomegalovirus manusia. Hasil virus rekombinan HA-EHV kemudian diberikan dengan kombinasi rute subkutan dan IM, menginduksi antibodi HI pada serum kuda dewasa dua minggu setelah vaksinasi awal. Dua dosis memproduksi titer yang mungkin cukup untuk memberikan proteksi klinis, meskipun hal ini tampaknya belum diuji. Penelitian sebelumnya menggunakan konstruksi MLV EHV-HA berbeda telah menunjukkan respons serologis dan proteksi parsial pada anjing yang diuji secara eksperimental dengan virus canine influenza [113]. EHV-1 adalah patogen yang umum ditemukan pada kuda di seluruh dunia dan terdapat juga MLV komersial, sehingga EHV-HA mungkin dapat berlaku sebagai vaksin kombinasi. Karena banyak kuda akan memiliki level imunitas yang telah ada terhadap EHV-1 dengan level yang tinggi, masih ditunggu apakah hal ini ataukah antibodi maternal terhadap EHV-1 pada anak kuda dapat mempengaruhi ekspresi HA dan performa vaksin. EHV-1 yang ditemukan pada kuda memproduksi keadaan laten karier dimana infeksi virus berulang dapat terjadi, dan dampak hal ini terhadap respon imun anti-HA masih belum diketahui.
Teknologi vaksin yang lain
Teknologi vaksin yang lain juga telah dipertimbangkan. Vaksin EIV rekombinan baculovirus-HA telah diuji pada mencit, dengan pemberian melalui IN pada lisate sel terinfeksi [93]. Vaksin ini berimunonegik rendah setelah dua dosis diberikan, menginduksi antibodi serum yang terdeteksi dengan ELISA tetapi tidak terdeteksi melalui uji netralisasi, dan mencit yang telah divaksin hanya terproteksi parsial saja. Pemberisan bersama toksin kolera tidak memperbaiki performa baculovirus-HA. Vaksinasi oral (misalnya vektor rekombinan Salmonella atenuasi) telah dipertimbangkan, tetapi sampai saat ini tidak dapat deskripsi penggunaannya untuk vaksinasi EIV.
Meningkatkan vaksin EIV dan cakupannya
Vaksin EIV yang tersedia sekarang ini lebih superior dibandingkan yang tersedia 20 tahun yang lalu. Terutama dikarenakan:
- Pengembangan dan penggunaan secara luas model uji tantang yang dapat dipercaya pada spesies target,
- Korelasi antara titer antibodi pasca vaksinasi dengan proteksi klinis dan virologi pada spesies target [87],
- Usaha yang bersungguh-sungguh untuk melacak antigenic drift pada virus yang bersirkulasi dan membuatnya sebagai bukti untuk rekomendasi untuk pembaharuan strain virus dalam vaksin [82].
Selain itu juga, kontrol kualitas produksi vaksin EIV telah diperbaiki dengan diperkenalkannya metodologi difusi radial tunggal untuk mengukur reproduksibilitas kandungan antigen [134].
Badan yang bertanggung jawab terhadap regulasi, termasuk USDA dan EMA telah menerima vaksinasi eksperimental dan uji tantang pada kuda sebagai bukti kritis untuk pembuktian efektivitas vaksin, dan juga telah menerima prinsip-prinsip perlunya pembaharuan strain vaksin yang efisien dalam vaksin, meskipun pada prakteknya diperlukan lebih banyak efisiensi. Komplain yang pada umumnya disuarakan oleh produsen vaksin adalah biaya pembaharuan strain yang tidak cocok dengan nilai pasaran produk. Penyederhanaan persyaratan akan membantu mengatasi permasalahan ini. Ketika vaksin dikembangkan dengan teknologi rekombinan DNA masuk ke pasaran dan pada prinsipnya dapat diperbaharui dengan mutasi beberapa nukleotida di dalam platform vektor yang dinyatakan cukup stabil, dengan tidak ada perubahan dalam proses manufakturnya, kita dapat membayangkan bahwa perizinan produk yang sudah diperbaharui tersebut mungkin akan menjadi rutinitas di masa depan.
Pembaharuan strain virus dalam vaksin yang efektif memerlukan pemahaman yang selengkap mungkin terhadap varian antigenik yang saat ini bersirkulasi. Hal ini memerlukan surveilans dan diagnosis yang efektif. Metode diagnosis saat ini untuk virus EIV memang efektif, tetapi surveilans yang ada masih jauh dari komprehensif di banyak bagian dunia, terutama dimana equine influenza bersifat enzootik. Penyakit ini tidak wajib dilaporkan di Amerika Serikat, dan penulis berpandangan bahwa kebanyakan kasus tidak pernah didiagnosa dengan layak. Tetapi mungkin masih untung bahwa varian antigenik baru masih mungkin memicu wabah penyakit berskala besar di suatu tempat di dunia, dan wabah-wabah ini kemudian menjadi perhatian yang besar.
Penghalang lainnya dalam pembaharuan vaksin bahwa di beberapa pasar besar, termasuk Amerika Serikat, tidak terdapat mekanisme efektif untuk penarikan vaksin yang sudah dijual dipasaran yang mengandung strain vaksin yang sudah usang. Vaksin-vaksin ini masih diizinkan untuk dipasarkan dan dijual. Model matematika telah mengindikasikan bahwa meskipun strain EIV yang usang dalam vaksin dapat memberikan dampak yang relatif kecil pada setiap individu kuda, pada level populasi mereka dapat meningkatkan resiko terjadinya wabah cukup signifikan [103].
Hanya kampanye diseminasi informasi berskala besar (edukasi berkelanjutan tingkat lokal, nasional, dan internasional) yang dapat membuat pemilik kuda dan praktisi perkudaan menyadari pentingnya membeli vaksin yang sudah diperbaharui. Level edukasi berkelanjutan yang ada saat ini masih belum cukup. Di banyak negara, termasuk Amerika Serikat, vaksinasi EIV bersifat opsional, kecuali pada saat-saat tertentu (misalnya jika kuda bepergian ke luar negeri ke negara dimana vaksinasi diperlukan sebagai prasyarat importasi). Informasi survei dari US National Animal Health Monitoring System (survei Equine 1998 dan Equine 2005) menunjukkan bahwa vaksinasi influenza adalah salah satu dari vaksinasi yang umum dilakukan di wilayah yang disurvei, akan tetapi hanya 63% dari kuda yang ada (anak kuda umur satu tahun atau lebih) menerima vaksinasi. Sementara itu, 24% dari usaha terkait kuda tidak memberikan vaksinasi apapun dalam waktu 12 bulan sebelum survei, dan 85% dari acara perkudaan (pacuan kuda, pameran, trial, polo, dan acara lainnya) tidak memberlakukan persyaratan vaksin (www.aphis.usda.gov/wps/portal/banner/help?1dmy&urile=wcm%3apath%3a%2Faphis_content_library%2sa_our_focus_%2Fsa_animal_health%2Fa_monitoring_and_surveillance%2Fsa_nahms%2Fct_nahms_equine_studies). Data survei yang dikumpulkan di Inggris menunjukkan bahwa capaian vaksinasi EIV sekitar 80% [61], meskipun telah dikatakan bahwa adanya bias responder berarti bahwa angka ini terutama mewakili kuda untuk kompetisi (klub Jockey mempunyai kebijakan persyaratan vaksinasi EIV wajib) dan cakupan keseluruhan mungkin serendah-rendahnya 45% [60].
Sehubungan dengan vaksin itu sendiri, pembaharuan dalam potensi antigenik dan durasi imunitas juga diperlukan. Berdasarkan uji SRH, puncak titer antibodi serum pasca vaksinasi pada kebanyakan kuda berkisar antara 120 – 200 mm2 yang menganugerahkan proteksi klinis tetapi mungkin marjinal dalam proteksi virologi penuh melawan tantangan dari strain virus heterolog, dan terutama pada kuda berumur kuda puncak titer ini tidak berlangsung lama. Satu hasil menunjukkan bahkan pada anak kuda sapih dan anak kuda umur 1 tahun yang dipelihara dengan baik, terdapat ‘celah imunitas’ seperti yang didiskusikan sebelumnya dalam bab ini. Vaksin yang menginduksi titer antibodi yang lebih tinggi dan bertahan lebih lama akan membantu mengurangi kerawanan virus EIV pada kuda umur muda dan kuda-kuda yang divaksin secara reguler. Potensi antigenik yang lebih besar juga seharusnya dapat membantu mengatasi permasalahan respon rendah dalam populasi kuda, yang kadang kala berlaku sebagai kasus indeks yang mendedahkan dan mengeluarkan bibit virus EIV dalam jumlah besar, yang mampu mengatasi proteksi parsial pada kuda yang berkontak, menyebabkan munculnya wabah. Lopez dan koleganya [70] mendemonstrasikan salah satu pilihan untuk meningkatkan performa vaksin konvensional. Pemberian vaksin virus EIV penuh ber adjuvan komersial bersama kombinasi dengan oligo deoksinukleotida yang mengandung CpG sintetik tidak bermetil (CpG ODN) menginduksi titer antibodi serum yang lebih tinggi secara signifikan daripada hanya vaksin saja, dan isotipe antibodi kritis IgGa dan IgGb, demikian juga subkelas IgG(T) juga meningkat signifikan. Akan tetapi, CpG ODN sebagai adjuvan sekunder tidak memunculkan titer antibodi yang bertahan lebih lama.
Pentingnya neuraminidase EIV sebagai antigen vaksin masih belum dieksplorasi. Evolusi NA telah paralel dengan evolusi HA, seperti ditunjukkan oleh pohon filogeni yang berstruktur serupa, dengan cabang keturunan “Amerika” dan “Eurasia” di tahun 1990-an, dan Florida clade 1 dan 2 sejak 2003 [88, 136]. Respon antibodi spesifik NA terhadap vaksin virus EIV penuh konvensional belum dilaporkan dan mungkin berkontribusi signifikan terhadap status imunitas kuda yang telah divaksin. Meskipun begitu, seperti yang ditunjukkan oleh vaksin canarypox-HA dan vaksin DNA eksperimental, proteksi klinis dan virologi signifikan melawan EIV dapat diinduksi hanya oleh HA saja.
Pada akhirnya, terdapat banyak minat untuk mengembangkan vaksin EIV universal yang tidak akan usang dikarenakan antigenic drift. Untuk influenza manusia, vaksin universal diarahkan pada isotop tersimpan, misalnya cabang HA atau M2 ectodomain masih dipelajari (untuk pembahasan silahkan baca Du, dkk. [33]). Pengembangan aplikasi vaksin influenza manusia diikuti dengan ketat oleh peneliti vaksinologi veteriner. Jika pengujian lapangan vaksin universal diinginkan pada manusia sebelum pengujian pada manusia, maka mungkin spesies babi atau unggas yang paling awal dipilih sebelum kuda, karena strain EIV yang bersirkulasi sekarang sangat bervariasi atau berevolusi dengan sangat cepat. Akan tetapi, masa hidup kuda yang lebih panjang daripada hewan pedaging memungkinkan studi jangka panjang tentang efektivitas vaksin baru, seperti misalnya efektivitas berkelanjutan vaksinasi booster berulang, atau penggunaannya dengan kombinasi bersama vaksin lain, yang mungkin memiliki dampak penggunaan pada manusia. Spektrum teknologi vaksin yang luas yang telah dikomersilkan untuk pembuatan vaksin EIV mengindikasikan bahwa vaksin universal yang baru untuk EIV akan mendapatkan penerimaan yang lebih cepat.
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

