Oleh: Gabriele A. Landolt dan Thomas M. Chambers
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Sejarah
Flu kuda (Equine Influenza/EI) telah sering kali diobservasi dalam 1000 tahun terakhir, sering diasosiasikan dengan epidemi influenza manusia [91], dan sindrom umum penyakit respirasi mirip influenza pada kuda telah dideskripsikan sejak zaman Romawi. Semua equidae (kuda, bagal dan keledai) rentan terhadap penyakit ini. Virus yang pertama kali diisolasi yaitu virus A/H7N7 didapatkan pada saat terjadinya epidemi penyakit respirasi di Eropa Timur tahun 1956 [131], dan virus-virus dari subtipe ini (equine-1) kemudian diisolasi dari kuda dari belahan bumi timur dan barat, menyebar sampai ke Amerika Serikat dan Inggris di tahun 1963. Secara kebetulan, subtipe 1963 kedua yaitu A/H3N8 (equine-2) ditemukan [153], dan sejak itulah virus equine influenza (EIV) tetap menjadi salah satu patogen respirasi paling penting pada kuda. Dari tahun 1963 sampai 1979, subtipe H7N7 dan H3N8 dari virus EIV bersirkulasi bersama-sama, dan kadang-kadang keduanya diisolasi bersama ketika terjadi wabah EI [1, 31, 120]. Sejak tahun 1979, virus-virus equine-1 H7N7 tampaknya telah menghilang dari populasi kuda [57, 150, 155], meskipun bukti serologis terbatas menunjukkan bahwa virus-virus H7N7 mungkin masih bersirkulasi dalam level yang rendah pada populasi di Asia Tengah [135], Afrika [111], dan Eropa Timur [1, 85]. Sebaliknya, virus-virus equine-2 H3N8 terus bersirkulasi secara luas, dianggap sebagai enzootik di Eropa dan Amerika, dan populasi kuda di sebagian besar wilayah dunia telah mengalami wabah yang berulang kali.
Diasumsikan bahwa kedua galur virus ini mungkin berasal dari leluhur virus avian influenza A akan tetapi berevolusi menjadi spesifik hospes dan secara genetik berbeda jauh dengan virus avian influenza dari subtipe yang sama [73, 156]. Untuk galur equine-2, HA dan NA demikian juga gen untuk beberapa protein internal, seperti PA, NP dan NS, mungkin bercabang dari leluhur virus avian influenza sekitar tahun 1952-1954 [12, 160]. Gen-gen ‘internal’ dari prototype virus EIV equine-1 (strain Prague/56) sangat-sangat primitif, dan dipercaya sebagai contoh gen-gen paling dekat yang masih tersisa dari leluhur awal virus influenza tipe A dan tipe B. Virus EIV H7N7 equine-1 telah memicu minat yang cukup besar karena sebuah studi oleh Worobey dan koleganya [160], dengan menggunakan model hospes spesifik jam lokal (local clock) untuk uji filogenetik, menemukan bahwa dalam keseluruhan 8 segmen gen kecuali keturunan NS ‘B’, leluhur paling umum terkini dari virus equine H7N7 dan virus avian influenza kemungkinan berasal dari zaman antara tahun 1830-an dan 1970-an. Peneliti-peneliti ini mengatakan bahwa kebetulan penanggalan ini bersamaan dengan epizootik flu kuda yang sangat masif di tahun 1872 yang berdampak pada kuda di seluruh Amerika Utara, berpindah dari timur ke barat mengikuti rute jalur kereta api [69]. Epizootik EI yang terjadi ini secara temporal dan geografis dihubungkan dengan epizootik kematian tinggi pada unggas yang dicurigai sebagai HPAI [90]. Fakta yang mendukung hal ini adalah HA dari virus H1N1 equine-1 adalah satu-satunya contoh jalur keturunan yang stabil dari genotipe HA ‘patogenitas tinggi’ pada mamalia, dengan tempat pembelahan HA1/HA2 polibasis (R-K-K-R dalam prototipe strain Prague/56) dan pembelahan HA efisien dalam kultur sel tanpa adanya tripsin eksogenus. Virus-virus equine-1 berpatogenitas tinggi pada mencit Balb/c tanpa adaptasi, dan reassortant virus avian influenza yang membawa HA H7 equine-1 bersifat patogenik tinggi pada ayam [8, 72]. Worobey dan koleganya telah berspekulasi bahwa epizootik unggas tahun 1872 adalah penanda epidemiologi untuk sebuah “global sweep”/ wabah penyapu dunia atau pergantian semua gen internal semua virus in avian influenza (kecuali untuk keturunan NS “B”). Selain itu pula, kandungan uracil dengan kadar yang tidak biasanya sangat tinggi pada gen virus keturunan H7N7 terus bersirkulasi pada kuda mulai dari 1872 [160].
Antara tahun 1964 dan 1973, sementara virus EIV H7N7 dan H3N8 sedang bersirkulasi bersama. Kejadian reasortansi satu arah (atau lebih dari satu kejadian) menggantikan sebagian besar gen internal primitif equine-1 ini (kecuali gen M) dengan bagian baru yang diturunkan dari equine-2 yang lebih modern [11, 68, 100]. Turunan avian influenza virus EIV didukung oleh kemunculan virus H3N8 baru tahun 1989 pada babi di China Utara, strain Jilin/98 yang secara antigenik dan genetik berbeda dengan keturunan equine-2 yang sudah ada. Ciri-ciri genetiknya tersusun seluruhnya dari keturunan avian, mengindikasikan bahwa virus telah menyebar secara langsung kepada kuda dari reservoir unggas tanpa genetic reassortment [59]. Meskipun virus tersebut menginfeksi lebih dari 20.000 ekor kuda dan menyebabkan kematian sekitar 400 ekor kuda, virus ini tidak bertahan lama, dan terakhir diisolasi tahun 1990. Hal ini mendemonstrasikan bahwa equidae rentan terhadap beberapa virus avian influenza, termasuk virus yang termasuk dalam subtipe H3N8. Subtipe avian influenza lain kompeten dalam bereplikasi dalam epitel trakea kuda, tetapi dari hanya sedikit yang telah diuji dengan infeksi eksperimentasi melalui aerosol pada kuda poni (H1N2, H6N2, dan H7N2), tidak ada yang mampu memproduksi replikasi yang terdeteksi ataupun gejala klinis [26].
Tingkat mutasi genetik virus EIV rendah jika dibandingkan dengan virus influenza A keturunan manusia [12, 39, 44, 100], sekitar 1,8 x 10-3 nukleotida dan 1,4 x 10-3 substitusi asam amino per situs per tahun pada HA1, dibandingkan dengan tingkat 4,8 x 10-3 nukleotida dan 6 x 10-3 substitusi asam amino per situs pembelahan per tahunnya pada HA virus H3 manusia. Virus EIV mengalami evolusi genetik dan antigenik yang signifikan. HA telah cukup banyak dipelajari karena kepentingan vaksinasi yang efektif (baca Bab 21). Sebelum akhir 1980-an, HA equine-2 tampaknya berevolusi dalam 1 galur keturunan [73], akan tetapi pemasukan dan menetapnya virus EIV keturunan Amerika pada babi di Eropa berakibat terjadinya sirkulasi bersama-sama kedua keturunan virus ini di Eropa, sementara sebaliknya hanya ada satu saja isolasi virus keturunan Eropa pada kuda di Amerika Utara [22, 40, 79]. Seterusnya, divergensi genetik HA dari virus EIV dari keturunan Amerika yang terus berlanjut mengakibatkan terbentuknya tiga sub keturunan berbeda, yaitu Amerika Selatan, Kentucky dan Florida [79]. Sepanjang 2002, HA dari sub keturunan Florida lebih jauh lagi berevolusi menjadi dua kelompok antigenik berbeda, disebut sebagai sub keturunan Florida clade I dan 2 (Gambar 20.1). Murcia dan kolega [100] mengelompokkan evolusi HA EIV kedalam 12 clade, dimana Florida clade 1 dan 2 termasuk yang paling baru. Mereka juga menemukan bahwa NA EIV dan gen internal telah berevolusi pula bersamaan dengan HA sesuai dengan keturunan dan clade nya, bersama adanya bukti reasortansi antar clade. Sementara clade 1 dominan di Amerika (dan memang sudah terdeteksi virus Florida clade 2 di Amerika Serikat dalam tahun-tahun belakangan), clade 1 EIV juga telah menyebar dan menyebabkan wabah di Eropa [22, 23, 53], Australia [154], Afrika [75], dan Asia [164]. Sebagai contoh, virus yang diisolasi dari wabah di Afrika Selatan tahun 2003, dan dari wabah tahun 2007 di Jepang yang menyebar ke Australia kemungkinan berasal dari Amerika Utara [22, 154]. Sebaliknya, virus yang termasuk dalam clade 2 sub keturunan Florida telah diisolasi di Eropa [80, 159], sebagian Afrika [78], dan Asia [13, 170, 171]. Dampak evolusi genetik dan antigenik ini terhadap vaksin didiskusikan lebih lanjut dalam Bab 21. Ciri lain dari evolusi virus EIV adalah ‘frozen evolution”/evolusi beku, yaitu sesekali terdeteksinya virus anakronistik, tampaknya bersirkulasi bertahun-tahun atau berdekade setelah mereka pertama kali diisolasi [18, 19, 44, 86]. Hal ini masih belum dapat dijelaskan, meskipun lepasnya virus dari laboratorium jelas merupakan sebuah kemungkinan, dan untungnya (karena hal ini akan mengacaukan pembaruan vaksin) virus-virus anakronistik ini tampaknya tidak bertahan dalam jangka waktu lama.
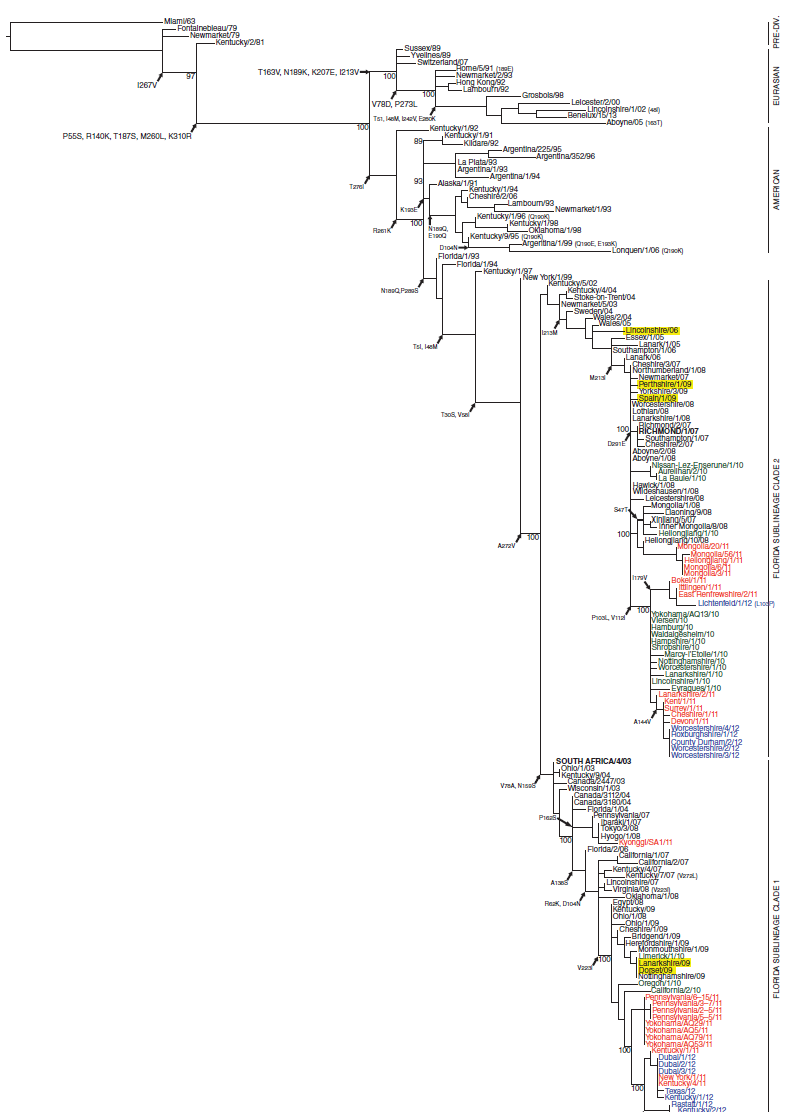
Gambar 20.1 Pohon filogenetik virus EIV sekuens nukleotida H3N8 HA1. pohon filogenetik dengan kemungkinan maksimum ini dibuat menggunakan PhyML versi 3. Nilai bootstrap didapat setelah 100 replikasi terlihat pada nodus-nodus utama. Substitusi asam amino ditunjukkan dalam kurung atau diindikasikan pada titik percabangan. Kelompok filogenetik (Pre-divergen, Keturunan Amerika, Keturunan Eurasia, sub-keturunan Florida clade 1 dan 2) ditunjukkan di sebelah kanan. Sekuens dikodekan dengan warna berdasarkan tanggal isolasi untuk tahun 2010 (hijau), 2011 (merah), dan 2012 (biru), dengan isolat yang lebih tua ditandai dengan warna hitam. Perwakilan strain vaksin yang direkomendasikan OIE saat ini yaitu A/eq/Richmond/1/07 dan A/eq/South Africa/4/03 dicetak tebal. Strain reassortant yang diidentifikasi mengandung HA dari satu clade Florida dan NA dari lainnya diberi penanda warna kuning. Direproduksi kembali dari Woodward A. L. et al., Development of a surveillance scheme for equine influenza in the United Kingdom and characterisation of viruses isolated in Europe, Dubai and the USA from 2010-2012. Veterinary Microbiology 169: 113-127, 2014, with permission from Elsevier. Kami berterima kasih pada Dr. Adam Rash yang menyediakan gambar untuk digunakan pada bab ini.
Meskipun telah dilakukan kampanye vaksinasi intensif dalam banyak negara industri di dunia, epizootik flu kuda berat terus terjadi secara sporadis dan menggarisbawahi adanya ancaman berkelanjutan yang dimiliki virus EIV terhadap kesehatan kuda di seluruh dunia. Sebagai contoh, mendekati akhir abad ke-20, wabah flu kuda signifikan dilaporkan dalam beberapa tahun di India [149], RRC [59, 60, 134], dan Afrika Selatan [62], dimana virus EIV tidak diketahui bersirkulasi. Di India dan China, dimana hanya ada sedikit upaya pengendalian, kemungkinan virus EIV terus bersirkulasi dalam level rendah, hanya meningkat menjadi wabah berskala besar jika varian antigenik baru muncul, dimana virus yang memacu wabah tahun 1987 di Afrika Selatan kemungkinan besar masuk melalui importasi kuda terinfeksi dari Amerika Serikat atau Eropa [74]. Di akhir 2003 wabah besar kedua terjadi di Afrika Selatan, dan wabah ini dianggap karena kombinasi dari masuknya kuda impor dari Amerika Serikat, meskipun sudah divaksin sebelumnya, dan adanya kebocoran dalam biosekuriti memungkinkan virus untuk menyebar melalui transmisi fomite [61]. Di tahun yang sama, wabah yang menyerang kuda yang pada umumnya telah divaksin dengan baik terjadi di Inggris, infeksi terkonfirmasi pada setidaknya 12 lokasi dan setidaknya 21 lapangan latihan kuda di Newmarket [9, 105]. Sejak saat itu, wabah flu kuda telah terjadi di Afrika Selatan [61], India [152], Jepang [164], dan, untuk pertama kalinya, di Australia [154]. Seperti wabah Afrika Selatan di 2003, wabah di Jepang dan Australia juga dipercaya disebabkan oleh importasi kuda terinfeksi subklinis yang sudah divaksin dari Amerika Serikat ke Jepang (strain Ibaraki/07) dan tidak lama kemudian berlanjut masuk ke Australia (strain Sydney/07) [25, 154, 164]. Di Sydney, setelah masuk ke negara itu kuda-kuda tersebut ditempatkan dalam karantina, tetapi telah ditetapkan bahwa kemungkinan terjadi kebocoran dalam protokol karantina telah memungkinkan transmisi fomite virus diluar fasilitas karantina, dan setelahnya virus tersebar ke dalam populasi kuda di Australia [25]. Sekitar 70.000 ekor kuda di New South Wales dan Queensland bagian tenggara terinfeksi selama wabah terjadi [25, 137]. Dengan secepatnya menginisiasi upaya pengendalian, terdiri dari kontrol ketat terhadap transportasi kuda, karantina tempat-tempat terdampak atau yang dicurigai terdampak, vaksinasi tertarget, surveilans aktif, dan biosekuriti dalam peternakan (higiene personal, higiene peralatan, dan akses terhadap upaya pengendalian), berhasil untuk menahan wabah tetap berada di dua negara bagian ini [47]. Lebih penting lagi, upaya pengendalian yang ketat ini akhirnya sukses mengeradikasi virus EIV dan Australia mendapatkan status bebas virus EIV pada bulan Desember 2008 [51, 131].
Implikasi Ekonomi
Bahkan dengan kesediaan vaksin yang efektif, flu kuda masih menjadi penyakit yang secara ekonomi penting bagi kuda. Di negara-negara industri, flu kuda sering dikendalikan dengan vaksinasi, dengan menerapkan pembatasan pergerakan hewan yang terdampak (karantina), dengan mengistirahatkan hewan terdampak, dan jika diperlukan, dengan memberikan penanganan medis suportif. Akan tetapi di banyak belahan dunia, kuda, keledai dan bagal tetap memiliki peranan utama sebagai hewan pekerja, dan wabah virus influenza dapat berakibat pada dampak sosio ekonomi berat pada negara-negara ini [134].
Biaya yang dihubungkan dengan infeksi flu kuda terutama disebabkan berkurangnya manfaat hewan tersebut (karena sakit dan/atau dikarantina), biaya medis (dihubungkan dengan pengobatan, vaksinasi, uji diagnostik dan manajemen wabah), dan kadang-kadang karena kematian hewan terdampak disebabkan oleh komplikasi terkait flu kuda itu sendiri. Meskipun sulit untuk menemukan data yang dapat diandalkan tentang dampak finansial terkait flu kuda, dua studi terbaru telah memperkirakan besarnya biaya terkait wabah virus EIV berskala kecil dan skala besar. Von Seeh dan koleganya baru-baru ini mempublikasikan dara yang dikoleksi selama wabah virus EIV skala kecil yang terjadi tahun 2009 pada sebuah fasilitas gudang yang memiliki 35 ekor kuda [132]. Hanya lima dari kuda-kuda ini telah divaksin influenza, dan tidak ada ada satupun dari kuda yang telah di vaksin yang menimbulkan gejala klinis flu kuda, dan 10 dari kuda tersebut membutuhkan perawatan veteriner. Biaya rata-rata perawatan medis veteriner yang disediakan kira-kira sebesar 450 dolar Australia per ekor [132]. Estimasi ini tidak mencakup kerugian karena hilangnya manfaat kuda yang dipelihara dalam fasilitas terdampak selama pemberlakuan periode karantina. Menariknya, biaya vaksinasi rata-rata, termasuk biaya vaksin kunjungan dokter hewan (biaya telepon, biaya pemeriksaan, biaya prosedur, dan biaya administrasi) diperkirakan sebesar 60 dolar Australia [132].
Analisis yang dipublikasikan oleh Smyth dan kolega mendeskripsikan biaya rata-rata baik yang dikeluarkan oleh pemerintah maupun industri kuda di Australia yang dikeluarkan sebagai respons darurat yang diarahkan untuk menahan dan mengeradikasi virus selama wabah di Australia tahun 2007 [137]. Biaya finansial wabah meliputi biaya upaya respons darurat dan hilangnya pendapatan karena terganggunya perpindahan kuda dan acara-acara terkait kuda. Paket asistensi (misalnya asistensi pekerjaan, tambahan upah) diberikan oleh pemerintah Australia kepada industri kuda jika ditotal mencapai lebih dari 263 juta dolar Australia. Selain itu, pemerintah menyediakan biaya sebesar 97.7 juta dolar Australia untuk mencakup biaya-biaya yang muncul dari respons darurat itu sendiri. Keseluruhan dampak ekonomi terhadap industri kuda antara bulan Agustus sampai Desember 2007 diperkirakan sebesar 381 juta dolar Australia (mewakili kerugian mingguan sebesar 21,2 juta dolar Australia). Angka ini dikalkulasi dengan menambahkan estimasi dampak ekonomi wabah terhadap pendapatan rumah tangga, pendapatan bisnis, kerugian bisnis lokal, kerugian yang diderita oleh asosiasi perkudaan, biaya dokter hewan, dan hilangnya nilai hewan karena sakit dan kematian. Meskipun hanya 1622 ekor (12,5%) dari 13.004 ekor kuda yang terinfeksi tercakup dalam survei yang dilaksanakan oleh Dewan Industri Kuda Australia memerlukan perawatan veteriner, biaya veteriner untuk kuda-kuda ini mencapai total 744.400 dolar Australia. Berdasarkan data dari survei yang sama, angka kematian diestimasikan sebesar 5% (79 kematian disebabkan EIV), dan total nilai dari kuda yang mati karena infeksi EIV dilaporkan sebesar 945.000 dolar Australia [137].
Meskipun angka-angka ini tampak besar, potensi dampak sosial setiap wabah penyakit menular tidak boleh diremehkan. Di negara-negara berkembang dimana equidae yang dipakai sebagai pekerja masih dipekerjakan secara luas sebagai hewan bean, wabah penyakit kuda, termasuk virus EIV, dapat berpotensi mengambil nyawa manusia. Morens and Taubenberger [91] menghubungkan bagaimana besarnya epizootik virus EIV tahun 1872 sebagian bertanggung jawab terhadap keparahan kejadian api besar yang membakar kota Boston (Great Boston Fire) yang menghancurkan sebagian besar kota itu. Kejadian ini merupakan kejadian kebakaran dengan kerugian paling besar dalam sejarah karena kuda milik Departemen Pemadam Kebakaran tidak mampu bekerja karena sakit dan kereta pemadam kebakaran harus ditarik oleh manusia dan karena itulah menjadi sangat sulit untuk mencapai tempat kebakaran. Wabah penyakit lokal di Hong Kong tahun 1992, yang mengenai 352 ekor kuda pacu (sekitar 25% dari populasi kuda yang ada), biaya yang dikeluarkan oleh kota Hong Kong adalah 10% dari penerimaan pajaknya selama wabah terjadi, dan harus diganti kemudian [121]. Wabah virus EIV di Australia tahun 2007 mengganggu banyak jadwal pacuan kuda, acara pameran dan atraksi, dan juga acara kualifikasi dan seleksi untuk mengikuti Olimpiade Beijing tahun 2008 [66]. Selain itu, Taylor dan koleganya mendokumentasikan stress psikologi yang dialami oleh para pemilik kuda selama wabah virus EIV Australia tahun 2007 [143], terutama pemilik kuda yang masih muda, yang pendapatan utamanya berasal dari industri terkait kuda, demikian juga dengan yang memiliki tingkat pendidikan rendah. Menariknya, meskipun terdapat fakta bahwa prevalensi stress psikologi lebih tinggi di wilayah dimana infeksi telah dilaporkan (di New South Wales dan Queensland), pemilik kuda secara nasional juga mengalami peningkatan level stress psikologi [143].
Penularan kepada hospes mamalia lainnya
Sebelum tahun 2004, kuda dipandang sebagai hospes terisolir atau ‘dead-end’ untuk virus influenza A, karena penularan cross spesies virus EIV terdokumentasikan hanya pada beberapa laporan saja. Sebagai contoh, infeksi eksperimental pada sukarelawan manusia dengan virus equine H3N8 mengakibatkan penyakit mirip influenza yang dihubungkan dengan pendedahan virus dan serokonversi [34, 70], meskipun virusnya hanya infeksius sedang dan berpatogenitas cukup lemah. Sebaliknya, penularan sesekali virus H1N1, H2N2, dan H3N2 antara manusia ke kuda telah dilaporkan [64, 148], dan infeksi eksperimental pada kuda dengan virus H3N2 dari manusia mendemonstrasikan kerentanan mereka terhadap infeksi virus dari manusia [70]. Meskipun terdapat laporan-laporan tersebut demikian juga laporan dari abad ke-12 sampai abad ke-19 tentang adanya hubungan antara wabah influenza pada kuda dan manusia [91], sejak dimulainya era virologi modern tidak ada bukti yang menunjukkan adanya penularan baik dari kuda ke manusia atau dari manusia ke kuda yang secara rutin terjadi dalam kondisi alamiah. Survei serologis individu yang berdekatan dengan kuda hanya menemukan titer positif sesekali dan juga dalam kadar yang rendah [24] (K. R Leedom Larson, komunikasi personal, 2009), dan satu-satunya laporan yang dipublikasikan tentang infeksi virus EIV pada manusia yang terjadi secara alamiah tidak disokong oleh isolat virus [14].
Akan tetapi, anggapan bahwa kuda sebagai niche ekologi terisolir dan akhir/’dead-end’ untuk virus influenza A telah hancur dengan adanya penularan virus EIV H3N8 pada anjing di Amerika [36, 116], Inggris [28, 104], dan Australia [76]. Berlawanan dengan infeksi sporadis virus influenza manusia yang dilaporkan sebelumnya pada anjing yang tidak berakibat munculnya gejala klinis pada anjing [15, 16, 30, 67, 144], dan tidak tersebar antar anjing [109], infeksi anjing dengan virus equine H3N8 telah dihubungkan dengan munculnya gejala klinis penyakit respirasi, termasuk pneumonia fatal [36, 38, 76, 104]. Selain itu, penyembuhan virus dari pada anjing dari seluruh Amerika Serikat mengindikasikan adanya penyebaran virus dan menyokong bertahannya virus H3N8 keturunan equine dalam populasi anjing di negara itu [36]. Selain kejadian penularan cross-spesies secara alami, virus EIV juga dilaporkan menyebar dari kuda yang diinfeksikan secara eksperimental kepada anjing yang dipelihara dalam satu tempat yang sama [163, dan inokulasi eksperimental pada anjing dengan virus EIV H3N8 mengakibatkan pendedahan virus via nasal dan kemudian serokonversi [117].
Di Amerika Serikat, kemunculan keturunan virus canine influenza dipercaya terjadi setelah penularan tunggal satu virus H3N8 dari kuda ke anjing yang terjadi sekitar tahun 2004 [36]. Meskipun begitu, bukti serologis [2] menunjukkan bahwa virus mirip canine influenza bersirkulasi pada anjing greyhound pacuan di Amerika Serikat sebelum 2004, dan kemungkinan dari tahun 1999. Karena beberapa kejadian penularan tambahan equine H3N8 telah didokumentasikan sejak awal tahun 2000, telah dipostulasi bahwa evolusi genetik virus-virus dari keturunan equine H3N8 berakibat terjadinya mutasi yang memfasilitasi infeksi pada sel respirasi canine oleh virus equine mutan ini. Hipotesis ini tampaknya didukung oleh temuan baru [56] yang menunjukkan bahwa infeksi trakea anjing dengan isolat virus EIV H3N8 2003 (A/equine/South Africa/2003) meniru karakteristik infeksi dan replikasi virus H3N8 keturunan canine. Sebaliknya, infeksi kultur jaringan trakea anjing dengan dua virus H3N8 equine yang diisolasi di tahun 1963 (A/equine/Miami 1963 dan A/equine/Uruguay/1963) menunjukkan berkurangnya efisiensi replikasi dan virusnya menjadi kurang patogenik [56]. Dalam istilah evolusi, virus-virus canine influenza H3N8 lebih dekat kekerabatannya dengan sub keturunan equine Florida clade 1, dan HA yang dikandungnya berbeda dengan HA dari virus equine H3N8 dilihat dari lima mutasi asam amino nya (N54K, N83S, W222L, 1328T, dan N483T) [36, 127]. Substitusi triptopan (W) menjadi Leusin (L) pada residu 222 yang berlokasi dekat kantong perlekatan reseptor menjadi titik perhatian, karena mempengaruhi spesifisitas perlekatan protein HA untuk analog reseptor. Menariknya, dengan begini, beberapa studi menunjukkan bahwa isolat equine dan canine menunjukkan preferensi perlekatan terhadap asam sialik (SA) ⍺2,3-gal [32, 38, 117, 142], yang dicerminkan dengan dominan residu SA ⍺2,3 disepanjang saluran pernafasan canine dan equine [38, 117, 142]. Akan tetapi dalam epitel trakea kuda sebagian yang dominan adalah N-glycolyl SA ⍺2,3-gal [142], daripada N-acetyl SA ⍺2,3-hal yang ditemukan pada spesies unggas. Menariknya juga, Yamanaka dan Koleganya [168] melaporkan bahwa sementara virus EIV menunjukkan preferensi perlekatan yang jelas untuk sebagian reseptor N-glycolyl SA⍺2,3-gal, isolat H3N8 tampaknya tidak menunjukkan preferensi untuk N-glycolyl SA ⍺2,3-gal dan satu strain canine menunjukkan berkurangnya perlekatan kepada bentuk N-glycolyl.
Melihat pada kesamaan preferensi tempat perlekatan reseptor ini, kita mungkin menduga bahwa virus H3N8 juga akan menyebar ke arah sebaliknya, yaitu dari anjing ke kuda lagi. Menariknya, studi independen menemukan bahwa dua isolat berbeda virus canine influenza H3N8 tidak dapat menginfeksi, bereplikasi bahkan menyebar kepada kuda yang naif influenza [124, 168]. Selain itu, inokulasi kuda dengan isolat dari anjing ini tidak menghasilkan penyakit klinis di kedua studi tersebut. Temuan ini menunjukkan bahwa ada faktor lain selain preferensi tempat perlekatan reseptor yang berkontribusi terhadap spesifisitas spesies dari virus-virus canine dan equine influenza H3N8. Anggapan ini didukung dengan studi terbaru tentang konsekuensi struktural dari substitusi asam amino tunggal antara virus H3N8 canine dan equine, yang mengindikasikan bahwa substitusi asam amino tunggal (T30S) dalam fusi subdomain HA dari virus influenza canine dan equine H3N8 baru-baru ini mungkin memodulasi stabilitas HA atau aktivitas fusi membran [32]. Substitusi ini tampaknya muncul pada virus EIV di tahun 1999, kebetulan bersamaan di tahun yang sama ketika studi serologis telah mendeteksi kemungkinan munculnya canine influenza di Amerika Serikat [2]. Kemungkinan lainnya adalah bahwa subtitusi spesifik canine 1328T pada tempat pembelahan HA1/HA2 mungkin terlibat dalam pengenalan protease terkait spesies pada tempat perlekatan tersebut [32]. Karena itu mungkin bahwa kombinasi mutasi seperti perubahan spesifisitas perlekatan reseptor dan fusi membran, mungkin penting untuk memungkinkan suksesnya penularan interspesies antara kuda dan anjing.
Virus EIV juga telah diisolasi dari dari babi selama surveilans di China [147]. Babi terdampak menunjukkan gejala respirasi termasuk batuk dan depresi. Sekuensing isolat virus mengungkapkan bahwa virus-virus ini berhubungan dengan virus EIV sejati (98.6 – 99.5% identik), tetapi dengan perubahan asam amino dalam semua segmen gen, meliputi dua perubahan pada HA (W222L dan 1328T) yang merupakan karakteristik virus canine influenza. Apakah canine atau equidae (atau spesies lain) sebagai sumber masuknya virus dalam populasi babi ini tidak diketahui. Ketika virus tersebut masuk ke babi maka dapat beradaptasi yang dapat memungkinkan virus yang diturunkan dari virus EIV menular ke manusia. Sudah jelas bahwa peranan potensial dari equidae dalam ekologi global virus influenza A masih belum dipahami.
Karakteristik klinis infeksi dan penyakit
Penampakan klinis infeksi flu kuda telah dideskripsikan secara luas di tempat lain [52], dan tetap tidak berubah sejak pertama kali dideskripsikan lebih dari 40 tahun yang lalu. Dalam kelompok kuda yang renan, flu kuda dikarakterisasikan dengan penyebaran secara cepat gejala sakit pernafasan akut disertai demam yang diikuti dengan batuk kering dan leleran hidung (Gambar 20.2). Periode inkubasinya yang singkat dan gejala klinis demikian juga pendedahan virus dapat terdeteksi paling awal 24-48 jam setelah terpapar dengan kuda yang terinfeksi atau setelah diinfeksikan secara eksperimental [37, 65, 138, 145]. Penyakit ini jarang bersifat fatal, akan tetapi kematian telah dilaporkan selama terjadinya beberapa epidemi, terutama pada keledai dan jarang pada anak kuda baru lahir (neonatal) [1, 54, 118]. Meskipun tingkat morbiditas dapat setinggi 60-90% pada populasi rentan, angka kematian biasanya kurang dari 1% [60]. Sebuah pengecualian hanya pada wabah influenza tahun 1989 di RRC yang disebabkan oleh virus H3N8 keturunan avian, dan dihubungkan dengan angka kematian 20% di beberapa kelompok hewan [59]. Angka morbiditas dalam kelompok besar kuda dengan derajat paparan terhadap antigen influenza yang bervariasi mungkin berkisar antara 20% sampai 37% [93,121].
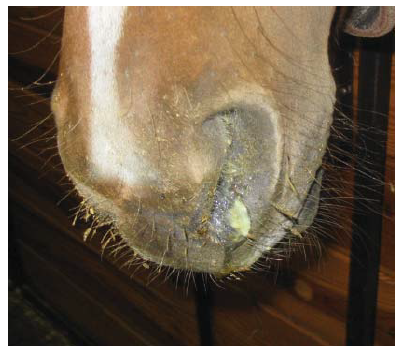
Gambar 20.2 Virus EIV yang menginfeksi kuda menunjukkan leleran hidung mukopurulen. Infeksi eksperimental dengan virus A/equine/Ohio/2003 (H3N8), 5 hari pasca infeksi. Kuda tidak menunjukkan gejala demam pada saat ini, akan tetapi batuk dan masih mendedahkan virus yang terdeteksi. Beberapa kuda pada studi ini menunjukkan puncak demam kedua, dan leleran hidung mukopurulen tetap ada sampai 9 hari pasca infeksi. Hak milik foto Thomas Chambers.
Presentasi klinis yang umum ditemukan pada flu kuda terdiri dari pireksia, anoreksia, letargi, leleran hidung dan batuk. Pireksia seringkali menjadi gejala yang pertama kali muncul, dengan temperatur tubuh yang seringkali dapat mencapai 41oC. Setelah inokulasi eksperimental, puncak pertama demam seringkali diamati 48-96 jam setelah infeksi, dengan kemungkinan puncak demam kedua terjadi antara hari ke 4 sampai ke-7 setelah infeksi. Leleran hidung biasanya berupa leleran serosa selama beberapa hari pertama, tetapi bisa berubah menjadi mukopurulen 72-96 hari pasca infeksi (Gambar 20.2). Setelahnya, muncul batuk kering. Seperti yang juga terjadi di spesies yang lain, batuk cenderung menetap lama bahkan setelah leleran hidung dan batuk tidak ada lagi, dan kuda mungkin masih batuk sampai 3 minggu pasca infeksi. Limfadenopati submandibular dan retrofaringeal adalah temuan yang bervariasi namun sering muncul.
Kebanyakan kuda yang terinfeksi menjadi anoreksia pada awal munculnya pireksia (mungkin keledai adalah pengecualian), meskipun hal ini biasanya sembuh dalam 1 – 2 hari. Konsekuensinya, penurunan berat badan terdokumentasi pada kuda yang terkena flu kuda. Efek negatif virus EI terhadap kesehatan kuda dapat diperparah bahkan hanya karena kegiatan ringan saja [166]. Abnormalitas hemogram meliputi anemia normositik, normokromik dan leukopenia. Leukopenia mungkin disebabkan adanya neutropenia dan limfopenia. Monositosis pada awal konvalensi adalah temuan yang bervariasi. Kasus equine influenza tanpa komplikasi sembuh dalam 1 – 14 hari pasca infeksi, meskipun batuk bisa tetap ada sampai 21 hari.
Pada infeksi berat, takipnea beserta terdeteksinya temuan auskultasi toraks abnormal dan bukti ultrasonografi terjadinya konsolidasi pulmoner mungkin saja terdeteksi. Pneumonia adalah konsekuensi umum pada infeksi berat, terutama jika ada komplikasi infeksi bakterial sekunder dan biasanya terjadi 7 – 14 hari setelah infeksi (Gambar 20.3) [58]. Pada kuda dewasa, kebanyakan kasus fatal mungkin karena adanya pneumonia bakterial sekunder. Karena replikasi virus mengakibatkan kematian sel [81, 82, 130], dan hilangnya epitel respiratori bersilia dalam trakea dan pohon bronkial [158], berkurangnya pembuangan dengan fungsi mukosiliar [31, 52, 157], demikian juga gangguan pada lapisan superfisial dari epitel respiratorik memberikan predisposisi kepada kuda yang terkena infeksi flu kuda terhadap berkembangnya infeksi bakterial sekunder [158, 161]. Infeksi bakterial sekunder dalam saluran pernafasan sebagian disebabkan karena proliferasi streptococcus ꞵ-hemolitik [71, 83, 92, 108, 128], dan dianggap penting dalam patogenesis pneumonia bakterial pada kuda [3, 4, 10, 98]. Myositis, myokarditis, dan edema tungkai juga telah dideskripsikan sebagai gejala sisa dari infeksi flu kuda [52, 120, 157]. Selain itu pula, telah dispekulasikan bahwa infeksi flu kuda dapat mempredisposisikan kuda terhadap berkembangnya penyakit inflamasi saluran pernafasan, sumbatan pernafasan berulang, atau hemoragi pulmoner yang diinduksi exercise [52, 120, 158]. Terakhir, defisit neurologi ditemukan pada dua ekor kuda selama wabah tahun 2003 di Inggris [42]. Hasil nekropsi pada salah satu dari dua ekor kuda ini mengungkapkan adanya ensefalitis non-supuratif. Meskipun ensefalopati terkait influenza adalah komplikasi penyakit yang jarang ditemukan, temuan ini telah dilaporkan terjadi pada manusia, terutama anak-anak [103, 141]. Patogenesis ensefalopati terkait influenza masih belum jelas. Karena virus jarang terdeteksi dalam sistem saraf pusat, invasi neuron langsung oleh virus influenza dianggap tidak menjadi penyebab terjadinya ensefalopati [141].
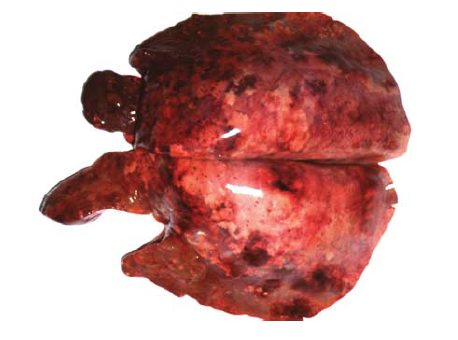
Gambar 20.3 Pneumonia broncho interstitial akut berat dengan edema dan hemoragi pada kuda disebabkan oleh infeksi virus flu kuda A dan infeksi sekunder bakteri. Foto dari Noah’s Arkive, University of Georgia.
Epidemiologi
Flu kuda adalah penyakit respirasi virus yang paling sering didiagnosa dan penyakit yang secara ekonomi penting pada kuda di sebagian besar wilayah dunia [93, 96, 133]. Dengan New Zealand, Islandia dan Australia sebagai pengecualian, virus EIV dikatakan enzootik pada populasi kuda di sebagian besar wilayah dunia. Berkebalikan dengan influenza manusia yang bersifat musiman, wabah flu kuda dapat terjadi pada waktu kapan saja di sepanjang tahun, meskipun wabah musiman juga telah dilaporkan [93, 107]. Seluruh kuda dari segala umur dan ras rentan terhadap infeksi [63, 110, 152]. Akan tetapi, meskipun infeksi pada anak kuda telah dideskripsikan [118], wabah berskala besar jarang terjadi pada kelompok umur ini [136]. Insidensi tertinggi penyakit ditemukan pada hewan muda [92, 157]. Hal ini mungkin disebabkan bercampurnya hewan-hewan muda yang sebelumnya tidak pernah berkontak satu sama lain (misalnya di racing track atau tempat penjualan kuda) [92]. Wabah flu kuda seringkali terjadi saat hewan rentan dikumpulkan satu sama lain dan dipelihara berdekatan satu sama lain, dan penyakit ini sangat penting dampaknya terhadap ekonomi pada populasi kuda berskala besar di wilayah enzootik dimana pergerakan kuda dan percampuran kuda adalah praktek yang umum ditemukan.
Penyebaran virus diantara hewan rentan diperkirakan terjadi melalui tiga mode, yaitu: kontak fisik langsung dengan hewan terinfeksi atau fomite yang terkontaminasi, penularan lewat droplet (droplet menular dengan diameter lebih dari 10 nanometer dan mampu dilontarkan dalam jarak cukup jauh dengan batuk dan bersin), dan penularan melalui aerosol (nuklei droplet berdiameter kurang dari 5 nanometer dan mampu untuk tersebar secara luas dan mencapai saluran pernafasan bawah) [20]. Akan tetapi, meskipun penularan aerosol tidak dapat disangkal lagi memiliki dampak yang paling besar terhadap pengendalian infeksi, pentingnya penularan bio-aerosol dalam penyebaran virus influenza A masih belum diketahui dengan jelas. Studi pada manusia menunjukkan virus influenza dapat tetap infeksius selama beberapa hari pada permukaan yang terkontaminasi, dengan durasi tepatnya tergantung pada kondisi lingkungan (misalnya kelembaban, temperatur, paparan sinar matahari) [17]. Faktor meteorologi yang telah dihubungkan dengan meningkatnya resiko penyebaran virus equine influenza antar tempat selama wabah equine influenza tahun 2007 di Australia adalah kelembaban relatif kurang dari 60% dan kecepatan angin lebih besar dari 30 km/jam dari arah kandang yang memelihara kuda terinfeksi [46]. Jika hewan yang rentan berkontak dekat dengan satu sama lain, penyakit dapat menyebar dengan cepat (bukti anekdotal menunjukkan bahwa penyebaran dapat terjadi dalam periode paling pendek 2 – 3 hari). Dalam populasi yang besar dengan level kekebalan yang bervariasi, penyebaran penyakit dapat dikatakan lambat, dan wabah penyakit mungkin bertahan sampai beberapa minggu [93].
Wabah flu kuda dalam populasi naif memberikan gambaran berbeda dengan yang terjadi pada populasi kuda di wilayah enzootik. Investigasi terhadap wabah tahun 2007 di Australia telah memberikan informasi baru terhadap epidemiologi penyakit pada populasi naif [35, 45, 48, 89]. Wabah diikuti oleh kurva epidemi klasik, mencapai puncaknya pada minggu ke 6 dan berlangsung sampai 18 minggu. Pada awal wabah, persebaran melampaui jarak yang jauh dihubungkan dengan transportasi kuda terinfeksi [35, 45, 48]. Penyebaran lokal karena kontak langsung, menyebar melalui droplet sekresi respirasi yang terbentuk dari batuk, atau kontak tidak langsung (fomites dan dibantu manusia) [35, 45, 63, 77, 89], dan penyebaran aerosol yang kontribusinya masih belum diketahui [45, 88]. Faktor resiko paling penting untuk introduksi virus adalah kedekatan jarak dengan fasilitas yang terinfeksi [47]. Setelah masuknya virus, gejala klinis teramati pada 75-100% kuda dalam fasilitas terinfeksi dalam waktu 5 – 9 hari [63, 95]. Kuda pacu thoroughbred betina pemacek adalah yang terdampak paling parah [63], sementara anak kuda dan anak kuda berumur 1 tahun (yearling) pada umumnya menunjukkan gejala klinis ringan. Meskipun ada satu kasus fatal pada anak kuda, kematian karena infeksi EIV sangat jarang terjadi [54]. Penyebaran penyakit ke seluruh negeri dicegah dengan penegakan pembatasan perjalanan, pembatalan acara perkudaan, dan upaya biosekuriti [35, 77, 78]. Dampak terjadinya sakit setelah vaksin, yang diimplementasikan 6 minggu setelah awal program pengendalian dan setelah epizootik mencapai puncaknya, masih belum ditentukan dengan tepat [35]. Modeling mengindikasikan bahwa memulai vaksinasi diawal (1 minggu setelah program pengendalian dimulai) akan mengurangi infeksi baru sampai 60% [50]. Akan tetapi, telah ditetapkan bahwa pemberlakuan biosekuriti yang ketat berhubungan dengan berkurangnya secara signifikan kemungkinan sebuah fasilitas menjadi terinfeksi [47]. Sebagai contoh, penggunaan pencucian kaku sebelum kejadian masuknya infeksi ke dalam fasilitas peternakan dihubungkan dengan reduksi 4 kali resiko terjadinya infeksi [47].
Modelling wabah virus EIV baru-baru ini telah dibahas [41]. Model awal menggunakan metodologi SEIR (susceptible-exposed-infectious-recovered) memproduksi estimasi angka reproduksi dasar R0 sebesar 10.89 dalam populasi tidak divaksin, dengan periode laten 1,25 hari dan periode infeksius 5,5 hari [55]. Vaksinasi mengurangi baik R0 dan periode infeksius sesuai dengan harapan. Studi yang lain [113] telah menemukan nilai konservatif R0 sekitar 2 – 5. Model ini telah menunjukkan bahwa faktor meliputi antigenic drift dan ketidakcocokan vaksin, heterogenitas dalam titer antibodi dan keberadaan kelompok hewan dengan respon rendah, waktu vaksinasi berhubungan dengan paparan, dan vaksinasi ketika terjadi wabah semuanya mempengaruhi hasil akhir penyakit [5, 113-115].
Diagnosis, Pengobatan dan Pengendalian
Diagnosa virus EIV memiliki dua tahapan utama, yaitu diagnosis awal/dugaan berdasarkan gejala klinis dan konfirmasi laboratorium dengan pengujian spesimen diagnostik. Tahapan ketiga, diagnosis prospektif sebagai bagian dari surveilans aktif, dipakai terutama pada program importasi kuda pada negara yang bebas penyakit influenza. Nilai dari diagnosa prospektif adalah dapat mendeteksi kuda yang terinfeksi subklinis. Kuda yang telah divaksinasi beberapa bulan sebelumnya mungkin memiliki kekebalan parsial yang cukup untuk mencegah atau meminimalisir gejala penyakit, namun tidak cukup untuk mencegah pendedahan virus dan penularan penyakit. Diagnosis presumtif memiliki nilai terhadap pemilik kuda atau manajer peternakan kuda karena memungkinkan upaya penanggulangan untuk diimplementasikan, seperti misalnya isolasi dan perawatan suportif, yang biasanya sudah cukup tergantung pada keakuratan diagnosa. Akan tetapi, untuk tujuan epidemiologi nilainya menjadi terbatas karena agen infeksius lain, terutama equine herpesvirus, dapat memproduksi gejala klinis yang serupa dengan virus EIV sehingga kadang membingungkan para ahli. Karena itulah konfirmasi diagnosis virus melalui laboratorium bersifat akurat untuk epidemiologi, akan tetapi tidak begitu penting untuk pemilik atau manajer kuda. Kesulitan yang berhubungan dengan konfirmasi laboratorium dapat berakibat banyaknya kasus flu kuda yang tidak mendapatkan konfirmasi laboratorium. Kesulitan ini meliputi sebagai berikut:
- Tidak ada pilihan perawatan spesifik yang ada sekarang ini untuk flu kuda, sehingga pemilik dan praktisi perkudaan dapat mengadopsi perilaku bahwa mereka tidak perlu mengetahui tentang itu,
- Di banyak negara, termasuk Amerika Serikat, flu kuda bukan penyakit yang harus dilaporkan,
- Spesimen diagnostik yang lebih disukai adalah swab nasofaring, dan banyak kuda yang sangat tidak menyukai prosedur pengambilan sampel ini. Karena itulah seringkali hanya ada sedikit insentif bagi petugas untuk mengoleksi spesimen ini.
Metode serologis secara singkat dibahas di Bab 21. Diagnosis berbasis serologi bersifat retrospektif dan tidak terlalu berguna pada saat wabah. Swab nasofaring pada kuda baru-baru ini telah dibahas secara mendetail [28]. Kualitas dan ketepatan waktu spesimen swab adalah titik kritis terhadap akuratnya diagnosis, akan tetapi faktor-faktor ini juga yang paling sulit untuk dipastikan atau diukur. Spesimen swab dapat diuji virus EIV dengan menggunakan berbagai metode, termasuk kebanyakan uji yang digunakan untuk influenza manusia, babi, dan unggas. Metode klasik meliputi inokulasi telur ayam berembrio atau kultur sel Madin-Darby canine kidney (MDCK) untuk menguji pertumbuhan virus [27], yang terlalu memakan waktu untuk digunakan pada pengendalian penyakit. Berbagai kit rapid test influenza dikembangkan untuk mendeteksi, sebagai contoh, antigen NP untuk avian influenza manusia, memuaskan dalam mendeteksi virus EIV [29, 87, 166]. Karena itulah, pada dasarnya, uji diagnostik saat dalam kandang mungkin dilakukan, meskipun pada prakteknya masih belum diadopsi secara luas. NP-ELISA juga digunakan [33], yang lebih sensitif dibandingkan kit rapid test. RT-PCR telah menjadi metode pilihan pada banyak laboratorium diagnostik dan telah terbukti sebagai teknik paling sensitif [122]. Sejumlah metode berdasarkan PCR telah dilaporkan (misalnya 6, 43, 84, 112, 123]. Demikian juga metode PCR yang biasanya digunakan untuk virus influenza A lainnya juga telah sukses diaplikasikan dalam deteksi virus EIV [misalnya 49, 151]. Di Amerika Serikat, protokol Spackman [140] digunakan secara luas oleh laboratorium diagnostik veteriner. kemajuan teknologi terkini seperti amplifikasi isotermal, juga telah diaplikasikan dalam deteksi virus EIV [7, 101, 102].
Pengobatan infeksi flu kuda terdiri dari istirahat dalam stall dan rawatan suportif, meliputi penggunaan antiinflamasi, antipyrexia, agen analgesik seperti fenilbutazon atau flunixin meglumine [119]. Antibiotik mungkin digunakan untuk melawan infeksi bakterial sekunder dan menghambat munculnya pleuropneumonia. Agen antiviral telah dipelajari untuk digunakan melawan virus EIV pada kuda. Amantadine dan Rimantadine keduanya menghambat replikasi virus H3NI dan mengurangi pendedahan virus secara signifikan pada kuda yang diinfeksikan secara eksperimental [21, 125, 126], tetapi diperlukan dosis sangat besar karena rendahnya bioavailabilitas dan cepatnya ekskresi agen-agen tersebut. Oseltamivir juga efektif untuk mengurangi pireksia dan pendedahan virus [165, 167], meskipun dosis yang diperlukan (2 mg/kg setidaknya dua kali sehari, tetapi tiga kali sehari lebih baik) [169] mungkin masih dianggap mahal. Peramivir, salah satu inhibitor neuraminidase, juga telah dipelajari. Ketika diberikan secara intravena (7,8-9,3 mg/kg berat badan) pada kuda yang telah diinjeksi secara eksperimental dengan virus EIV pada hari pertama pireksia, peramivir secara signifikan mengurangi keparahan dan durasi pireksia dan gejala klinis lainnya dibandingkan dengan yang diobservasi pada kontrol yang diinjeksikan saline. Selain itu, dosis tunggal peramivir sudah cukup, karena konsentrasi plasma pada 36 jam pasca pemberian obat masih 30 kali lebih tinggi daripada yang terukur dalam konsentrasi inhibisi virus in-vitro [162]. Akan tetapi, selama agen-agen ini tetapi menjadi pilihan garda terdepan untuk digunakan pada manusia, maka masih susah disetujui untuk digunakan untuk pemakaian veteriner.
Pengendalian infeksi virus EIV seringkali sangat bergantung pada penggunaan vaksin. Selain immune profilaksis, resiko memasukkan virus ke dalam fasilitas peternakan dapat ditangani secara substansial dengan prosedur pemeliharaan. Jika fasilitas peternakan menggunakan prosedur yang sama dengan yang tercantum dalam Terrestrial Animal Health Code dari OIE (www.oit.int) untuk memenuhi kualifikasi negara bebas influenza, kemungkinan pemasukan virus EIV ke dalam peternakan dapat dihindari. Dengan kata lain, kuda yang baru masuk atau yang baru kembali ke peternakan harus diisolasi 4 minggu sebelum masuk kembali ke peternakan. Selama berada dalam isolasi, tidak boleh ada gejala flu kuda yang terdeteksi dan tidak ada kuda baru yang boleh masuk ke dalam fasilitas karantina. Testing virologi pada awal masa karantina mungkin harus dilakukan untuk meningkatkan tingkat kepercayaan terhadap status bebas influenza pada hewan tersebut.
Sayang sekali upaya-upaya ini bisa jadi sulit diimplementasikan untuk banyak peternak kuda, karena itulah penanggulangan flu kuda masih sangat tergantung pada vaksinasi. Prosedur pemeliharaan lainnya, meliputi segregasi kuda kedalam kelompok-kelompok kecil, dapat menjadi alat yang berharga untuk pengendalian penyebaran virus melalui populasi. Segregasi dapat memungkinkan potensi pembatasan penyakit, karena infeksi bergerak lebih lambat pada fasilitas dimana populasi kuda dipisah-pisahkan [93]. Sebaliknya, peralatan yang dipakai bersama seperti alat grooming meningkatkan resiko infeksi [94]. Monitoring respons imun terhadap vaksinasi melalui serologi telah dilaporkan berguna dalam pencegahan dan pengendalian wabah flu kuda [107, 146]. Dalam populasi kuda yang besar, surveilans rutin untuk virus EIV dapat memberikan kesempatan deteksi dini wabah dan untuk deteksi strain virus baru yang mungkin tidak dapat dikendalikan dengan vaksin yang sudah ada [97].
Upaya tambahan yang dapat bermanfaat dalam pengendalian virus EIV digarisbawahi oleh data yang dikumpulkan selama wabah Australia. Sebagai contoh, penggunaan upaya pembersihan kaki (footbath) mengurangi level resiko, seperti yang didiskusikan sebelumnya [47]. Studi telah memperlihatkan bahwa pemilik peternakan yang percaya bahwa upaya-upaya ini lebih efektif akan menunjukkan level kepatuhan yang tinggi terhadap upaya biosekuriti yang disarankan [129], dan pemilik kuda yang menerima informasi pengendalian infeksi dari dokter hewan langsung (dibandingkan dengan menerima informasi itu dari media, pemerintah, dan pemilik kuda yang lain, dst) akan lebih mungkin menerima bahwa upaya biosekuriti itu efektif [129].
Vaksinasi untuk virus EIV didiskusikan pada Bab 21.
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

