Oleh: Kristien van Reeth, Amy L. Vincent dan Kelly M. Lager
Diterjemahkan oleh: Agna D. Lantria
DISCLAIMER
This article was translated to enable Bahasa Indonesia readers to better understand the topic explained inside the article in their native language. The translator made no profit in translating the article.
Pengenalan
Influenza babi adalah penyakit pernafasan akut pada babi yang disebabkan oleh virus influenza A H1N1, H3N2, dan H1N2 (direview oleh van Reeth, dkk. [82]). Virus-virus ini biasanya berasal dari manusia atau unggas, dan kebanyakan virus influenza yang telah beradaptasi pada babi adalah akibat dari reasortansi genetik antara virus-virus yang telah menetap pada babi dengan virus-virus yang baru saja diperkenalkan dari manusia atau unggas. Dalam Bab ini kita akan menggunakan sebuah istilah tradisional yang dikenal luas untuk menyebut virus influenza pada babi, yaitu ”swine influenza virus (SIV)” untuk menyebut virus influenza A yang telah menetap dalam populasi babi, meskipun rekomendasi terkini yang diberikan oleh OFFLU adalah untuk menggunakan istilah “virus influenza A pada babi”. SIV bereplikasi dalam sel epidel saluran pernafasan atas dan bawah babi, dan terutama pada paru-paru. Tidak terjadi infeksi sistemik, dan transmisi virus terjadi secara eksklusif melalui rute respirasi. Infeksi berlangsung selama hanya 6 – 7 hari, dan gejala seperti gangguan pernafasan, demam dan lemah membaik dalam waktu beberapa hari saja. Meskipun infeksi jarang sekali fatal, masih terdapat potensi dampak ekonomi yang signifikan dikarenakan berkurangnya berat tubuh pada babi yang sedang bertumbuh, dan kegagalan reproduksi pada induk babi disebabkan oleh demam tinggi. SIV juga mungkin berkontribusi dalam timbulnya permasalahan penyakit respirasi kronis dan multifaktorial. Kebanyakan infeksi yang tidak kompleks adalah infeksi subklinis atau sangat ringan. Berkembang atau tidaknya gejala klinis tipikal “flu babi” sebagian besarnya tergantung pada status imun babi, tekanan infeksi, dan viral load yang muncul pada paru-paru selama 24 jam pertama penentu infeksi. Metode utama untuk mengendalikan SIV adalah dengan vaksinasi untuk imunitas aktif atau pasif, yang akan mencegah infeksi atau mengurangi titer virus dalam paru-paru yang akan mencegah penyakit.
Vaksin SIV yang sangat ini tersedia secara komersial sebagian besar berupa vaksin inaktif tradisional yang diberikan melalui injeksi intramuskular (IM). Metode produksi dan dasar imunologi perlindungan vaksin menyerupai vaksin influenza inaktif yang diperuntukkan untuk manusia dan kuda, akan tetapi juga terdapat beberapa perbedaan mencolok. Salah satu perbedaannya adalah kurangnya sistem formal untuk strain vaksin SIV. Hal ini telah menjadi isu penting karena beberapa subtipe dan genotipe SIV baru telah muncul pada babi selama dua dekade terakhir. Selain itu, evolusi antigenik dan reasortansi genetik antara virus yang ada sekarang telah berkontribusi terhadap virus yang beragam dalam satu subtipe yang sama di banyak wilayah geografis yang berbeda. Beberapa tipe vaksin generasi baru untuk SIV telah dikembangkan dan diuji secara eksperimental, tapi hanya satu diantaranya, yaitu vaksin partikel replikon RNA, telah diberikan izin penggunaan pada babi di Amerika Serikat.
Meskipun vaksin SIV inaktif telah digunakan berdekade lamanya, informasi secara mendetail tentang komposisinya dan analisis kritikal tentang efektivitasnya sangat sulit ditemukan. Studi uji tantang vaksinasi dari setiap tipe vaksin SIV yang dipublikasikan haruslah diinterpretasikan dengan hati-hati, karena banyaknya perbedaan dalam desain eksperimen dan metodologinya, serta perbedaan terkait situasi di lapangan. Tujuan dari Bab ini adalah untuk memberikan pembahasan kritis terhadap performa vaksin tradisional dan vaksin generasi baru untuk SIV dalam studi eksperimental, dan memberikan analisis yang dilaksanakan dengan hati-hati terhadap kekuatan dan kelemahannya. Kita akan berfokus pada vaksin SIV inaktif komersial, dan memberikan perhatian khusus terhadap perbedaan situasi di Eropa dan Amerika Utara, demikian juga permasalahan seleksi strain vaksin. Bab ini dimulai dengan ringkasan fakta-fakta berkaitan dengan penggunaan vaksin, dan akan ditutup dengan diskusi tentang potensi vaksin SIV generasi berikutnya di masa depan.
Sebuah primer terhadap evolusi virus AI babi dan imunologi vaksin
Sebuah pemahaman mendalam tentang kapabilitas dan limitasi vaksinasi AI babi yang terkait dengan karakteristik antigenik dan evolusi SIV dan imunologi vaksin influenza. Karena itulah kita akan merekapitulasi beberapa fakta dasar tentang epidemiologi terkini virus SIV, demikian juga perbedaan besar antara respons imun yang muncul pasca infeksi virus influenza hidup dengan respons imun pasca vaksinasi dengan vaksin SIV ‘killed’. Pembaca diarahkan untuk membaca Bab-bab lain dalam buku ini untuk mendapatkan tinjauan lebih luas secara komprehensif tentang kedua topik ini.
Virus AI babi di wilayah-wilayah berbeda di dunia
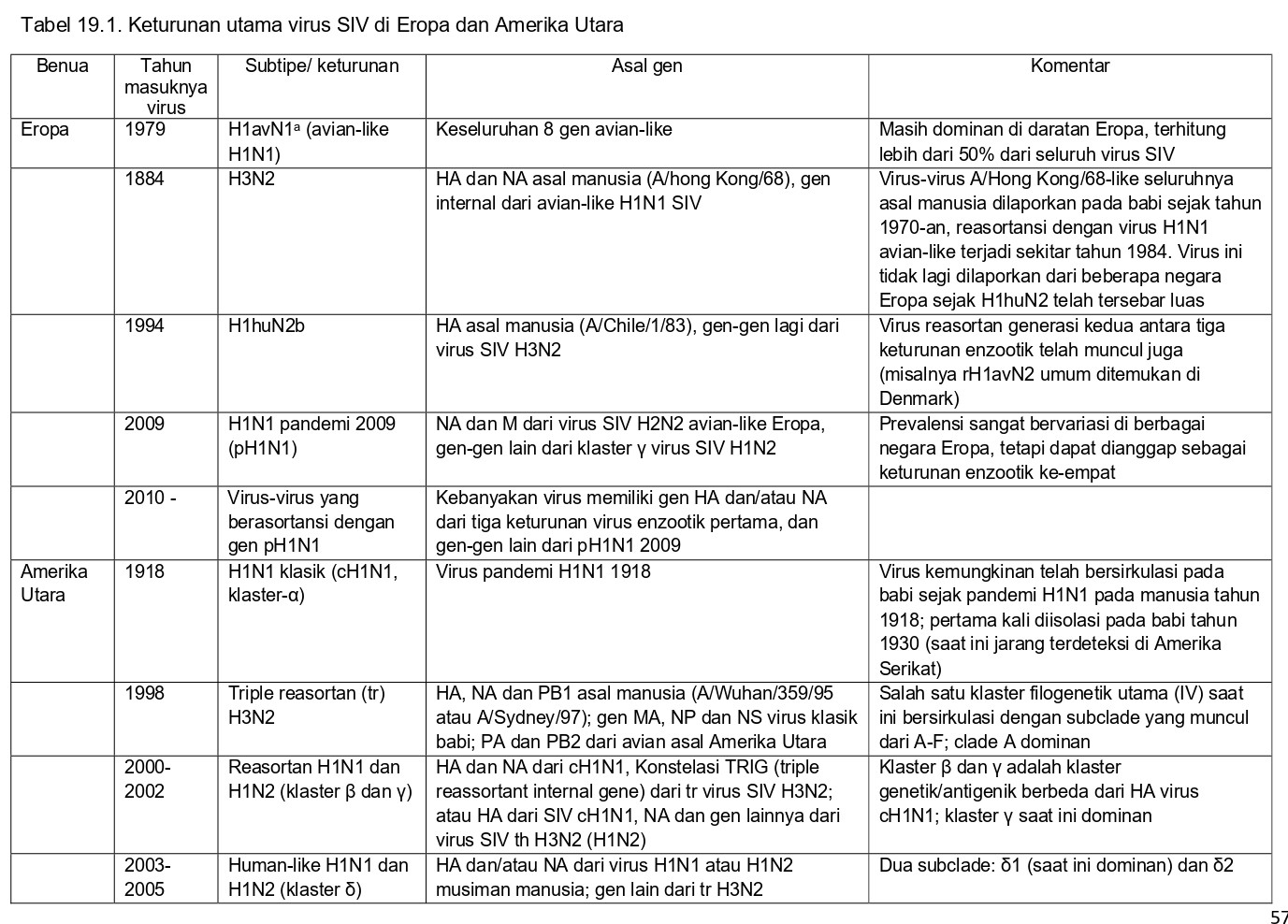
Virus AI babi dari subtipe H1N1, H3N2, dan H1N2 bersifat enzootik pada babi di seluruh dunia, namun asal mereka, demikian juga karakteristik genetik dan antigeniknya berbeda antar benua dan wilayah geografis [94]. Selama dekade terakhir, banyak virus keturunan SIV H1 dan H3 yang muncul, umumnya merupakan akibat penularan virus dari manusia ke babi dan kemudian karena reasortansi dan evolusi genetik virus-virus asal manusia ini di dalam populasi babi [61]. Seiring waktu, virus SIV juga mengalami antigenik drift dalam HA, meskipun proses ini pada umumnya lebih lambat pada babi daripada pada manusia [16]. Salah satu fitur untuk epidemiologi virus SIV adalah keturunan genetik berbeda dari virus H1 dan H2 dapat eksis bersama-sama. Tabel 19.1 menyajikan rangkuman keturunan utama virus-virus SIV di Eropa dan Amerika Utara [3, 9, 40, 52, 74]. Sekuens HA dari beberapa keturunan H1 virus SIV berbeda sampai 20 – 25% di level asam aminonya. Perbedaan genetik sebesar itu ada diantara tiga keturunan virus H1N1 avian-like Eropa (H1avN1), H1N2 human-like (H1huN2), dan H1N1 pandemi 2009 pH1N1), dan antara virus H1 SIV Amerika Utara dari klaster 𝛿 dan klaster-klaster lainnya. Perbedaan genetik yang lebih kecil terjadi antara klaster H1 𝛼, β, dan ℽ, dan antara klaster H3 Amerika Utara, demikian juga di dalam setiap keturunan virus. Virus SIV di Amerika Selatan dan Asia berasal dari subtipe HA dan NA yang sama dengan virus-virus Eropa dan Amerika Utara, tetapi banyak diantaranya dari keturunan genetik yang berbeda [11, 13, 108]. Virus pH1N1 2009 telah menetap di populasi babi di seluruh dunia setelah terjadinya penularan berulang dari manusia kepada babi sejak tahun 2009. Virus baru ini telah bereasortansi secara ekstensif dengan hampir seluruh virus SIV yang menetap di wilayah regional masing-masing, menyebabkan berkembangnya genotipe SIV baru dan gambaran epidemiologiknya yang menjadi semakin kompleks. Di Eropa, perbedaan virus SIV antar antar wilayah regional telah menjadi semakin jelas sejak tahun 2009 [9, 74]. Di Amerika Serikat setidaknya ada 10 pola genotipe H3N2 telah muncul, bersama reaktivitas silang hasil serologis yang tidak konsisten antara virus tersebut [24, 40, 48]. Sudah jelas dari hal ini bahwa epidemiologi influenza pada babi lebih kompleks jika dibandingkan dengan manusia, dan karena itulah hal ini menyebabkan masalah pada seleksi strain untuk produksi vaksin.
Respons imun terhadap infeksi virus AI babi tipe liar (wild type)
Respons imun adaptif yang muncul setelah infeksi virus influenza hidup meliputi imunitas mukosal dan humoral-sistemik dan imunitas yang dimediasi sel (CMI). Pengetahuan umum kita tentang respon imun terhadap virus influenza didiskusikan secara detail dalam artikel pembahasan lainnya [15, 20, 79, 106], sehingga hanya sedikit dijelaskan di sini.
Antibodi umumnya diarahkan kepada protein virus hemagglutinin (HA), neuraminidase (NA), matriks (M), dan nukleoprotein (NP). Antibodi yang bereaksi terhadap protein virus paling variabel, yaitu HA, dapat memblokade perlekatan virus dengan reseptor sel hospes dan kemudian mencegah virus untuk menginfeksi sel. Antibodi-antibodi diukur melalui pengujian inhibisi hemaglutinasi (HI) atau netralisasi virus (VN). uji VN lebih sensitif daripada uji HI, dan mengevaluasi antibodi yang menghambat masuknya virus demikian juga antibodi yang mungkin menetralisir virus pada tahapan lain dari siklus replikasi. Antibodi anti-NA belum dipelajari dengan sangat ekstensif seperti HA, tetapi juga penting untuk perlindungan, terutama ketika antibodi anti-HA gagal menetralisir virus. Meskipun antibodi anti-NA tidak dapat menetralisir virus, mereka mengurangi pelepasan partikel virus yang baru saja di sintesa dari sel terinfeksi dengan menghambat aktivitas enzimatik dari antigen NA, dan dapat diukur dengan uji inhibisi neuraminidase (NI). Antibodi terhadap protein NP dan M berkontribusi dalam membunuh sel terinfeksi melalui mekanisme tergantung antibodi, akan tetapi ini pun tidak dapat mencegah infeksi. Perubahan antigenik yang terus menerus dalam epitop HA dan NA, yang disebut antigenic drift, memungkinkan virus influenza menghindari efek dari antibodi anti HA dan anti NA.
CMI (Cell-mediated immunity/Imunitas yang dimediasi virus) terutama dimediasi oleh sel T sitotoksik (CD8+) yang dapat membunuh sel yang terinfeksi virus. Sel T pembantu (CD4+) sangat diperlukan agar produksi sel B dan produksi antibodi selanjutnya mencukupi. Tidak seperti antibodi yang menargetkan protein permukaan virus, sel T lebih luas lagi mengarahkan targetnya kepada epitop tersimpan dalam permukaan dan protein internal virus. Respons CMI membantu melengkapi proses menghabiskan virus, dan dapat memberikan perlindungan lebih luas terhadap reinfeksi virus-virus heterolog, akan tetapi tidak mencegah infeksi. Antibodi penetralisir spesifik-HA dalam serum dan lebih banyak lagi dalam mukosa saluran nafas, dianggap sebagai yang terpenting untuk melindungi terhadap reinfeksi virus dalam subtipe yang sama yang berkerabat dekat. Karena sifat polimeriknya, antibodi IgG mukosa dipercaya lebih cross reaktif terhadap virus influenza hasil antigenic drift daripada IG monomer. Titer antibodi dan sel imun efektor akan berkurang seiring waktu, tetapi populasi sel T memori dan sel B dipertahankan jumlahnya dalam saluran nafas dan jaringan limfoid, dan dapat secepatnya diaktivasi setelah terpapar virus influenza kembali.
Beberapa studi yang telah dilakukan untuk mengetahui kinetika respons imun spesifik terhadap virus influenza pada babi dirangkum di dalam artikel lain [87]. Respons imun spesifik yang sangat cepat dan kuat sebagiannya dapat dikaitkan dengan produksi sitokin pro-inflamasi yang sangat besar diproduksi secara lokal dalam paru-paru, yang juga memiliki kemampuan stimulasi imunitas. Sitokin-sitokin ini meliputi IFN-⍺, TNF–⍺, IL-1ꞵ, IL-6, dan IL-12 [5, 38, 88, 89]. Karena keberadaan situkin inilah, virus dieliminasi dalam waktu 1 minggu setelah infeksi dimulai, biasanya sebelum antibodi penetralisir dapat terdeteksi. Respons imun yang khas yang ditemukan pada infeksi SIV adalah bahwa respons imun dapat melindungi terhadap reinfeksi varian influenza lain yang berbeda dalam satu subtipe HA yang sama; hal ini juga disebut proteksi heterolog atau heterovarian. Studi eksperimental infeksi pada babi telah memberikan bukti adanya proteksi silang antara tiga virus SIV H1 keturunan Eropa yang ada dalam tabel 19.1, antara virus SIV H1 Amerika Utara klaster 𝛼 dan klaster ℽ, antara virus H1N1 dari Eropa dan Amerika Utara, demikian juga keturunan virus SIV H3N2 [10, 18, 25, 65, 66, 81, 84, 97]. Dalam penelitian-penelitian ini, babi yang naif influenza untuk pertama kali diinokulasikan virus SIV melalui intranasal (IN) dan/atau intratracheal (IT), diikuti dengan inokulasi kedua menggunakan virus yang secara antigenik berbeda 4 – 6 minggu kemudian. Virus yang kedua ditemukan tidak terdeteksi dari swab nasal ataupun jaringan paru-paru babi percobaan, atau titer virus secara signifikan berkurang dibandingkan dengan yang terukur pada babi kontrol yang hanya diinokulasi dengan virus kedua saja. Proteksi silang antara virus SIV H1N1 dan H3N2 disebut proteksi heterosubtipik, bersifat lebih lemah [37, 66]. Infeksi virus H1N1 atau H3N2 yang sebelumnya tidak dapat mencegah replikasi subtipe yang lain, akan tetapi pendedahan virus via nasal lebih pendek 1 – 2 hari dibandingkan kelompok kontrol. Dikesemua studi ini, proteksi silang terjadi meskipun tidak ada serum antibodi HI yang cross-reaktif. Respons imun cross-reaktif telah terdeteksi dalam serum melalui uji VN dan/atau NI, dalam basuhan hidung dan cairan BAL melalui uji ELISA, dan dalam limfosit yang bersirkulasi melalui uji CMI. Peranan dan kontribusi relatif respons imun ini dalam memberikan proteksi silang masih belum diketahui benar, demikian juga protein target virus.

Respons imun terhadap vaksin AI babi inaktif
Vaksin AI babi inaktif yang tersedia secara komersial kebanyakannya berupa preparasi virus secara lengkap (whole-virus) dengan adjuvan berbasis minyak yang diberikan dengan injeksi IM dalam di leher. Dua dosis yang diberikan terpisah selama 2 – 4 minggu penting diberikan untuk menginduksi respons antibodi kuat pada babi yang naif terhadap influenza. Untuk kawanan induk babi, metode yang lebih disukai adalah dengan memvaksinasi babi dara dua kali sebelum breeding, dan induk babi baik setiap empat bulan sekali atau 3 – 6 minggu sebelum beranak (farrowing), dengan tujuan utama meningkatkan transfer antibodi pasif kepada anak babi menyusu demikian juga sebagai pencegahan penyakit klinis pada induk babi seperti yang akan didiskusikan di paragraf berikutnya.
Prinsip yang mendasari vaksin ‘killed’ influenza pada babi pada umumnya adalah induksi antibodi serum untuk menargetkan protein HA virus (dirangkum di literatur lainnya [20]). Antibodi ditransfer ke dalam mukosa saluran respirasi dengan transudasi, dimana mereka bisa berkontak dan menetralisir virus influenza. Seperti juga vaksin inaktif lainnya, respons imun yang dihasilkan berbeda dengan respons imun yang diinduksi oleh infeksi virus tipe liar, dimana dia gagal dalam menginduksi respons limfosit T mukosal atau sitotoksik. Memang babi yang divaksinasi dengan vaksin SIV inaktif memiliki IgG spesifik virus dalam serum dan cairan bilasan bronkoalveolarnya (BALF), akan tetapi jumlah IgA yang ada hanya sedikit dalam saluran respirasi bawah dan atas [35, 46, 53, 54, 73, 97, 101]. Limfosit yang ada dalam sirkulasi darah atau dalam limpa babi yang sudah divaksinasi mungkin menunjukkan adanya peningkatan limfoprofilerasi dan produksi IFN-ℽ [35, 46, 63, 73], akan tetapi ini lebih mungkin merefleksikan aktivitas sel NK, sel T-helper atau “double positif” subset sel T CD4+CD8+, daripada efektor CD8+ sel T sitotoksik tradisional.
Titer antibodi yang diinduksi vaksin mencapai puncaknya 2 minggu setelah vaksinasi kedua, dan dapat menurun deras setelahnya [17, 44]. Disisi lain, puncak titer antibodi terhadap strain H1 dan H3 dalam vaksin biasanya beberapa kali lebih tinggi dibandingkan titer antibodi setelah infeksi dengan virus hidup [35, 97], titer HI setinggi 160-2560 bukanlah pengecualian [17, 35, 44, 85]. Titer antibodi homolog yang tinggi ini tampaknya memberikan antibodi yang cross-reaktif terhadap strain heterolog, meskipun dengan titer yang rendah. Meskipun hanya terdapat sedikit informasi tentang respons antibodi yang diinduksi vaksin terhadap NA, antibodi NI telah terdeteksi pada babi yang divaksin dengan vaksin SIV komersial Eropa, dan mereka mungkin memainkan peranan sekunder yang signifikan dalam proteksi [21] (Van Reeth, dkk, data yang tidak dipublikasikan). Dari empat vaksin yang diuji, kesemuanya menginduksi antibodi NI terhadap N2, tetapi dua diantaranya gagal menginduksi antibodi N1. hal ini mungkin karena stabilitas fisik NA yang kurang selama proses pembuatan vaksin.
Vaksin SIV inaktif didesain untuk melindungi setiap individu babi terhadap dampak klinis virus SIV dengan mengurangi titer virus dalam paru-paru. Studi eksperimental mendukung hipotesis bahwa kandungan virus yang banyak dalam paru-paru diperlukan untuk menginduksi beberapa sitokin pro-inflamasi sampai level yang tinggi, yang selanjutnya akan menginduksi inflamasi paru dan memunculkan gejala penyakit [5, 38, 88, 89]. Studi uji tantang intratrakea telah menunjukkan adanya korelasi terbalik antara titer HI pasca vaksinasi atau titer antibodi VN dalam serum babi yang sudah divaksinasi di salah satu sisi, dan titer virus dan sitokin dalam paru-paru di sisi lain [89]. Dalam penelitian ini, titer H1 sebesar 80-160 atau titer VN sebesar 128-192 terhadap virus tantang dapat mencegah replikasi virus dalam paru-paru pada setidaknya 50% babi. Titer antibodi lebih rendah mungkin masih bisa mengurangi replikasi virus dalam jumlah cukup besar untuk memberikan proteksi menyeluruh melawan penyakit, dan angka titer persisnya juga tergantung pada dosis uji tantang virus dan rute pemberiannya [44, 83, 85]. Harus ditekankan bahwa penelitian itu tidak mengklaim bahwa vaksin SIV ‘killed’ mengurangi ekskresi virus via nasal pada babi yang sudah divaksin atau mengurangi penularan SIV dalam populasi, meskipun manfaat yang berhubungan dengan parameter-parameter ini telah ditemukan dalam studi eksperimental [41, 43, 46, 47, 55, 70]. Berkurangnya pendedahan virus via nasal mungkin disebabkan rendahnya jumlah virus dalam saluran udara dalam atau di mukosa nasal, atau keduanya. Akan tetapi, berkurangnya titer virus dalam paru-paru babi yang divaksinasi hampir selalu lebih besar daripada yang terdapat dalam ekskresi nasal [17, 21, 39, 51, 53]. Hal konsisten dengan fakta bahwa transudasi serum antibodi kurang efisien dalam hidung daripada paru-paru [31], dan bahwa vaksin inaktif tradisional hanya menyebabkan stimulasi produksi IgA yang rendah.
Di lapangan, vaksinasi SIV untuk induk babi lebih umum dilakukan dibandingkan vaksinasi babi untuk konsumsi. Vaksinasi induk babi utamanya bertujuan untuk meningkatkan dan memperpanjang level antibodi maternal (MDA) pada babi muda. Anak babi dari induk babi yang divaksin sering menunjukkan titer HI yang lebih tinggi secara signifikan dan relatif seragam (>/ 160) dibandingkan dengan induk babi yang tidak divaksin. Akibatnya, MDA dapat terdeteksi sampai 12 minggu pada babi dari induk babi yang sudah divaksin, dibandingkan 4 – 6 minggu pada babi dari induk babi yang tidak divaksin [78]. Akan tetapi, meskipun MDA akan mengurangi infeksi dan penyakit dari strain yang serupa selama periode rentan tinggi terhadap infeksi SIV [68], MDA juga mengganggu perkembangan kekebalan aktif setelah infeksi atau vaksinasi [39, 41, 50]. Konflik antara perlunya melindungi anak babi menyusui melalui MDA dan untuk dapat secara efektif mengimunisasi anak babi sedang bertumbuh adalah sebuah halangan yang besar dalam penggunaan vaksin ‘killed’.
Karena itu, meskipun tidak adanya antibodi HI yang terdeteksi dalam serum tidak selalu berkorelasi dengan kurangnya proteksi kekebalan tubuh babi setelah infeksi dengan virus SIV hidup,antibodi HI adalah protektor utama dan hal ini berkorelasi dengan proteksi melalui vaksin SIV. Vaksin SIV generasi bari, sebaliknya mungkin menstimulasi tambahan respons imun lain bersama atau diluar antibodi sistemik. Respons imun yang dihasilkan terutama oleh vaksin hidup atenuasi lebih serupa dengan yang terjadi pada infeksi secara alami jika dibandingkan dengan vaksin inaktif atau vaksin non-replikasi lainnya. Vaksin-vaksin alternatif ini didiskusikan nanti di bagian akhir bab ini.
Vaksin AI babi inaktif komersial
Karakteristik vaksin dan komposisinya
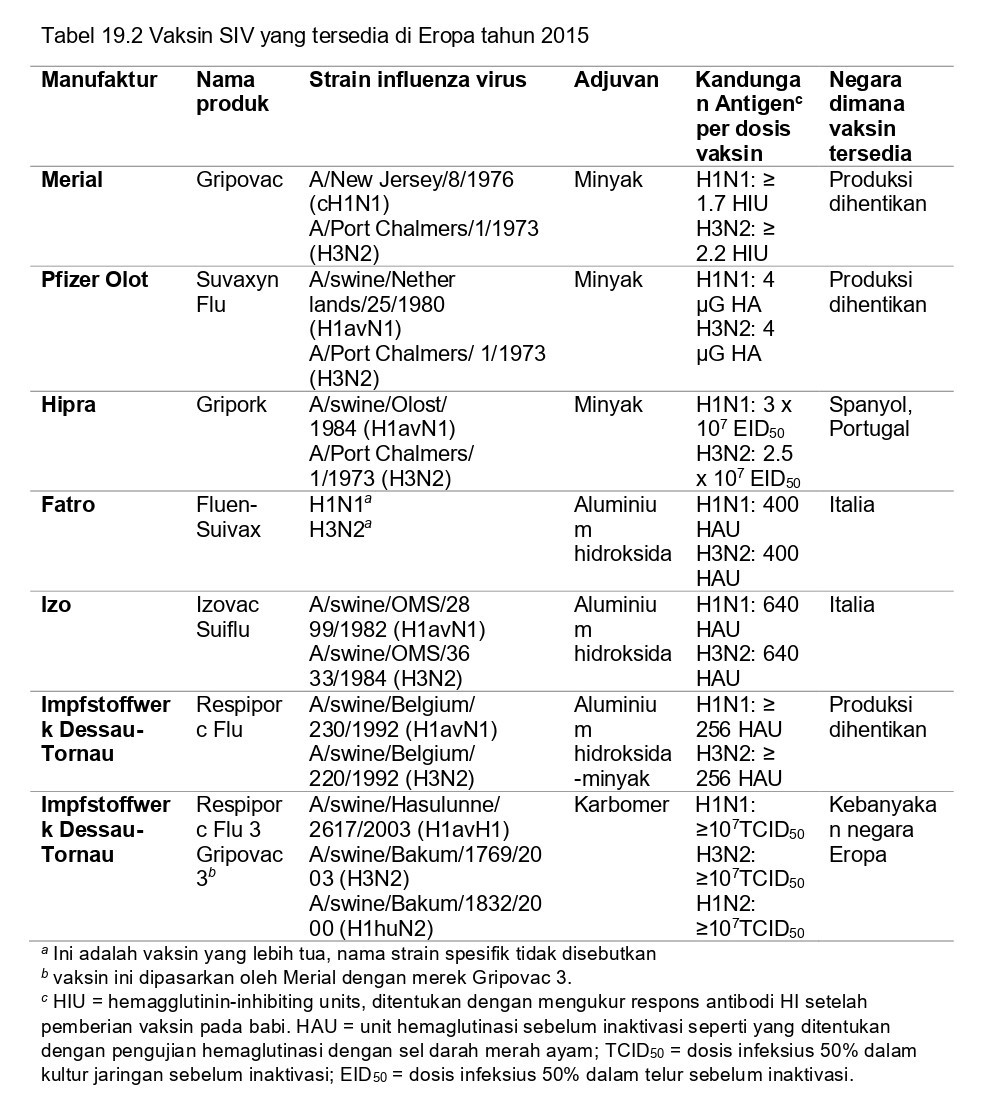
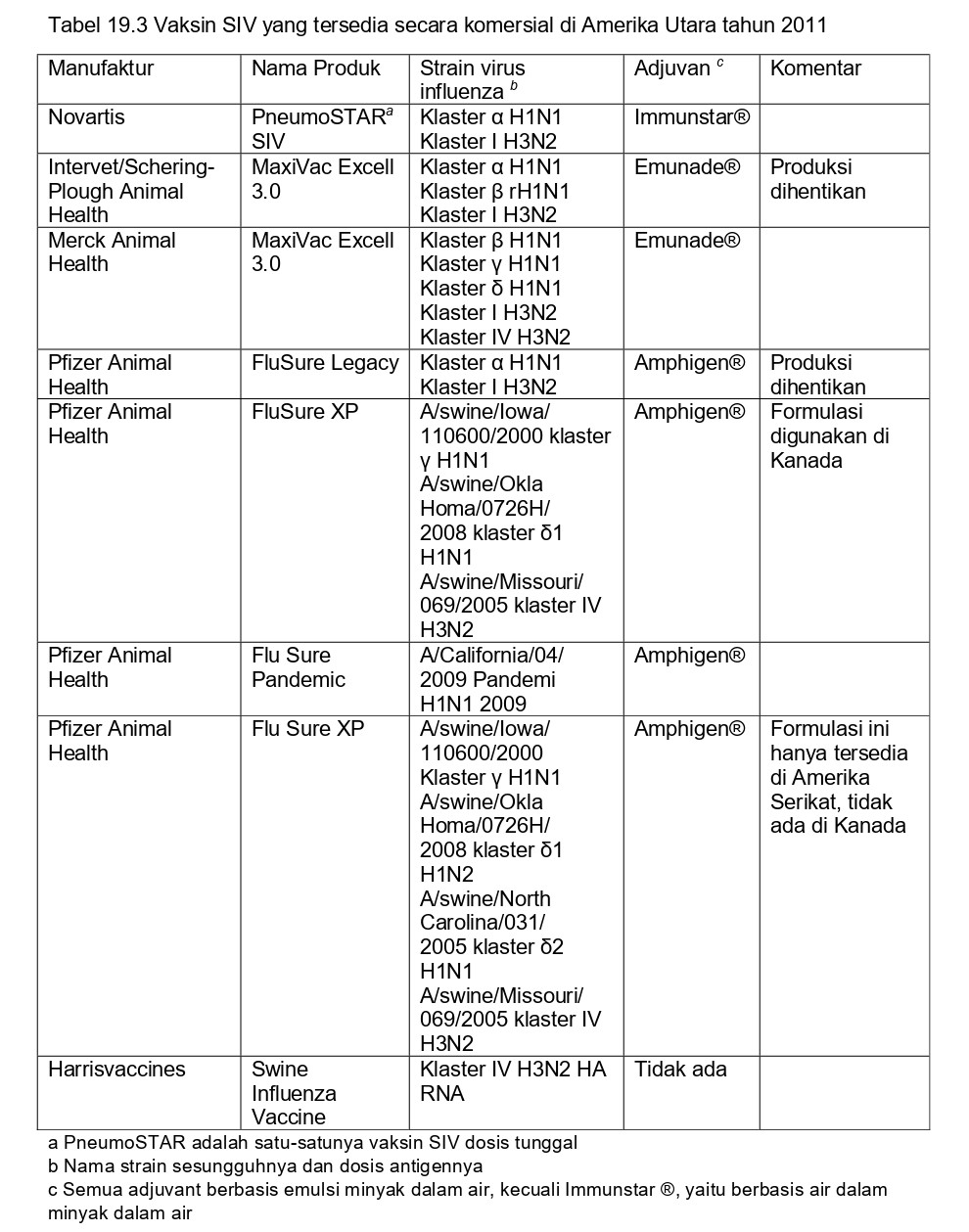
Vaksin AI babi inaktif komersial berbagi kesamaan dengan vaksin influenza ‘killed’/mati pada manusia, akan tetapi juga terdapat perbedaan yang penting. Sementara vaksin manusia pada umumnya mengandung antigen permukaan virus yang sudah dimurnikan tanpa adjuvan (untuk informasi lebih lanjut, baca Fiore, dkk [26]), kebanyakan vaksin SIV adalah preparasi virus penuh (whole-virus) dengan adjuvan berbasis minyak. Tidak seperti vaksin manusia, untuk vaksin SIV tidak ada standar dosis antigen dan strain vaksinnya. Konsisten dengan perbedaan antigen dan genetik virus SIV antara Eropa dan Amerika Utara, vaksin untuk setiap wilayah geografis ini diproduksi secara lokal dan vaksin-vaksin tersebut mengandung strain yang sangat jauh berbeda. Di setiap benua, strain vaksin yang ada mungkin berbeda antar produk yang berbeda, demikian juga formulasi adjuvannya dan dosis antigennya. Hal ini digambarkan dalam Tabel 19.2 untuk vaksin-vaksin di Eropa dan dalam Tabel 19.3 untuk vaksin-vaksin di Amerika Utara.
Di Eropa, vaksin SIV pertama kali dilisensikan pada pertengahan 1980-an dan awal 1990-an. Vaksin ini mengandung dua subtipe virus influenza yang dominan pada saat itu, yaitu H1avN1 dan H3N2. Pada kebanyakan vaksin ini, produksinya dihentikan di tahun 2010, tetapi vaksin-vaksin tersebut telah digunakan pada banyak penelitian uji tantang vaksinasi eksperimental. Vaksin trivalen yang mengandung subtipe H1huN2 diberikan perizinan tahun 2010, dan saat ini adalah vaksin utama pada pasar Eropa. Di beberapa negara, vaksin pH1N1 monovalen 2009 kadang-kadang diimpor dari Amerika Utara. Produk vaksin yang digunakan dan kebijakan vaksinasi dapat sangat bervariasi antar negara, akan tetapi strain vaksin sangat jarang diperbaharui. Seperti yang ditunjukkan dalam Tabel 19.2, tidak mungkin membandingkan massa antigenik dari berbagai produk komersial, karena produsen vaksin yang berbeda menggunakan metode yang berbeda untuk mengukur dan mengekspresikan jumlah antigen. Di sebagian besar negara Eropa, hanya 10-20% dari populasi induk babi yang divaksin SIV, dan vaksin jarang digunakan pada babi yang digemukkan.
Vaksin SIV pertama di Amerika Utara pertama kali diluncurkan tahun 1994. Vaksin itu adalah vaksin monovalen yag dkembangkan dari virus H1N1 klasik. Setelah munculnya virus influenza H3N2 pada populasi babi di Amerika Serikat tahun 1998, vaksin SIV H3N2 monovalen dan vaksin bivalen H1/H3 kemudian diluncurkan. Sebagai respons terhadap kemunculan terkini klaster antigenik baru yang berbeda di dalam subtipe H1 dan H3, produsen vaksin telah mereformulasikan vaksin mereka menjadi vaksin polivalen. Dari empat vaksin inaktif yang saat ini tersedia di Amerika Serikat, dua diantaranya mengandung virus SIV dari beberapa klaster H1 dan/atau H3 (Tabel 19.3). Vaksin monovalen dengan basis virus pH1N1 2009 diberikan izin edar tahun 2009. Penggunaan vaksin lebih tinggi di Amerika Serikat jika dibandingkan dengan Eropa, dengan sekitar 70% breeding stok diperkirakan sudah divaksin [99]. Pembaharuan strain juga dianggap lebih penting di Amerika Utara jika dibandingkan dengan Eropa. Akibatnya, vaksin autogenous yang mengandung strain spesifik kawanan juga sangat populer di Amerika Serikat. Informasi lengkap tentang vaksin-vaksin ini dapat ditemukan dalam artikel lain [72], dan tidak akan didiskusikan lebih lanjut pada bab ini.
Sulit untuk memperoleh gambaran vaksin SIV yang digunakan di Amerika Selatan dan Asia. negara-negara dimana vaksin SIV telah digunakan meliputi Argentina, Brazil, Jepang dan Korea Selatan, tetapi vaksin-vaksin ini tidak tersedia di banyak negara lainnya, seperti Vietnam, Thailand dan produsen babi tebesar di dunia yaitu China. Pada umumnya, negara-negara di Amerika Selatan menggunakan produk komersial yang sama dengan yang ada di Amerika Utara, sementara vaksin yang diproduksi secara lokal dengan menggunakan strain lokal seringkali digunakan di Asia. Di Jepang, vaksin lokal menggunakan strain H1N1 dan H3N2 lama yang diisolasi tahun 1979 dan 1969. Di Korea Selatan, dua dari tiga produk lokal adalah vaksin trivalen dan kesemuanya mengandung strain SIV dari tahun 2004-2005. Di kedua negara itu, vaksin SIV sering mengandung adjuvan non-oil, seperti ammonium fosfat, Amphigen ®, Rehydragel ®, dan IMS 1313. Serapan vaksinasi di negara-negara ini dilaporkan cukup rendah, dan karena itulah Bab ini akan berfokus pada vaksin SIV di Eropa dan Amerika Utara.
Aspek regulasi dan seleksi strain vaksin
Proses otorisasi vaksin veteriner berbeda antara Eropa dan Amerika Serikat. Di Eropa, evaluasi vaksin SIV sangat bergantung pada efektivitasnya dalam penelitian uji tantang vaksinasi. Penelitian uji tantang harus dilakukan untuk setiap subtipe influenza dalam vaksin, menurut persyaratan yang ditetapkan oleh Farmakope Eropa. Babi yang secara seronegatif negatif influenza harus divaksinasi dua kali sesuai dengan petunjuk label, diuji tantang dengan isolat lapangan SIV melalui rute IT, dan dieuthanasia 24 dan 72 jam setelah uji tantang. Vaksin lulus tes jika rata-rata titer dalam paru-paru babi yang divaksinasi secara signifikan lebih rendah daripada babi kontrol yang tidak divaksin di kedua waktu tersebut. Persyaratan untuk mendemonstrasikan efek manfaat vaksinasi terhadap demam dan berkurangnya berat badan tidak disebutkan lagi dalam edisi revisi monograf Farmakope Eropa tahun 2003, karena sulitnya mereproduksi gejala flu yang khas dengan inokulasi eksperimental, dan juga korelasi signifikan antara titer virus dalam paru-paru dengan penyakit. Meskipun perubahan-perubahan ini telah terjadi, produsen vaksin masih harus melakukan prosedur perizinan penuh hanya untuk sekedar merubah strain vaksin saja, yang setengahnya mungkin menjelaskan mengapa kebanyakan vaksin SIV Eropa masih memiliki strain yang ketinggalan zaman. Di Amerika Serikat, Departemen Pertanian Amerika Serikat (USDA) memperkenalkan pedoman perizinan baru untuk memperbaharui strain yang ada dalam vaksin yang telah mendapat izin penuh pada bulan September 2007. Sejak itulah, imunogenitas strain yang baru yang ditambahkan dalam vaksin atau menggantikan strain lama dari perizinan lama dapat didemonstrasikan melalui uji serologis pada babi, tidak melalui uji tantang. Harus ditunjukkan pula bahwa antigen yang ada dalam produks kombinasi vaksin ini tidak mengganggu munculnya respons imun yang muncul terhadap setiap komponen yang ada dalam vaksin. Produsen vaksin di Amerika Serikat kemudian memiliki kesempatan untuk memperbaharui vaksin dengan lebih cepat dan fleksibel jika dibandingkan dengan permasalahan yang dihadapi di Eropa. Akan tetapi, meskipun terdapat fleksibilitas dan observasi terkini dari genetika yang semakin meluas [3] dan evolusi antigenik [48], hanya ada sedikit pembaharuan strain yang terjadi antara tahun 2007 sampai 2014.
Sejak vaksin inaktif menginduksi proteksi melalui antibodi yang sangat spesifik untuk melawan komponen HA virus, strain vaksin haruslah cocok dengan strain yang bersirkulasi di lapangan dalam setiap subtipe, dan keragaman strain-strain saat ini membuat semakin kompleksnya pengendalian penyakit melalui vaksin inaktif. Beberapa penelitian eksperimental pada babi telah menunjukkan respons antibodi dan perlindungan yang tidak mencukupi terhadap keturunan virus yang baru masuk dengan menggunakan vaksin berdasarkan strain yang ada. Dalam kasus-kasus ini biasanya terdapat homologi asam amino sampai 75% pada HA1 antara vaksin H1/H3 dan strain uji tantang. Sebagai contoh, vaksin bivalen H1N1/H3N2 Eropa gagal untuk menimbulkan respons antibodi H1 cross-reaktif atau gagal memberikan proteksi melawan virus SIV keturunan H1huN2 Eropa [22, 90]. Lebih jauh lagi, vaksin Eropa yang tersedia sekarang ini dalam keadaan terbaik dapat menginduksi respons antibodi cross-reaktif yang rendah sampai moderat terhadap virus pH1N1 2009 [22, 45, 51], dan proteksi yang didapatkan pada saat uji tantang bersifat inferior dibandingkan dengan proteksi yang didapatkan dengan vaksin pH1N1 2009 monospesifik secara eksperimental [22, 51]. Karena pentingnya kecocokan genetik dan antigenik antara vaksin dan virus tantang, cross-reaktivitas antara antibodi HI dan analisis gen HA paling sering digunakan sebagai prediktor cross-proteksi vaksin. Akan tetapi, masih belum diketahui seberapa banyak jarak antigenik atau genetik sampai diperlukan perubahan strain vaksin. Selain itu, lokasi perubahan protein HA mungkin saja lebih penting daripada total perubahan yang ada. Studi terkini tentang virus SIV H3N2 Amerika Utara telah mengidentifikasi enam posisi asam amino berdekatan dengan tempat perlekatan reseptor HA yang memainkan peranan besar dalam merubah fenotipe antigenik [48]. Penulis menyimpulkan bahwa substitusi beberapa, semisal satu atau dua dari asam amino ini mungkin saja cukup untuk menghindari sistem imun dan kegagalan vaksinasi pada babi.
Faktor selain kesamaan antara vaksin dan strain di lapangan mungkin juga sangat mempengaruhi efektivitas vaksin, yaitu diantaranya imunogenitas strain vaksin, kuantitas antigen yang dikandungnya, dan adjuvan yang digunakan. Hal ini dapat menjelaskan mengapa terdapat korelasi buruk antara kecocokan vaksin pada uji laboratorium dan performa vaksin pada penelitian uji tantang. Vaksin SIV komersial Eropa khususnya telah sering menunjukkan perlindungan yang lebih luas pada penelitian uji tantang daripada yang diharapkan berdasarkan perbandingan genetik dan antigenik antara strain vaksin dan strain di lapangan. Strain H1N1 A/New Jersey/8/76 dalam vaksin Eropa yang pertama diciptakan adalah virus H1N1 ‘klasik’ yang sangat berkerabat dekat dengan virus H1 Amerika Utara dibandingkan virus SIV H1N1 Eropa avian-like. Namun demikian, vaksin ini menunjukkan perlindungan sangat baik pada uji tantang dengan virus H1avN2 dari tahun 1980-an dan 1990-an, yang menunjukkan homologi asam amino hanya sebesar 78-81% saja dengan strain vaksin tersebut [33, 85]. Seperti itu pula, strain H3N2 A/Port Chalmers/1/73 dalam vaksin SIV pertama Eropa memberikan proteksi signifikan melawan virus SIV H3N2 yang lebih baru yang masuk dalam keturunan yang sama dengan klaster antigenik yang berbeda [17, 35, 83]. Virus-virus ini yang baru-baru ini muncul, tidak hanya menunjukkan homologi asam amino yang rendah (84-92%) saja dengan strain vaksin, akan tetapi juga berbeda dalam tiga dari enam posisi asam amino dalam HA yang dianggap sebagai kunci peralihan/switch antigenik pada virus-virus H2N3 babi di Amerika Utara [17]. Beberapa temuan memberikan bukti tentang peranan kunci adjuvan berbasis minyak dalam memberikan cross-reaktivitas serologis dan perlindungan yang relatif luas dari hasil observasi vaksin-vaksin SIV Eropa ini, seperti yang dideskripsikan secara detail dalam artikel pembahasan sebelumnya [87]. Emulsi berdasar minyak tidak hanya meningkatkan titer antibodi, tetapi juga memperluas cross-reaktivitas respons antibodi [20]. Hasil yang didapat dari studi komparatif yang cukup memprovokasi pemikiran melibatkan vaksin komersial mengandung strain H1N1 yang berbeda dan diuji tantang dengan virus SIV H1avN1 2007 [44]. Dua vaksin mengandung adjuvan berbasis minyak dengan strain H1N1 menunjukkan homologi asam amino masing-masing sebesar 93% dan 89% dengan virus tantang memberikan proteksi solid terhadap uji tantang. Sebaliknya, vaksin yang mengandung adjuvan Carbomer gagal menawarkan proteksi signifikan, meskipun memiliki homologi asam amino sebesar 95% dengan strain virus tantang H1N1. Hal ini kemungkinan besar disebabkan karena Carbomer, yang memiliki keuntungan bertoleransi lebih baik, adalah adjuvan yang lebih buruk dari minyak. Selain itu juga, vaksin yang mengandung strain identik tetapi mengandung adjuvan yang berbeda dan/atau jumlah antigen yang berbeda menunjukkan perbedaan potensi dan performa dalam uji tantang [22, 83, 85]. Dengan kata lain, efektivitas vaksin tidak selalu berkorelasi langsung dengan seberapa dekat kecocokan strain vaksin dengan virus di lapangan, dan juga data analisis sekuensing atau data antigenik seperti itu tidak selalu menjadi penentu terpercaya untuk menentukan efektivitas vaksin. Meskipun data uji tantang cross-proteksi tetap menjadi pengujian utama, pengujian antisera yang diinduksi vaksin untuk mengukur reaktivitasnya terhadap isolat lapangan melalui uji HI atau VN mungkin adalah alternatif paling berharga selain studi in-vivo berbiaya mahal itu.
Efikasi vaksin SIV yang digunakan di Eropa
Kebanyakan studi uji tantang peer-reviewed telah dilakukan dengan menggunakan vaksin bivalen SIV H1N1/H3N2 Eropa generasi pertama, yang berbasis pada strain manusia A/New Jersey/8/76 dan A/port Chalmers/1/73. Pada penelitian ini, babi yang seronegatif SIV divaksinasi dua kali dengan vaksin komersial dan kemudian diuji tantang dengan isolat virus SIV lapangan 2 – 7 minggu setelah vaksinasi kedua. Babi biasanya dieuthanasi selama stadium infeksi sangat akut, 1 – 3 hari setelah infeksi. Titer virus dalam paru-paru adalah kriteria utama untuk mengevaluasi proteksi. Karena adanya persyaratan Farmakope Eropa, studi awal menggunakan uji tantang IT dengan dosis sangat tinggi (7.5 log10 EID50) virus SIV H1avN1 dan H3N2 dari tahun 1980-an dan 1990-an [33, 83, 85, 91]. Dibawah kondisi-kondisi ini, babi kontrol yang tidak divaksin selalu menunjukkan titer virus yang tinggi dalam paru-paru (sampai 7.0-8.0 loh10 ID50). Babi tersebut juga menunjukkan dyspnea berat atau sementara, demam sampai 41OC, depresi, dan anoreksia yang khas dengan wabah akut SIV. Vaksin memberikan proteksi virologis yang sangat baik melawan uji tantang virus yang sangat ketat ini, dan paru-paru dari 50% babi yang divaksinasi menunjukkan hasil uji negatif virus tantang. Babi sisanya menunjukkan berkurangnya titer virus di dalam paru-paru, yang biasanya berakibat proteksi klinis penuh. Studi lebih terkini relah menggunakan rute inokulasi alternatif (aerosol, IN, atau IT dengan dosis rendah, yati 5.0 log10 EID50), dan mereka juga telah mengevaluasi efek vaksinasi terhadap sekresi virus [17, 21, 35, 51]. Metode inokulasi ini juga berakibat tingginya titer virus di sepanjang saluran respirasi babi yang tidak divaksin, tetapi metode inokulasi IN atau IT dosis rendah gagal mereproduksi penyakit. Meskipun vaksin berbasis virus New Jersey/76 dan/atau Port Chalmers/73 sekarang tidak lagi digunakan di sebagian besar negara di Eropa, studi uji tantang menggunakan vaksin-vaksin ini memberikan pelajaran umum yang berharga tentang potensi vaksin SIV. Seperti yang sudah disebutkan sebelumnya, vaksin-vaksin ini telah menunjukkan kemampuan untuk memberikan proteksi terhadap virus SIV H1avN1 dan H3N2 yang diisolasi selama bertahun-tahun yang mengalami antigenik dan genetik drift dalam jumlah cukup besar jika dibandingkan dengan strain vaksin. Sangat luar biasa bahwa vaksin berdasar virus Port Chalmers masih dapat memberikan proteksi terhadap uji tandang dengan virus SIV H3N2 yang diisolasi 35 tahun lebih muda daripada strain vaksin, yang memiliki homologi asam amino hanya sebesar 86.6% pada HA1 dan perbedaan sebanyaknya pada 11 asam amino pada situs antigenik. Vaksin ini juga menginduksi titer antibodi yang cukup besar melawan virus SIV H3N2 yang diisolasi antara tahun 2008 dan 2012 [17]. Vaksin berbasis virus New Jersey/76 sangat efektif melawan virus H1N1 avian-like dari tahun 1980-an dan 1990-an, tetapi gagal memproduksi reduksi titer virus dalam paru-paru yang signifikan setelah uji tantang dengan isolat virus H1avN1 2007 [44]. Faktanya, hal ini juga sama untuk vaksin trivalen H1N1/H1N2/H3N2 Eropa, meskipun vaksin itu mengandung virus H1avN1 yang berkerabat lebih dekat. Akan tetapi, tidak seperti vaksin bivalen Eropa, vaksin trivalen menawarkan proteksi 100% melawan tantangan virus H1huN2 homolog, dan sekarang merupakan vaksin utama di pasar Eropa [21, 90]. Tidak ada satupun vaksin yang disebutkan mampu menginduksi proteksi optimal terhadap virus pH1N1 2009. Karena itulah di beberapa negara, peternakan yang mendapatkan diagnosis pH1N1 2009 mendapatkan izin khusus untuk mengimpor dan menggunakan vaksin monovalen dari Pfizer, “FluSure Pandemic”.
Hanya sedikit penelitian tentang vaksin yang dilakukan pada babi yang telah memiliki imunitas terhadap virus SIV. akan tetapi, skenario ini mungkin merefleksikan situasi di lapangan, karena kebanyakan babi dara (dibawah 1 tahun) dan induk babi telah terekspos dengan satu atau lebih virus SIV melalui infeksi. Dalam salah satu penelitian serologi, babi naif influenza di inokulasi intranasal dengan virus SIV hidup, meliputi 2 atau 3 subtipe berbeda dengan interval 2 – 6 minggu. Beberapa minggu kemudian, babi percobaan diinjeksi dengan vaksin IM tunggal menggunakan vaksin bivalen SIV komersial [86]. Strain vaksin H1N1 (A/New Jersey/8/76) dan H3N2 (A/Port Chalmers/1/73) berhubungan jauh dengan virus SIV terkini dari H1avN1, H3N2, dan H1huN2 yang digunakan untuk uji infeksi dan serologi. Seperti yang telah diperkirakan, vaksinasi tunggal tidak cukup untuk menstimulasi titer antibodi yang kuat pada babi naif influenza, dan hanya mengembangkan titer antibodi H1NavN1 dan H3N2 minimal dan tidak ada antibodi terhadap H1huN2. Sebaliknya, babi yang sudah pernah terkena virus menunjukkan peningkatan titer antibodi AI secara dramatis terhadap virus manapun yang pernah menjangkitinya sebelumnya, termasuk H1huN2. Dua minggu setelah vaksinasi babi yang pernah terinfeksi H1avN1, sebagai contoh, titer rata-rata antibodi kelompok terhadap H1avN1 sebesar 2319 pada uji HI dan 11.230 pada uji VN. Hal ini mungkin berarti bahwa kecocokan antigenik dekat antara vaksin dan strain lapangan tidak begitu penting pada babi yang telah mengalami infeksi pertama dengan strain lapangan. Selain itu, merujuk kepada penelitian terkini pada hewan model dan manusia, respons antibodi cross-reaktif anti-HA secara umum dapat dicapai paling baik dengan vaksinasi berkelanjutan dengan menggunakan strain dengan keragaman paling luas dalam satu tubtipe (dirangkum oleh Chiu, dkk [12]).
Efikasi vaksin SIV yang digunakan di Amerika Utara
Dalam penelitian tentang vaksin SIV di Amerika Utara, babi biasanya diuji tantang 10-21 hari setelah vaksinasi kedua. Uji tantang dilakukan melalui rute IN atau IT, atau kombinasi keduanya dengan dosis virus moderat. Babi seringkali dieuthanasi di akhir berlangsungnya infeksi, pada hari ke-5 dan seterusnya, dan titer virus pada jaringan paru-paru jarang sekali diukur. Alih-alih, investigator mengevaluasi pendedahan virus nasal, level virus dalam BALF, lesi paru-paru, dan gejala klinis. Bisa saja terjadi renang keparahan penyakit dengan metode uji tantang yang digunakan. Beberapa studi juga telah mengevaluasi efek vaksinasi terhadap transmisi virus. Terdapat studi efikasi vaksin yang dipublikasikan tentang vaksin H1N1 monovalen pertama [46, 55], dan vaksin bivalen H1N1/H3N2 [41, 43]. Uji tantang yang dilakukan adalah dengan virus SIV H1N1 klasik dari tahun 1988 atau 1992, yang heterolog dengan strain vaksin H1N1 klasik. Vaksin telah menunjukkan kemampuan mengurangi skor gejala klinis dan lesi makroskopis dan mikroskopis, ekskresi virus via nasal berkurang [41, 47], atau tidak terdeteksi [43, 46]. Mulai awal tahun 1990-an, virus SIV H1 dan H3 telah mulai menunjukkan keragaman antigen yang besar, dan hal ini dianggap sebagai halangan yang besar dalam pengendalian penyakit melalui vaksin inaktif, bahkan dengan vaksin formulasi multivalen yang baru. Seringkali sulit untuk menentukan kesamaan secara tepat antara vaksin dan strain virus di lapangan, karena nama strain dan sekuens genetik spesifik adalah hak milik dari produsen vaksin, sehingga biasanya mereka hanya mengungkapkan klaster filogenetik strain vaksin milik mereka.
Dalam studi uji tantang yang melibatkan virus SIV H1 lebih terkini, vaksin eksperimen yang berbasis strain H1N1 klaster ⍺ A/swine/Iowa/1930 memberikan proteksi kurang menyeluruh terhadap uji rantang dengan virus SIV H1N1 klaster ℽ terkini A/swine/Minnesota/2003 [43, 97]. Di kedua studi tersebut, babi yang telah divaksin dengan vaksin inaktif penuh A/swine/Iowa/1930 dan ditantang dengan virus A/swine/Minnesota/2003 heterolog menunjukkan lesi paru yang lebih berat dibandingkan grup lainnya, termasuk grup kontrol uji tantang yang tidak divaksinasi. Fenomena ini kemudian direproduksi kembali dengan virus pH1N1 2009 dan 𝛿-H1N2, kedua virus ini digunakan baik sebagai vaksin atau strain virus tantang [8, 28, 29]. Observasi klinis disebut penyakit respirasi yang diamplifikasi terkait vaksin (vaccine-associated enhanced respiratory disease/ VAERD), dan tampaknya terbatas pada vaksin inaktif penuh dengan sepasang virus yang berasal dari subtipe HA yang sama tetapi telah mengalami drift terpisah jauh sehingga tidak lagi mendemonstrasikan reaksi silang antibodi HI dan VN. Ketidakcocokan NA demikian juga dengan adjuvan yang dikandung vaksin inaktif telah didemonstrasikan sebagai faktor integral terhadap model VAERD (Vincent, data yang dipublikasikan).
Prediksi proteksi vaksin dilihat dari kesamaan sekuens HA atau filogeni tidak dapat diandalkan. Peneliti Kanada telah menunjukkan proteksi cross-klaster terhadap virus SIV H1N1 klaster ⍺ A/swine/Illinois/02450/2008 dengan vaksin tivalen komersial Flusure XP [19]. Vaksin yang terakhir ini secara eksklusif mengandung strain H1N1 klaster ℽ dan 𝛿2. Antara strain vaksin klaster ℽ, yang memiliki leluhur HA yang sama dengan klaster ⍺, dengan virus tantang hanya terdapat homologi sekuens asam amino sebesar 87.2% saja, dan terdapat perbedaan sebanyak 11 asam amino pada situs antigenik HA. Meskipun vaksin tidak memiliki efek terhadap lesi dalam paru-paru, jumlah virus dapat dikurangi signifikan dalam sekresi nasal, paru-paru dan BALF pada babi yang divaksinasi dibandingkan dengan babi placebo. Penulis menyimpulkan bahwa vaksin multivalen komersial membantu melindungi dalam uji tantang dengan virus dari klaster SIV H1 uang tidak terwakili dalam vaksin. Vaksin trivalen yang sama dan vaksin eksperimental monovalen klaster ᵦ dibandingkan dalam sebuah studi transmisi dengan uji tantang dengan klaster ᵦ [70]. Virus uji tantang menunjukkan cross-reaktivitas serologis yang rendah dengan antiserum yang diinduksi oleh vaksin heterolog. Kedua regimen vaksin secara signifikan mengurangi transmisi dari babi bibit yang tidak divaksinasi menuju babi yang divaksinasi, akan tetapi kelompok yang telah divaksin dengan vaksin heterolog masih mengalami penularan melalui sebagian kontak dan menunjukkan pendedahan virus terukur, meskipun lambat dan berkurang jumlahkan dibandingkan dengan babi kontrol yang diuji tantang. Segera setelah kemunculan virus pH1N1 2009 pada populasi babi di Amerika Utara, tiga vaksin berizin diuji kemampuannya dalam menginduksi antibodi dan proteksi cross-reaktif. Meskipun virus pH1N1 2009 mengandung HA dari keturunan H1 klaster-ℽ, telah diobservasi cross-reaktivitas serologis terbatas pada dua vaksin yang mengandung antigen H1 dari klaster yang sama [96]. Meskipun begitu, kedua vaksin tersebut mendemonstrasikan proteksi parsial dalam uji tantang dengan virus pH1N1 2009, tetapi titer antibodi yang lebih tinggi dan proteksi menyeluruh didapat dengan vaksin monovalen eksperimental pH1N1 2009 [95].
Penelitian uji tantang juga telah dilakukan dengan vaksin komersial menggunakan vaksin SIV terhadap SIV H3N2 dari klaster heterolog. Tiga dari vaksin komersial awal yang mengandung hanya strain H3N2 klaster I tidak cukup untuk mengurangi pendedahan virus H3N2 klaster III setelah infeksi uji tantang, meskipun babi yang sudah divaksin menunjukkan gejala klinis relatif ringan dan berkurangnya lesi pada paru-paru [47]. Karena babi telah divaksin dengan vaksin homolog eksperimental menunjukkan imunitas penetralisir penuh, hasil yang kurang memuaskan ini dipercaya karena adanya heterogenitas antara strain vaksin klaster I dan virus tantang, yang menunjukkan homologi asam amino sekitar 93 -94% [32]. Studi tantang eksperimental yang lebih baru memberikan bukti serupa bahwa vaksin polivalen komersial mengandung virus H3N2 klaster IV dapat menawarkan proteksi yang lebih baik terhadap stran hasil drift kontemporer yang berasal dari klaster IV daripada vaksin komersial yang hanya mengandung satu virus H3N2 klaster I saja [53]. Dua vaksin seperti itu yang mengandung irus klaster IV secara signifikan mampu mengurangi titer virus dalam BALF, tetapi vaksin kuadrivalen FluSure XP memberikan reduksi paling signifikan, dan hanya vaksin ini saja yang mampu mengurangi jumlah babi yang mengekskresikan virus melalui hidung. Meskipun vaksin tidak dapat mencegah penularan virus kepada babi naif yang berkontak dengannya, penularan yang terjadi lebih terbatas dan berkorelasi dengan jumlah pendedahan virus yang lebih kecil melalui hidung pada babi yang divaksin. Efeknya terhadap replikasi dan ekskresi virus dikonfirmasi melalui sebuah studi menggunakan virus tantang klaster IV dengan identitas asam amino sebesar 97,2% dengan strain vaksin klaster IV [39].
Karena babi di Amerika Serikat sering kali ditransportasikan ke tempat-tempat pemeliharaan anak dan finisher di tempat terpisah, terdapat kemungkinan yang sangat besar bahwa mereka akan terekspos virus-virus yang heterolog/berbeda dengan virus yang sedang bersirkulasi atau dengan virus dalam vaksin yang digunakan pada peternakan induk babi. Beberapa studi telah berupaya untuk meneliti proteksi terhadap uji tantang virus heterolog pada anak babi yang telah memiliki antibodi maternal yang didapat melalui vaksinasi induknya. Kegagalan antibodi maternal dalam melindungi terhadap infeksi dan penularan virus dalam uji tantang eksperimental dengan virus heterolog tampaknya lebih jelas [1] dibandingkan dengan babi naif yang divaksinasi yang telah memiliki respons imun aktif dalam penelitian yang telah disebutkan sebelumnya [70]. Corzo dan koleganya [14] menunjukkan bahwa anak babi yang memiliki antibodi maternal dari induk babi yang telah divaksin dengan vaksin heterolog tetap dapat terinfeksi secara alami dan mendedahkan virus, dan salah satu babi dari induk babi yang telah divaksin dengan vaksin homolog tetap mendedahkan virus setelah uji tantang dengan virus homolog. Menangani virus SIV pada anak babi melalui antibodi maternal tampaknya sama kompleksnya dengan melalui vaksinasi primer, atau mungkin lebih.
Vaksin SIV baru
Vaksin SIV ideal harus dapat menginduksi respons imun seluas mungkin dan mampu mengatasi gangguan dari antibodi maternal, dan hal ini telah menstimulasi penelitian menuju pendekatan alternatif terhadap vaksinasi. Sampai saat ini, beberapa vaksin generasi baru untuk virus SIV telah dikembangkan dan diuji pada babi, tetapi hanya satu dari vaksin-vaksin ini yaitu vaksin partikel replikon RNA yang telah mencapai pasar. Vaksin Live attenuated influenza virus (LAIV) adalah salah satu kandidat vaksin paling menjanjikan, dan sangat mungkin nantinya akan tersedia secara komersial di Amerika Utara dalam waktu dekat. Karena itulah, kita akan berfokus pada vaksin LAIV ini, dan hanya sedikit mengulas tentang vaksin generasi baru lainnya.
Vaksin atenuasi hidup
Vaksin LAIV diberikan melalui mukosa (misalnya dengan rute IN atau IT) mampu menyerupai infeksi alami dan mendemonstrasikan potensi imunitas cross protektif yang luas dengan virus heterolog dari subtipe yang sama dan bahkan virus heterosubtipik [100]. Peneliti di Amerika Utara telah menggunakan tiga strategi berbeda untuk dapat dengan stabil mengatenuasi virus SIV dengan teknologi reverse genetic. Vaksin-vaksin ini telah diuji pada babi untuk mengetahui imunogenitas dan efikasinya dalam uji tantang infeksi, yang biasanya dievaluasi berbasis titer virus dalam swab nasal, titer virus dalam BALF pada hari kelima pasca uji tantang, dan juga lesi paru. Selain itu, efek LAIV terhadap penularan virus pada babi yang berkontak atau performa vaksin pada saat antibodi maternal masih ada juga telah diinvestigasi. Reversi kembali ke keadaan virulen belum pernah dikonfirmasi terjadi pada vaksin LAIV untuk manusia, dam platform sensitif temperatur telah menunjukkan banyak mutasi teratenuasi, mengurangi kesempatan terjadinya reversi. Akan tetapi, terdapat kekhawatiran tentang penggunaan vaksin LAIV pada babi, dan potensi terjadinya reversi virulensi dan reasortansi antara tipe virus liar dan strain vaksin. Salah satu faktor yang mungkin dapat memitigasi risiko ini berhubungan dengan fakta bahwa LAIV yang digunakan dalam studi eksperimental di Amerika Serikat berasal dari virus babi keturunan Amerika Utara, dan kemudian akan berkontribusi terhadap materi genetik asing jika terjadi reasortansi.
Vaksin atenuasi hidup dengan protein NS1 yang dimodifikasi
Protein NS-1 non struktural dari virus influenza A secara eksklusif diekspresikan dalam sel yang terinfeksi virus, dan tidak ada dalam partikel virus. Salah satu fungsi utama protein NS-1 adalah menghambat respons antiviral yang dimediasi interferon type I. Trunkasi protein NS-1 pada virus SIV H3N2 klaster I A/swine/Texas/4199-2/1998, dari asam amino sepanjang 230 menjadi 120, memproduksi mutan dengan replikasi terbatas dalam saluran pernapasan babi dan memiliki karakteristik imunogenik [69, 76]. Selain level antibodi sistemik penetralisir yang sedang, vaksin LAIV ini memunculkan IgA mukosa dalam basuhan nasal dan cairan BALF, dan juga menimbulkan respon imunitas yang dimediasi sel (CMI) sistemik [37, 53, 69, 73, 100]. Respons CMI ini lebih lemah daripada yang diobservasi setelah infeksi dengan virus tipe liar A/sine/Texas/198, yang dapat dikaitkan dengan level replikasi LAIV sangat rendah dalam saluran pernafasan [37]. Rute intranasal (IN) lebih efisien dibandingkan rute intramuskular (IM) dalam memprimerkan respons antibodi mukosa, dan sebagian besar penelitian telah dilakukan menggunakan dua dosis vaksin yang diberikan melalui intra nasal, meskipun pemberian dosis tunggal melalui IN juga ditemukan efisien dalam penelitian yang lebih baru lagi [100]. Vaksin LAIV memberikan proteksi yang kuat dalam uji tantang homolog pada babi yang naif influenza dan memberikan perlindungan hampir penuh melawan strain virus SIV H3N2 klaster II yang secara antigen berbeda A/swine/Colorado/23619/1999 [69, 73, 76, 100, 101]. Sebaliknya, vaksin yang kurang efektif terhadap uji tantang dengan virus H1N1 heterosubtipik, meskipun terdapat sedikit reduksi titer virus dalam BALD dan swab nasal pada hari kelima pasca uji tantang, tanpa adanya efek pada lesi paru-paru [37, 69, 100]. Ketiadaan antibodi serum HI terhadap virus heterovarian dan heterosubtipik dalam studi-studi ini mengindikasikan bahwa respons hospes kompleks melibatkan baik mekanisme seluler maupun humoral berkontribusi pada terciptanya proteksi yang luas [100], tetapi respons imun protektif membutuhkan investigasi lebih lanjut. Menurut studi terbaru, vaksin NS1 mungkin juga efektif secara parsial pada anak babi yang memiliki antibodi maternal [98, 99, 101]. Meskipun tidak sepenuhnya melindungi pada babi yang memiliki antibodi maternal yang cocok dengan strain virus vaksin, proteksi terhadap strain heterolog Colorado/99 lebih baik daripada setelah pemberian vaksin ‘killed’ eksperimental melalui IM. Pada babi kontrol tanpa antibodi maternal, kedua vaksin memberikan proteksi penuh terhadap replikasi tidak hanya untuk strain Texas/98 homolog tetapi juga melindungi terhadap strain Colorado/99 heterolog. Akan tetapi, babi yang divaksinasi dengan vaksin inaktif kemudian diuji tantang dengan virus heterolog mengembangkan VAERD yang tidak terobservasi dalam grup LAIV. Temuan serupa juga dilaporkan pada studi terbaru [73].
Vaksin atenuasi hidup yang sensitif temperatur
Mutasi pada gen polimerase virus teridentifikasi dalam virus influenza teratenuasi beradaptasi dingin yang dikembangkan untuk kuda [80] dan manusia [6]. Mutasi-mutasi ini diperkenalkan ke dalam virus SIV H3N2 triple reassortant yang sudah dikarakterisasikan dengan baik, menyebabkan terganggunya aktivitas polimerase, berkurangnya pertumbuhan pada temperatur saluran pernafasan bawah, dan fenotipe ter atenuasi pada mencit dan babi [62]. Jaringan penyokong gen internal LAIV sensitif temperatur (ts) dipasangkan dengan beberapa protein permukaan HA dan NA melalui rekayasa genetik pembalikan/ reverse genetic, dan konstruksi semacam itu terbukti mampu melindungi terhadap uji tantang dengan pH1N1 2009 homolog [62]. Selama tahun 2011-2012, telah terdeteksi beberapa ratus infeksi pada manusia disebabkan virus SIV H3N2 klaster IV yang secara antigenik telah mengalami drift, dilambangkan sebagai H3N2V saat terdeteksi pada manusia [23, 36]. Pada penelitian oleh Loving dan koleganya yang telah disebutkan sebelumnya [53], vaksin multivalen komersial dengan derajat cross reaktifitas serologis yang tinggi terhadap H3N2v [39] memberikan proteksi parsial signifikan seperti yang terukur dengan berkurangnya pendedahan nasal. Akan tetapi, babi yang berkontak tidak langsung menjadi terinfeksi, mengindikasikan bahwa reduksi pendedahan virus nasal tidak mencegah penularan aerosol. Sebaliknya, tsLAIV yang diuji dalam studi yang sama memberikan proteksi menyeluruh, dan tidak ada babi yang berkontak secara tidak langsung menjadi terinfeksi. Kedua vaksin tersebut memberikan proteksi yang secara signifikan lebih baik daripada dua vaksin ‘killed’ komersial dan vaksin LAIV dengan delesi NS1 yang mengandung HA dengan keturunan lebih jauh seperti yang dijelaskan sebelumnya. Hal ini secara jelas menunjukkan bahwa efektivitas vaksin tergantung pada banyak faktor dan mungkin sangat bervariasi baik bagi kedua vaksin ‘killed’ maupun LAIV, terutama dengan HA dan NA yang secara antigenik telah mengalami drift.
Dalam serangkaian studi terhadap virus SIV H1, tsLAIV pH1N1 2009 dibandingkan dengan vaksin dengan subunit protein HA yang cocok saat diuji tantang dengan virus H1N2 heterolog klaster 𝛿-1 [67]. Babi yang diproteksi parsial oleh tsLAIV, memperlihatkan berkurangnya pendedahan virus dan penghilangan virus dari tubuh lebih cepat, karena tidak ada virus yang terdeteksi dalam paru-paru setelah 5 hari pasca uji tantang. Sebaliknya babi yang telah divaksinasi dengan subunit HA menunjukkan lesi paru dan lesi trakea yang lebih berat yang konsisten dengan temuan VAERD setelah uji tantang. Temuan ini baru-baru ini dikonfirmasi melalui studi yang lain [27]. Gejala klinis dan lesi paru ringan pasca uji tantang yang ditunjukkan pada grup imun tsLAIV dengan ketiadaan antibodi penetralisir dalam serum menunjukkan adanya peranan imunitas mukosal cross reaktif dalam proteksi LAIV terhadap infeksi dan penyakit klinis.
Vaksin atenuasi hidup yang tergantung pada elastase
Peneliti lainnya telah menciptakan virus influenza atenuasi dengan memodifikasi tempat pembelahan dalam HA virus sehingga memerlukan enzim elastase. Meskipun elastase dapat ditambahkan sebagai suplemen selama kultivasi virus, jumlahnya terlalu jarang dalam hewan hospes untuk menyokong replikasi virus secara signifikan. Mutan tergantung elastase ini telah diciptakan dari virus H1N1 yang diisolasi dari babi di Kanada, yaitu A/swine/Saskatchewan/18789/2002 [56]. Virus ini sangat teratenuasi pada babi dan masih menginduksi respons antibodi sistemik dan mukosal dan juga imunitas dimediasi sel (CMI) setelah dua dosis melalui IT atau IN [57, 58]. Dalam studi uji tantang, vaksin LAIV tergantung elastase memberikan proteksi terhadap uji tantang dengan virus H1N1 homolog dan virus SIV H1N1 yang secara antigenik jauh berbeda, tetapi hanya beberapa ekor babi yang terlindungi melawan infeksi H3N2 heterosubtipik [4, 56, 58]. Peneliti yang sama baru-baru ini telah membuat kandidat vaksin LAIV yang sama sekali baru [59]. Dalam virus yang direkayasa secara genetik ini protein N1 dari virus A/swine/Saskatchewan/2002 telah diganti dengan H3 dari SIV H3N2. Secara teoritis virus semacam itu dapat berlaku sebagai LAIV bivalen dan memberikan proteksi menyeluruh terhadap H1 maupun H3, tidak seperti seluruh vaksin LAIV lain yang telah diteliti sampai sekarang. Dalam studi uji tantang awal, babi divaksinasi dua kali melalui rute IT dengan vaksin batu ini, diuji tantang dengan virus SIV H1N1 atau H3N2 20 hari pasca vaksinasi booster kemudian dieuthanasi untuk mengetahui titrasi virus tantang pada hari kelima pasca uji tantang. Tidak ada satupun dari kedua subtipe yang dapat diisolasi dari paru-paru babi yang divaksinasi, tetapi virus H3N2 juga tidak terdeteksi dalam paru-paru empat ekor dari lima ekor babi kontrol. Karena itulah data uji tantang yang tersedia harus interpretasi dengan hati-hati, dan diperlukan data lebih banyak lagi. Rute vaksinasi, dosis vaksin, dan regimen nya juga memerlukan investigasi lebih lanjut, karena pemberian dua dosis vaksin melalui IT atau IN tidak menyenangkan untuk dilakukan di lapangan.
Jika disimpulkan bersama, penelitian-penelitian ini menunjukkan bahwa pemberian vaksin LAIV via IN adalah metode yang lebih disukai untuk menginduksi respons antibodi yang disekresi lewat mukosa dan untuk mencegah atau mengurangi penularan virus SIV dalam populasi. Proteksi dapat meluas mencakup varian antigenik dari strain vaksin, tetapi formulasi multivalen atau vaksin chimera akan diperlukan untuk melindungi terhadap variasi virus SIV H1 dan H3. Selain itu, keberadaan antibodi maternal yang cocok dengan strain vaksin mengurangi efektivitas vaksin LAIV, dan efek dari keberadaan imunitas aktif yang telah ada lebih dulu ini belum dipelajari. Pada manusia vaksin LAIV tampaknya lebih efektif pada anak-anak daripada orang dewasa, karena gangguan imunitas aktif yang telah ada sebelumnya terhadap vaksin LAIV. Vaksin hidup tampaknya lebih efektif daripada vaksin ‘killed’ sebagai vaksin primer, sementara vaksin ‘killed’ tampaknya lebih efektif dalam meningkatkan imunitas humoral yang sudah ada sebelumnya [2, 20, 26].
Partikel replikon RNA
Partikel replikon yang diturunkan dari Alphavirus (RP) adalah teknologi vaksin vektor virus pertama yang telah disetujui vaksinasi SIV pada babi di Amerika Serikat. Vektor adalah bentuk modifikasi dari virus equine encephalitis Venezuela yang telah di atenuasi. Replikasinya bersifat defektif karena gen struktural telah dihapus dan diganti dengan RNA yang mengkode gen yang diinginkan, seperti misalnya gen HA virus SIV. Alphavirus rekombinan RP masih dapat berikatan sel hospes, membawa material genetik ke dalam sitoplasma, dan memacu ekspresi protein dari gen yang dimasukkan. Akan tetapi, tidak ada progeni virus infeksius yang diproduksi dan hal ini menimbulkan kekhawatiran pembalikan kembali virulensi pada hewan yang divaksin. Alphavirus RP juga memiliki karakteristik adjuvan bawaan, yang mungkin berkontribusi terhadap efektivitasnya. Vaksin SIV RP berizin mengekspresikan gen HA virus SIV H3N2 klaster IV Amerika Utara, dan vaksinasi primer seharusnya terdiri dari dua kali injeksi intramuskular yang diberikan terpisah selama 2 – 3 minggu kemudian. Vaksin ini telah mampu menginduksi imunitas protektif terhadap uji tantang homolog, meskipun tidak memberikan proteksi pada saat masih ada antibodi maternal [7]. Platform yang sama yang mengekspresikan protein HA pH1N1 2009 juga bersifat protektif terhadap infeksi homolog, dan vaksin yang mengekspresikan gen NP yang diturunkan dari H3N2 mengurangi pendedahan virus via nasal dan replikasi virus mengikuti uji tantang H1N1 pada babi [92, 93]. Salah satu keuntungan platform adalah bahwa HA dari setiap strain yang baru muncul dapat dikloning dengan cepat dan dimasukkan ke dalam vektor. Teknologi ini kemudian sering digunakan untuk membuat vaksin SIV yang dibuat khusus menurut pesanan. Data lapangan tentang penggunaan dan efektivitas vaksin RP RNA tidak tersedia saat bab ini ditulis.
Vaksin lainnya
Vaksin protein rekombinan
Vaksin protein rekombinan berbasis pada protein amplop M2 tersimpan virus influenza telah dikembangkan dan diuji pada babi. Vaksin semacam ini sangat menjanjikan ketika diujicobakan model tikus untuk virus influenza [60, 75], dan telah menginduksi respons imun yang diinginkan pada babi [34, 42], tetapi tidak ada penurunan sekresi virus yang signifikan setelah uji tantang. Akan tetapi, antibodi anti-M2 tidak bersifat penetralisir, yang dapat menjelaskan kurangnya perlindungan secara signifikan dalam uji tantang pada babi.
Hasil yang lebih menjanjikan yang telah diperoleh dengan trimer soluble trimer dari HA virus HA pH1N1 2009 [49]. Trimer HA dianggap sebagai kandidat vaksin yang lebih baik daripada monomer HA karena lebih dekat menyerupai HA yang alami dan kemudian menginduksi level antibodi penetralisir yang lebih tinggi [102]. Babi yang divaksin dengan vaksin rekombinan ini mengembangkan antibodi H1 dan VN dalam level yang sangat tinggi terhadap virus homolog, yang cross reaktif dengan virus SIV H1avN1, akan tetapi tidak cross reaktif dengan H1huN2. Vaksin rekombinan ini hampir sepenuhnya melindungi terhadap uji tantang virus homolog. Akan tetapi, penelitian ini menggunakan dosis rekombinan vaksin yang tinggi dan menggunakan virus tantang yang sangat dekat hubungannya dengan strain vaksin. Selain itu, vaksin subunit sepertinya tidak dapat menawarkan manfaat signifikan dibandingkan dengan vaksin SIV ‘killed’ tradisional.
Vaksin vektor
Adenovirus Serotipe 5 manusia (Ad5) telah dibuat defektif replikasinya dengan membuang dua segmen genomnya, dan posisi dua segmen genome ini digunakan untuk memasukkan sekuen antigen HA atau NP dari virus SIV klaster I H3N2 A/swine/Texas/1998 [77, 105]. Pemberian satu dosis tunggal IM hanya menggunakan Ad5-HA saja atau dengan kombinasi bersama Ad5-NP memicu antibodi spesifik HI virus dengan level yang tinggi. Kombinasinya menawarkan proteksi yang lebih baik terhadap uji tantang dengan virus H3N2 yang berkerabat dekat daripada hanya Ad5-HA saja, dan kalau hanya Ad5-HA efeknya hanya minimal [105]. Strategi primer-booster dengan menggunakan kombinasi Ad5-HA dan Ad5-NP diikuti dengan vaksin bivalen komersial 3 minggu kemudian menunjukkan hasil efektif terhadap uji tantang virus SIV H3N2 pada anak babi yang memiliki antibodi maternal spesifik H3N2, tidak seperti pemberian dosis tunggal vaksin vektor atau vaksin ‘killed’ [104]. Antigen Ad5 juga dapat diberikan tanpa jarum suntik [103]. Pada penelitian terbaru, babi divaksinasi satu kali via IN dengan antigen Ad5-HA vektor virus pH1N1 tahun 2009 dengan HA yang telah dioptimasi dengan coding vektor kodon [8]. Vaksin ini mampu menginduksi respons antibodi mucosal terhadap virus homolog dan proteksi penuh terhadap uji tantang virus homolog, tetapi kurang efektif terhadap uji tantang dengan virus H1N2 klaster 𝛿 heterolog. Baru-baru ni, vektor rekombinan cacar babi dan vektor herpesvirus 1 equine mengekspresikan gen HA virus SIV juga memberikan hasil yang memuaskan dalam percobaan uji tantang dengan virus homolog [71, 107]. Akan tetapi, harus diperhatikan bahwa penelitian terhadap babi ini menggunakan dosis vektor vaksin yang sangat tinggi (seringkali sampai 9.0 – 10 log10 TCID50), dan di kebanyakan kasus, virus tantang memiliki hubungan dekat dengan antigen vaksin. Selain itu juga, imunitas terhadap vektor virus tersebut dapat mengganggu vaksinasi booster pada induk babi, dan juga vaksinasi anak babi, yang diharapkan mendapatkan antibodi maternal dari vektor.
Vaksin DNA
Vaksin plasmid DNA yang mengkode perlindungan memiliki keuntungan teoritis dalam mengekspresikan antigen dalam bentuk aslinya dan kemudian menstimulasi respons imunitas diinduksi sel dan respons imun humoral, termasuk CTL. Selain itu, beberapa antigen dapat dikombinasi dalam satu plasmid tunggal, dan mereka seharusnya mampu untuk menginduksi imunitas meskipun terdapat keberadaan MDA (antibodi maternal). Sejumlah studi pada babi menggunakan vaksin DNA berbasis gen HA virus SIV telah memperlihatkan respons imun dan proteksi moderat terhadap uji tantang infeksi virus homolog [30, 46, 55]. Baik injeksi IM konvensional dan metode pemberian vaksin tanpa jarum keduanya sukses [30]. Regimen vaksinasi primer-booster terdiri dari satu dosis vaksin DNA diikuti dengan vaksin inaktif konvensional 4 minggu kemudian memberikan hasil yang lebih baik secara signifikan daripada dua dosis vaksin DNA [46]. Dengan hanya menggunakan vaksin DNA saja diperlukan dosis DNA yang sangat besar, seringkali memerlukan tiga dosis atau lebih, dan proteksi terhadap uji tantang homolog bersifat tidak signifikan atau tidak lengkap. Sudah jelas bahwa diperlukan upaya lebih lanjut untuk mengembangkan vaksin DNA menjadi alternatif yang praktis dan dapat berkesinambungan.
Kesimpulan dan perspektif
Influenza babi telah menjadi penyakit yang sangat dinamis, dengan banyak virus H1 dan H3 yang bersirkulasi bersama-sama, yang berbeda antar benua dan wilayah. Tidak ada satupun vaksin komersial dan eksperimental yang didiskusikan dalam bab ini yang mampu memberikan perlindungan universal sejati terhadap setiap virus yang ada. Faktanya, respons imun yang muncul setelah infeksi setiap virus SIV tipe liar juga gagal memberikan proteksi heterovarian dan heterosubtipik, dan proteksi silang menjadi semakin lemah seiring meningkatnya keragaman genetik antar virus. Hal ini menimbulkan pertanyaan tentang kelayakan vaksin SIV ‘universal’. Studi uji tantang eksperimental biasanya dilakukan dibawah kondisi ideal yang berbeda dengan keadaan yang dijumpai di lapangan. Di kebanyakan studi, investigator menggunakan babi yang naif SIV, interval waktu yang pendek antara vaksinasi dan uji tantang, dan virus tantang yang relatif dekat hubungannya dengan strain yang dikandung vaksin. Di lapangan, babi-babi tetapi divaksin meskipun masih ada keberadaan kekebalan maternal, atau seringkali, masih memiliki imunitas terhadap virus SIV yang mungkin akan mengganggu efektivitas vaksin. Meskipun antibodi maternal telah diperlihatkan mampu mengurangi efektivitas baik vaksin inaktif maupun LAIV, data performa vaksin dengan keberadaan imunitas aktif hampir-hampir tidak ada. Selain itu pula, hanya ada sedikit studi komparatif tentang efektivitas vaksin komersial dan eksperimental.
Kebijakan dan sikap vaksinasi yang diambil sangat berbeda antara Eropa dan Amerika Serikat, demikian juga pandangan kami terhadap vaksin AI babi di masa depan. Di Eropa, penyerapan vaksin lebih rendah daripada Amerika Serikat, dan para peneliti masih memiliki kepercayaan diri pada vaksin inaktif tradisional. Kepercayaan ini setengahnya didasarkan pada proteksi cukup luas yang diberikan vaksin generasi pertama jenis ini, dan pada fakta bahwa bahkan hanya dengan berkurangnya titer virus secara moderat dalam paru-paru hewan yang sudah divaksin sudah cukup untuk mengurangi gejala penyakit. Selain itu VAERD tidak pernah diobservasi dengan menggunakan vaksin SIV ‘killed’ komersial maupun eksperimental di Eropa, bahkan meskipun strain vaksin tidak cocok dengan strain virus tantang dan hanya menimbulkan sedikit proteksi saja. Beberapa peneliti virus SIV percaya bahwa proteksi yang luas dan kemungkinan juga perlindungan silang antar klaster dapat dicapai melalui vaksin inaktif dengan mengoptimalkan formulasi dan regimen vaksin. Pendekatan yang mungkin dilakukan mencakup penggunaan adjuvan yang telah diperbaiki, stimulasi respons antibodi anti-NA, dan penggunaan strain yang berbeda secara antigenik untuk digunakan sebagai vaksinasi primer dan booster. Sebagai contoh, vaksinasi berturut-turut dengan vaksin monovalen eksperimental yang didasarkan pada virus SIV H3N2 Eropa dan Amerika Utara, telah menunjukkan induksi respon antibodi penetralisir dan memproduksi produksi terhadap dua keturunan virus tersebut, tidak seperti vaksinasi primer dan booster tradisional yang menggunakan virus yang identik [64].
Setelah munculnya pandemi virus H1N1 yang berasal dari dua keturunan virus AI babi dan terjadinya wabah H3N2v pada manusia, terdapat dua fokus ganda yang dilakukan Amerika Serikat untuk mengurangi penyakit di level individu babi, dan dalam pencegahan pendedahan virus via nasal dan pencegahan transmisi virus dalam populasi babi, demikian juga penularan antara babi dan manusia. Hal ini sebagian dapat menjelaskan minat dalam perizinan vaksin LAIV, yang merupakan satu-satunya vaksin yang telah mendemonstrasikan imunitas mukosal.
Peneliti virus SIV di seluruh dunia menyetujui sejumlah jalan yang diperlukan untuk memperbaiki vaksin SIV, salah satunya dengan meningkatkan surveilans virus SIV. Surveilans penting untuk mendapatkan gambaran subtipe dan keturunan virus dominan di suatu wilayah geografis yang berbeda, untuk mendeteksi perubahan, dan untuk membantu seleksi strain vaksin. Sayangnya, surveilans virus influenza pada babi secara kronis memang sudah kurang dana, dan sama sekali tidak ada di banyak tempat di dunia [94]. Dari sudut pandang regulasi, persyaratan perizinan vaksin SIV yang berbelit-belit di Eropa tetap menjadi halangan untuk pembaharuan vaksin, ketika benar-benar diperlukan. Para pembuat kebijakan seharusnya mempertimbangkan menerima data serologis jika produsen vaksin ingin mengganti salah satu strain dalam vaksin multivalen. Pada akhirnya, masih banyak pertanyaan yang belum terjawab tentang imunologi vaksin influenza yang menghambat proses pengendalian influenza babi melalui vaksinasi. Sebagai contoh, mengapa beberapa vaksin SIV mati ‘killed’ menawarkan perlindungan yang lebih luas dari vaksin lainnya? Seberapa besar drift yang diperlukan sebelum strain vaksin dari subtipe tertentu tidak dapat digunakan lagi? Perubahan asam amino manakah yang paling penting? Apa saja nilai protektif sejati dari respons imun selain menetralisasi HA dengan antibodi? Apakah korelasi protektif terbaik untuk vaksin LAIV? Sampai sejauh mana kombinasi banyak strain dalam satu vaksin akan mengakibatkan ‘kompetisi antigenik’ dan mengurangi atau membiaskan respons imun? Bagaimana imunitas yang sudah ada sebelumnya akan mempengaruhi reaksi berbagai tipe vaksin influenza yang berbeda? Banyak dari pertanyaan ini juga dapat diaplikasikan terhadap vaksin influenza manusia. Selain itu juga, studi respons imun terhadap influenza pada babi dapat memberikan gambaran dan informasi yang penting baik bagi dunia kedokteran hewan maupun manusia.
Pengakuan
Penulis mengakui adanya sumber pembiayaan dari National Institute of Allergy and Infectious Diseases, National Institute of Health, Department of Health and Human Services (Kontrak No. HHSN266200700005C), the European Commission (FP7-GA258084, FLUPIG), dan Belgian Federal Public Service for Health, Food Chain Safety dan Environment (RT 09/6227, FLUCROSS).
Setiap kali disebutkan merek dagang maupun produk komersial dalam tulisan ini hanya bertujuan untuk memberikan informasi secara spesifik, dan tidak mengimplikasikan rekomendasi maupun endorsement dari United States Department of Agriculture (USDA). USDA adalah pemberi manfaat dan pemberi pekerjaan yang memberi kesetaraan kesempatan.
DISCLAIMER
Artikel terjemahan ini dimaksudkan bagi pembaca berbahasa Indonesia untuk dapat mempelajari artikel keilmuan terkait. Penerjemah tidak mendapatkan keuntungan apapun dari kegiatan penerjemahan ini.

